氟苯尼考对嗜水气单胞菌的防突变浓度
2018-03-07单奇刘书贵马丽莎李丽春郑光明
单奇,刘书贵,马丽莎,李丽春,郑光明
(中国水产科学研究院珠江水产研究所,农业部休闲渔业重点实验室,农业部水产品质量安全风险评估实验室(广州),广东 广州 510380)
嗜水气单胞菌(Aeromonashydrophila)为弧菌科气单孢菌属,该菌广泛分布于淡水、咸水、河水和海水中[1],从健康或患病水产动物体内均能分离得到,可引起多种淡水鱼类发生烂鳃病、烂尾病、流行性溃疡综合征和细菌性败血症等[2-3]。近年来该菌引起疾病更是呈爆发趋势,由嗜水气单胞菌引起的混合感染已成为鲤科鱼类养殖的主要病害[4]。
氟苯尼考(florfenicol)为动物专用第3代氯霉素类广谱抗菌药物,与氯霉素和甲砜霉素相比,因其具有抗菌谱广、抗菌活性强和副作用小等特点[5],被广泛用于水产病害防治。氟苯尼考对大多数鱼类病原菌都具有较强的抗菌活性,包括嗜水气单胞菌、杀鲑气单胞菌、发光杆菌、爱德华氏菌、迟缓爱德华氏菌、鳗弧菌等[6]。欧洲、挪威、加拿大、日本、中国、韩国均已批准氟苯尼考用于各种水产动物[7]。然而,随着氟苯尼考在水产动物细菌性疾病治疗上的广泛使用甚至滥用,多种鱼类病原菌已经出现了耐药性,如嗜水气单胞菌[8]、维氏气单胞菌[9]、肺炎克雷伯氏菌[10]、沙门氏菌[11]等。很多学者倡导通过优化给药方案来减少耐药菌株的产生、传播和扩散。
防突变浓度(MPC)是指防止步耐药突变菌株选择性富集扩增所需的最低药物浓度[12]。最低抑菌浓度(MIC)和防突变浓度(MPC)之间的药物浓度范围称为突变选择窗(MSW)[13]。防突变浓度(MPC)理论认为血药浓度始终高于MPC,不仅可以发挥好的疗效,也会防止菌株发生耐药突变;血药浓度始终处于MIC以下,虽不能产生预期疗效,但低水平药物浓度压力下,菌株发生耐药的几率也很低;相反,血药浓度在整个给药间隔或较长时间处于突变选择窗内,即使临床治疗成功,菌株发生耐药突变的机率也加大[12-13]。因此,在兽医临床用药时,将血药浓度维持在MPC以上,不仅可以达到最佳疗效,也可以减少耐药菌株的产生。本实验拟通过测定氟苯尼考对多株嗜水气单胞菌的MIC和MPC,为水产临床优化氟苯尼考的给药方案、减少耐药菌株的产生提供基础依据。
1 材料与方法
1.1 材料
1.1.1 实验药品
氟苯尼考对照品(含量99%),购自中国兽医药品监察所;氟苯尼考原料药(含量98%),珠江水产研究所药厂惠赠。
1.1.2 菌株与培养基
受试菌41株,其中嗜水气单胞菌标准株ATCC7966由中国水产科学研究院珠江水产研究所鱼病研究室提供,40株嗜水气单胞菌(表1)于2015—2016年分离自广东省佛山、中山和肇庆等重点养殖区域患病的水生动物。Mueller-Hinton(MH)琼脂、MH肉汤均购自广东环凯微生物科技有限公司。
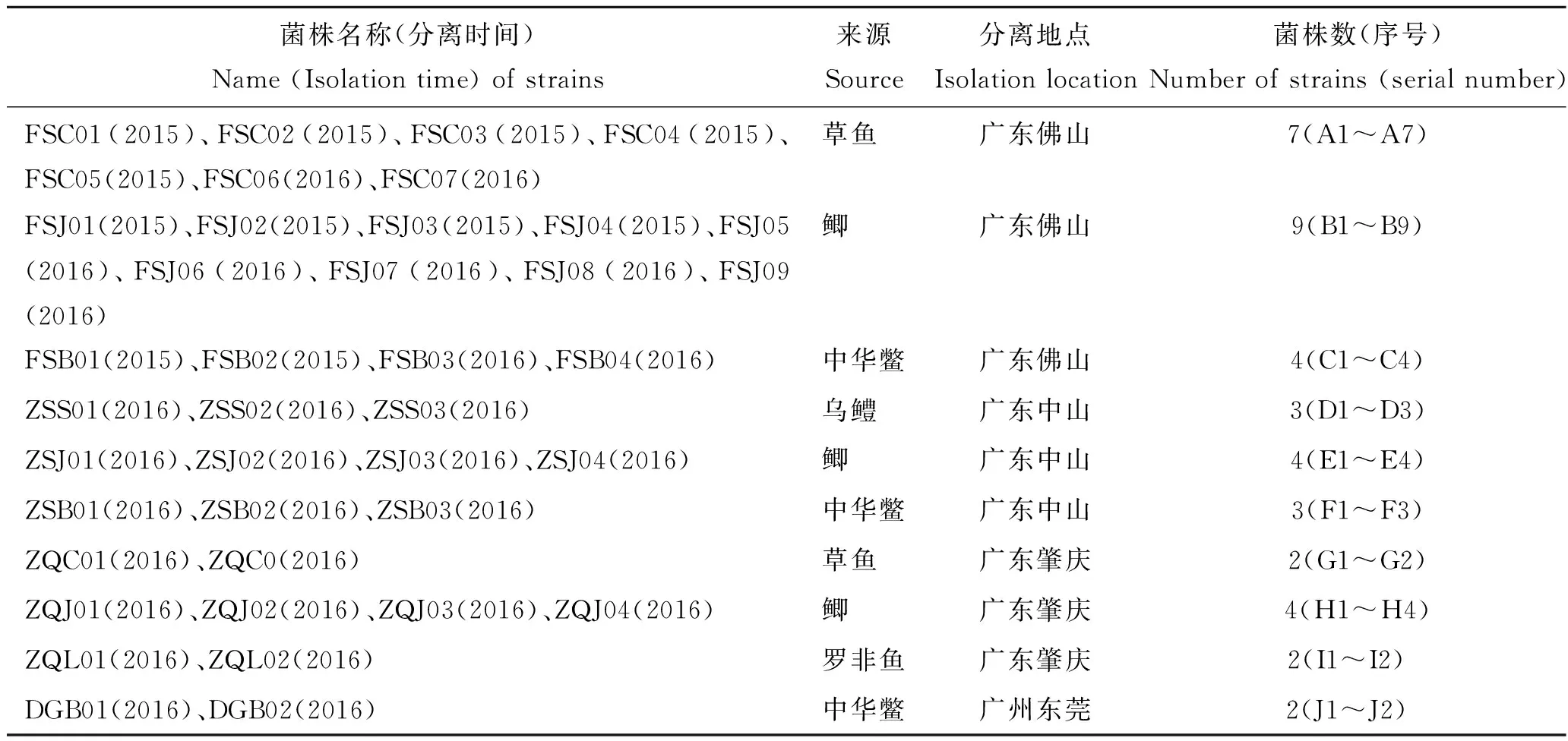
表1 菌株来源与背景Tab.1 Source and background of the Aeromonashy drophilia strains
1.2 实验方法
1.2.1 MIC和MIC99的测定
采用琼脂平板二倍稀释法测定氟苯尼考对嗜水气单胞菌的MIC,MH琼脂平板所含药物的质量浓度范围为0.031~128 μg/mL,将处于对数生长期的菌悬液,用新鲜的MH肉汤稀释调整到1×105CFU/mL,每个平板接种100 μL(最终接种量约为1×104CFU),28℃培养24 h后,按美国国家临床实验室标准化委员会(NCCLS)2010年颁布的无细菌生长的最低药物浓度判定为MIC。
在测得的MIC的基础上,依次递减20%至1/2MIC药物浓度,制成含不同药物浓度的琼脂平板。将处于对数生长期的菌落溶于无菌生理盐水中, 调整浓度至3×107CFU/mL,再经无菌生理盐水10倍倍比稀释至3×102CFU/mL。将不同稀释倍数的菌液各取100 μL接种于平板上,使每个药物浓度平板上的含菌量分别为3×106、 3×105、 3×104、 3×103、 3×102CFU。28 ℃培养24 h后,挑选合适的平板计数,按照崔俊昌等[14]报道的方法计算MIC99(抑制99%细菌生长的最低抑菌浓度)。
1.2.2 MPCpr和MPC的测定
从长有嗜水气单胞菌的琼脂平板上挑取3个菌落接种于10 mL新鲜的MH肉汤中,28 ℃恒温摇床上过夜培养,3 500 r/min离心20 min后,将富集后的细菌再悬浮在100 mL新鲜的 MH肉汤中,28 ℃恒温摇床上培养6 h,将全部菌液经3 500 r/min离心20 min后富集,用无菌生理盐水将菌液浓度稀释到3×1010CFU/mL。
在测得的MIC基础上,制得系列药物浓度为1、2、 4、 8、 16、 32和64 MIC的MH琼脂平板,每个药物浓度各设4个平行,每个平板接种100 μL菌悬液,最终嗜水气单胞菌接种量为1.2×1010CFU。接种后的平板放置在28 ℃培养箱中培养 72 h。以72 h 后孵育不出菌落的最低药物浓度设为暂定防突变浓度(MPCpr)。然后在测得的MPCpr的基础上,依次递减(20%)药物浓度,制备含药平板,没有出现菌落生长的最低药物浓度即为MPC。
1.3 数据处理
应用SPSS 17.0软件内嵌的probit回归模型对氟苯尼考药效学数据(MIC和MPC)进行统计分析,计算氟苯尼考对多株嗜水气单胞菌的MIC50、MIC90和MPC90。
2 结果
2.1 氟苯尼考对嗜水气单胞菌ATCC7966的MIC、MIC99和MPC
采用琼脂稀释法测定,氟苯尼考对嗜水气单胞菌ATCC7966的MIC为1.0 μg/mL、MIC99为0.8 μg/mL,MPC为4.8 μg/mL,MSW(MIC99~MPC)为0.8~4.8 μg/mL、SI(MPC/MIC99)为6。
2.2 氟苯尼考对嗜水气单胞菌临床分离株的MIC50、MIC90和MPC90
氟苯尼考对40株临床分离的嗜水气单胞菌的MIC和MPC见表2。由表2中可知,氟苯尼考对40株嗜水气单胞菌的MIC范围为0.5~4.0 μg/mL,基于SPSS Probit模型计算所得MIC50和MIC90分别为1.0和2.0 μg/mL;氟苯尼考对40株嗜水气单胞菌的MPC为3.2~25.6 μg/mL,基于SPSS Probit模型计算所得MPC50和MPC90分别为6.4和16.0 μg/mL,MSW(MIC90~MPC90)和SI(MPC90/MIC90)分别为2.0~16.0 μg/mL和8。
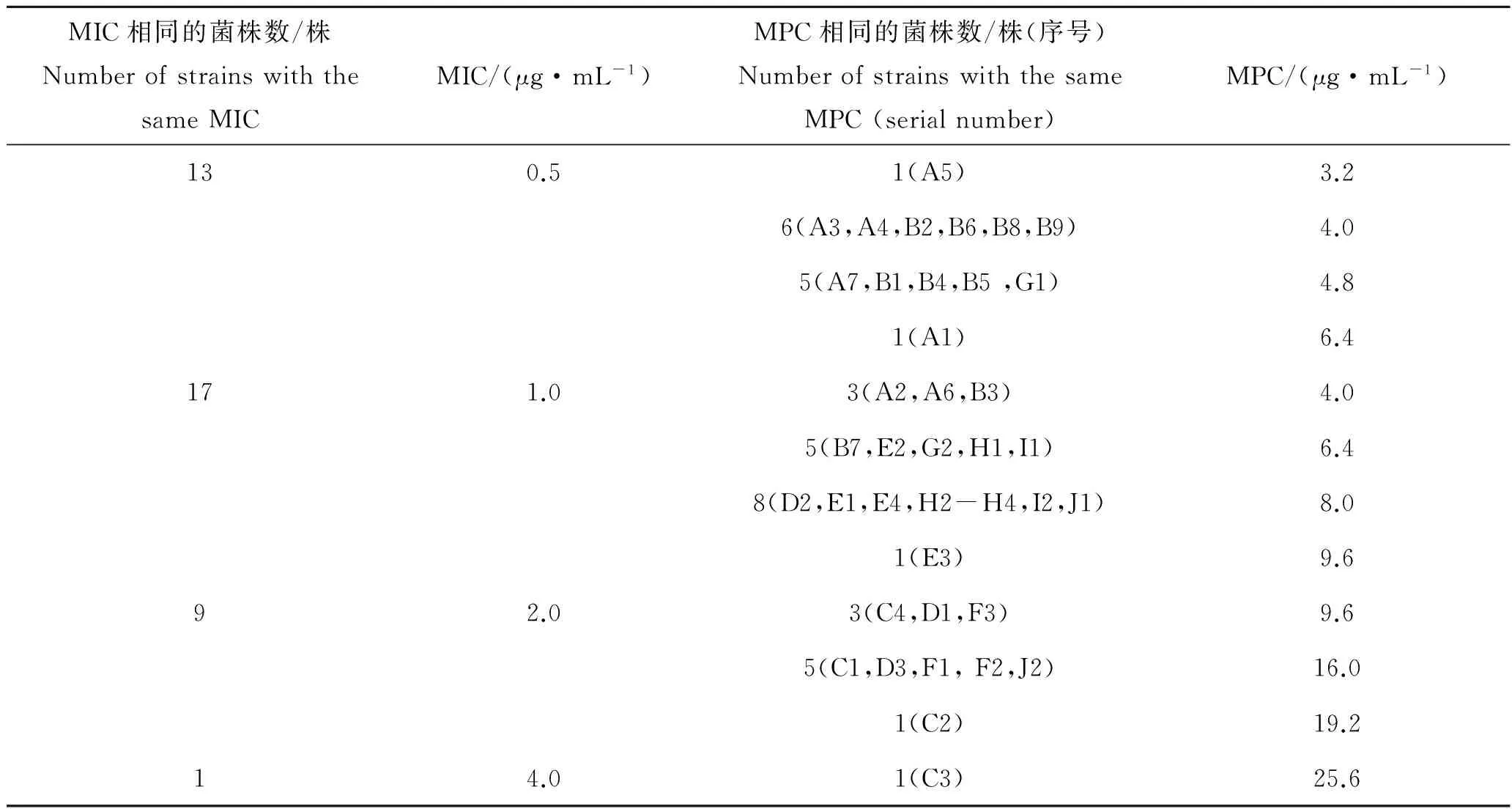
表2 氟苯尼考对40株嗜水气单胞菌临床株的最低抑菌浓度(MIC)和防突变浓度(MPC)Tab.2 MIC and MPC of florfenicol against 40 isolates of Aeromonashy drophilia
3 讨论
抗菌药物的大量使用,特别是毫无节制的不合理使用导致细菌耐药性日趋严重。然而新药研发费用巨大且周期很长,因此充分利用现有药物,并利用药动学和药效学理论来制定合理的给药方案是防止和控制耐药性产生的有效办法。传统生产中,抗菌药物的使用以治愈疾病而非阻止耐药为目标,药效学参数主要以MIC为指导,其着眼点是通过抗菌药物杀死或抑制敏感细菌,依赖宿主防御系统清除突变菌,从而达到控制感染,减少严重不良反应的目的,但大量反复使用抗菌药物所产生的选择压力,使细菌中的突变亚群逐渐发展成为优势菌群,导致细菌发生不同水平的耐药性。这就迫切需要寻找新的治疗策略,在控制感染的同时,防止细菌耐药性的进一步发展。美国学者Zhao及其团队[15-16]于1999年首先提出了关于细菌MPC和MSW的理论,将MPC作为评价抗菌药物新的药效学指标,为临床优化抗菌药物给药方案,限制耐药突变体选择性扩增提供了新思路,也对新药的开发提出了新要求。MPC与MSW治疗策略既要控制感染,又要防止耐药。选择MPC低、MSW窄的药物,调整剂量和给药方案,联合用药,规律用药,有助于关闭或缩小MSW,减少耐药突变菌选择性富集扩增的机率,达到防止细菌产生耐药性的目的。本实验测定了氟苯尼考对嗜水气单胞菌标准株ATCC7966和40样临床分离菌的MIC和MPC,为临床合理用药提供基础数据。
本实验测得氟苯尼考对嗜水气单胞菌ATCC7966的MIC为1.0 μg/mL。而吴雅丽等[17]报道恩诺沙星、多西环素和甲氧苄啶对嗜水气单胞菌ATCC7966的MIC分别为0.002、 0.125和2.000 μg/mL。Libisch等[18]报道环丙沙星、庆大霉素、四环素对嗜水气单胞菌ATCC7966的MIC分别为<0.5、 2.0和0.5 μg/mL。表明恩诺沙星、多西环素、环丙沙星和四环素对嗜水气单胞菌ATCC7966的抗菌活性可能优于氟苯尼考,而甲氧苄啶和庆大霉素对嗜水气单胞菌ATCC7966的抗菌活性可能不如氟苯尼考。
本实验中氟苯尼考对40株嗜水气单胞菌分离菌的MIC为0.5~4.0 μg/mL,MPC为3.2~25.6 μg/mL,SI为4.8~12.8。李梦影等[19]测得氟苯尼考对 1株嗜水气单胞菌的MIC为0.5 μg/mL,MPC为6.0 μg/mL,SI为12,这些参数数值均在本实验测定的相应参数数值的范围之内,说明本实验选取菌株数量较多,所得数据具有一定程度的代表性。然而俞观泉等[20]测得氟苯尼考对5株嗜水气单胞菌的MIC为8.0~19.2 μg/mL,MPC均大于128 μg/mL,这些数值与本实验数据相比存在着较大差异,这可能是所用菌株本身MIC值较高所致。SI为选择指数,是MPC与MIC的比值,用于比较抗菌药物诱导产生耐药突变株的能力,选择指数越小,MSW窗口越窄,筛选出耐药菌株的机会就越小;反之,选择指数越大,MSW窗口越宽,产生耐药菌株的机会就越大。本实验不同临床分离株选择指数差异较大,这可能与不同菌株发生耐药突变的基因不同有关。MIC范围为0.5~4.0 μg/mL,MIC50和MIC90分别为1.0和2.0 μg/mL;MPC为3.2~25.6 μg/mL,MPC50和MPC90分别为6.4和16.0 μg/mL。
李梦影等[19]报道鲫口服10 mg/kg氟苯尼考,血浆中氟苯尼考达峰时间为4.0 h,峰浓度为7.80 μg/mL,消除半衰期为92.11 h。根据2010年版《兽药使用指南(化学药品)》对于各种水产动物,氟苯尼考口服给药推荐剂量为10 mg/kg(以氟苯尼考计)。国内批准上市的水产用氟苯尼考粉说明书上的推荐剂量为:“以氟苯尼考计,每1 kg体重鱼、虾、蟹拌饵投喂10~15 mg”。据文献报道,水产动物口服10~15 mg/kg 氟苯尼考,血药浓度达峰时间一般为3~12 h,峰浓度在2.37~7.80 μg/mL之间[19,21-23]。此时氟苯尼考血药浓度虽远在MIC90之上,但是却显著低于MPC90(16.0 μg/mL),落在了MSW内,菌株发生耐药突变的机率加大。因此,按照氟苯尼考推荐给药方案,容易出现细菌耐药性。研究表明氟苯尼考为浓度依赖性药物,其杀菌作用和临床疗效随着血药浓度的增加而增加[24]。本实验得到的MPC90高达16.0 μg/mL,而氟苯尼考在鲫和草鱼体内的药物代谢动力学研究表明,即使增加给药剂量到30 mg/kg,也无法使血药浓度处于MPC90以上[19]。加大给药剂量使血药浓度始终处于MPC90之上,这样既可以清除细菌,又能避免出现耐药菌株。但是因为药物毒副作用和药物残留问题,临床用药时不能随意提高给药剂量,因此该法难以在临床上推广。有研究表明,联合用药可以缩小或关闭病原菌的突变选择窗,氟苯尼考联合多西环素使氟本尼考对3株大肠杆菌的MPC分别由原来的256.0、 128.0、 460.8 μg/mL,变为8.0、 8.0、 16.0 μg/mL,均关闭了MSW,有效抑制了耐药突变菌株的产生[25]。卢静等[26]报道在联合药敏试验中,没食子酸或槲皮素与氟苯尼考联合用药对嗜水气单胞菌具有协同作用,有助于降低抗生素的用量及残留。理论上,通过联合用药,耐药菌株的产生必须同时对两种药物发生耐药突变,发生的概率约为10-14~10-18,因此不易产生耐药性[27]。以上研究表明,单纯使用氟苯尼考易导致嗜水气单胞菌产生耐药性,或许将氟苯尼考与其他抗菌药物联合应用,是缩小甚至关闭耐药突变选择窗的最佳选择。因此,下一步仍需继续研究氟苯尼考和其他抗菌药物合用对嗜水气单胞菌耐药突变的影响,并结合药动学数据,探索制定氟苯尼考在水产养殖中合理使用的具体方案,以更好地服务实际生产。
[1] Rahman M M, Somsiri T, Tajima K, et al. Distribution ofAeromonassp. emphasizing on a newly identified species ofAeromonassp. T8 isolated from fish and aquatic animals in Southeast Asia[J]. Pak J Biol Sci, 2004, 7(2): 258-268.
[2] 吴学祥,温贵兰,文明,等. 大鲵致病性嗜水气单胞菌的分离鉴定与耐药性分析[J]. 黑龙江畜牧兽医, 2014, 4(7): 108-110.
[3] Vivas J F, Carracedo B, Riano J, et al. Behavior of anAeromonashydrophilaaroA live vaccine in water microcosms[J].Appl Environ Microb, 2004, 70(5): 2702-2708.
[4] Guz L, Kozinska A. Antibiotic susceptibility ofAeromonashydrophilaandA.sobriaisolated from farmed carp (CyprinuscarpioL.)[J]. Bull Vet Inst Pulawy, 2004, 48: 391-395.
[5] 贺利民,曾振灵,黄显会,等. 气相色谱-质谱联用法测定猪肉组织中氟苯尼考残留[J]. 华南农业大学学报, 2005, 26(3): 100-102.
[6] Mcginnis A, Gaunt P, Santucci T, et al. In vitro evaluation of the susceptibility ofEdwardsiellaictaluri, etiological agent of enteric septicemia in channel catfish,Ictaluruspunctatus(Rafinesque), to florfenicol[J]. J Vet Diagn Invest, 2003, 15(6): 576-579.
[7] Gaunt P, Endris R, Khoo L, et al. Preliminary assessment of the tolerance and efficacy of florfenicol againstEdwardsiellaictaluriadministered in feed to channel catfish[J]. J Aquat Anim Health, 2003, 15(3): 239-247.
[8] 张文文. 常用渔药有效含量、杀菌效果比较及抗生素耐药性初步研究[D].舟山: 浙江海洋学院, 2014.
[9] 耿昕颖,葛铮,孔令聪,等. 52 株不同淡水鱼类维氏气单胞菌耐药表型的分析[J]. 中国兽药杂志, 2015, 49(6): 1-5.
[10] 曹颖颖,杜泓明,白安斌,等. 家养观赏地图鱼肺炎克雷伯氏菌, 维氏气单胞菌与黏质沙雷氏菌的分离鉴定及耐药性分析[J]. 中国畜牧兽医, 2015, 42(1): 215-223.
[11] 丛莉. 鱼塘生态体系沙门氏菌的耐药性及耐药基因分析[D].广州: 暨南大学, 2011.
[12] Drlica K, Zhao X. Mutant selection window hypothesis updated[J]. Clin Infect Dis, 2007, 44(5): 681-688.
[13] Xilin Z, Drlica K. Restricting the selection of antibiotic-resistant mutant bacteria: measurement and potential use of the mutant selection window[J]. J Infect Dis, 2002, 185(4): 561-565.
[14] 崔俊昌,刘又宁,王睿,等. 4 种氟喹诺酮类药物对金黄色葡萄球菌的防耐药变异浓度[J]. 中华医学杂志, 2004, 84(22): 1863-1866.
[15] Dong Y, Zhao X, Domagala J, et al. Effect of fluoroquinolone concentration on selection of resistant mutants ofMycobacteriumbovisBCG andStaphylococcusaureus[J]. Antimicrob Agents Ch, 1999, 43(7): 1756-1758.
[16] Zhao X, Drlica K. Restricting the selection of antibiotic-resistant mutants: a general strategy derived from fluoroquinolone studies[J]. Clin Infect Dis, 2001, 33(Supplement 3): S147-S156.
[17] 吴雅丽,邓玉婷,姜兰,等. 广东省水产动物源气单胞菌对抗菌药物的耐药分析[J]. 上海海洋大学学报, 2013, 22(2): 219-224.
[18] Libisch B, Giske C G, Kovács B, et al. Identification of the first VIM metallo-β-lactamase-producing multiresistantAeromonashydrophilastrain[J]. J Clin Microbiol, 2008, 46(5): 1878-1880.
[19] 李梦影,徐丽娟,吕利群. 氟苯尼考在鲫和草鱼体内的药代/药效动力学联合参数及其临床给药方案的研究[J]. 水产学报, 2014, 38(6): 888-895.
[20] 俞观泉, 卢彤岩, 杨雨辉. 几种抗茵药物对嗜水气单胞菌突变选择窗 (MSW) 范围的研究[J]. 中国兽医杂志, 2012, 48(12): 73-75.
[21] Gaunt P S, Langston C, Wrzesinski C, et al. Single intravenous and oral dose pharmacokinetics of florfenicol in the channel catfish (Ictaluruspunctatus)[J]. J Vet Pharmacol Ther, 2012, 35(5): 503-507.
[22] 王瑞雪. 氟苯尼考在西伯利亚鲟的体内外药效学及药动学研究[D]. 哈尔滨: 东北农业大学, 2012.
[23] 王伟利,罗理,姜兰,等. 适温条件下氟苯尼考在罗非鱼体内的药物动力学[J]. 大连水产学院学报, 2010, 25(4): 285-288.
[24] Sidhu P, Rassouli A, Illambas J, et al. Pharmacokinetic-pharmacodynamic integration and modelling of florfenicol in calves[J]. J Vet Pharmacol Ther, 2014, 37(3): 231-242.
[25] 陈阳阳,薛慧亮,马红霞,等. 氟苯尼考联合多西环素缩小猪源大肠杆菌耐药突变选择窗[J]. 中国兽医学报, 2013, 33(11): 1720-1723.
[26] 卢静,王振宁,陈锐,等.几种中药单体和抗生素对嗜水气单胞菌及温和气单胞菌的体外抑菌活性研究[J].水生生物学报, 2013, 37(6):1128-1132.
[27] 肖永红.细菌耐药防突变浓度与抗菌药的合理应用[J].中国医学论坛报, 2007, 33(24): 20-20.
