气相色谱法测定罗非鱼肌肉和血浆中4种拟除虫菊酯类农药残留
2018-03-07李丽春刘书贵尹怡郑光明马丽莎谢文平戴晓欣单奇赵城
李丽春,刘书贵,尹怡,郑光明,马丽莎,谢文平,戴晓欣,单奇,赵城
(中国水产科学研究院珠江水产研究所,农业部水产品质量安全风险评估实验室(广州);农业部休闲渔业重点实验室,广州 510380)
拟除虫菊酯类农药因其高效广谱、低毒低残留的特性被广泛运用于农业和渔业生产中。其在水产品中可被鱼鳞吸收,进入鱼体产生毒性[1],进而经食物链进入人体,给人类健康带来风险[2-3]。许多国家和地区对其在水产品中的残留量做出了限定,欧盟规定水产品中氯氰菊酯最大残留量为50 μg/kg,溴氰菊酯为10 μg/kg[4]。日本“肯定列表制度”中规定了鲑形目:大马哈鱼(Oncorhynchusketa)和虹鳟(Oncorhynchusmykiss)等中氯氰菊酯、溴氰菊酯最高残留限量为30 μg/kg,其他鱼及水生动物均为10 μg/kg[5],中国农业部235号公告也规定鱼肌肉中溴氰菊酯最大残留限量为30 μg/kg[6],近年来由于部分有机磷和有机氯农药的限用,拟除虫菊酯类农药在水产养殖中的运用越来越多,水产品中拟除虫菊酯类农药残留风险倍受关注。
罗非鱼(Oreochromisspp.)为热带暖水性鱼类,在亚洲、美洲和非洲100多个国家均有养殖[7-8],目前中国已成为世界上最大的罗非鱼生产国、出口国和消费国,2007年中国罗非鱼出口总量和出口总额分别占全球的50%和70%[9]。随着贸易量的增加,罗非鱼的质量安全也越来越受到重视。目前罗非鱼中药物残留研究大多集中在兽药残留方面,拟除虫菊酯类农药在罗非鱼中残留分析仅限于肌肉样品[10-11]。水产品中有机磷和有机氯农药的研究较多,而拟除虫菊酯类农药残留情况的报道较少[12-16]。
目前拟除虫菊酯农药残留量检测的常规方法有气相色谱法(GC)[17-19]、气相色谱质谱法(GC-MS)[17,20-22]、高效液相色谱法(HPLC)[23-26]和酶联免疫分析方法(ELISA)[27],其中GC-MS大多采用层析柱净化的方法,处理过程繁琐[17,19,28-29],且大多集中在水体和肌肉中的残留分析,对于鱼体血浆中的残留分析研究尚未见报道。血浆中药物残留可揭示药物在鱼体内的吸收、代谢和消除等动态变化规律,预示药物在其体内是否发生蓄积残留等规律,进而为药物残留隐患分析提供依据。因此,本研究拟开发更加高效、快捷、简单的水产品中拟除虫菊酯类农药残留分析方法,能够实现同时检测拟除虫菊酯类药物在罗非鱼肌肉和血浆中残留量,从而为拟除虫菊酯农药在罗非鱼中的药代动力学研究及其质量安全风险评估提供技术支持。
1 材料和方法
1.1 材料和试剂
甲氰菊酯、氯氰菊酯、氰戊菊酯和溴氰菊酯,纯度为99.0%~99.5%,购买于德国Dr. Ehrenstorfer公司。乙腈(色谱纯)和正己烷(色谱纯),韩国 Honeywell Burdick & Jackson公司;无水硫酸镁(分析纯)和氯化钠(分析纯),国药集团化学试剂有限公司;N-丙基乙二胺(PSA,40~60 μm)和中性氧化铝(100~300目),天津博纳艾杰尔科技公司。罗非鱼购买于广州市荔湾区荔塱市场,在实验室饲养一周后取肌肉和血浆。
1.2 仪器设备
气相色谱仪(Agilent 7890A),配备63Ni-ECD 检测器,HP-5(5%苯基甲基硅氧烷)毛细管色谱柱(30 m×0.32 mm×0.25 μm),天平(XS5003SXDR,Mettrt Toedo,UAS),氮吹仪(N-EVAP-112, USA),离心机(TDL-5-A),漩涡振荡器(MS3, IKA, Germany)及其他常规器皿等。
1.3 标准储备液的配制
分别准确称取10.0 mg的甲氰菊酯、氯氰菊酯、氰戊菊酯和溴氰菊酯标准品用正己烷定容至10 mL,配制成1.0 mg/mL标准储备液。分别移取0.1 mL的4种菊酯类农药标准储备液于同一容量瓶中,用正己烷定容至10 mL配制成10 μg/mL混合标准溶液。采用系列稀释法分别配制实验所需混合标准溶液。
1.4 前处理方法
1.4.1 肌肉样品
准确称取罗非鱼肌肉样品5.0 g,加入10 mL乙腈、2.0 g无水硫酸镁和1.0 g氯化钠,振荡提取1 min,以2 400 g离心5 min,上层提取液转入装有PSA 150 mg、中性氧化铝300 mg和无水硫酸镁300 mg的离心管中,剩余残渣再用5 mL乙腈提取1次,合并提取液,涡旋振荡1 min,然后2 400 g 离心5 min,上层净化液,转移至50 mL 玻璃指型管中,氮气吹干,用1 mL正己烷定容,过0.22 μm微孔滤膜待GC-ECD检测。
1.4.2 血浆样品
准确量取罗非鱼血浆样品1 mL于装有0.3 g无水硫酸镁、0.2 g氯化钠和50 mg PSA的15 mL离心管中,加入5 mL乙腈,振荡提取1min,以2 400 g离心5 min,上层溶液转移至10 mL 玻璃指型管中,剩余残渣用2 mL乙腈重复提取1次,合并提取液,氮气吹干,然后用1 mL正己烷定容,过0.22 μm微孔滤膜待GC-ECD检测。
1.5 测定条件
气相色谱仪7890A(Agilent),63Ni-ECD 检测器,色谱柱为HP-5毛细管柱 (5%苯基-甲基聚硅氧烷),30 m×0.32 mm×0.25 μm;载气为99. 999%高纯氮气。进样口温度270 ℃,进样量1 μL,不分流进样。柱温程序:初始温度160 ℃,维持1 min;以40 ℃/min 升至250 ℃,维持2 min;再以10 ℃/min升至280 ℃,保持8 min。柱流速为2.5 mL/min(恒定流量) 。检测器为63Ni-ECD 检测器,检测器温度300 ℃。尾吹气流速为25 mL/min。
2 结果与讨论
2.1 色谱条件优化及标准色谱图
进样口温度和检测器对4种菊酯类农药的响应值有一定影响,为了防止色谱柱出来的样品对检测器造成污染,降低检测器灵敏度,检测器温度应高于进样口温度[23,30],因此选择4种菊酯类农药分析的最佳进样口温度和检测器温度分别为270 ℃和300 ℃。采用100 ng/mL的混合标准工作溶液和空白基质溶液在已确定的色谱条件下检测,可获得较为理想的色谱图(图1),4种菊酯类农药分离效果较好,无杂质峰干扰。

图1 100 ng·mL-1标准溶液色谱图Fig.1 Chromatograms of pyrethroids standard solution (100 ng·mL-1)
2.2 提取剂的选择
目前拟除虫菊酯类农药常用提取剂有乙腈、正己烷、环己烷、丙酮和乙酸乙酯等[31],本研究优化比较了乙腈、1%乙酸酸化的乙腈、正己烷-丙酮(2∶1,V∶V)和环己烷-乙酸乙酯(1∶1,V∶V)4种提取剂对罗非鱼肌肉中4种菊酯类农药的提取效果,采用基质加标法评价提取剂对目标化合物的提取效果,分别向5.0 g肌肉样品中加入1.0 μg/mL混合标准工作溶液0.25 mL,使样品中4种菊酯含量为50 ng/g,分别用15 mL乙腈、1%乙酸酸化的乙腈、正己烷-丙酮(V∶V=2∶1)和环己烷-乙酸乙酯(V∶V=1∶1)提取,经吸附剂净化后GC-ECD检测,比较其回收率,每种提取剂重复实验6次。
表1结果表明,提取剂对肌肉中4种菊酯类农药的回收率影响较大,乙腈对4种菊酯类农药的提取效果较为理想,回收率均在97.4%~106.8%之间;酸化乙腈明显降低了其提取效率,4种菊酯类农药回收在81.3%以下;而正己烷-丙酮(2∶1,V/V)和环己烷-乙酸乙酯(1∶1,V/V)提取时基质效应较大,其回收率在113.5%~217.0%之间,为此本研究最终确定采用乙腈作为肌肉样品中4种农药的提取剂。
2.3 超声时间对回收率的影响
肌肉样品采用基质加标的方法对超声提取时间进行了优化选择,5.0 g肌肉基质中加入1.0 μg/mL混合标准工作溶液0.25 mL,使样品中4种菊酯含量为50 ng/g,分别超声提取0、5、10、15和20 min,比较不同超声时间下的回收率,分析超声时间对回收率的影响。
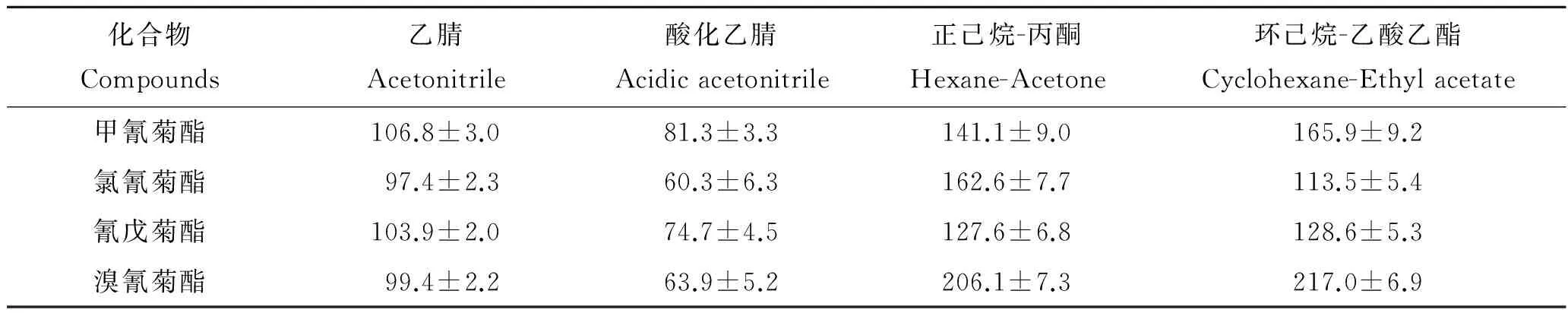
表1 不同提取剂处理下肌肉中4种菊酯类农药的回收率Tab.1 Recoveries of 4 pyrethriods in muscle extracted with different extraction agents %,n=6
超声波可利用其空化作用产生的能量将农药从各类食品中提取到溶剂中[30],因此本研究对超声波提取时间进行了优化比较。结果发现,超声提取对甲氰菊酯的提取回收率没有太大影响,超声提取5~20 min提取回收率在106.2%~114.9%之间(表2);氯氰菊酯、氰戊菊酯和溴氰菊酯随着超声时间的增加提取回收率逐渐降低,说明超声可能对3种菊酯有降解作用。已有研究表明,超声波对菊酯具有催化降解作用,氯氰菊酯在26.85 ℃下超声处理28.64 min 降解率可达到44.9%[32];在弱酸性环境中超声波-TiO2光催化降解高效氯氰菊酯时,超声处理2 h其降解率可达98.3%[33];联合Fenton试剂超声降解氯氰菊酯模拟废水,其降解率可达100%[34]。而本研究在未超声情况下,肌肉中4种菊酯类农药提取回收在98.0%~110.7%之间,因此实验选择采用涡旋振荡1 min的方法提取罗非鱼肌肉中的4种菊酯类农药。
2.4 净化剂的选择
2.4.1 肌肉样品净化剂选择
选用中性氧化铝和PSA为净化剂,分别设计150 mg PSA、300 mg 中性氧化铝、150 mg PSA+300 mg中性氧化铝3种净化方法,同时加入300 mg 无水硫酸镁用于吸附提取液中的水分,采用基质加标法比较3种净化方式对罗非鱼基质的净化效果,以不加吸附剂为对照,净化后样品经GC-ECD检测分析获得其色谱叠加图(图2)。

表2 不同超声时间下肌肉中4种菊酯类农药的加标回收率Tab.2 Recoveries of 4 pyrethroids in muscle treated with different ultrasonic time %,n=6
由图2可知,罗非鱼肌肉样品基质对检测干扰较大,不采用吸附剂进行净化处理的色谱图基线漂移较为严重,存在较大的干扰,使得甲氰菊酯和氯氰菊酯无法准确定性和定量;采用PSA和中性氧化铝单独净化时对甲氰菊酯和氯氰菊酯干扰仍较明显,基线较高,可导致基质效应增强,且无法准确定量;而选择PSA+中性氧化铝净化,净化后样品色谱图干净,基线稳定无漂移,对目标化合物无干扰,可准确定性和定量。因此本方法选择PSA+中性氧化铝作为检测罗非鱼肌肉中4种拟除虫菊酯类农药的净化剂,可得到无干扰的色谱图,满足分析要求。
2.4.2 血浆样品净化剂选择
采用中性氧化铝和PSA为净化剂,分别设计50 mg PSA、100 mg 中性氧化铝、50 mg PSA+100 mg 中性氧化铝3种净化方法,采用基质加标法比较3种净化方式对罗非鱼血浆样品的净化效果,以不加吸附剂为空白对照。

图2 不同净化方式下肌肉样品色谱叠加图Fig.2 Chromatograms of 4 pyrethroids with different clean-up procedures
由表3可知,不同净化方式对血浆样品中菊酯类农药的加标回收率影响较大,PSA净化下的加标回收率在96.1 %~105.1%,相对标准偏差在2.6%~4.0%;其他两种净化方式下回收率在54.8%~88.1%,相对标准偏差在2.6%~6.6%;而未净化的样品中加标回收率在119.8%~137.2%,相对标准偏差在5.6%~6.4%。未净化的样品因为杂质峰较多,对目标化合物的定量造成干扰,存在明显的基质增强效应,使样品检测值偏高。因此本方法采用PSA作为血浆样品的净化剂。

表3 不同净化方式下血浆样品中4中葡酸类农药的加标回收率Tab.3 Recoveries of 4 pyrethriods with different clean-up procedures in blood sample %,n=6
2.5 基质效应
在建立的前处理方法和色谱测定条件下,测定空白基质提取液与纯溶剂中同浓度目标物的响应强度,通过二者峰面积的相对比值评价基质效应(matrix effect,ME)[35],即ME=基质中目标物峰面积/溶剂中目标物峰面积。如果ME大于1.0,说明基质对目标化合物具有增强响应强度的作用;如果ME小于1.0,说明基质对目标化合物具有抑制其响应强度的作用;如果ME等于1.0,则说明基质对目标化合物无影响,即不存在基质效应。ME偏离1.0越大说明基质效应越强,ME越接近1.0,则表明基质效应越小[36-40]。本研究分别对罗非鱼肌肉和血浆进行了基质效应的评价,加标水平分别为0.5、 1.0、 2.0、 10、 20、 50、 100和150 ng/g(或ng/mL),4种菊酯类农药在肌肉和血浆中的基质效应结果如图3。

图3 4种菊酯农药在血浆(A)和肌肉(B)中的基质效应Fig.3 Matrix effects of 4 pyrethroids in plasma(A)and muscle(B)
4种菊酯类农药在肌肉和血浆中除甲氰菊酯外均存在一定的基质效应,甲氰菊酯基质效应在0.97~1.04之间,表明甲氰菊酯在罗非鱼肌肉和血浆基质中基质效应较小。其他3种菊酯类农药均存在基质增强效应,溴氰菊酯在肌肉中基质效应最强,其基质效应在2.19~2.52之间(图3)。据文献报道,基质效应大小与基质中目标分析物浓度有一定关系,高浓度水平基质效应低于低浓度水平[41],本研究中浓度对基质效应的影响与前人研究一致。溴氰菊酯在肌肉和血浆中均存在明显的基质增强效应,且4种菊酯类农药在含量为10~150 ng/g(或ng/mL)范围内变化时,基质效应变化不明显。因此本方法采用基质加标的方式降低残留分析中基质效应的影响。
2.6 线性范围、检出限和定量限
采用系列稀释法配制质量浓度范围在2.5~750 ng/mL的4种菊酯类农药混合标准溶液,按照最终优化好的色谱条件进行测定,以峰面积为纵坐标,质量浓度为横坐标建立标准曲线,获得4种菊酯类农药的线性方程及相关系数(表4)。4种菊酯类农药在2.5~750 ng/mL范围内线性良好,相关系数在0.999 1以上。分别以性噪比(S/N)等于3和10计算方法中农药的检出限(LOD)和定量限(LOQ),甲氰菊酯和溴氰菊酯方法检出限和定量限分别为肌肉中0.1 μg/kg和0.4 μg/kg,血浆中0.5 μg/L和2.0 μg/L;氰戊菊酯和氯氰菊酯方法检出限和定量限分别为肌肉中0.2 μg/kg和0.6 μg/kg,血浆中1.0 μg/L和3.0 μg/L,该方法检出限和定量限满足农药残留分析要求。
2.7 回收率和精密度
采用基质加标的方法分别考察了罗非鱼肌肉和血浆中2.0、 10.0和50.0 μg/kg(或μg/L)3个含量水平的添加回收率,每个水平设置6次重复,并对其加标回收率及日内精密度和日间精密度进行了测定,测定结果见表5。
由表5可知,4种菊酯类农药在肌肉样品中加标水平为2.0、 10.0和50.0 μg/kg的平均回收率在92.3%~107.5%,相对标准偏差在3.2%~7.6%;血浆样品中3个浓度水平的平均回收率在97.5%~105.1%,相对标准偏差在1.9%~8.7%。肌肉样品中日间精密度为1.8%~8.3%,血浆样品中日间精密度为1.3%~7.7%。该方法下加标回收率在92%以上,相对标准偏差在8.7%以下,在仪器稳定条件下该方法满足农药残留检测要求。
3 结论
本研究通过对前处理方法和气相色谱条件进行优化,建立了罗非鱼血浆和肌肉中4种拟除虫菊酯类农药残留量的分析方法。样品经乙腈提取,PSA和中性氧化铝净化,正己烷定容后GC-ECD测定,采用基质标准曲线外标法定量。该方法建立的色谱条件可在10 min之内完成4种菊酯类农药的测定,色谱分离效果较好且无杂质峰干扰;在2.5~750 ng/mL质量浓度范围内线性关系良好,相关系数在0.999 1以上。在2.0、 10.0和50.0 μg/kg 3个添加水平下,肌肉平均加标回收率在92.3%~107.5%,相对标准偏差在3.2%~7.6%;血浆平均加标回收率在97.5%~105.1%,相对标准偏差在1.9%~8.7%;在肌肉和血浆中日间精密度在1.8%~8.3%和1.3%~7.7%。

表4 4种菊酯类农药线性方程、相关系数、检出限和定量限Tab.4 Linear equation, correlation, LOD and LOQ for 4 pyrethriods
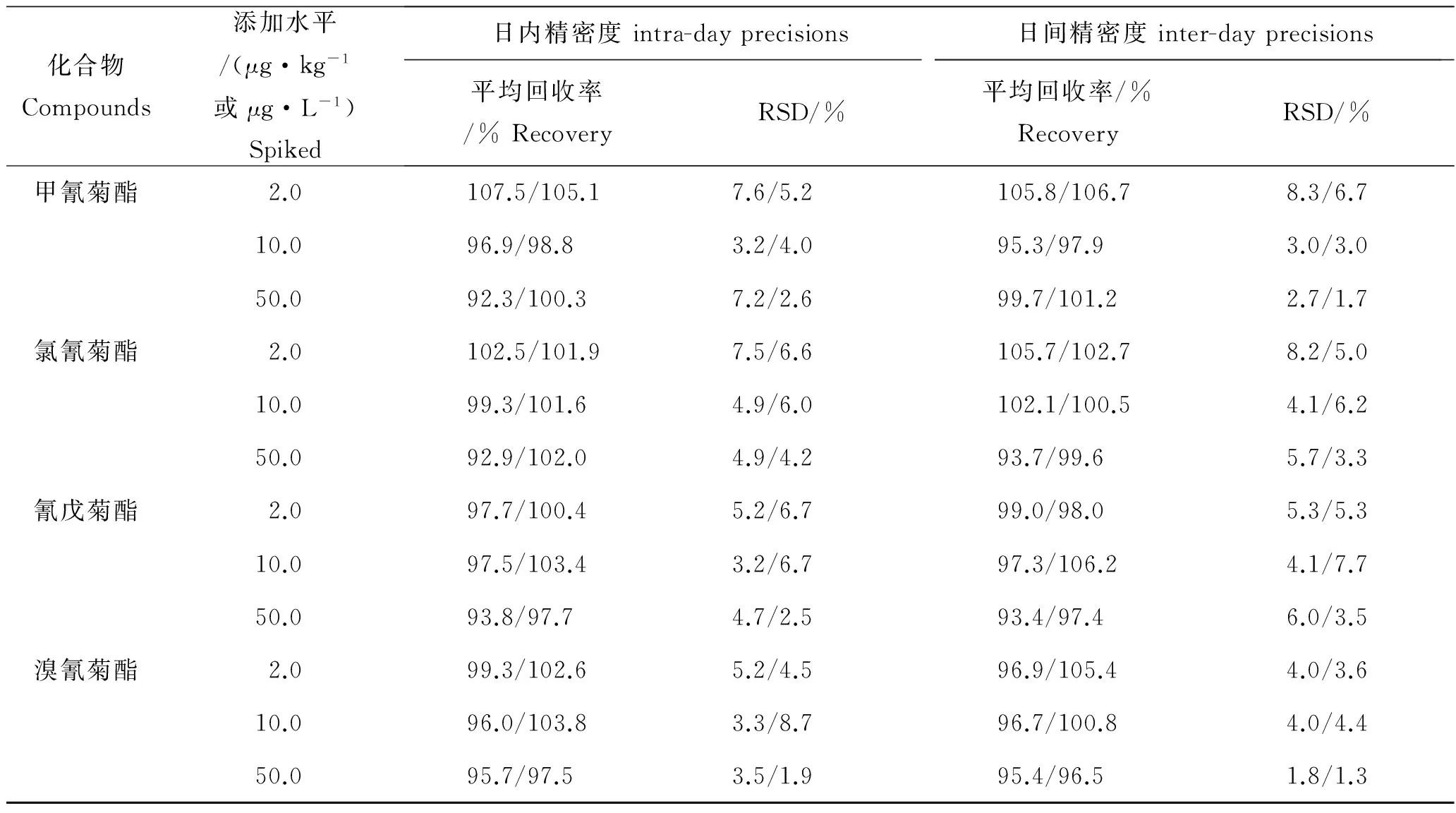
表5 肌肉和血浆中4种菊酯类农药平均加标回收率和精密度Tab.5 Average recoveries and precisions of 4 pyrethroids in muscle and plasma n=6
注:日内和日间精密度中斜杠前方数据表示为在肌肉中的值,后方数据表示为在血浆中的数值。
甲氰菊酯和溴氰菊酯方法检出限和定量限分别为肌肉中0.1 μg/kg和0.4 μg/kg,血浆中0.5 μg/L和2.0 μg/L;氰戊菊酯和氯氰菊酯方法检出限和定量限分别为肌肉中0.2 μg/kg和0.6 μg/kg,血浆中1.0 μg/L和3.0 μg/L。结果表明,该方法前处理操作便捷,肌肉样品经提取和净化两步完成,血浆样品提取和净化同时进行;且前处理所需要的溶剂量较少,可有效节约成本,降低环境污染,大大缩短分析时间。该方法灵敏度、重复性和准确性较好,适用于罗非鱼等水产品肌肉和血浆中拟除虫菊酯类农药残留量的测定,可为该类药物在水产品中的药代动力学和质量安全风险评估研究提供可靠的技术支持。
[2] 张征, 李今, 梁威, 等. 拟除虫菊酯杀虫剂对水生态系统的毒性作用[J]. 长江流域资源与环境, 2006(1):125-129.
[3] 刘淑娟. 生物农药与生态环境保护[J]. 泰安师专学报, 2002(6):74-75.
[4] Esteve-Turrillas F A, Pastor A, de la Guardia M. Comparison of different mass spectrometric detection techniques in the gas chromatographic analysis of pyrethroid insecticide residues in soil after microwave-assisted extraction[J]. Anal Bioanal Chem, 2006,384(3):801-809.
[5] 葛志荣. 食品中农业化学品残留限量(食品卷)[M]. 北京: 中国标准出版社, 2006.
[6] 农业部畜牧兽医局. 农业部发布动物性食品中兽药最高残留限量[J]. 中国兽药杂志, 2003, 25(2):5-11.
[7] 夏德全. 中国罗非鱼养殖现状及发展前景[J]. 科学养鱼, 2000(5):4-21.
[8] 陈胜军, 李来好, 杨贤庆, 等. 我国罗非鱼产业现状分析及提高罗非鱼出口竞争力的措施[J]. 南方水产, 2007(1):75-80.
[9] 雷光英, 曹俊明, 万忠, 等. 2008年度广东省罗非鱼产业发展现状分析[J]. 广东农业科学, 2009(7):240-243.
[10] 阮伟达, 叶文迪, 黄剑锋. 罗非鱼中拟除虫菊酯类农药检测净化条件的优化[J]. 海峡预防医学杂志, 2015(1):10-13.
[11] 王帅. 罗非鱼及水体中拟除虫菊酯类农药残留量的测定[D]. 长沙:中南林业科技大学, 2013.
[12] Caldas E D, Coelho R, Souza L C K R, et al. Organochlorine pesticides in water, sediment, and fish of Paranoá Lake of Brasilia, Brazil[J]. B Environ Contam Tox, 1999, 62(2):199-206.
[13] Sankararamakrishnan N, Kumar Sharma A, Sanghi R. Organochlorine and organophosphorous pesticide residues in ground water and surface waters of Kanpur, Uttar Pradesh, India[J]. Environ Int, 2005, 31(1):113-120.
[14] Omwenga M, Kanja L, Nguta J, et al. Assessment of organochlorine pesticide residues in farmed fish in Machakos and Kiambu Counties, Kenya[J]. Toxicol Lett, 2016, 258:S176-S177.
[15] Varol M, Sünbül M R. Organochlorine pesticide, antibiotic and heavy metal residues in mussel, crayfish and fish species from a reservoir on the Euphrates River, Turkey[J]. Environ Pollut, 2017, 230:311-319.
[16] Jayashree R, Vasudevan N. Organochlorine pesticide residues in ground water of Thiruvallur district, India[J]. Environ Monit Assess, 2007, 128(1):209-215.
[17] Zhang Y, Zhang X, Jiao B. Determination of ten pyrethroids in various fruit juices: comparison of dispersive liquid-liquid microextraction sample preparation and QuEChERS method combined with dispersive liquid-liquid microextraction[J]. Food Chem, 2014,159:367-373.
[18] Fernandez-Alvarez M, Llompart M, Lamas J P, et al. Development of a matrix solid-phase dispersion method for the simultaneous determination of pyrethroid and organochlorinated pesticides in cattle feed[J]. J Chromatogr A, 2009, 1216(14):2832-2842.
[19] Chen L, Chen W, Ma C, et al. Electropolymerized multiwalled carbon nanotubes/polypyrrole fiber for solid-phase microextraction and its applications in the determination of pyrethroids[J]. Talanta, 2011, 84(1):104-108.
[20] 陈剑刚, 朱克先, 张亦庸, 等. 固相萃取-气相色谱-质谱联用测定水体中拟除虫菊酯残留[J]. 现代预防医学, 2005(6):648-650.
[21] Raeppel C, Appenzeller B M, Millet M. Determination of seven pyrethroids biocides and their synergist in indoor air by thermal-desorption gas chromatography/mass spectrometry after sampling on Tenax TAⓐpassive tubes[J]. Talanta, 2015, 131:309-314.
[22] 杨广, 刘新, 鄢铮, 等. 4种拟除虫菊酯农药的GC-MS和GC-MS/MS检测[J]. 福建农业大学学报, 2003(4):447-452.
[23] Yu X, Yang H. Pyrethroid residue determination in organic and conventional vegetables using liquid-solid extraction coupled with magnetic solid phase extraction based on polystyrene-coated magnetic nanoparticles[J]. Food Chem, 2017, 217:303-310.
[24] Bagheri H, Yamini Y, Safari M, et al. Simultaneous determination of pyrethroids residues in fruit and vegetable samples via supercritical fluid extraction coupled with magnetic solid phase extraction followed by HPLC-UV[J]. J Supercrit Fluid, 2016, 107:571-580.
[25] 罗晓燕, 林玉娜, 周洪伟, 等. 反相高效液相色谱法检测水中五种拟除虫菊酯农药残留量[J]. 中国卫生检验杂志, 2011(6):1371-1372.
[26] Cheng J, Liu M, Yu Y, et al. Determination of pyrethroids in porcine tissues by matrix solid-phase dispersion extraction and high-performance liquid chromatography[J]. Meat Sci, 2009, 82(4):407-412.
[27] 骆爱兰, 余向阳, 张存政, 等. 拟除虫菊酯类农药多残留酶免疫分析方法的建立[J]. 中国农业科学, 2005(2):308-312.
[28] 母玉敏, 叶玫, 吴成业, 等. 气相色谱法测定南美白对虾中10种拟除虫菊酯残留方法的研究[J]. 上海海洋大学学报, 2011(3):399-404.
[29] 万译文, 肖维, 黄华伟. 气相色谱法测定水产品中拟除虫菊酯类农药残留量[J]. 食品与机械, 2010(5):68-70.
[30] 高钰一, 沈美芳, 宋红波, 等. 气相色谱法测定水产品中7种拟除虫菊酯的残留量[J]. 水产学报, 2009,33(1):132-138.
[31] 高立国, 宋小利. 超声波法降解氯氰菊酯的工艺条件优化[J]. 化学试剂, 2017, 39(2):183-186.
[32] 祁晓月, 徐泓, 周兴振. 超声波-二氧化钛光催化耦合法降解高效氯氰菊酯[J]. 化学研究, 2012(3):45-49.
[33] 李百慧. 超声强化Fenton试剂对拟除虫菊酯的降解效能研究[D]. 哈尔滨:哈尔滨商业大学, 2013.
[34] Matuszewski B K, Constanzer M L, Chavez-Eng C M. strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J]. Anal Chem, 2003, 75(13):3019-3030.
[35] 王立琦, 曾振灵, 束建花, 等. 液相色谱-电喷雾串联质谱测定猪组织中β-兴奋剂残留的基质效应[J]. 分析化学, 2012, 40(9):1445-1449.
[36] Garrido F A, Martinez V J, Fernandez M J, et al. Compensation for matrix effects in gas chromatography-tandem mass spectrometry using a single point standard addition[J]. J Chromatogr A, 2009, 1216(23):4798-4808.
[37] Li Y, Chen X, Fan C, et al. Compensation for matrix effects in the gas chromatography-mass spectrometry analysis of 186 pesticides in tea matrices using analyte protectants[J]. J Chromatogr A, 2012,1266:131-142.
[38] Stahnke H, Reemtsma T, Alder L. Compensation of matrix effects by postcolumn infusion of a monitor substance in multiresidue analysis with LC-MS/MS[J]. Anal Chem, 2009, 81(6):2185-2192.
[39] Gergov M, Nenonen T, Ojanpera I, et al. Compensation of matrix effects in a standard addition method for metformin in postmortem blood using liquid chromatography-electrospray-tandem mass spectrometry[J]. J Anal Toxicol, 2015, 39(5):359-364.
[40] 平新亮, 林媚, 王燕斌, 等. 添加13种有机磷农药在4种果蔬中的回收率和基质效应[J]. 江西植保, 2009(3):120-122.
[41] 江燕玲, 成秀娟, 魏燕秋, 等. 有机磷农药残留量检测过程中基质效应研究[J]. 农药科学与管理, 2012(2):25-29.
