欣力康胶囊对肿瘤细胞增殖抑制作用初探
2018-03-07余晓魁李定祥
沈 剑,余晓魁,李定祥,张 杰
欣力康胶囊是由半枝莲、黄芪、当归、龙葵、郁金、红参、蛇莓、雪莲花、轮环藤根和丹参组成的中药复方制剂,具有补气养血、化瘀解毒等功效,可用于癌症放化疗的辅助治疗,增强放化疗的疗效,提高生活质量,防止肿瘤复发与转移[1]。之前研究结果表明,欣力康胶囊对人肺癌细胞A549、人鳞癌细胞A431、人卵巢癌细胞SK-OV-3、白血病细胞HL-60均有一定的抑制作用,其对细胞的抑制率随药物浓度的增加而增加,呈现一定的剂量依赖性[2]。但是,其对其它肿瘤细胞的抗肿瘤活性尚无研究,而且其所含抗肿瘤活性成分也不清楚。本研究考察了欣力康胶囊对乳腺癌细胞(MDA-MB-231、MCF-7)和宫颈癌细胞(silla、caski、C33A)的抗肿瘤活性,并进一步考察其组方中所含化学成分对肿瘤细胞体外增殖的影响,试图寻找其中抗肿瘤的有效成分,为其抗癌机制的深入研究和临床用药提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞株 人乳腺癌细胞株MDA-MB-231、MCF-7由复旦大学药学院提供,人宫颈癌细胞株silla、caski、C33A由复旦大学附属肿瘤医院提供。
1.1.2 药品与试剂 欣力康胶囊、人参皂苷、黄芪甲苷、阿魏酸、秋水仙碱、姜黄素、野黄芩苷均由贵阳新天药业股份有限公司提供。DMEM和RPMI1640培养基、胎牛血清、四甲基偶氮唑盐(MTT)均购自SIGMA公司。
1.1.3 仪器设备 酶标仪(M200 TECAN,瑞士);无菌净化工作台(苏州净化设备厂);二氧化碳培养箱(NV-2500E,美国);微量振荡器(江苏金坛市中大仪器厂);电子天平(BP-2110,德国)。
1.2 实验方法
1.2.1 药物配置 欣力康胶囊用含5% DMSO的无菌水溶解。人参皂苷、黄芪甲苷、阿魏酸、秋水仙碱、姜黄素、野黄芩苷单体均用DMSO溶解。母液分装后于–20 ℃保存备用。
1.2.2 细胞培养 细胞株用含10%的胎牛血清(Gibco)的DMEM或RPMI1640培养液,在37 ℃,5% CO2条件下培养,使用0.25%胰蛋白酶(EDTA)消化,每周传代2~3次。实验所用细胞均处于对数生长期。
1.2.3 MTT法 取对数生长期的细胞,消化配成5×104/mL细胞悬液,每孔100 μL 接种于96孔板内。待细胞24 h贴壁后,再向各孔内按浓度梯度分别加入欣力康胶囊及6个单体化合物(人参皂苷、黄芪甲苷、阿魏酸、秋水仙素、姜黄素、野黄芩苷),欣力康胶囊浓度为0.031 25、0.0625、0.125、0.25、0.5、1 mg/mL,6个单体化合物浓度为2、5、10、20、50、100μg/mL,并设相应的溶剂对照,每孔100μL(DMSO < 0.1%),每组至少设3个平行孔。37 ℃培养72 h后,弃上清,每孔加入含0.5 mg/mL MTT培养基,培养4 h,弃上清。加入200 μL DMSO/孔溶解甲臜沉淀,震荡20 s,用M200 TECAN酶标仪检测570 nm处OD值。以溶剂处理的肿瘤细胞为对照组,按公式:抑制率= (对照组OD值 – 加药组OD值)/ 对照组OD值×100%来计算药物对肿瘤细胞生长的抑制率,并以化合物浓度的对数和抑制率作回归方程,计算化合物的IC50值。
2 结果
2.1 欣力康胶囊对不同肿瘤细胞增殖的影响 欣力康胶囊共设置6个浓度,由低到高分别为0.031 25、0.0625、0.125、0.25、0.5、1 mg/mL。结果显示,欣力康胶囊最低浓度0.031 25 mg/mL对5株肿瘤细胞MDA-MB-231、MCF-7、silla、caski、C33A的抑制率均为零,最高浓度1 mg/mL时对5种肿瘤细胞增殖的抑制率分别为60.38%、53.47%、34.45%、2.68%、20.36%(图1)。结果表明,欣力康胶囊对5种肿瘤细胞的增殖均有一定的抑制能力,并且其效应呈浓度依赖性。进一步SPSS方差分析发现,欣力康胶囊对乳腺癌细胞株MDA-MB-231、MCF-7增殖的抑制作用明显强于对宫颈癌细胞株silla、caski、C33A的抑制作用,差异有显著性(P < 0.05),这说明欣力康胶囊能够选择性的抑制肿瘤细胞增殖。

图1 欣力康胶囊对不同肿瘤细胞增殖的影响
2.2 欣力康胶囊6个单体化合物对不同肿瘤细胞增殖的影响 研究所选择的6个单体化合物(人参皂苷、黄芪甲苷、阿魏酸、秋水仙素、姜黄素、野黄芩苷)的浓度梯度均为2、5、10、20、50、100 μg/mL。结果显示,人参皂苷、黄芪甲苷、阿魏酸和野黄芩苷在此浓度梯度内对5种肿瘤细胞增殖抑制率几乎为零。而2 μg/mL秋水仙素对MDA-MB-231、MCF-7、silla、caski、C33A的抑制率分别为59.16%、53.62%、45.03%、48.99%、44.31%,100 μg/mL秋水仙素对5种肿瘤细胞株的抑制率分别为90.28%、72.47%、64.16%、64.38%、64.56%。经SPSS方差分析发现,秋水仙素对乳腺癌细胞株MDA-MB-231、MCF-7增殖的抑制作用明显强于对宫颈癌细胞株silla、caski、C33A的抑制作用,差异有显著性(P < 0.05)。2 μg/mL姜黄素对5种肿瘤细胞株的抑制率几乎为0,而100 μg/mL姜黄素对5种肿瘤细胞株的抑制率分别为92.13%、94.15%、85.38%、97.72%、87.01%,经SPSS方差分析,姜黄素对乳腺癌细胞株MDA-MB-231、MCF-7的抑制率和对宫颈癌细胞株silla、caski、C33A的抑制率比较,组间无显著性差异(P>0.05)(图2)。研究表明,秋水仙素和姜黄素对5种肿瘤细胞的增殖均具有显著的抑制作用,这说明秋水仙素和姜黄素可能是欣力康胶囊抑制肿瘤细胞增殖的有效成分之一。

图2 欣力康胶囊6个单体化合物对不同肿瘤细胞增殖的影响
2.3 欣力康胶囊及其6个单体化合物抑制肿瘤细胞增殖的IC50值分析 计算欣力康胶囊及其含有的6个单体化合物对5种肿瘤细胞增殖抑制的IC50值,并进行对比分析。结果显示,欣力康胶囊对MDA-MB-231、MCF-7的IC50值明显低于另外三株肿瘤细胞,经SPSS方差分析发现,差异有显著性(P < 0.05)。而秋水仙素对MDA-MB-231、MCF-7的IC50值也明显低于另外三株肿瘤细胞,经SPSS方差分析,差异具有显著性(P<0.05)(表1)。表明欣力康胶囊,秋水仙素对MDA-MB-231、MCF-7细胞的增殖更加敏感,这更进一步说明秋水仙素可能是欣力康胶囊抑制肿瘤细胞增殖的有效成分之一。
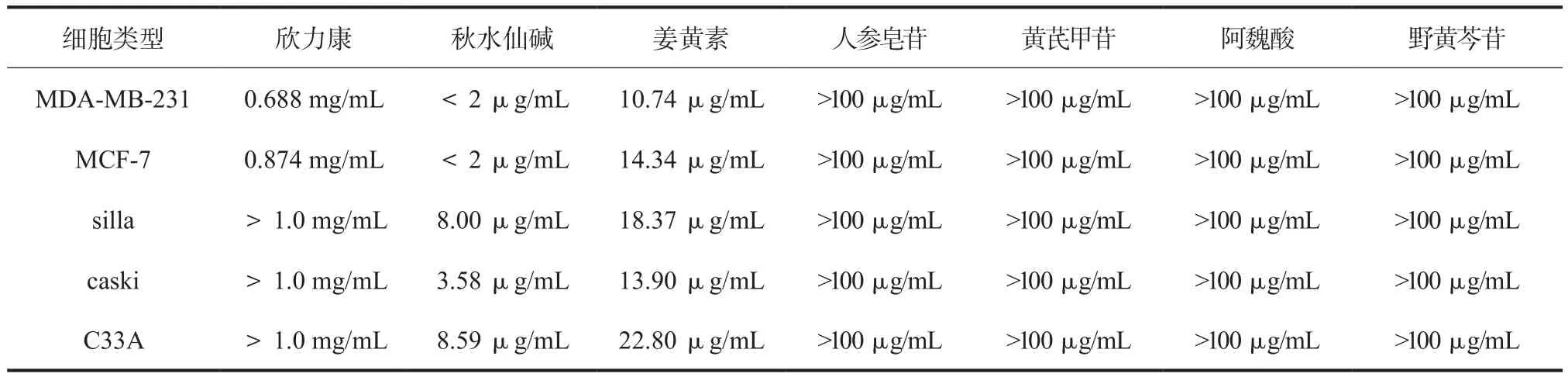
表1 欣力康及其6个单体化合物的IC50值
3 讨论
欣力康胶囊在临床上被广泛的应用于各种癌症放化疗的辅助治疗,例如肺癌、乳腺癌、肝癌、大肠癌、食管癌、胃癌等,具有增效减毒的功效[1,3,4],但其有效成分和作用机制尚不清楚。现代药理学研究显示,其君药成分之一半枝莲对肝癌、肺癌、结肠癌和胃癌细胞均有一定的抑制作用[5-7]。同时,文献报道组方中的红参[8-9]、黄芪[10-11]、当归[12-13]、郁金[14-15]和雪莲花[16]也具有抗肿瘤作用。因此,本研究的目的一方面是要探讨欣力康胶囊对肿瘤细胞增殖的影响,另一方面以半枝莲的主要成分之一野黄芩苷、红参的主要成分之一人参皂苷、黄芪的主要成分之一黄芪甲苷、当归的主要成分之一阿魏酸、郁金的主要成分之一姜黄素、雪莲花的主要成分之一秋水仙素作为检测对象,看这些单体对肿瘤细胞增殖的影响,从而鉴定欣力康胶囊中抗肿瘤的有效成分。
本研究结果显示,欣力康胶囊对5种肿瘤细胞(人乳腺癌细胞株MDA-MB-231、MCF-7,人宫颈癌细胞株silla、caski、C33A)均有一定的抑制作用,1 mg/mL欣力康胶囊对MDA-MB-231、MCF-7、silla、caski、C33A的抑制率分别为60.38%、53.47%、34.45%、2.68%、20.36%,表明欣力康胶囊对乳腺癌细胞株MDA-MB-231、MCF-7增殖的抑制作用可能更加敏感。但是,本研究所选择欣力康的浓度相对于欣力康在体内的浓度仍然偏高,欣力康在体内是否能够抑制肿瘤细胞的增殖还需动物实验的验证。
另外,欣力康的6个单体化合物,人参皂苷、黄芪甲苷、阿魏酸、秋水仙素、姜黄素和野黄芩苷中,在相同的浓度梯度下,只有秋水仙素和姜黄素对肿瘤细胞的增殖显示出显著的抑制作用,而人参皂苷、黄芪甲苷、阿魏酸和野黄芩苷在此浓度范围内对肿瘤细胞的抑制率几乎为零,这可能和其浓度设置太低有关,并不能说明人参皂苷、黄芪甲苷、阿魏酸和野黄芩苷无抗肿瘤作用。但从这个结果分析,至少表明秋水仙素和姜黄素可能是欣力康胶囊抑制肿瘤细胞增殖的有效成分之一。并且,秋水仙素也对乳腺癌细胞株MDAMB-231、MCF-7更加敏感,和欣力康的作用一致,这更进一步说明秋水仙素可能是欣力康胶囊抗肿瘤作用的部分有效成分。
本研究的不足之处主要是缺乏对欣力康胶囊单体成分含量的鉴定。主要原因是欣力康胶囊是由十味中药合理组方后经加热提取而制成,其化学成分复杂,可能存在化学成分相互作用,极大地增加了鉴定的难度。并且,本文所选取的单体化合物虽然为各中药材中代表性成分,但是经组成复方提取后,是否仍以原型存在于复方提取物中,仍然是一个值得探讨的问题。已有研究证明,欣力康配方提取物中野黄芩苷仍保持较高的含量[17]。其他成分的鉴定与含量测定未有实际证据,需要在后续研究中继续探讨。
虽然本研究存在以上不足,但是本次研究初步探索了欣力康胶囊抑制肿瘤细胞增殖的活性,并且筛选了其可能的有效成分,为欣力康抗癌机制的深入研究和临床用药提供了实验依据。
[1] 袁一枫, 翟范.欣力康治疗中晚期癌症68例 [J].中医杂志,2002, 43(9): 694.
[2] 李定祥, 张杰.欣力康胶囊对4种肿瘤细胞抑制作用的实验研究 [J].中国药师, 2016, 19: S5-6.
[3] 李定祥, 张飞, 张杰.复方中药欣力康治疗胃癌30例 [J].中国中医药现代远程教育, 2017, 15(14): 102-103.
[4] 李定祥, 张飞, 张杰.欣力康颗粒联合化疗治疗癌症20例 [J].中国中医药现代远程教育, 2017, 15(16): 106-108.
[5] 满其倩, 左琳, 吕青涛.半枝莲抗肿瘤作用及机制研究进展 [J].辽宁中医杂志, 2015, 42(11): 2251-2253.
[6] 石梦莹, 卢小路, 熊思会, 等.半枝莲抗肿瘤药理研究进展 [J].世界中医药, 2016, 11(4): 741-743.
[7] 窦锦明, 荆汉卫.半枝莲黄酮类有效部位体内抗肿瘤实验研究[J].药学与临床研究, 2015, 23(1): 21-22.
[8] 周秋秋, 任谓明, 王艳红, 等.红参的炮制、化学成分及药理活性研究进展 [J].上海中医药杂志, 2016, 61(2): 97-100.
[9] 张琴芬, 任慕兰, 赵维英, 等.红参中人参总皂苷联合雷公藤红素体内外抗卵巢癌作用评价 [J].中成药, 2017, 39(1): 170-175.
[10] 陈书磊, 高萍, 王涛.黄芪抗肿瘤有效成分及其作用机制研究进展 [J].中国中医药现代远程教育, 2015, 13(5): 151-152.
[11] 汪晶, 杨蕾, 金鑫, 等.黄芪甲苷对人参皂苷CK肿瘤细胞摄取及抗肿瘤作用的影响 [J].中草药, 2016, 47(13): 2308-2312.
[12] 韩涛, 胡鹏斌.当归提取物抗肿瘤研究进展 [J].中医临床研究,2014 (29): 139-141.
[13] 王艳杰, 康芯荣, 张雨薇, 等.当归补血汤抗肿瘤作用研究进展 [J].中国医学装备, 2017, 14(8): 165-169.
[14] 金海峰, 王楼蕾, 吕宾.郁金抗肿瘤作用的研究进展 [J].医药导报, 2009, 28(12): 1565-1568.
[15] 王征, 雷天葵, 汪荔, 等.姜黄、郁金、莪术寒热药性与姜黄素含量关系研究[J],中国药师,2017,20 (7):1173-1176.
[16] 吕芳,结直肠癌肝转移标志物的筛选和临床相关性分析及雪莲对结肠癌细胞抑制作用的研究 [D].新疆大学, 2009.
[17] 程蓉.HPLC法测定欣力康颗粒剂中野黄芩苷的含量 [J].中国药事, 2004, 18(10): 628-629.
