参一胶囊联合腹腔镜解剖性肝段切除术治疗老年原发性肝癌的临床研究
2018-03-07何盟国沈乃营王智翔
谭 栋,何盟国,沈乃营,韩 朝,梁 刚,王智翔,郑 康
老年原发性肝癌是严重威胁老年人群生命健康的恶性肿瘤之一,手术切除是其最有效的治疗手段,而腹腔镜解剖性肝段切除术作为一种有效的手术方法,已被逐渐的应用于治疗原发性肝癌等多种类型肝脏恶性肿瘤[1-3]。与传统开腹手术比较,腹腔镜解剖性肝段切除术具有创伤小、安全性高、病灶清除更彻底等诸多优点,更适合于体质较差的老年人群,但该手术仍不可避免地对患者的全身状况及免疫功能造成不同程度的损伤,进而影响老年患者的治疗效果及生活质量,故在术后还需对患者进行综合治疗[4]。大量实验药理学及临床疗效观察研究结果表明,恶性肿瘤术后采用中医药进行治疗可有效提高治疗效果,延长患者生存时间[5]。本研究回顾性分析了2013年1月—2017年1月陕西核工业215医院肝胆外科采用参一胶囊联合腹腔镜解剖性肝段切除术治疗74例老年原发性肝癌患者的临床资料,旨在为该疾病的治疗提供一定的借鉴。
1 资料与方法
1.1 一般资料 选取2013年1月—2017年1月陕西核工业215医院肝胆外科收治的74例老年原发性肝癌患者作为研究对象,并采用随机数字表法将其分为观察组及对照组,每组37例。两组患者性别、年龄、病灶大小、Child-Pugh分级、临床分期及肿瘤中心位置等一般情况相比较,差异均无统计学意义,见表1。

表1 患者一般情况比较(n = 37)
1.2 纳入及排除标准 根据影像学、细胞学及组织病理学检查结果,并结合《原发性肝癌诊疗规范(2011年版)》[6]中诊断标准,明确诊断为原发性肝癌者;年龄≥60岁且能耐受肝切除术的老年患者;由于患者自身或体质较差等原因无法接受开腹手术治疗者;肿瘤病灶仅局限于单个肝段且未发生相邻组织器官侵犯与远处转移者;根据结合肝脏Couinaud分段法及上腹部增强CT结果显示各肿瘤病灶中心均位于预切除肝段内的患者;肝功能Child-Pugh A级和B级、总胆红素<40 μmol/L、血红蛋白≥8.0 g/L、白细胞计数≥3.5×109/L且预计生存期>3个月的患者;肿瘤直径≤8 cm,且参与本研究3个月内未接收其他治疗的患者;本研究中患者及其直系亲属均知情同意,并签署知情同意书。排除患有免疫性肝炎、乙型肝炎、肝硬化等其他肝脏疾病者;肿瘤累及肝段数目大于1个的患者;术中探查存在上腹部严重粘连,腹腔镜手术器械无法置的患者。患有严重心血管疾病、凝血功能障碍、严重精神病者;依从性差者。
1.3 治疗方法 两组患者均进行腹腔镜解剖性肝段切除术治疗:全麻后取仰卧位,并对患者进行二氧化碳气腹,压力维持于12 mmHg(1 mmHg =0.133 kPa)后脐下30°置入腹腔镜并对腹腔进行探查,于患者右腋中线肋缘下、右锁骨中线肋缘下、左腋前线肋缘下及剑突下分别开4个操作孔,并根据术中实际情况变换主操作孔。切开患者镰状韧带、肝圆韧带、左右三角韧带及左右冠状韧带,用合成夹将肝圆韧带及左三角韧带夹闭。病灶位于左内叶或左半肝:用超声刀将第一肝门解剖,仔细分离胆管左右支、门静脉和肝动脉;将第二肝门解剖,仔细分离肝右、肝左及肝中静脉,阻断肝左静脉、肝动脉与门静脉左支。直接用超声刀于腹腔镜下将患者小管道与肝实质离断,用腔内切割缝合器或合成夹夹闭较粗大管道后将其切断,并最终完整切除左内叶或左半肝。用电凝将肝脏创面止血,检查是否存在胆漏或出血,并用生物蛋白胶将其封闭。病灶位于左外叶:沿患者左纵沟仔细解剖至可显露囊部、矢状部及门静脉左干角部,并通过其左侧解剖将下段支、左外叶上段支及中间支门静脉支阻断,阻断并解剖肝左静脉后将病灶部位肝段切除,其他具体手术过程同左半肝切除术。病灶位于右肝V及VI段切除:通过术前增强CT或MRI等影像学检查结果判断局部主供血管,游离右肝叶后寻找主供血管,并用超声刀将距主供血管最近的肝表面切开后夹闭主供血管,其他具体手术过程同左半肝切除术。如患者术中出现难以控制的大出血需立即进行开腹,操作结束后对肝断面进行反复冲洗及仔细检查,确认无胆汁漏与出血后彻底清洗腹腔,放置腹腔引流管后结束手术。术后第1 d根据患者恢复情况可适当下床活动及进饮食,术后3 d将腹腔引流管拔除。观察组在上述治疗的基础上于术后第3 d另口服给予参一胶囊(吉林亚泰制药股份有限公司;国药准字Z20030044;批号:2012092211、2014110926及2016031102;规格:10 mg/粒),2粒/次,2次/d,治疗时间为2个月,对照组则在腹腔镜解剖性肝段切除术后给予安慰剂,2粒/次,2次/d。
1.4 近期疗效评价标准[7]治疗后,根据上腹部增强计算机断层扫描检测两组患者肿瘤体积,并根据mRECIST评价标准对两组患者的近期疗效进行评估:完全缓解(complete response,CR)为患者所有肿瘤病灶均完全消失;部分缓解(partial response,PR)为患者肿瘤病灶长径总和下降≥30%;稳定(stable disease,SD)为患者肿瘤病灶长径总和下降 < 30%或增大 < 20%;进展(progressive disease,PD)为患者出现新病灶或肿瘤病灶长径总和增加≥20%,总有效率=(CR +PR)/总数 × 100%。
1.5 观察指标 术后密切观察两组患者并发症发生情况,主要观察指标包括血常规、尿常规、一般临床症状及心电图等。治疗前后,分别抽取2组患者肘静脉血5 mL,总计抽取2次,治疗前抽取5 mL,治疗后抽取5 mL,采用流式细胞仪检测其中CD3+及CD4+等T细胞亚群指标水平,利用单向琼脂扩散法对其中IgG、IgA及IgM等免疫球蛋白指标水平。治疗前后,分别抽取2组患者肘静脉血5 mL,总计抽取2次,治疗前抽取5 mL,治疗后抽取5 mL,采用酶联免疫法检测其中甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原125(CA-125)及α-岩藻糖苷酶(AFU)等肿瘤标记物水平。
1.6 统计学处理 采用SPSS 19.0软件进行数据分析,以百分率(%)表示计数资料,采用秩和检验进行总有效率比较,采用卡方检验进行治疗前性别、病灶大小、Child-Pugh分级、肿瘤中心位置等一般情况的两两比较;以()表示计量资料,采用两独立样本间的t检验进行组间比较,采用配对的t检验进行同组前后比较。P < 0.05为差异有统计学意义。
2 结果
2.1 并发症 观察组中,3例患者中转开腹,其中1例为肝中静脉损伤、1例门静脉左支损伤、1例肝实质深部出血且腹腔镜下止血困难,其余34例患者均顺利完成手术。对照组中,4例患者中转开腹,其中1例为左肝静脉损伤、1例门静脉左支损伤、2例肝实质深部出血且腹腔镜下止血困难,其余33例患者均顺利完成手术,故观察组和对照组有效病例分别为34例和33例。并发症观察结果表明,所有患者均未发生围手术期死亡、严重休克及严重感染,观察组中,3例患者出现疼痛,1例出现胸腔积液,1例出现低热,总并发症发生率为14.7%(5/34);对照组中,3例患者出现疼痛,3例出现胸腔积液,总并发症发生率为18.1%(6/34),两组并发症发生率相比较,差异无统计学意义(P >0.05)。本研究疼痛患者给予止痛药物口服治疗后得到有效缓解,低热患者通过加强抗感染治疗1周内恢复正常,胸腔积液患者穿刺抽液3周后复查均已吸收。
2.2 近期疗效 本研究发现采用参一胶囊及腹腔镜解剖性肝段切除术治疗的观察组患者总有效率为85.3%,明显高于对照组患者的66.7%,差异有统计学意义(P < 0.05,表2)。

表2 两组患者疗效比较结果(n, %)
2.3 免疫功能 治疗前,2组患者各项免疫功能指标水平均基本一致,差异无统计学意义(P>0.05)。治疗后,观察组CD3+、CD4+、IgG、IgA及IgM水平均明显高于对照组,差异均有统计学意义(P<0.05,见表3)。
表3 两组患者免疫功能指标比较 ( )
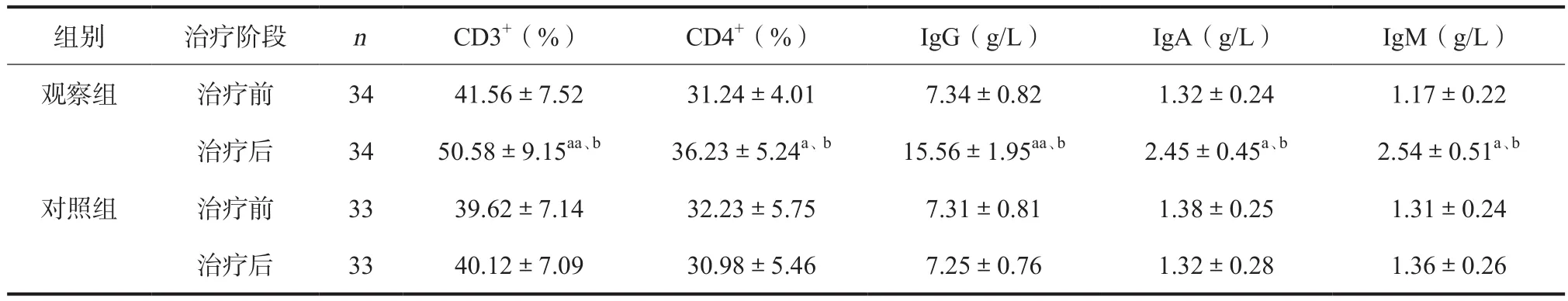
表3 两组患者免疫功能指标比较 ( )
注:与对照组同期比较,aP<0.05,aaP<0.01;与同组治疗前比较,bP<0.01
组别治疗阶段nCD3+(%)CD4+(%)IgG(g/L)IgA(g/L)IgM(g/L)观察组治疗前3441.56±7.5231.24±4.017.34±0.821.32±0.241.17±0.22治疗后3450.58±9.15aa、b36.23±5.24a、b15.56±1.95aa、b2.45±0.45a、b2.54±0.51a、b对照组治疗前3339.62±7.1432.23±5.757.31±0.811.38±0.251.31±0.24治疗后3340.12±7.0930.98±5.467.25±0.761.32±0.281.36±0.26
2.4 肿瘤标记物 治疗前,两组患者各项肿瘤标记物水平均基本一致,差异无统计学意义(P>0.05)。治疗后,2组血清AFP、CEA、CA-125及AFU水平均明显改善,且观察组改善程度均明显优于对照组,差异均有统计学意义(P<0.05,见表4)。
表4 两组患者肿瘤标记物比较()
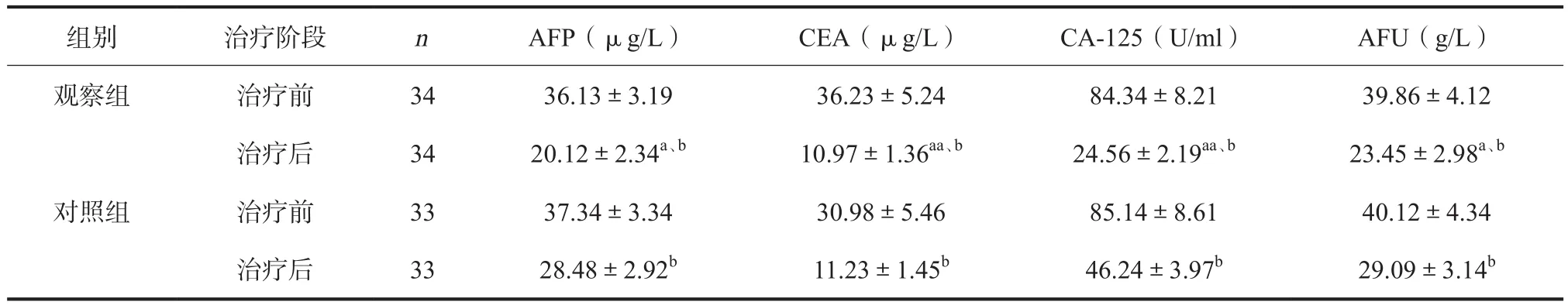
表4 两组患者肿瘤标记物比较()
注:与对照组同期比较,aP<0.05,aaP<0.01;与同组治疗前比较,bP<0.01
组别治疗阶段nAFP(μg/L)CEA(μg/L)CA-125(U/ml)AFU(g/L)观察组治疗前3436.13±3.1936.23±5.2484.34±8.2139.86±4.12治疗后3420.12±2.34a、b10.97±1.36aa、b24.56±2.19aa、b23.45±2.98a、b对照组治疗前3337.34±3.3430.98±5.4685.14±8.6140.12±4.34治疗后3328.48±2.92b11.23±1.45b46.24±3.97b29.09±3.14b
3 讨论
随着微创技术在肝脏外科的应用不断普及,腹腔镜在胆囊癌根治、肝恶性肿瘤规则性切除及肝内胆管结石治疗等多种复杂手术中均取得较好的治疗效果,该项技术已成为目前肝胆外科发展的主要方向[8]。腹腔镜肝肿瘤切除术是目前较安全可靠的肝脏微创手术切除方法之一,对于原发性肝癌、转移性肝癌等多种肝脏恶性肿瘤具有较好的疗效[9]。诸多临床研究结果表明,与开腹手术相比较,腹腔镜解剖性肝段切除术治疗原发性肝癌可有效降低患者术中输血需求及出血量,提前进食时间,降低术后并发症的发生率,减少住院时间,在改善患者术后疼痛,降低术后对镇痛药物的需求量,提高患者生存质量等方面均具有重要意义[10]。因此,对于体质较差,患有基础疾病,无法耐受开腹手术的老年人群而言,腹腔镜解剖性肝段切除术具有更显著的优势[11]。然而由于肝脏是实质性器官,血运丰富,故腹腔镜解剖性肝段切除术中存在大出血及二氧化碳气体栓塞的风险,且腹腔镜术中显露病灶较为困难,手术操作难度明显增大,故腹腔镜肝切除术在原发性肝癌的治疗中仍未得到广泛的应用[12]。我院是国内较早开展腹腔镜解剖性肝段切除术的医院之一,在多年的临床实践中对于降低大出血及二氧化碳气体栓塞等并发症的发生率,改进复杂的操作等方面均积累了丰富的经验,即先根据病灶位置确定肝叶切除的范围,再根据患者的肝脏解剖结构将需切除部位的出入肝血流进行解剖性阻断,在去血管化的治疗基础上进行肝脏切除,这对于防止大出血及二氧化碳气体栓塞,提高手术成功率等方面具有重要意义。
尽管腹腔镜解剖性肝段切除术在老年人群中具有较强的应用价值,但由于手术的创伤性及老年人的体质较弱等因素,患者术后仍会出现不同程度的机体损伤及免疫功能受损,另由于腹腔镜肝切除术治疗本身存在的局限性,部分患者仍存在疗效不够明显等不足,还需在术后进行综合治疗以提高治疗效果,改善患者免疫力[13-14]。诸多研究结果表明,中西医结合治疗肝癌等癌症能够更有效的提高治疗效果,中医药的主要治疗特点在于利用整体调治及扶正培本的原则,在调动人体自身的抗癌因素,保护患者各脏器于系统的正常功能等方面具有重要意义[15-16]。传统中医学认为,原发性肝癌属“积聚”、 “癥瘕”、“胁痛”、“臌胀”、“肝积”与“黄疸”等范畴,多与正气虚损、气阴两虚、肝郁、肝肾亏虚、痰饮、湿热及瘀血等密切相关[17-18]。参一胶囊主要成分为提取自人参的人参皂苷Rg3,可有效阻碍肿瘤细胞黏连蛋白的黏附作用,诱导癌细胞凋亡,同时还可抑制肿瘤新生血管的形成,破坏浸润血管内壁[19]。此外,参一胶囊还可有效调节免疫功能,降低由于放化疗所致毒副反应[20]。为此,笔者在老年原发性肝癌患者腹腔镜解剖性肝段切除术后采用参一胶囊进行治疗,期望为该疾病的优化治疗提供依据。
在本研究中,所有患者均未发生围手术期死亡、严重休克及严重感染等并发症,提示本研究手术较为安全可靠,其主要经验在于术前对患者进行了详细的影像学检查,并与术中超声探查相互结合,准确地预判了需处理的血管及切除范围,而在手术开始后,对第二肝门及显露肝静脉的解剖过程中使用钛夹夹闭,可有效减少反流出血,防止由于血管破裂所致气体栓塞及大出血。此外,用超声刀切断肝脏小管道,而大管道则采用血管夹夹闭后进行切断,在创面采用电凝止血等方法亦可有效降低并发症的发生率。此外,观察组患者总有效率明显高于对照组(P<0.05),而AFP、CEA、CA-125及AFU水平均明显低于对照组(P<0.05),IgG、IgA、IgM、CD3+及CD4+水平均明显高于对照组(P<0.05),提示术后给予参一胶囊可进一步提高患者治疗效果,改善患者免疫功能,而该药物可有效提高老年患者免疫力可能是观察组疗效优于对照组的主要机制之一。
综上所述,相较单一采用腹腔镜解剖性肝段切除术,参一胶囊联合腹腔镜解剖性肝段切除术治疗原发性肝癌具有疗效更佳、患者免疫功能更好等优点。然而本研究仍存在样本量不足等诸多问题,后期还需通过设置多实验中心、扩大样本量等措施予以完善。此外,由于腹腔镜解剖性肝段切除术方法复杂,需要特殊的手术器械,虽然本研究中未见严重后遗症,但在后期研究中还需对其不断探索,对手术方法进行不断优化。
[1] Kudo M, Kitano M, Sakurai T, et al.General Rules for the Clinical and Pathological Study of Primary Liver Cancer,Nationwide Follow-Up Survey and Clinical Practice Guidelines:The Outstanding Achievements of the Liver CancerStudy Group of Japan [J].Dig Dis, 2015, 33(6): 765-770.
[2] Kim JW, Shin SS, Heo SH, et al.Ultrasound-Guided Percutaneous Radiofrequency Ablation of Liver Tumors: How We Do It Safely and Completely [J].Korean J Radiol, 2015, 16(6): 1226-1239.
[3] Bhayani NH, Jiang Y, Hamed O, et al.Advances in the pharmacologic treatment of hepatocellular carcinoma [J].Curr Clin Pharmacol, 2015, 10(4): 299-304.
[4] 王恺, 徐智, 黄明文, 等.腹腔镜解剖性肝切除术治疗肝癌16例 [J].世界华人消化杂志, 2010, 18(20): 2163-2165.
[5] 吴同玉, 李宇涛, 朱龙, 等.原发性肝癌病性证素湿与五脏病位证素的关系.中华中医药杂志, 2013(1): 75-77.
[6] 中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版)[J].临床肝胆病杂志, 2011, 27(11): 1141-1159.
[7] Edeline J, Boucher E, Rolland Y, et al.Comparison of tumor response by response evaluation criteria in solid tumors (RECIST)and modified RECIST in patients treated with sorafenib for hepatocellular carcinoma [J].Cancer, 2012, 118(1): 147-156.
[8] 张红卫, 李闻达, 曹君, 等.3D 腹腔镜下解剖性肝切除术治疗肝脏肿瘤的应用价值 [J].中华肝脏外科手术学电子杂志,2014,3(3): 152-156.
[9] Lin NC, Nitta H, Wakabayashi G.Laparoscopic major hepatectomy: a systematic literature review and comparison of 3 techniques [J].Ann Surg, 2013, 257(2): 205-213.
[10] 马渝城, 严律南.微创理念下腹腔镜肝切除的研究现状分析 [J/CD].中华肝脏外科手术学电子杂志, 2013, 2(6): 358-362.
[11] Rao A, Rao G, Ahmed I.Laparoscopic or open liver resection?Let systematic review decide it [J].Am J Surg, 2012, 204(2):222-231.
[12] Ikeda T, Mano Y, Morita K, et al.Pure laparoscopic hepatectomy in semiprone position for right hepatic major resection [J].J Hepatobiliary Pancreat Sci, 2013, 20(2): 145-150.
[13] Takahashi M, Wakabayashi G, Nitta H, et al.Pure laparoscopic right hepatectomy by anterior approach with hanging maneuver for large intrahepatic cholangiocarcinoma[J].Surg Endosc, 2013,27(12): 4732-4733.
[14] Bilgen K, Ustün M, Karakahya M, et al.Comparison of 3D imaging and 2D imaging for performance time of laparoscopic cholecystectomy [J].Surg Laparosc Endosc Percutan Tech, 2013,23(2): 180-183.
[15] 徐光星.何任治疗原发性肝癌学术思想探究 [J].世界中医药,2008, 3(6): 340-342.
[16] 罗安明, 戎志斌.肿瘤以脾虚为本探析 [J].中国中医基础医学杂志, 2014(2): 164-165.
[17] 洪荣健, 奚胜艳, 王彦晖.基于《丹溪心法.痰》探讨肝癌发病与痰的相关性 [J].中华中医药学刊, 2014, 32(1): 164-166.
[18] 安佰平, 吴煜.从中医“肝主疏泄”理论谈肝癌辨治思维 [J].辽宁中医药大学学报, 2014, 16(7): 1-4.
[19] 成远, 陈超, 马兴群, 等.参一胶囊联合化疗治疗胃肠道恶性肿瘤的系统评价 [J].现代肿瘤医学, 2015, 23(16): 2323-2328.
[20] 成远, 陈超, 陈歆妮, 等.参一胶囊对恶性肿瘤患者血清血管内皮生长因子影响的Meta分析 [J].现代肿瘤医学, 2015,23(6): 844-849.
