金钱草总黄酮对草酸钙结晶肾损伤的作用机制
2018-03-07解海杰高宏伟李传波张昌文刘春雨
解海杰,高宏伟,王 军,李传波,张昌文,刘春雨
全世界泌尿系结石的发病率已达10%~15%[1]。一水合草酸钙(calcium oxalate monohydrate,COM)可刺激肾小管上皮细胞并引起肾损伤[2],促进草酸钙结晶粘附,进一步引起结晶积聚和结石形成[3]。复方金钱草颗粒具有抗肾结石、利尿、减轻输尿管张力和抗炎作用,对尿路结石有良好的防治作用[4]。最近的研究显示,金钱草黄酮提取物能抑制高草酸尿症大鼠肾脏草酸钙晶体的形成[5-6]。但金钱草总黄酮抑制草酸钙结石的机制并不明确,本文探讨金钱草总黄酮提取物对COM诱导肾小管上皮细胞凋亡所致肾损伤的作用机制。
1 材料与方法
1.1 试剂及药物 金钱草总黄酮购自于西安天瑞生物技术有限公司。第一抗体抗人肾损伤分子(kidney injury molecule-1,KIM-1)、抗LC3-II、抗p-p38、抗p38(1:1000)、内参β-actin均购自于Merck Millipore。
1.2 COM晶体准备 二水氯化钙(10 mmol/L,CaCl2·2H2O)和草酸钠(10 mmol/L, Na2C2O4)购自国药,加入到缓冲液Tris-HCl(10 mmol/L,pH 7.4)中,使其终浓度分别为5 mmol/L和0.5 mmol/L。混合液于室温下过夜,然后在3000 r/min转速下离心5 min。弃上清,用甲醇清洗沉淀。3000 r/min离心5 min后去甲醇,沉淀干燥后于37℃过夜。在紫外线辐射下净化30 min,即制备成COM晶体。
1.3 细胞培养与处理 肾小管上皮细胞(HK-2细胞)购自于中国科学院上海细胞库,于含有10%胎牛血清(Gibco)、1.2%青霉素/链霉素、2mol/L的L-谷氨酸的DMEM培养基中培养,并置于含5%CO2培养箱中于37 ℃孵育。HK-2细胞接种于24孔板过夜。COM晶体处理细胞48 h使其终浓度分别为0.1、0.5、1、2和5 mmol/L。
1.4 仪器 Eppendorf 5418 小型高速离心机(德国),BINDER C150二氧化碳培养箱(德国),赛默飞Multiskan GO全波长读数仪(美国),BD FACS 420流式细胞仪(美国),GE Typhoon FLA 9500 多功能激光成像仪(美国)。
1.5 分组 将肾小管上皮细胞分为6组:对照组、金钱草总黄酮处理组(TF组)、p38丝裂原活化激酶(p38/MAPK)抑制组(SB组)、COM处理组(COM组)、COM和金钱草总黄酮处理组(CTF组)、COM和p38/MAPK抑制组(CSB组)。TF组给予50 μg/mL金钱草总黄酮处理,SB组给予50 μmol/L的SB203580即p38/MAPK抑制剂处理,COM组给予2 mmol/L的COM处理,CTF组给予COM和50 μg/mL金钱草总黄酮处理,CSB组给予2 mmol/L的COM和50 μmol/L的SB203580处理。
1.6 观察指标及检测方法 (1)测定细胞存活率。WST-1法检测HK-2细胞的生存能力,测定细胞存活率。不同处理组的HK-2细胞(对照组,0.1、0.5、1、2和5 mmol/L COM组)接种于含DMEM(10%胎牛血清)的96孔板中,随后将WST-1加入培养孔中于37 ℃孵育2 h。分光光度计设定测量波长450 nm,参考波长630 nm,读取各组吸光度值A。各组细胞活力以其吸光度值与空白对照组吸光度值的比值表示。(2)测定细胞凋亡率,用流式细胞术检测细胞凋亡数。收集6组细胞,1500 r/min离心5 min,PBS液洗涤3次。加入1×Annexin V结合缓冲液使各组细胞终浓度为5×105/mL。加入Annexin-V和PI溶液(1 μg/mL,100 μg)于室温染色15 min。用流式细胞术检测细胞凋亡数。细胞凋亡率(%)=(凋亡细胞数/总细胞数)×100%。(3)蛋白免疫印迹测定肾损伤标志物KIM-1,肾小管细胞损伤通路相关分子p38及自噬相关蛋白LC3-II的表达。RIPA缓冲液提取来自于不同组别的HK-2细胞中的总蛋白。蛋白溶液于12 000 r/min离心15 min,BCA蛋白浓度测定试剂盒检测蛋白浓度。10% SDS-PAGE凝胶分离蛋白,转膜。5%脱脂奶粉封闭2 h。ECL系统(GE)检测蛋白质-抗体复合物。
1.7 统计学处理 统计分析采用SPSS17.0统计软件。各组间的比较采用单因素方差分析,进一步两两比较采用bonferroni方法,以P < 0.05具有统计学意义。
2 结果
2.1 COM诱导降低HK-2细胞存活率 应用COM处理HK-2细胞建立体外泌尿系结石细胞模型,与对照组相比,随着COM浓度的增加,HK-2细胞的存活率逐渐下降(图1)。

图1 不同浓度COM处理HK-2细胞后的细胞存活率

图2 2 mmol/L COM诱导HK-2细胞不同时长KIM-1、LC3-II、p-p38和p38蛋白含量的变化
2.2 COM诱导HK-2细胞不同时长KIM-1,LC3-II,p-p38和p38蛋白含量的变化 应用COM处理肾小管上皮细胞建立体外泌尿系结石细胞模型,在2 mmol/L COM处理的肾小管上皮细胞中,随着时间的增加, KIM-1、p-p38、LC3-II表达增加(图2)。
2.3 阻断p38/MAPK通路对COM诱导的HK-2细胞凋亡的影响 COM可诱导HK-2细胞凋亡增加,CSB组细胞凋亡率较COM组细胞凋亡率降低,应用p38/MAPK抑制剂SB203580可抑制COM诱导的细胞凋亡(图3、4)。

图3 各组HK-2细胞凋亡率的变化

图4 阻断p38/MAPK通路对COM诱导的HK-2细胞凋亡的影响
2.4 阻断p38/MAPK通路对COM诱导的HK-2细胞自噬的影响 COM可诱导HK-2细胞过度自噬,CSB组自噬相关蛋白LC3-II较COM组细胞降低(图5、6)。

图5 各组LC3-II/actin表达水平

图6 阻断p38/MAPK通路对COM诱导HK-2细胞LC3-II/actin表达水平的变化
2.5 金钱草总黄酮对COM诱导HK-2细胞p-P38蛋白表达的影响 Western blotting结果显示,CTF组较COM组p-p38蛋白水平降低,说明金钱草总黄酮可阻断p38/MAPK通路(图7)。2.6 金钱草总黄酮对COM诱导的HK-2细胞存活率的影响 随着金钱草总黄酮浓度的增加,HK-2细胞存活率也逐渐增加,说明金钱草总黄酮对HK-2细胞具有保护作用(图8)。
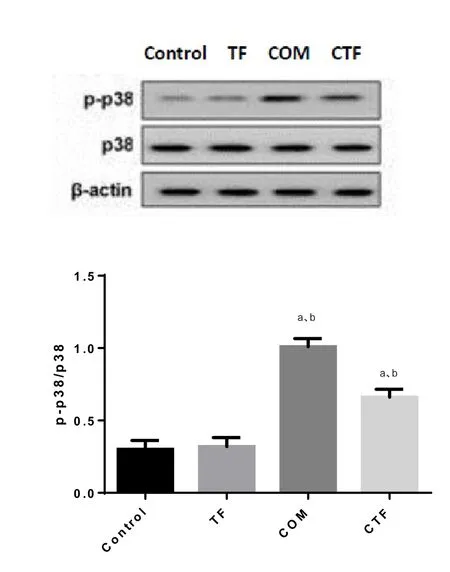
图7 金钱草总黄酮对COM诱导HK-2细胞p-P38蛋白表达的影响

图8 不同浓度金钱草总黄酮对COM诱导的HK-2细胞存活率的影响
2.7 金钱草总黄酮对COM诱导的HK-2细胞凋亡的影响 CTF组细胞凋亡率较COM组细胞凋亡率降低,金钱草总黄酮可抑制COM诱导的细胞凋亡(图3、9)。
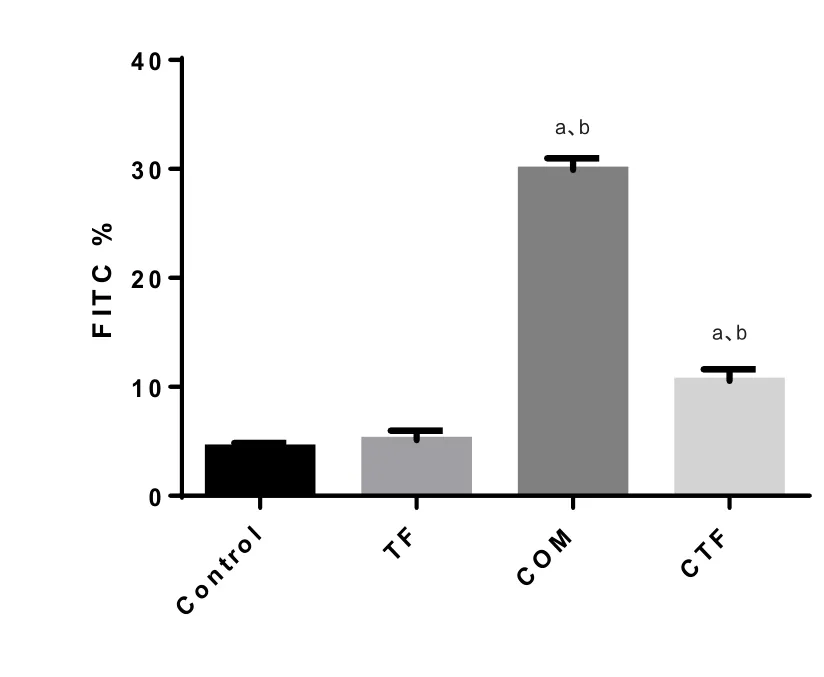
图9 金钱草总黄酮对COM诱导的HK-2细胞凋亡的影响
2.8 金钱草总黄酮对COM诱导的HK-2细胞自噬的影响 CTF组自噬相关蛋白LC3-II较COM组降低,金钱草总黄酮可抑制COM诱导的细胞过度自噬(图5、10)。
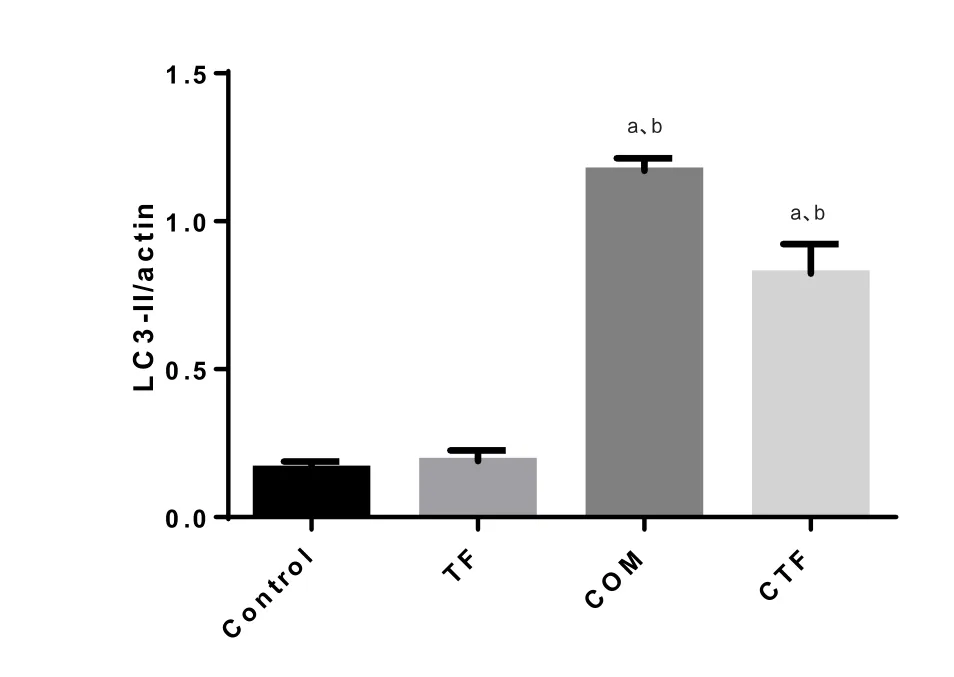
图10 金钱草总黄酮对COM诱导的HK-2细胞自噬LC3-II水平的变化
3 讨论
泌尿系结石是全球性常见病,其发病率约10%~15%,并有逐年增高的趋势[7]。虽然如体外冲击波碎石术、经皮肾镜取石术、经尿道输尿管镜取石术等微创技术已广泛应用并取得成效,但泌尿系结石的复发率仍然很高[8]。泌尿系结石成分最常见的是草酸钙结石,其中COM约占80%。目前结石成因最为重要的观点是草酸钙对肾小管上皮细胞损伤假说[9]。本研究发现随着COM浓度的升高,细胞存活率逐渐降低,并且KIM-1、p38及自噬相关蛋白LC3-II的表达也增加,抑制p38/MAPK通路可减少细胞过度自噬和凋亡。肾损伤标志物KIM-1是MAPK的下游基因,推测草酸钙通过激活p38/MAPK通路引起肾小管上皮细胞出现过度自噬,细胞凋亡水平增加,导致肾小管上皮细胞的损伤。这与Paleerath等[10]研究结果相一致,其研究发现COM晶体会通过p38 MAPK活化导致肾小管上皮细胞紧密连接屏障功能的破坏。草酸钙导致的肾损伤与p38/MAPK通路激活有关,从而导致草酸钙晶体的沉积,而抑制p38/MAPK通路可减少肾小管上皮细胞凋亡[11]。
金钱草作为排石之要药,其临床作用已得到不断地验证,但其作用机制尚不明确。研究显示金钱草可抑制草酸钙结晶聚集并减轻肾损伤[12]。Rodgers等[13]报道,金钱草汤剂可显著降低人工合成尿液中草酸钙结晶的平均体积,并减少草酸钙结晶的饱和率,从而证明金钱草可能是一种有效的草酸钙抑制剂。Zhao等[14]发现黄酮类是金钱草正丁醇部位的主要成分,总黄酮对OH-和O2-具有清除功能,且能减少乙二醇诱导的大鼠肾结石的形成。最近研究[15]在动物实验发现金钱草总黄酮具有抗氧化应激作、抗炎作及碱化尿液的作用,降低单核细胞趋化蛋白-1、骨桥蛋白的水平,减轻肾损伤,抑制结石的形成。本研究发现在COM处理过的HK-2细胞中加入金钱草总黄酮后KIM-1、p38及自噬相关蛋白LC3-II的表达水平降低,同时细胞凋亡水平降低,推测金钱草总黄酮可阻断p38/MAPK通路,抑制COM诱导的HK-2细胞凋亡和过度自噬,起到保护肾小管上皮细胞的作用。
综上所述,草酸钙可能通过激活p38/MAPK通路导致肾小管上皮损伤,使草酸钙晶体发生黏附,从而形成结石。而金钱草总黄酮可通过阻断p38/MAPK通路抑制肾小管上皮细胞的过度自噬和凋亡,减少肾小管上皮细胞的损伤,从而抑制泌尿系结石的形成。
[1] Chung SD, Liu SP, Lin HC.A population-based study on the association between urinary calculi and kidney cancer [J].Can Urol Assoc J, 2013, 7(11-12): E716-721.
[2] Gan QZ, Sun XY, Bhadja P, et al.Reinjury risk of nano-calcium oxalate monohydrate and calcium oxalate dihydrate crystals on injured renal epithelial cells: aggravation of crystal adhesion and aggregation [J].Int J Nanomed, 2016, 11: 2839-2854.
[3] Mittal A, Tandon S, Singla SK, et al.In vitro inhibition of calcium oxalate crystallization and crystal adherence to renal tubular epithelial cells by Terminalia arjuna [J].Urolithiasis, 2016, 44(3):287-287.
[4] 周军, 韦桂宁, 吴超伟, 等.复方金钱草颗粒对肾结石的影响及其利尿、解痉、抗炎作用 [J].中国实验方剂学杂志, 2011,17(18): 206-209.
[5] 邹志辉, 崔维奇, 谌辉鹏, 等.金钱草黄酮提取物对大鼠肾脏草酸钙结石形成的影响 [J].中国实验方剂学杂志, 2013,19(4): 195-199.
[6] 陶婷婷, 吕伯东, 黄晓军, 等.金钱草总黄酮提取液抑制大鼠草酸钙结石形成机制的研究 [J].中国现代医生, 2016, 54(18):30-33.
[7] Edvardsson VO, Indridason OS, Haraldsson G, et al.Temporal trends in the incidence of kidney stone disease [J].Kidney Int,2013, 83(1): 146-152.
[8] Ferraro PM, Curhan GC, D' Addessi A, et al.Risk of recurrence of idiopathic calcium kidney stones: analysis of data from the literature [J].J Nephrol, 2016, 30(2): 227-233.
[9] Ouyang JM, Yao XQ, Tan J, et al.Renal epithelial cell injury and its promoting role in formation of calcium oxalate monohydrate[J].J Biol Inorg Chem, 2011, 16(3): 405-416.
[10] Peerapen P, Thongboonkerd V.p38 MAPK mediates calcium oxalate crystal-induced tight junction disruption in distal renal tubular epithelial cells [J].Sci Rep, 2013, 3:1041.
[11] Li X, Ma J, Shi W, et al.Calcium Oxalate Induces Renal Injury through Calcium-Sensing Receptor [J].Oxid Med Cell Longev,2016, 2016: 5203801.
[12] Mi J, Duan J, Zhang J, et al.Evaluation of antiurolithic effect and the possible mechanisms of Desmodium styracifolium and Pyrrosiae petiolosa in rats [J].Urol Res, 2012, 40(2): 151-161.
[13] Rodgers AL, Webber D, Ramsout R, et al.Herbal preparations affect the kinetic factors of calcium oxalate crystallization in synthetic urine: implications for kidney stone therapy [J].Urolithiasis, 2014, 42(3): 221-225.
[14] Zhou C, Luo JG, Kong LY.Quality evaluation of Desmodium styracifolium using high-performance liquid chromatography with photodiode array detection and electrospray ionisation tandem mass spectrometry [J].Phytochem Anal, 2012, 23(3): 240-247.
[15] Zhou J, Jin J, Li X, et al.Total flavonoids of Desmodium styracifolium attenuates the formation of hydroxy-L-prolineinduced calcium oxalate urolithiasis in rats [J].Urolithiasis, 2017.doi: 10.1007/s00240-017-0985-y.
