由“蛋的奇妙变化”引出的酸碱主题复习课的教学反思
2018-03-06游梅
游梅


摘要:文章是基5-“鸡蛋中的化学”主题的酸碱性质复习课的教学反思。教师用“酸蛋”实验让学生分析了反应物的几种可能,酸性废液的处理方法等。从制做皮蛋的配料之间的反应,到料液中氢氧化钠浓度的测定,再到皮蛋的酸碱性检验、皮蛋的最佳吃法等方面讨论“碱蛋”知识。整节课主题新颖,科学、技术、社会三者巧妙结合,融知识、情境一体,实验、计算一体。
关键词:酸蛋;碱蛋;实验;计算;中性;细节
文章编号:1008—0546(2017)11—0067—03 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008—0546.2017.11.022
一、教学思路
本堂课有“酸蛋”和“碱蛋”两个版块的内容,每个版块又有明线、暗线两条线索。课堂的每条线索、每个环节都是紧紧围绕酸、碱的性质展开,将化学知识灵活运用到實验和实际生产、生活中,把化学、技术、社会三者巧妙地结合在一起,还在新授课基础上进行了深度的挖掘,在复习课中体现出“新、深、活”的特点。
二、主题式复习,将化学知识置于实验、生活情境中
主题化复习是以某一主题为中心,调动有关的化学知识、能力得以发展。主题化复习有效地契合学生的直接经验和间接经验,有利于学生对所学内容的意义构建,有利于化学学科观念的形成。
1.融知识、情境、实验一体
本堂课酸碱盐的性质内容比较枯燥、繁琐,怎样让学生用积极的态度参与学习呢?这就涉及到激发学生学习兴趣的问题了。初三学生的心智很不成熟,他们的认知特点有其特殊性:注意力不能持久集中,而且只有对感兴趣的事物才产生深层次学习的要求,因此不能用成人学习的态度和方式要求他们。针对学生这样的认知特点,课堂没有采取机械炒冷饭的方式复习酸的5条性质、碱的4条性质,而是在“把鸡蛋泡在酸溶液中”“分析皮蛋制作的配料”等情境中展开复习。教师先设计了一个“酸蛋”趣味实验:在烧杯中倒一种无色溶液,放入一只鸡蛋,鸡蛋沉在溶液底部没有明显现象,再倒另一种无色溶液,观察到溶液先变红,再褪色,鸡蛋表面逐渐产生大量气泡,最终鸡蛋上浮。这个实验吸引了学生的目光,激发他们思考:趣味实验中先后倒的两种溶液分别是什么?同学们想到起初蛋壳表面没有气泡,而最终蛋壳表面产生大量气泡,因为蛋壳的主要成分是碳酸钙,那么后倒的一定是酸性溶液,先倒的是碱性溶液如氢氧化钠溶液,且之后倒的酸性溶液中一定含有酚酞,课堂讨论第一次达到高潮。
接下来,从“酸蛋”到“碱蛋”,情境贴近学生生活实际,在“碱蛋”中给出制作皮蛋的配料,分析配料中可能的化学反应,料液中氢氧化钠溶液浓度的测定计算,皮蛋酸碱性的检测,皮蛋的最佳吃法等。在生活素材中用化学,不仅体现了化学学科的有用性,学了化学能更好地生活,也避免了复习的枯燥,提高了复习效率。在讨论酸液会不会是稀硫酸时,有学生说不行,有学生说可以,在大家相持不下时,教师把鸡蛋放人盛大量稀硫酸的烧杯中,让学生观察实验现象:开始鸡蛋表面产生气泡,一会儿就停止了,鸡蛋没有上浮!从这个现象学生联系到实验室制取二氧化碳不用稀硫酸的原因,有了实验佐证,教师不需要太多的言语,学生自然会领悟其中的道理!还有在讨论废酸液如何处理时,教师拿来了几个久置石灰水的细口瓶,瓶内壁上有较多白色固体,分析了白色固体的成分后,教师倒入废酸液,轻轻振荡几下,瓶壁变干净透明了!白色固体被“洗”掉了。一个简单的实验,诠释了变废为宝,循环利用,节约药品的理念,处理既合理又巧妙!
2.融实验与真实计算一体
受知识水平和实验仪器的限制,初中化学定量实验不多,大多数是定性实验。试题常常会出现“恰好完全反应”的说法,而在真实的实验和生产实际中,恰好完全反应的情况并不多。新课程强调:化学计算必须是真实的计算,是基于真实实验情境和实践运用的计算,因此,化学计算和纯数学计算是有很大不同的。
课堂中皮蛋问题的情境:制作皮蛋时要用到碱性物质,因此皮蛋也称为“碱蛋”。某地制作皮蛋的配料:生鸡蛋800枚,生石灰10kg(纯度80%),纯碱3.5kg,食盐4kg,花椒250g,松柏枝300g,红茶末50g,水100kg,锯末稻壳、黄泥适量。(生石灰480元/t,纯碱1700元/t)
问题1:配料表中的10kg生石灰与水反应得到的熟石灰与3.5kg纯碱最多能产生多少千克氢氧化钠?
思路:先算一算10kg含氧化钙80%的生石灰与水反应,最多得到熟石灰多少千克?再算:多少千克的氢氧化钙与3.Skg纯碱恰好完全反应?最后算:最多能产生多少千克氢氧化钠?
该题中熟石灰和纯碱的配比,氢氧化钙大大过量,主要是为了更好地利用价格更高的纯碱。这个实例说明在实际生产生活中的化学反应,反应物之间不一定会恰好完全反应,一种反应物过量的情况往往会更多。那么,有没有恰好完全反应的情况呢?接下来的问题2便是恰好完全反应的应用实例。
问题2:为保证松花蛋的质量,需要对料液中氢氧化钠进行定量分析。一般浓度大于6%或者小于4.5%时,都需要调整原料的投入量。某禽蛋加工厂用烧碱代替石灰、纯碱配制料液加工皮蛋。现取某待测料液样品10g加蒸馏水到250mL,摇匀后过滤。取滤液25mL注入锥形瓶,滴入1-2滴酚酞,溶液呈粉红色,用0.365%的盐酸标准液滴定至溶液的粉红色恰好消失,共消耗盐酸12mL,标准液的密度以1g/mL计。计算说明该料液中氢氧化钠的质量分数是否在正常范围。
这里的滴定法用到盐酸和氢氧化钠恰好完全反应的定量实验,这样的设计在深层次上进行挖掘,将初三学生的实验和计算能力提高到一个新的高度,而这种高度是新授课无法企及的。这也是我们上复习课的一个重要目的:在复习中接触新实验、学习新方法,加深对新授课内容的理解。
三、两点反思
本节课开始的趣味实验,实验结束后,请学生用广泛pH试纸测废液的pH,测定结果为0。我又提出:如何将废液处理至中性?endprint
学生思考后,提出了很多方案,说到镁、锌、生石灰、熟石灰、氢氧化钠、大理石等可以与酸反应的物质都可以处理该废液至中性。我对学生的方案表示非常肯定,说考虑到试剂价格的因素,一般选用熟石灰或大理石。
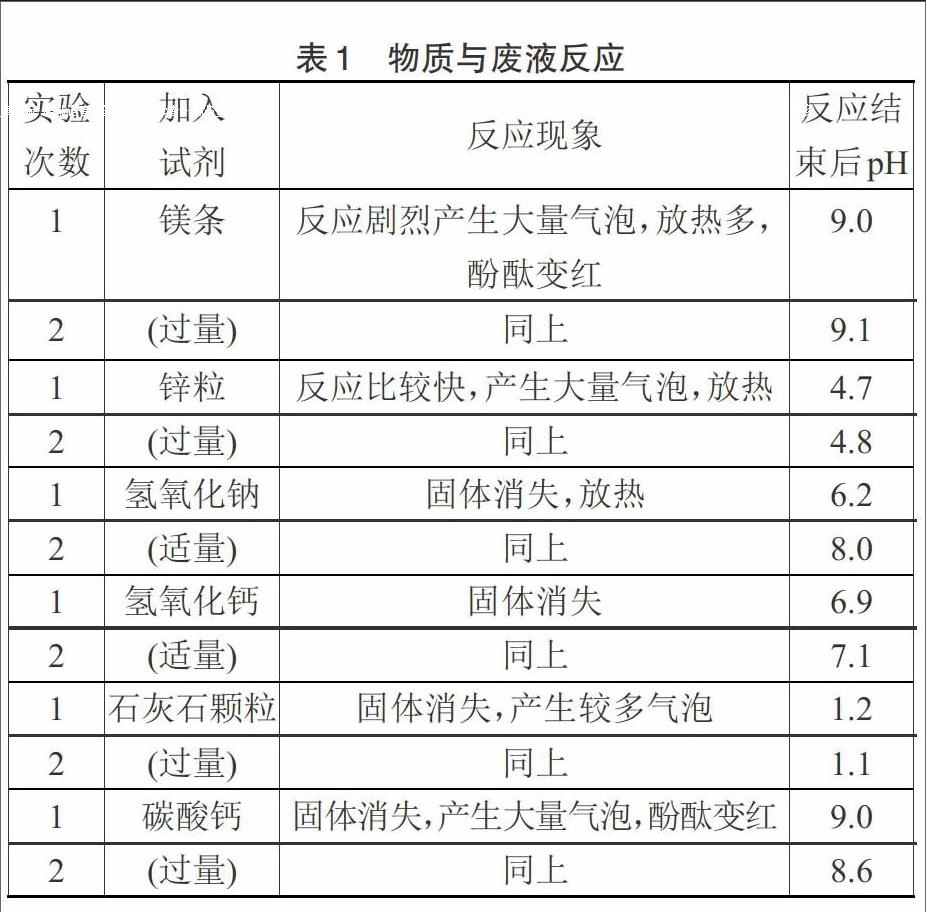
这些物质真能将废液反应至中性吗?笔者用镁、锌、氢氧化钠、氢氧化钙、石灰石颗粒、碳酸钙等6种固体试剂分别与废液反应,每种试剂做2次实验,实验现象、结果见表1。
废液的pH=0.1(精密pH计测定)
一般废液排放的标准是pH=6~9,从实验过程和结果分析:
①镁条与盐酸反应放热且在气温较高的夏天实验时,过量的镁与水反应产生了氢氧化镁,溶液显弱碱性。镁价格较高,且与废液产生大量氢气,不适合用来处理废液。
②锌粒不能将废液反应至中性,盐酸的浓度小到一定程度时反应几乎停止,应是氯化锌溶液呈酸性的缘故。
③氢氧化钠能将废液反应至中性,但氢氧化钠碱性、腐蚀性太强,价格较高,一般也不用于废液的处理。
④氢氧化钙能将废液处理至中性,反应的终点(pH=7.0)容易把握,氢氧化钙的价格也不高,一般可用于废液的处理。
⑤石灰石颗粒不能将废液反应至中性,可能盐酸的浓度小到一定量反应就几乎停止,最终溶液呈酸性。
⑥碳酸钙粉末能将废液处理成中性,碳酸钙過量后溶液呈弱碱性,碳酸钙粉末可用于处理废液。
综上分析:处理酸性废液合适的物质是氢氧化钙或碳酸钙。
我们可以在实验之前作出合理的假设、推测,但不宜轻易下结论,因为化学反应有其复杂性,有时一个看似很简单的问题,也需要在实验之后才能下结论。那么,如何更好地处理该废液呢?废物利用、以废治废是最佳的处理、利用废液的方法。实验室中盛放石灰水的试剂瓶壁上的一层白膜、厕所便池中的污垢、校园铁质车棚、铁质运动器材上的铁锈等等都可以用该废酸处理。
还有一个反思是课堂教学要关注细节,比如,皮蛋计算题的问题2中数据的有效数字位数不统一,有1位、2位还有3位,很不规范。“细节决定成败”,“勿以恶小而为之,勿以善小而不为”,追究细节不是强调细枝末节,而是一种严谨的态度和科学的精神。我们教育的对象是模仿性极强的未成年人,我们不经意的一句话、一个操作细节,他们就记住了。提高教师的专业素养,细节很重要!
本堂是基于“鸡蛋中的化学”的复习课,即以鸡蛋在酸性溶液中的变化和皮蛋制作知识为主题的酸碱性质的复习课,题材新颖、线索清晰,值得反思、品味。真正完美的课堂几乎是不存在的,却是我们追求的。不断追求,不断超越,一辈子做化学教师,一辈子学做化学教师。endprint
