超高效液相色谱-四极杆线性离子阱质谱法同时检测石蒜属3种生物碱
2018-03-06李青竹张永春郑玉红杨柳燕蔡友铭
李青竹,张永春,郑玉红,杨柳燕,蔡友铭*
(1.上海市农业科学院林木果树研究所 上海市设施园艺技术重点实验室,上海 201106;2.江苏省中国科学院植物研究所,江苏 南京 210014)
石蒜属(Lycorisspp.)是石蒜科(Amaryllidaceae)球根草本植物,富含多种石蒜属植物特有的生物碱成分[1-3]。迄今为止,从石蒜属植物中分离出超过500种结构各异的生物碱类化合物,植物化学研究表明,该类化合物具有多种药理学功能,药用价值极高。其中,加兰他敏和力可拉敏可用于治疗阿尔茨海默症,石蒜碱在抗菌、抗疟疾、治疗肿瘤、抗病毒和保护心血管等方面具有重要价值[4-7]。野生的石蒜资源是药用生物碱最重要的来源,因此,对石蒜中加兰他敏、力可拉敏和石蒜碱的含量进行准确定性和定量分析是育种和生物碱类物质合成代谢研究的重要内容之一。
目前高效液相色谱[8]、气相色谱-质谱联用[9-10]和高效液相色谱-质谱联用[11-12]技术已被广泛应用于植物重要代谢产物含量、中药药用成分、化妆品活性成分和农产品药物残留的分析中。上述分析方法也被用于石蒜生物碱类物质的检测分析,如高效液相色谱检测(HPLC)法[13-15]。Quan等[15]通过对比样品与已知的标准品在相同条件下的保留时间和峰面积,进行了石蒜属忽地笑中生物碱的定量研究,但植物样本和试剂消耗极大,同时,其仅采用HPLC方法根据物质的保留时间进行含量检测,无法对待测物质进行准确定性,因此物质定量结果不可靠,不能进行结构、定性和精确定量分析。Saliba等[16]采用HPLC-ESI-MS方法,对夏雪片莲芽中的生物碱进行定量分析,采用梯度洗脱,梯度洗脱前期和后期需很长的分析时间,检测程序时长为36 min,加兰他敏的洗脱时间为33 min,石蒜碱的洗脱时间为25.5 min,且在定性定量准确性上仍有缺陷。上述两种技术还存在提取时间长,操作繁琐的问题,为生物碱类物质的快速定量分析带来不便。
本研究基于UPLC-QTRAP-MS/MS这一准确且应用广泛的定性定量方法[17-20],建立了快速同时测定石蒜属中12个种加兰他敏、力可拉敏和石蒜碱的分析方法,通过二级质谱提供的母离子和子离子信息监测,能提高定性及定量分析的准确性,将为研究石蒜属植物中生物碱的积累规律和合成代谢调控提供快速、有效且准确的分析方法。
1 实验部分
1.1 仪器与试剂
超高效液相色谱仪Nexera UHPLC LC-30A(日本岛津公司),配Waters ACQUITY UPLC BEH C18(150 mm×2.1 mm,1.7 μm)液相色谱柱;Qtrap 5500质谱检测系统(美国AB Sciex公司),配有电喷雾(ESI)离子源和Analyst 1.6.2工作站; SB-5200DT超声波清洗机(宁波新芝生物科技股份有限公司,超声功率200 W,40 kHz) ; BS210S型电子分析天平(万分之一,北京赛多利斯天平有限公司);标准品溴氢加兰他敏购于梯希爱(上海)化成工业发展有限公司,纯度>98%,力可拉敏和石蒜碱标准品均购自上海安谱实验科技股份有限公司,纯度>98%,实验用水为Millipore纯水器制备的超纯水,乙醇、甲醇和乙腈为色谱纯(德国默克公司),其余试剂均为分析纯。
1.2 溶液配制
1.2.1标准溶液的制备称取适量加兰他敏、力可拉敏、石蒜碱标准品各0.010 g,分别用甲醇溶解并定容至100 mL,得到上述3种物质的标准储备液(质量浓度均为100 mg/L)。
标准中间液:分别准确移取1 mL上述标准储备液置于100 mL容量瓶中,用甲醇定容配成1.0 mg/L的混合标准中间液;标准工作液:根据需要移取适量混合标准中间液,分别用甲醇稀释成质量浓度为0.5、1、5、10、100、500 μg/L的标准工作溶液。
1.2.2材料与样品制备方法供试石蒜属植物材料由江苏省中国科学院植物研究所(南京中山植物园)提供,在上海市农业科学院种质资源圃保存种植,由南京林业大学王良桂教授指导采集,并由江苏省中国科学院植物研究所郑玉红鉴定,凭证标本编号如下:长筒石蒜(Lycorislongituba,0653969)、香石蒜(Lycorisincarnata,0653959)、换锦花(Lycorissprengeri,0653967)、石蒜(Lycorisradiata,0653965)、忽地笑(Lycorisaurea,0653958)、红蓝石蒜(Lycorishaywardii,0653964)、矮小石蒜(Lycorisradiatavar.pumila,0653966)、中国石蒜(Lycorischinensis,0653960)、稻草石蒜(Lycorisstraminea,0646254)、鹿葱(Lycorissquamigera,0653962)、陕西石蒜(Lycorisshaanxiensis,726057)和乳白石蒜(Lycorisalbiflora,0653963),凭证标本存于江苏省中国科学院植物研究所标本馆。以鳞茎为待测样品,取0.2 g鲜样冷冻干燥后,研磨成粉,取石蒜鳞茎干样0.02 g,置于EP管中加入2 mL 70%乙醇,超声提取30 min,12 000 r/min离心10 min,取上清液,滤渣加入2 mL 70%乙醇再次超声提取30 min,涡旋1 min,12 000 r/min 离心10 min,取上清液,合并两次上清液,氮吹浓缩至近干,以1 mL 0.1%甲酸水溶液-乙腈(体积比95∶5)溶解,稀释1 000倍至0.5~500 μg/L,过0.22 μm滤膜。
1.2.3含量计算将待测样品的质谱峰面积数据代入所得到的线性方程中,获得待测样品溶液中目标分析物的质量浓度C(μg/L),再根据复溶的溶剂体积V(mL),稀释倍数D,以及样品质量M(干重,单位为g),计算样品中目标分析物的含量m(单位为ng/g干重),含量计算公式为:m=(C×V×D)/M。
1.3 实验条件
1.3.1色谱条件液相色谱柱:Waters ACQUITY UPLC BEH C18(150 mm×2.1 mm,1.7 μm);柱温:50 ℃;进样量:5 μL;流速为0.2 mL/min;流动相:A为0.1%甲酸-水溶液,B为乙腈;梯度洗脱条件:0~3.5 min,95%A;3.5~4.5 min,95%~40%A;4.5~6 min,95%A。
1.3.2质谱条件离子源:电喷雾离子源(ESI);扫描及采集方式:正离子扫描下以多反应监测(MRM)模式进行分析;离子源喷雾电压4 500 V;雾化气Gas1:55;辅助气Gas2:55;气帘气30。
2 结果与讨论
2.1 色谱-质谱条件的优化
考察了乙腈-水、甲醇-水、乙腈-0.1%甲酸水溶液、甲醇-0.1%甲酸水溶液等不同流动相的洗脱效果,发现乙腈作为流动相时粘度小、传质快、柱压低且目标物质的保留时间更短,在乙腈中加入一定比例的甲酸可提高检测的灵敏度、减少色谱峰拖尾,改善分析物的峰形,经优化选择乙腈-0.1%甲酸水溶液作为流动相。
色谱分离样品有梯度和等度洗脱2种方式,梯度洗脱适用于多种复杂成分的物质分离,本研究同时检测3种生物碱类物质,等度洗脱无法实现物质之间的有效分离,因此选择梯度洗脱。在优化的色谱条件下,加兰他敏的保留时间为2.86 min,力可拉敏的保留时间为2.31 min,石蒜碱的保留时间为1.95 min。
在质谱条件的优化中,根据加兰他敏、力可拉敏和石蒜碱的结构并结合前人研究结果[16],发现三者在正离子模式下具有较高的响应和灵敏度及较清晰的质谱图,因此质谱的离子化模式选择正离子模式。3种物质的提取离子色谱图及MS/MS质谱图见图1,质谱参数见表1。

表1 优化的质谱条件参数Table 1 Optimized MS/MS parameters for the determination of Gal,Lycm and Lyc
2.2 供试品制备方法的优化
对提取溶剂(50%、70%、90%乙醇),超声波提取时间(15、30 min)和二次提取方法进行考察(表2),结果表明,采用70%乙醇作为溶剂,超声波辅助提取2次,每次提取30 min具有较高的提取效率。

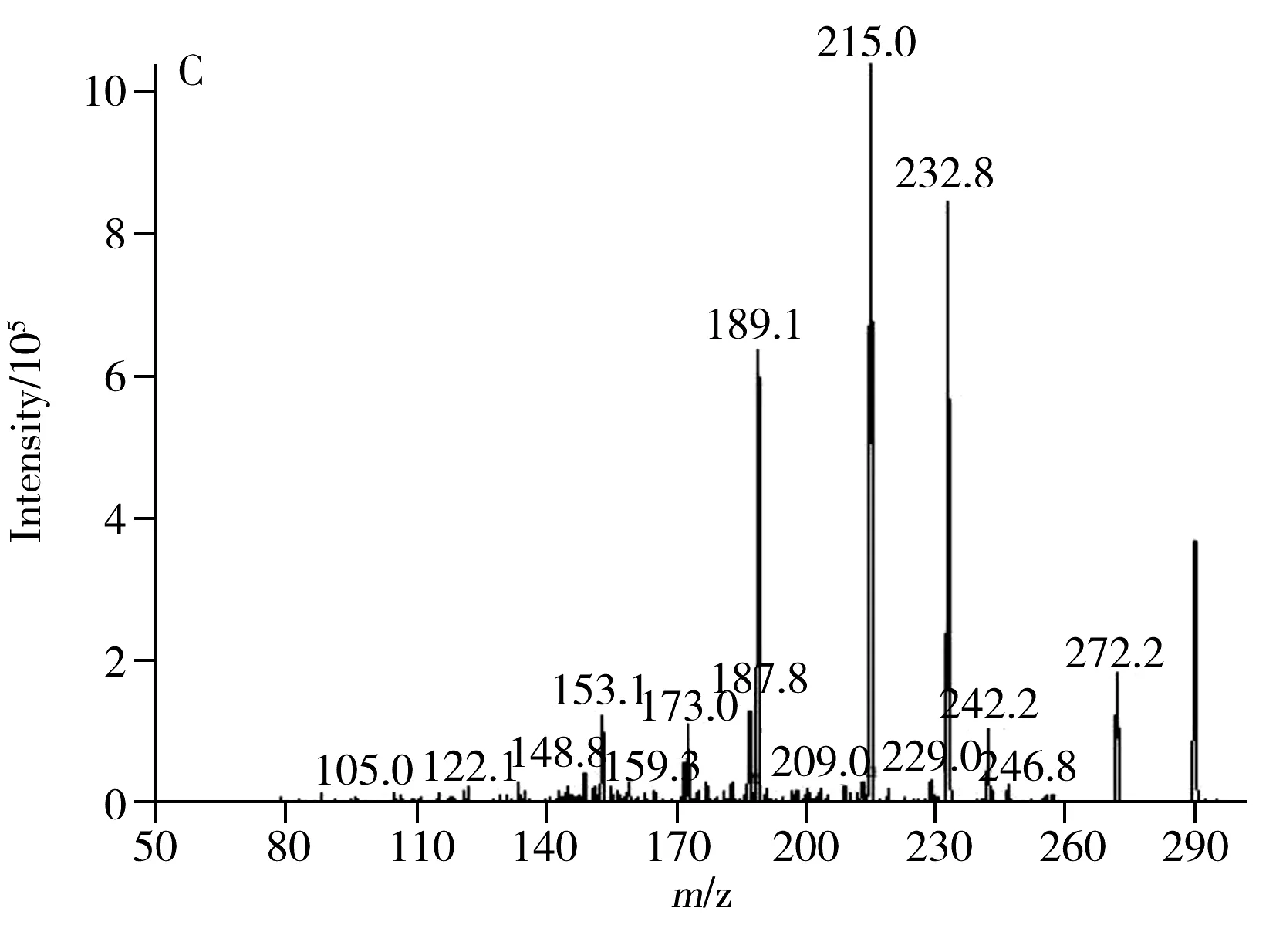
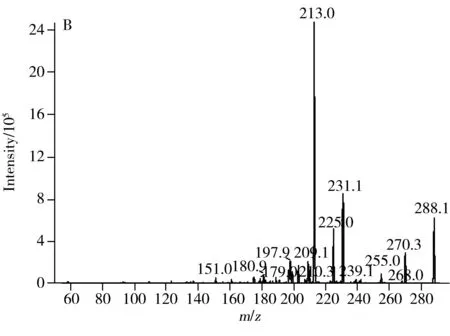

图1 样品的总离子流图(A)及加兰他敏(B)、力可拉敏(C)与石蒜碱(D)的MS/MS质谱图Fig.1 TIC chromatogram of the extract from sample(A),and MS/MS spectrum of galanthamine(B),lycoramine(C)and lycorine(D)

SolventExtractiontime/minGalcontent/(μg·g-1DW)Lycmcontent/(μg·g-1DW)Lyccontent/(μg·g-1DW)50%Ethanol15390 1384 83932 350%Ethanol30417 2410 94164 570%Ethanol15436 5428 34302 170%Ethanol30464 9466 24515 690%Ethanol15413 4397 54200 690%Ethanol30436 3434 44389 7
DW:dry weight(干重)
2.3 方法学考察
2.3.1线性关系与检出限按“1.2”方法进行标准溶液配制,在优化实验条件下采用本方法进行测定,以峰面积(Y)对相应标准溶液浓度(X,μg/L)绘制标准曲线,得到线性方程、相关系数以及线性范围。以信噪比(S/N)为3确定仪器的检出限(IDL),以EPA定义的方法确定方法的检出限(MDL),结果列于表3。结果表明,3种生物碱在0.5~500 μg/L质量浓度范围内线性良好(r2>0.999),以仪器在信噪比为3时能检测到的最低浓度计算得IDL为0.1 μg/L。根据美国EPA对MDL认定方法,利用本文的分析步骤,对加标样品进行 8次平行测定(加标浓度为预估检出限的1~5倍),结果经 Grubbs检验可以用于检出限的计算,根据8个平行测定的标准偏差S和t分布值,利用公式MDL=t(8-1,0.99)×S确定该法测定Gal、Lycm、Lyc的MDL分别为0.34、0.25、0.25 μg/L。

表3 3种生物碱的线性回归方程及检出限Table 3 Linear regression equation,MDL and IDL of three types of alkaloids
2.3.2精密度、重复性及稳定性取同一Gal、Lycm和Lyc标准品溶液,重复进样5次,计算Gal、Lycm和Lyc峰面积的相对标准偏差(RSD)分别为0.5%、0.79%、0.4%,说明仪器精密度较好。取同一样品,按照“1.2”方法制备供试品溶液,进样重复测定 5次,计算Gal、Lycm和Lyc含量的RSD分别为2.0%、3.4%、3.6%,说明方法重复性较好。取同一样品溶液,分别在 0、3、6、9、24 h 进样5次,测得Gal、Lycm和Lyc含量的RSD分别为3.4%、3.5%、3.0%,说明供试品溶液在24 h内稳定性较好。
2.3.3加标回收率实验取已知含量的0.10 g干重样品,精密称定5份,加入一定量的标准品溶液,使供试品溶液中Gal、Lycm和Lyc的质量浓度分别为25.00、10.00、40.00 mg/L,按“1.2”方法制备供试品溶液并进行测定,3种生物碱的平均回收率为97.2%~98.6%,RSD为0.8%~4.3%,表明该方法具有较好的准确度,可以用于样品中3种生物碱的分析(见表4)。

表4 供试品溶液中3种生物碱的加标回收率与相对标准偏差(n=5)Table 4 Spiked recoveries and RSDs of three types of alkaloids in test solutions(n=5)
2.4 石蒜属12个种3种生物碱含量的测定
采用优化的方法及条件,测定石蒜属12个种3种生物碱的含量 (以干重计),结果显示,加兰他敏的含量在石蒜属不同种间差异可达 20倍,含量范围为21.98~496.77 μg/g DW(表5)。加兰他敏含量以长筒石蒜、忽地笑和中国石蒜较高,而红蓝石蒜、鹿葱和矮小石蒜含量很低;石蒜碱含量以长筒石蒜、香石蒜和陕西石蒜较高,在鳞茎中的含量最高约为0.45%,除乳白石蒜较低外,种间差别约达45倍;力可拉敏含量以长筒石蒜、换锦花、红蓝石蒜较高,在鳞茎中的含量最高约为0.046%,除忽地笑、乳白石蒜和鹿葱中极低外,种间差别约为38倍。

表5 石蒜属3种生物碱的含量(n=5)Table 5 Three types of alkaloids contents in Lycoris spp.(n=5)
2.5 方法对比
本文建立了液相色谱-串联二级质谱检测石蒜中3种生物碱的新方法,与传统方法相比,本方法的样品前处理具有操作简单、有机溶剂消耗少、分析快速、分离效果好等特点。与已有文献相比,如Saliba等[16]的方法主要提取步骤为:甲醇提取24 h、浓缩、硫酸酸化、氯仿抽提、蒸发、复溶、过滤,而本方法采取快速简化的提取步骤,经过2次超声波辅助提取、离心、蒸发、复溶、过滤,提取过程快速简单。Quan等[15]建立的HPLC方法中单次提取石蒜鳞茎材料需鲜样20 g,甲醇110 mL,盐酸10 mL,氯仿15 mL,对植物样本和试剂消耗极大,本方法待测样品鲜重可低至0.2 g,提取剂体积为2~5 mL。在保证提取效果的前提下,极大节约了植物材料和提取试剂。李明凯等[14]和Saliba等[16]的方法检测程序长达30~50 min,而本方法的检测程序时间≤6 min,3种物质的洗脱时间<3 min,并且串联了二级质谱,分析了加兰他敏、力可拉敏和石蒜碱子离子的信息,经方法学确认,取得了很好的提取和分析效果,大大提高了分析速度和准确性。通过进一步的拓展研究,本方法可用于3种生物碱类物质的提取和检测,是一种简捷、高效和准确的检测方法。
3 结 论
本研究利用超声波辅助进行二次提取,并以液相色谱-质谱联用技术为基础,对石蒜属植物中3种生物碱进行检测,分析时间在6 min内。通过对3种生物碱的保留时间、母离子、子离子的三级信息整合,特别是二级质谱中多组母离子/子离子对的信息监测,能确保定性和定量的准确性。此方法能快速提取并准确定性定量分析石蒜植物中的加兰他敏、力可拉敏和石蒜碱,大幅缩短分析时间,提高分析准确度,为研究石蒜植物中上述生物碱类物质的积累规律和合成代谢调控提供了有效且准确的分析方法。
[1] Zhu Z S,Xie S L.JiangxiForestSci.Technol.(朱重胜,谢树禄.江西林业科技),2008,5:41-42.
[2] Xie J,Tan F,Feng W,Chen B.Chin.Tradit.Herb.Drugs(谢峻,谈锋,冯巍,陈斌.中草药),2007,38(12):1902-1905.
[3] Quan M H,Xia W J.Chin.J.Spectrosc.Lab.(全妙华,夏伟健.光谱实验室),2012,29(3):1800-1803.
[4] Yuan J H.Subtrop.PlantSci.(袁菊红.亚热带植物科学),2011,40(4):1-7.
[5] Liu J,Hu W X,He L F,Ye M,Li Y.FEBSLett.,2004,578(3): 245-250.
[6] Sun C S,Zhu H,Peng Z J.Res.Pract.Chin.Med.(孙长生,朱虹,彭志金.现代中药研究与实践),2011,6:30-31.
[7] Wang R,Xu S,Jiang Y M,Jiang J W,Li X D,Liang L J,He J,Peng F,Xia B.PlosOne,2013,8(4):e60449.
[8] Chen P J,Liang H,Xiao F,Lin L,Tu X K.J.Instrum.Anal.(陈沛金,梁宏,肖锋,林黎,涂小珂.分析测试学报),2017,36(3):403-408.
[9] Zhang W H,Xie W,Hou J B,Tong Y K,Lu S,Wang P.J.Instrum.Anal.(张文华,谢文,侯建波,童赟恺,陆顺,汪鹏.分析测试学报),2016,35(10):1241-1247.
[10] Zhu J G,Li P W,Zhang W,Sun X M,Yang Q Q,Zhang Q,Zhang Z W,Ding X X.J.Instrum.Anal.(朱建国,李培武,张文,孙晓曼,杨青青,张奇,张兆威,丁小霞.分析测试学报),2016,35(9):1087-1093.
[11] Qin W H,Liu X,Yang Y,Zhang X M,Guo Y L,Liu F.J.Instrum.Anal.(秦伟瀚,刘翔,阳勇,张小梅,郭延垒,刘飞.分析测试学报),2017,36(3):312-318.
[12] Qin Y,Yin J B,Du D S,Cao J,Yin C L,Cheng Z H.J.Instrum.Anal.(秦艳,尹建兵,杜冬生,曹捷,尹成乐,程志红.分析测试学报),2017,36(1):9-17.
[13] Li X,Xiong H R,Jiang L H,Wen Z Y,Xiong Y F.Chin.J.Appl.Chem.(李霞,熊海蓉,蒋利华,文祝友,熊远福.应用化学),2010,27(11):1362-1364.
[14] Li M K,Zhang Y Q,Dong Z R,Gao C Y,Zhong Y L,Chen N,Wang M F.J.Instrum.Anal.(李明凯,张玉琼,董召荣,高翠云,仲延龙,陈娜,王梅方.分析测试学报),2012,31(8):957-961.
[15] Quan M H,Ou L J,She C W,Wu X J,Chen D M,Lu J T.Afr.J.Biotechnol.,2012,15: 3686-3691.
[16] Saliba S,Ptak A,Laurain-Mattar D.Eng.LifeSci.,2015,15:640-645.
[17] Liu J X,Luo Y Y,Liu X H,Song J P,Hua Y J,Wang S N.J.Chin.Mass.Spectral.Soc.(刘娟秀,罗益远,刘训红,宋建平,华愉教,王胜男.质谱学报),2016,37(6):542-553.
[18] Zhu W X,Zhang L,Li S,Zhang L,Liu Y F,Yang J Z.Chin.J.Chromatogr.(祝伟霞,张莉,李睢,张丽,刘亚风,杨冀州.色谱),2016,34(7):681-685.
[19] Li Q Z,Zhu F Y,Gao X,Sun Y,Li S,Tao Y,Lo C,Liu H.Planta,2014,240:701-712.
[20] Lam P Y,Liu H,Lo C.PlantPhysiol.,2015,168:1527-1536.
