脾脏硬化性血管瘤样结节性转化的MRI特征与病理对照
2018-03-06房文皓曾蒙苏盛若凡张亚林
房文皓,曾蒙苏,盛若凡,张亚林
(1.湖南省长沙市中心医院放射科 410004;2.复旦大学附属中山医院放射科,上海 200032)
脾脏硬化性血管瘤样结节性转化(sclerosing angiomatoid nodular transformation,SANT)是近几年逐渐被认识的一种罕见的脾脏良性血管性病变,实为非肿瘤性良性病变,其组织学主要表现为血管瘤样增生。1993年最早由KRISHNAN等研究提出,将其称为脾索毛细血管瘤[1]。在2003年KRISHNAN等[2]根据免疫组化表型将此病认定为脾错构瘤的一种亚型;阿克曼外科病理学第9版将其称为多结节性血管瘤[3]。2004年由MARTEL等[1]首先提出了脾脏SANT这一病理命名,该研究回顾性分析了25例脾脏相似病变的病理特点提出其组织学特征:纤维硬化的脾脏间质中见多结节性血管瘤样改变,结节周围见纤维组织呈同心圆排列。目前为止,国内外文献报道的脾SANT病例不多,其发病机制尚不明确。作者回顾性分析8例经手术病理证实的脾脏SANT患者的磁共振成像(MRI)资料,对该病的临床表现、病理学特点、MRI影像学特征及鉴别诊断等方面进行讨论,期望进一步提高本病的影像诊断水平。
1 资料与方法
1.1一般资料 收集2007年1月至2016年11月复旦大学附属中山医院经手术病理证实的8例脾脏SANT患者MRI资料,其中女3例,男5例;年龄24~83岁。8例患者术前均行MRI平扫及动态增强扫描。7例(87.50%)为B超体检时发现,无临床症状,体检及实验室检查阴性;1例(12.50%)患者因腹痛胆囊癌行检查时意外发现。8例脾脏SANT患者7例行腹腔镜下脾脏切除术,1例行剖腹探查手术。
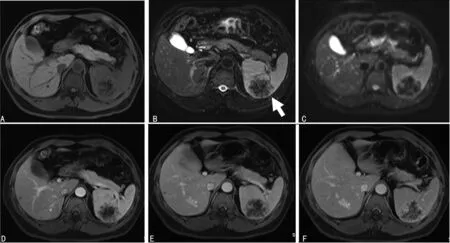
A:T1WI;B:T2WI;C:DWI;D~F:动态增强扫描
图1典型病例MRI图像

A:T2WI;B:DWI;C:增强扫描;D:典型的辐轮样强化;E:延迟期扫描;F:镜下图像(HE ×200)
图2典型病例MRI图像及显微镜下图像
1.2方法
1.2.1影像检查方法 采用德国Siemens Avanto 1.5T磁共振扫描仪行MRI平扫及动态增强检查,采用相控阵体部线圈。平扫包括快速自旋回波T2WI抑脂序列(TR 2 000.00 ms,TE 70.00 ms);小角度激发快速梯度回波(FLASH) T1WI序列(TR 230.00 ms,TE 2.47 ms);3D GRE T1W抑脂序列(TR 4.90 ms,TE 2.40 ms);扩散加权成像(DWI)单次激发回波平面成像序列(TR 2 400~2 600 ms,TE 66.00 ms)。经肘静脉快速手动推注对比剂钆喷酸葡甲胺(Gd-DTPA),剂量为0.10 mL/kg,行动脉期(注射后25 s左右)、门静脉期(75 s左右)和延迟期(120 s左右)扫描。
1.2.2图像分析 由两位主治医师以上职称诊断医师对所有MRI影像资料分别进行独立分析,结果不一致时通过协商达成一致。具体分析内容:病灶的大小、形态、边缘、有无出血、坏死囊变,以及病灶平扫和动态增强多期扫描的信号特点及强化形式等。
2 结 果
2.1MRI表现 8例脾脏SANT患者均为单发肿块,类圆形;直径为3.30~8.20 cm,中位为4.60 cm;边界清楚8例(100.00%),T1WI呈等或低信号7例(87.50%),稍高信号1例(12.50%);T2WI呈不均匀低信号8例(100.00%),DWI 呈不均匀性低信号8例(100.00%);表现扩散系数(ADC) 7例为稍高信号(87.50%);6例延迟期可见中心性星芒状持续低信号改变(75.00%)。增强扫描均呈现血管瘤样强化方式,即渐进性、向心性充填强化,典型呈辐轮状强化6例(75.00%),中央星芒状结构始终不强化呈低信号。8例患者病灶均未见坏死囊变。
2.2病理表现 大体标本见肿块实性,灰白或灰红色,质中等硬,边界清楚,无明显包膜,结节内见不规则灰白色星状瘢痕组织。镜检显示病变组织正常脾脏结构破坏,脾脏纤维硬化性间质中间可见多个血管瘤样结节,结节内或结节周围见含铁血黄素沉积及结节间纤维化。免疫组化结果显示,8例均见CD31+,CD34+,F8+、SMA+。
2.3典型病例 患者1,男,49岁,体检发现脾脏占位;T1WI显示病灶呈稍低信号(图1A),T2WI显示肿块呈明显低信号,中央见星芒状更低信号(图1B,白箭头)。DWI显示呈不均匀性低信号(图1C),动态增强扫描病灶呈渐进性、向心性强化,见图1D~F。患者2,女,24岁,体检发现脾脏占位;T2WI显示呈不均匀稍低信号(图2A),病灶DWI显示呈低信号(图2B),增强扫描动脉期病变呈边缘强化,中央见星芒状瘢痕(图2C,黑箭头),门脉期病变强化进一步向中央推进形成典型的辐轮样强化(图2D);延迟期肿块呈持续性渐进性强化,呈相对高信号,中央瘢痕组织“星芒状结构”始终不强化呈持续性低信号(图2E,黑箭头);显微镜下显示硬化纤维间质中见多发大小不一血管瘤样结节(白箭头),结节内可见“星芒状”纤维瘢痕组织(黑箭头)和含铁血黄素沉积,见图2F。
3 讨 论
3.1SANT的临床表现及病理学特征 文献报道本病女性稍多于男性,男女比例约1.0∶1.3[4-5],而本组SANT资料,男5例,女3例,男女比例1.7∶1.0,与文献报道有差异。此病临床表现缺乏特异性,本文中大部分患者(7例,87.50%)因体检发现或因合并其他疾病行检查发现(1例,12.50%)。8例患者经目前追踪亦无复发转移征象,表明 SANT 是脾脏的一种少见良性病变,临床仅需行单纯脾脏切除术即可达到完全治愈。
大体标本通常大于5.00 cm,多为单个,境界清楚,类圆形,无明显包膜,切面实性,灰白灰红色,肿块中央见纤维瘢痕组织,周边为血管瘤样结节。迄今为止国内外文献共报道脾多发SANT仅有8例[6-7];杨旦君等[8]报道的仅1例多发SANT肿块病变数大于10个。本文8例标本均符合上述单发肿块特点,未见多发病例。SANT的病理组织学具有特征性,主要表现为镜下纤维硬化性的脾脏间质中多个结节样血管瘤样改变。免疫组化F8、CD34、SMA、CD31、CD68等血管受体均表达均为阳性。
3.2SANT的影像学特征 作者回顾性分析8例经手术证实的脾脏SANT患者资料,总结其影像学表现如下:(1)单发,边界清楚,类圆形肿块,无坏死囊变;(2)T1WI呈等或稍低信号,T2WI及DWI呈不均匀性低信号,ADC呈等或稍高信号;(3)动态增强扫描呈渐进性、向心性的辐轮状持续性强化,作者认为辐轮状及持续性强化特点是SANT较为特异的影像学特征;(4)延迟期病灶中央呈星芒状或放射状持续低信号改变。
经总结发现T2WI及DWI弥散序列多呈不均匀低信号,作者认为此特点可能是诊断脾脏SANT较为重要的特征之一,其低信号为脾脏病变组织内含铁血黄素超顺磁性物质沉积所致[9]。有关脾SANT的DWI和ADC表现文献报道甚少,本组8例均行DWI和ADC序列检查,8例DWI均呈不均匀性低信号(100.00%),ADC呈稍高信号7例(87.50%),更加支持良性病变的诊断,对该病的诊断及鉴别诊断很有价值。动态增强扫描动脉期的边缘结节状强化,门脉期和延迟期逐渐向中心充填样强化,低信号的星芒状中心持续存在,这种特异的渐进性向心性强化和星芒状中心则构成了THACKER等[10]和KARAOSMANOGLU等[11]描述的“辐条轮征”,这种辐轮状强化一直被认为是脾SANT较为特征的MRI表现,病灶中央的低信号持续存在即反映了结节内纤维组织瘢痕和含铁血黄素的沉积。本组见典型辐轮征状6例(占75.00%),延迟期病灶内星芒状低信号6例(75.00%),明显高于LEWIS等[4]报道的22%的比例,分析原因可能为对于始终不强化的纤维组织瘢痕和含铁血黄素沉积能力的显示MRI明显优于CT。
3.3鉴别诊断 脾SANT需要与脾脏常见的良性肿瘤鉴别,如海绵状血管瘤、窦岸细胞血管瘤(littoral cell angiomas,LCA)、错构瘤等,主要手段还要依靠免疫组化[11]。(1)海绵状血管瘤:二者动态增强的强化方式很相似,均为渐进性向心性充填,SANT区别于血管瘤的是T2WI为低信号,而非血管瘤的T2WI“亮灯泡征”,动脉期病灶边缘结节状、血池样强化也不及血管瘤明显。(2)LCA:常见多发且不可数,T2WI以混杂高信号多见而非SANT的低信号,无钙化,延迟强化较均匀,可见假包膜,镜下缺乏硬化间质背景和多结节瘤样特征。(3)错构瘤:典型的错构瘤具有囊变、脂肪、钙化,动态增强后呈弥漫性不均匀强化及延迟期的持续性强化,常呈等或稍高信号,SANT则多呈辐轮状强化及中心裂隙瘢痕双特点,易与之鉴别。
综上所述,具有单发、类圆形、无包膜、无囊变坏死,T2WI及DWI呈不均匀低信号,ADC稍高信号,伴有始终无强化的星芒状瘢痕,以及渐进性向心性辐轮状强化等特点,均高度提示本病的可能。
[1]MARTEL M,CHEUK W,LOMBARDI L,et al.Sclerosing angiomatoid nodular transformation (SANT):report of 25 cases of a distinctive benign splenic lesion[J].Am J Surg Pathol,2004,28(10):1268-1279.
[2]KRISHNAN J,FRIZZERA G.Two splenic lesions in need of clarification:Hamartoma and inflammatory pseudotumor[J].Semin Diagn Pathol,2003,20(2):94-104.
[3] ROSAI J.Rosai and Ackerman 's surgical pathology[M].9th ed.Edinburg:Mosby,2004:2035.
[4]LEWIS R B,LATTIN J,NANDEDKAR M A.Sclerosing angiomatoid nodular transformation of the spleen:CT and MRI features with pathologic correlation[J].Am J Roentgenol,2013,200(4):353-360.
[5]VYAS M,DESHMUKH M,SHET T,et al.Splenic angiomatoid nodular transformation in child with inflammatory pseudotumor-like areas[J].Indian J Pathol Microbiol,2011,54(4):829-831.
[6]DIEBOLD J,LE TOURNEAU A,MARMEY B,et al.Is sclerosing angiomatoid nodular transformation(SANT) of the splenic red pulp identical to inflammatory pseudotumour? Report of 16 cases[J].Histopathology,2008,53(3):299-310.
[7]KUO T T,CHEN T C,LEE L Y.Sclerosing angiomatoid nodular transformation of the spleen(SANT):Clinicopathological study of 10 cases with or without abdominal disseminated calcifying fibrous tumors,and the presence of a significant number of IgG4+plasma cells[J].Pathol Int,2009,59(12):844-850.
[8]杨旦君,谭延斌,钱姿桦,等.脾脏硬化性血管瘤样结节性转化的MRI表现[J].临床放射学杂志,2015,34(4):572-576.
[9]KIM H J,KIM K W,YU E S,et al.Sclerosing angiomatoid nodular transformation of the spleen:clinical and radiologic characteristics[J].Acta Radiol,2012,53(7):701-706.
[10]THACKER C,KORN R,MILLSTINE J,et al.Sclerosing angiomatoid nodular transformation of the spleen:CT,Mr,PET,and99Tcm-sulfur colloid SPECT CT findings with gross and histopathological correlation[J].Abdom Imaging,2010,35(6):683-689.
[11]KARAOSMANOGLU D A,KARCAALTINCABA M,AKATA D.CT and MRI findings of sclerosing angiomatoid nodular transformation of the spleen:spoke wheel pattern[J].Korean J Radiol,2008,9 Suppl:S52-55.
