不同手术与化疗时机配合治疗老年卵巢癌的价值对比分析
2018-03-06孙慧霞李国正
孙慧霞,孙 会,李国正,周 中
(1.河南省南阳市中心医院妇产科 473000;2南阳医学高等专科学校,河南南阳 473000;3.重庆市荣昌区人民医院妇产科 402460)
卵巢恶性肿瘤是女性生殖器官最常见的恶性肿瘤之一,发病率仅次于宫颈癌和子宫体癌而居于第三位。但卵巢上皮癌病死率却居各类妇科肿瘤的首位。据欧洲统计结果显示,女性恶性肿瘤患者中58%为65岁以上老年人[1]。而55岁以上是妇科恶性肿瘤发病的高峰年龄,尤其是卵巢癌患者。随着我国人口老龄化,老年卵巢癌患者的人数逐年增长,其预后差且并发症较多。同时高龄增加了治疗的难度,除要求严格掌握手术指征,对化疗时机的选择也有一定的限制。现本文就不同手术与化疗时机的配合对老年卵巢癌的治疗效果的影响分析如下。
1 资料与方法
1.1一般资料 选择2013年1-5月南阳市中心医院住院治疗的老年卵巢癌患者60例,年龄大于或等于65岁。排除标准:治疗期间糖类抗原(CA)-125不降反升,或发现新生病灶需要更换治疗方案;放弃治疗者;智力或精神障碍,不能配合此次研究。患者均知情同意并签署知情同意书。根据其治疗方法分为两组。其中应用新辅助化疗(NACT)后再行肿瘤减灭术的患者为观察组(n=33),应用肿瘤减灭术后再行化疗的患者则为对照组(n=27)。观察组入组标准:胸、腹腔积液细胞或细针穿刺活检检查临床诊断为卵巢癌;血清CA125>1 000 U/mL;CT、B超、MRI等影像学检查腹腔积液大于3 000 mL[2],腹膜大网膜饼状肿块,盆腔巨块肿瘤,腹膜弥漫性粘连;以上3项中符合1项均可入选。对照组入组标准:血清CA125>1 000 U/mL;术后病理诊断符合上皮性卵巢恶性肿瘤。两组患者的年龄、性别、病程、术后病理、临床分期等基础资料比较,差异无统计学意义(P>0.05)。病理分期参照国际妇产科协会(FIGO)联合国际妇科肿瘤协会(IGCS)共同制订的妇科恶性肿瘤分期标准,两组患者一般资料比较,见表1。
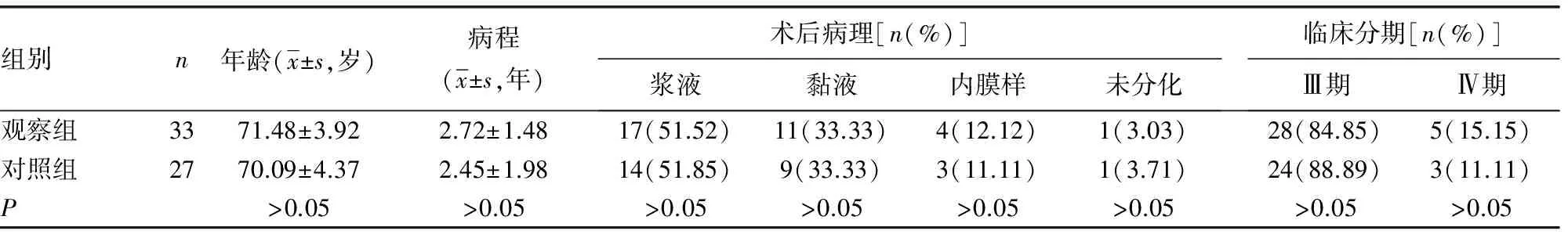
表1 两组患者一般资料比较
1.2方法
1.2.1观察组治疗方法 应用TP化疗方案,紫杉醇135 mg/m2>3 h静脉滴注;卡铂300 mg/m2,>1 h静脉滴注,化疗21 d为1个疗程,共进行2~3个疗程,全部疗程结束后评估化疗效果。效果满意后应用肿瘤细胞减灭术治疗,切除全子宫双附件、大网膜、阑尾(仅限黏液性卵巢癌)及肿瘤转移灶,并行腹主动脉旁、盆腔淋巴结清扫或选择性活检术。手术与化疗间隔1~2个月。
1.2.2对照组治疗方法 对照组先行肿瘤减灭术,方法与观察组相同,术后8~10 d后再行化疗,化疗方案与观察组相同。
1.2.3观察指标 观察两组患者临床疗效及术中出血量等手术指标。对所有患者随访3年,观察比较两组患者生存情况。两组患者在所有治疗结束1个月后的首周周一进行疗效评价,疗效标准参照1979年世界卫生组织实体瘤疗效评级标准[3-4],完全缓解(CR):所有目标病灶消失;部分缓解(PR):基线病灶长径总和缩小小于30%;病灶进展(PD)基线病灶长径和增加大于20%或出现新病灶;病灶稳定(SD):基线病灶长径总和有缩小但未达到PR或有增加但未达到PD;总有效为CR+PR。手术评价项目包括手术时间、术中出血量、理想减灭率(残余病灶小于2 cm为理想减灭,≥2 cm为非理想减灭)、残余病灶直径。对所有患者通过电话、短信、邮件、到院复查等方式随访3年,观察对比患者的生存情况。

2 结 果
2.1两组患者疗效比较 观察组CR 9例,PR 18例,总有效率为84.85%;对照组CR 5例,PR 14例,总有效率为70.38%;两组患者比较,差异有统计学意义(P<0.05),见表2。
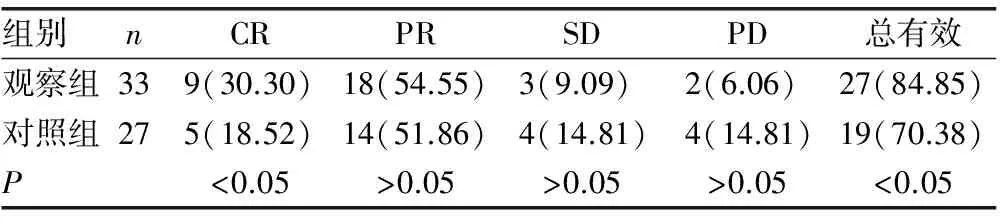
表2 两组患者疗效比较[n(%)]
2.2两组患者手术相关指标比较 观察组患者在手术时间、术中出血量、理想减灭率、残余病灶直径等手术指标均优于对照组(P<0.05),见表3。
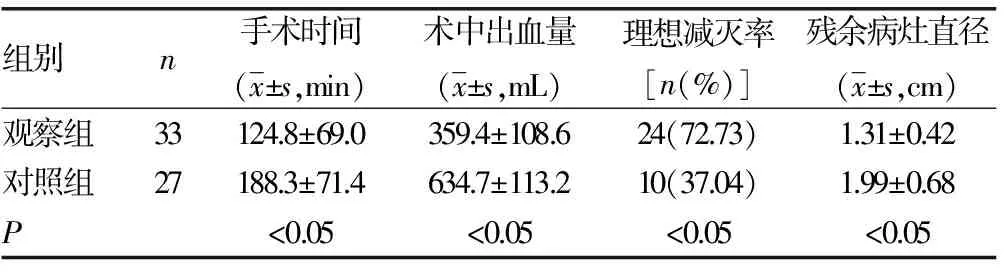
表3 两组患者手术相关指标比较
2.3两组患者生存情况比较 60例患者中无失访病例,随访至2015年3月1日,平均随访期为(33.71±2.47)个月。两组患者中位生存时间(MST)及1、3年生存率比较,见表4。
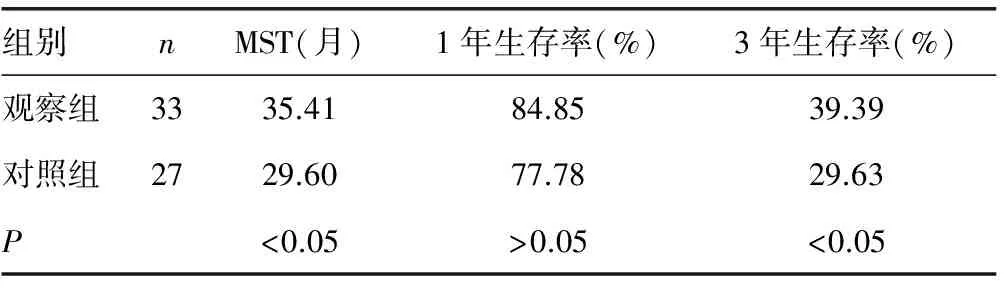
表4 两组患者随访期间生存情况比较
3 讨 论
卵巢癌死亡率高往往由于该病的诊断率较低,由于卵巢癌早期多无明显症状,多数患者就诊时已有腹腔内广泛转移或合并胸、腹腔积液,无法将病灶完全切除,只能酌情行肿瘤减灭术[5-6]。
NACT又称为先期化疗,是指对术前评估肿瘤细胞减灭术无法达到最佳减灭效果或不能耐受肿瘤细胞减灭术的卵巢癌患者先行化疗、然后实行肿瘤细胞减灭术[7-8]。其可杀灭癌灶周围转移灶,减轻肿瘤与周围组织的粘连从而降低周围组织的水肿,缩小肿瘤体积,降低肿瘤分期,提高手术成功率,同时可缩小手术范围从而保留脏器功能,以降低手术的并发症与死亡率[9-10]。NACT可控制老年卵巢癌患者的胸、腹腔积液,从而减少术中蛋白的丢失,在改善患者的全身状况对手术耐受性的同时降低术后发生低蛋白血症的危险[11];可促使卵巢癌细胞进入休眠状态,从而减少手术过程中因机械原因引起的肿瘤扩散与种植,进而降低术后复发率;同时可避免因术后凝血机制加强及免疫抑制引起的肿瘤转移。
术后化疗又称为辅助化疗,主要是在对身体的肿瘤进行手术或放疗后,应用化疗,用以缩小原发肿瘤,同时消灭残存的微小转移病灶,减少肿瘤复发和转移的机会。但在临床中,辅助化疗应用的时限对患者生存率与生活质量具有明显的影响,但其易受药物治疗价格、效应等多方面因素的干扰[12]。在本研究中,观察组手术时间、术中出血量、理想减灭率及残留病灶直径等指标均明显优于对照组(P<0.05)。并且观察组的治疗总有效率达到84.85%也明显高于对照组(P<0.05)。
需要注意的是,NACT并不适用于所有老年卵巢癌患者,一般在化疗2个疗程中,患者的胸、腹腔积液得到控制、肿瘤松动缩小者,经评估可达到最佳减灭效果后则可行肿瘤细胞减灭术。肿瘤缩小不理想的患者可行第3个疗程化疗,但若仍不满意,提示患者对NACT并不敏感,增加化疗疗程并不能改变患者状态,且过多疗程有增加肿瘤耐药性的风险[13]。
本研究中,观察组、对照组MST分别为35.41、29.60个月,1年生存率分别为84.85%、77.78%,3年生存率分别为39.39%、29.63%,观察组3年生存率明显高于对照组(P<0.05)。但与既往研究相比[14],老年卵巢癌患者的生存率低于年轻患者,分析原因主要为老年患者往往伴有其他合并症,一般状态较差。有研究发现,65岁以上老年卵巢癌患者仅8%无合并症,其中55%有2种以上合并症[15]。临床医生往往对老年患者采取姑息治疗,本研究认为,年龄不应作为影响治疗决定的惟一因素,临床应结合多种条件衡量老年卵巢癌患者的最佳治疗方案。
综上所述,对老年卵巢癌患者术前应用NACT较之术后辅助化疗具有更佳的临床疗效,并可提高患者远期生存率。
[1]董晖.新辅助化疗或手术治疗ⅢC 或Ⅳ期卵巢癌患者[J].中国老年学杂志,2015,34(1):230-231.
[2]付建红,高湛,翟旭华.新辅助化疗治疗老年女性晚期卵巢上皮癌的疗效[J].中国老年学杂志,2013,33(13):3224-3225.
[3]刘恩令,糜若然,周玉秀,等.新辅助顺铂腹腔热灌注化疗治疗老年晚期卵巢癌的疗效[J].中国老年学杂志,2015,35(17):4883-4884.
[4]李正红,郭科军,温放,等.新辅助化疗治疗晚期卵巢癌的临床疗效评价[J].中国医科大学学报,2012,41(7):645-649.
[5]娄雪玲,张占薪,张喜红,等.新辅助化疗联合肿瘤细胞减灭术及术后腹腔热灌注化疗治疗晚期卵巢癌的疗效观察[J].中国肿瘤临床,2014,52(14):930-932.
[6]胡章华,张茹,杜驰.TP方案新辅助化疗晚期卵巢癌38例疗效观察[J].中国医药指南,2013,11(1):47-49.
[7]李昱川.术前新辅助化疗治疗晚期卵巢癌的疗效分析[J].实用癌症杂志,2014,30(2):220-221,225.
[8]阎蓓,邸石,王罡,等.香菇多糖对Ⅲ期卵巢癌术后TP方案辅助化疗疗效的影响[J].武汉大学学报(医学版),2014,35(3):462-464,473.
[9]马一鸣,王莉.中晚期卵巢癌患者手术时机选择的临床分析[J].中国保健营养(上旬刊),2014,24(4):1868-1869.
[10]张恒,王宇平,谷杨,等.不同给药途径的新辅助化疗在晚期上皮性卵巢癌的疗效观察[J].现代生物医学进展,2015,15(1):96-99.
[11]BARUAH U,BARMON D,KATAKI A C,et al.Neoadjuvant chemotherapy in advanced epithelial ovarian cancer:a survival study[J].Indian J Med Paediatr Oncol,2015,36(1):38-42.
[12]HUANG S,DANG Y,LI F,et al.Biological intensity-modulated radiotherapy plus neoadjuvant chemotherapy for multiple peritoneal metastases of ovarian cancer:a case report[J].Oncol Lett,2015,9(3):1239-1243.
[13]SEWARD S M,WINER I.Primary debulking surgery and neoadjuvant chemotherapy in the treatment of advanced epithelial ovarian carcinoma[J].Cancer Metastasis Rev,2015,34(1):5-10.
[14]SEGEV Y,GEMER O,AUSLENDER R,et al.Advanced ovarian cancer:primary debulking(PDS) or neoadjuvant chemotherapy (NACT)-still a debate[J].Harefuah,2014,153(9):527-531,558.
[15]HIMOTO Y,KIDO A,FUJIMOTO K,et al.Mr imaging-based evaluation of morphological changes in the uterus and ovaries of patients following neoadjuvant chemotherapy for cervical cancer[J].Magn Reson Med Sci,2015,14(1):65-72.
