叶酸及维生素B12水平对培美曲塞联合铂类化疗的维汉两族NSCLC患者疗效的影响
2018-03-06马晨璐李建军
滕 菲,马晨璐,李建军,单 莉
(1.新疆医科大学研究生学院,乌鲁木齐 830000;2.新疆医科大学附属肿瘤医院肺内一科,乌鲁木齐 830000)
随着空气的污染及不良生活习惯的增加,目前我国肺癌的发病率及病死率逐年上升,且因大部分肺癌于确诊时已处于晚期,失去了早期手术治疗的时机,故肺癌的总体生存期并不理想[1]。最近,美国国立综合癌症网络(national comprehensive cancer network,NCCN)已将含铂的联合化疗方案用于一线和二线治疗晚期非小细胞肺癌(non-small-cell lung carcinoma,NSCLC)的标准方案,针对临床中非鳞NSCLC,含铂类联合培美曲塞化疗方案具有很好的治疗效果[2]。但目前仍然缺乏简单有效地血清学标志物来预测使用该方案化疗的获益人群。有研究表示,维吾尔族(以下简称维族)患者化疗效果与汉族患者相比较差,这可能与维族患者经济条件差,对疾病的认识不足等情况有关,也可能是与维族患者与汉族患者由于民族及基因的不同,对化疗的敏感性不同所致。因此,针对使用培美曲塞联合铂类化疗的维族与汉族NSCLC患者,本研究通过特定的方法检查其血液中叶酸与维生素B12水平,旨在了解维族患者使用培美曲塞联合铂类化疗效果不如汉族患者的原因是否与体内叶酸及维生素B12水平高低相关。
1 资料与方法
1.1一般资料 选取新疆医科大学附属肿瘤医院2015年1月至2016年10月收治于肺内一科经病理组织学确诊为NSCLC初治的维族(n=24)及汉族(n=37)患者共61例。且所有患者在新疆地区生活大于10年。其中男36例,女25例,年龄38~74岁,中位61岁,患者均经CT 或PET-CT 证实具有可测量的病灶。血常规、肝功能、肾功能及心电图均未见明显异常,既往无放、化疗史,无靶向治疗史,资料完整(包括性别、年龄、民族、吸烟史、肿瘤分化程度、肿瘤分期等),患者均知情并签署化疗同意书,同意使用培美曲塞联合铂类化疗方案的NSCLC患者,同时均在化疗前1周接受叶酸及维生素B12预处理。排除标准:非维族或汉族的患者;一线非使用培美曲塞联合铂类方案化疗的NSCLC患者;合并全身其他脏器的恶性肿瘤;同时正在进行放化疗或靶向治疗的患者。
1.2方法
1.2.1化疗方案 培美曲塞500 mg/m2+顺铂70 mg/m2或卡铂300 mg/m2或草酸铂135 mg/m2第1天静脉滴注,每 21 天为1 个周期。所有患者用药前需予以叶酸及维生素B12预处理,即化疗前 1 周给予口服叶酸 400 μg/d,持续至治疗结束;用药前1 周给予维生素B121 000 μg 肌内注射,每 9 周 1 次;用药前1 d及第1、2天口服地塞米松 4.5 mg,每天2次,并至少完成两个周期本方案化疗。
1.2.2检测方法 患者在入院后第2天清晨空腹采集左臂肘静脉血,注入含促凝胶的生化试管中,3 000 r/min离心5 min,取上清液。血清叶酸和维生素B12水平测定应用德国罗氏COBAS E601型全自动免疫分析仪,采用电化学发光法检测,试剂由罗氏试剂公司提供。各项操作严格按照说明书进行,所有室内质控均在控,于采集后4 h内检测完毕。测试项目的参考值:叶酸10.4~42.4 nmol/L, 维生素B12156~698 pmol/L[3]。在治疗前检测患者的叶酸和维生素B12水平,并至少每两个周期进行化疗疗效评价1次,随访至患者出现疾病进展或一线化疗完成。

2 结 果
2.1两组NSCLC患者临床相关指标比较 维族汉族NSCLC患者的性别、吸烟史、年龄、肿瘤分化程度、肿瘤分期、血清维生素B12水平比较,差异无统计学意义(P>0.05);但两组患者血清叶酸水平比较,差异有统计学意义(P<0.05),汉族NSCLC患者血清叶酸水平明显高于维族患者,见表1、2。
2.2单因素分析
2.2.1影响NSCLC患者预后的非连续性单因素分析 性别、吸烟史、肿瘤分化程度、肿瘤分期均对一线使用培美曲塞联合铂类化疗的NSCLC患者预后无明显影响(P>0.05)。民族、年龄对一线使用培美曲塞联合铂类化疗的NSCLC患者预后有影响(P<0.05),年龄小于等于60岁的患者较年龄大于60岁的患者预后好,且汉族患者无进展生存期(PFS)较维族患者长,见表3。
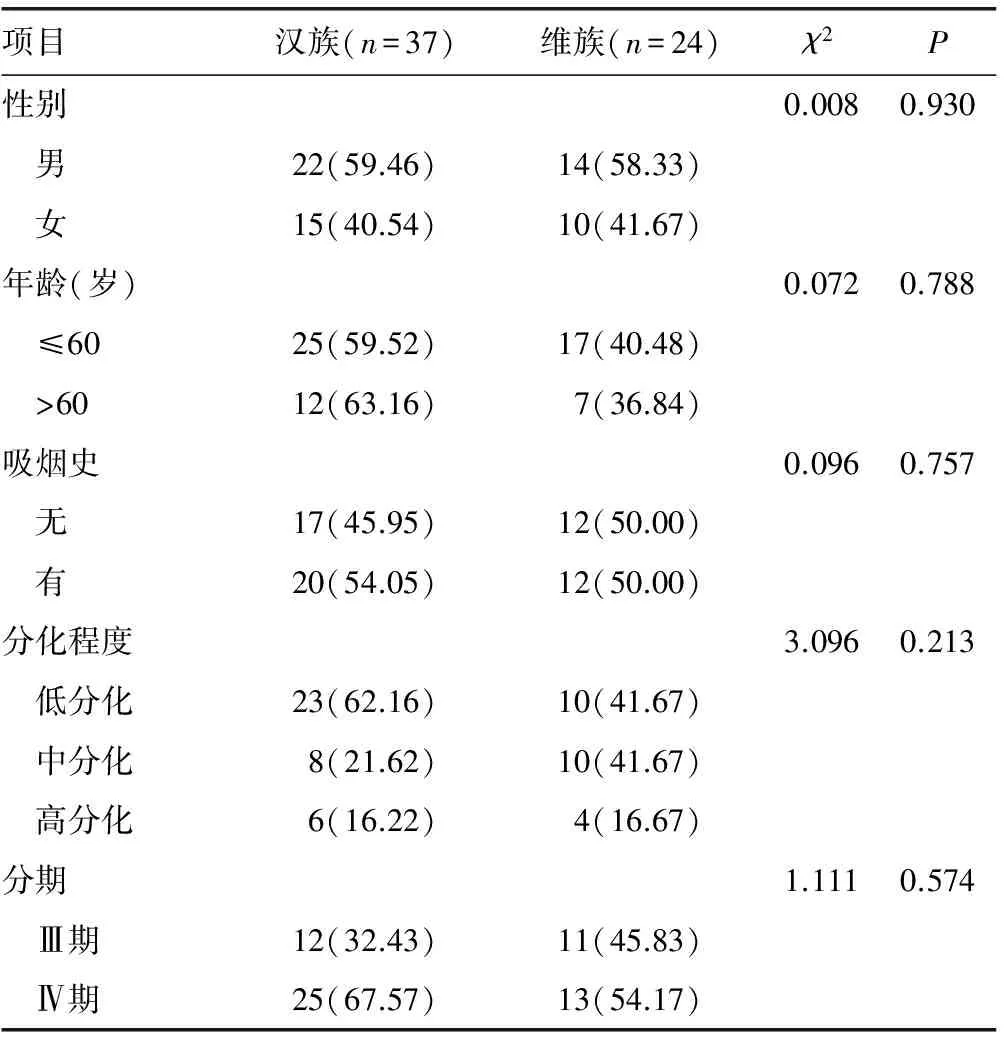
表1 两组NSCLC患者临床相关指标比较[n(%)]
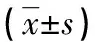
表2 两组NSCLC患者维生素B12及血清叶酸水平比较
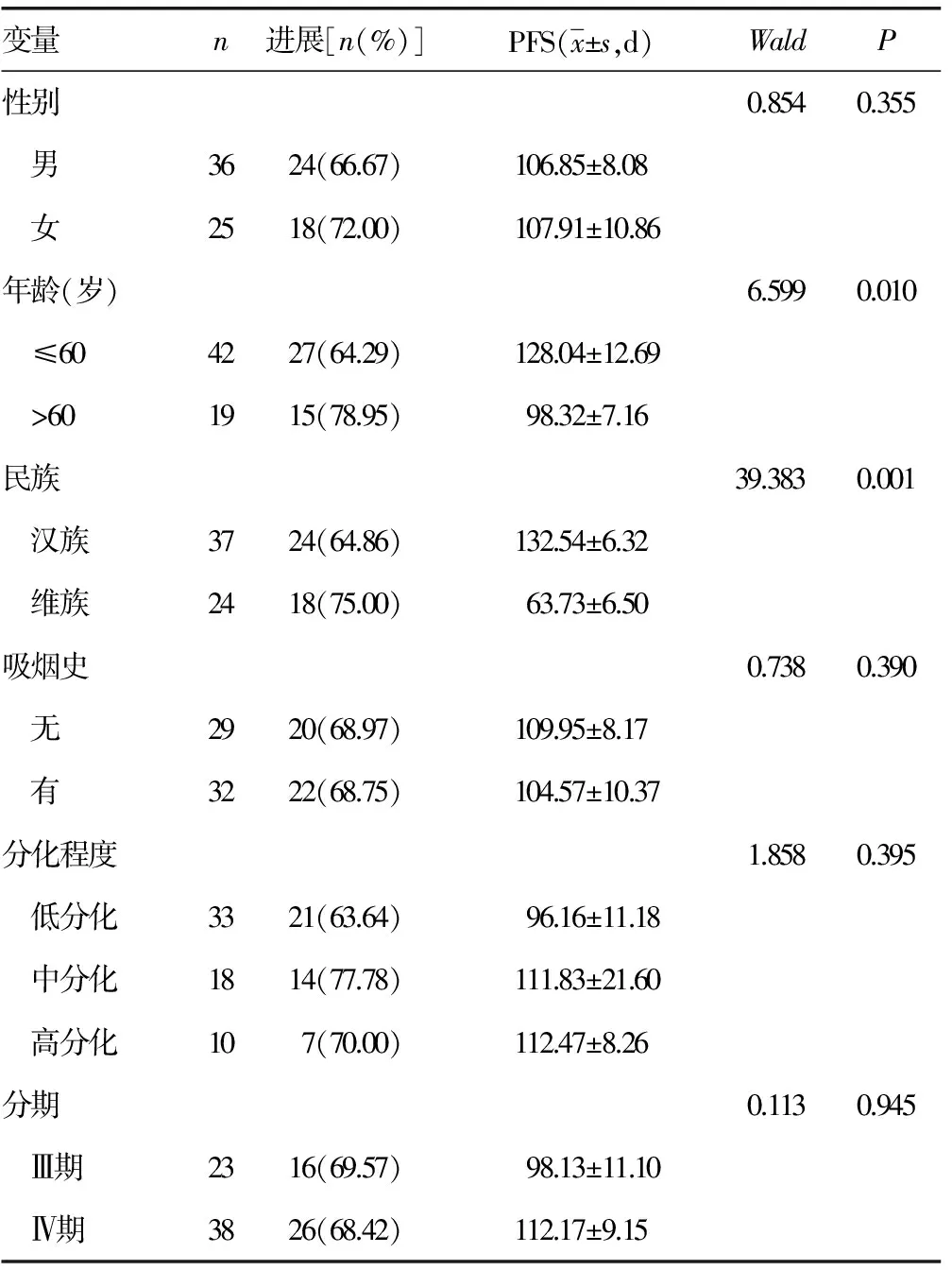
表3 影响NSCLC患者预后的非连续性单因素(n=61)
2.2.2影响NSCLC患者预后的连续性单因素分析 血清维生素B12水平对一线使用培美曲塞联合铂类化疗的NSCLC患者预后无影响(P>0.05)。而血清叶酸水平对一线使用培美曲塞联合铂类化疗的NSCLC患者预后影响明显(P<0.05),且血清叶酸水平高的患者预后明显好于血清叶酸水平低的患者,见表4。
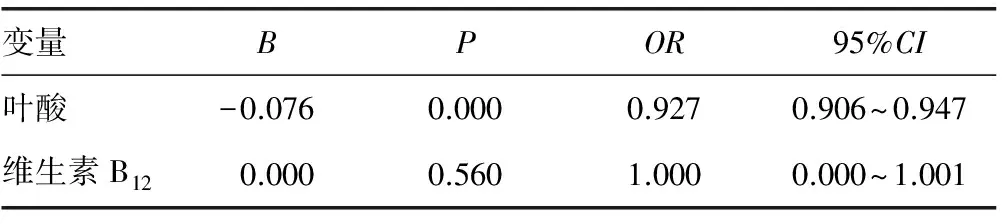
表4 影响NSCLC患者预后的连续性单因素
2.3多因素分析 将单因素分析中有意义的3个因素(年龄、民族、血清叶酸水平)作自变量,PES作应变量,应用Cox模型进行多因素分析后发现民族及血清叶酸水平为独立的预后危险因素(P<0.05),见表5。
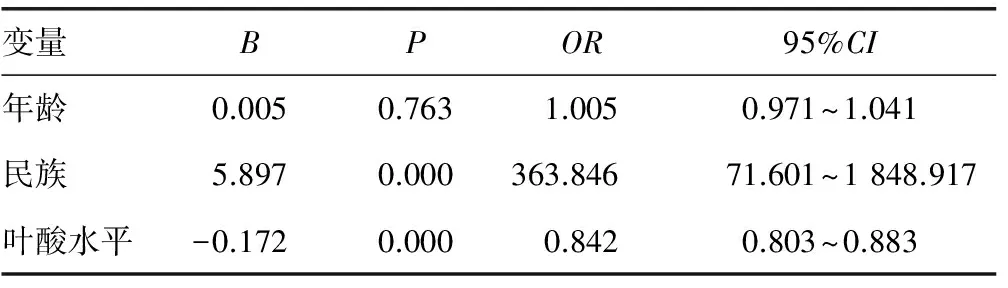
表5 NSCLC患者预后危险因素多因素分析
2.4两组NSCLC患者PFS比较 随访时间1~7个月,61例患者中失访3例(4.92%),其中维族患者2例,汉族患者1例。截止2016年10月1日,58例患者中有19例(32.76%)患者病情未出现进展,其中维族患者6例(27.27%),汉族患者13例(36.11%)。汉族患者PFS为4.40个月,维族患者PFS为2.10个月。两组NSCLC患者生存曲线,见图1。
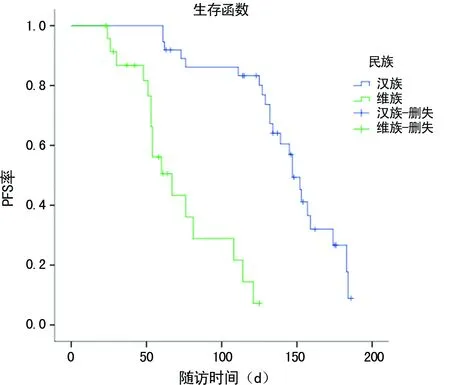
图1 两组NSCLC患者生存曲线
3 讨 论
培美曲塞联合铂类化疗已经成为NSCLC的一线化疗方案,于该方案化疗前使用叶酸及维生素B12预处理已成为共识,因为使用预处理可明显减少化疗的毒副反应,尤其是消化道反应,可增加患者的依从性。目前,培美曲塞在临床肿瘤治疗中建议的叶酸摄入量是400 μg/d,尚没有数据表明这种摄取叶酸的方式达到了保持药效利减少细胞毒性作用之间的平衡。国外有相关文献显示,补充叶酸及维生素B12可增加培美曲塞的化疗疗效,尤其是抑制肺癌细胞株(A549、H460及H1299)的生长[4]。但该研究为基础研究,尚未有临床研究去研究体内原有叶酸及维生素B12水平可对培美曲塞联合铂类化疗疗效产生影响。本研究对化疗前使用叶酸的预处理可能会影响患者体内原有叶酸水平进行了深入细致的评估,有研究结果提示,每摄入100 mg叶酸将增加2.5 ng/mL血清叶酸水平[5],即增加5.7 nmol/L,故预处理服用400 μg/d约增加0.22 nmol/L血清叶酸水平,较正常血清叶酸水平有很大差距。且因为无论何种民族NSCLC患者均服用同等剂量的叶酸,因此本研究认为预处理服用叶酸情况对原有血清叶酸水平影响较小。
本研究选取维族与汉族的NSCLC患者,针对性别、吸烟史、年龄及叶酸、维生素B12水平等因素进行探究,最终结果显示,两组患者在血清叶酸水平上有明显差异,且汉族NSCLC患者血液中叶酸水平比较高。之所以出现这种情况,很可能与两个民族不同的生活习俗、宗教信仰等直接有关。新疆地区海拔较高,冬天与夏天的温差非常大,当地居民多数情况生活在室内,很少从事户外运动,钟爱于面食,羊肉为其必备食物,食盐摄入量高[6],而蔬菜,水果摄入的比例少,因而缺乏叶酸。
不同的患者服用相同药物以后,临床表现并不相同,尤其是肿瘤患者,化疗以后临床表现差距更大。最近几年,分子生物学、蛋白质基因组学等学科飞速发展,科学家开始从基因的层面审视癌症,结果发现,正是由于基因的差异性,才导致治疗以后患者出现不同的临床表现。亚甲基四氢叶酸还原酶(5,10-methylenetetrahydrofolate reductase,MTHFR)是叶酸代谢转化过程中最为关键的酶,其位于1号染色体的短臂处,cDNA 的总长度为2.2 kb,整个基因上包含11个外显子,没有内含子[7],并且该基因突变的概率非常大[8],表现出很强的地域、种族差异[9],其基因突变多数情况下出现在第4个外显子上,并且为第677个核苷酸,由胸腺嘧啶取代原有的胞嘧啶,基因型有3种(TC、CC、TT型),正是由于基因的突变出现了HinfI限制性酶识别序列,原本222 位密码子编码的丙氨酸被缬氨酸替代[10]。MTHFR 出现基因突变,直接导致叶酸代谢过程中,其酶活直线下降,并且该基因也随之减少[11],最终使得DNA甲基化、基因组波动与原癌基因被抑制,无形之中增加癌症的发病率[12]。有文献指出,新疆汉族人群MTHFR C677T基因型频率分别为C/C 21.7%,C/T 53.0%和T/T 25.3%;维吾尔族为C/C 16.4%,C/T 80.6%和T/T 2.96%,二者差异有统计学意义(P<0.05)[13]。故本研究推测因为MTHFR C667T基因型的不同,引起维吾尔族的MTHFR酶的活性较汉族的低,影响了半胱氨酸循环,因此引起维族体内叶酸水平的降低。
叶酸属于水溶性B 族维生素,其基础成分为对氨基苯甲酸、谷氨酸残基及喋啶,属于生物体内常见的碳载体,其主要生理功能为参与机体许多细胞代谢过程[14]。人体内部,血清中叶酸真正发挥生物活性的物质为5,10-亚甲基四氨叶酸(5,10-methylenetetrahydrofolate,5,10-MTHF)和5-甲基四氨叶酸(5-methylenetetrahydrofolate,5-MTHF)。5,10-MTHF最主要的作用之一是参与胸苷腺嘧啶合成酶介导的把单磷酸脱氧尿嘧啶(dUMP)转化为单磷酸脱氧胸腺嘧啶(dTMP),其主要利用碳单元进行反应,保证遗传物质始终处于动态平衡性。所以,机体内叶酸水平降低时,将扰乱DNA的正常合成与作用,引发染色体破裂,进而演变为癌症[15-16]。机体内叶酸还有其他的活动模式——5-MTHF,加快甲基集团的传递速度,将其转化为蛋氨酸,迫使机体内DNA不断的甲基化。如果启动子被甲基化,将使得基因不能顺利表达,不管是原癌基因还是抑癌基因都将失去活动;如果甲基化水平过低将导致原癌基因被激活,上述两种基因也表现异常,导致染色体不稳定,从而可能与肿瘤的发生、发展有关联[17-18]。
众所周知,癌细胞的特点就是扩散快、增殖快,物质合成与甲基化水平偏高,而血清中叶酸水平降低,短时间内同型半胱氨酸(Hcy)无法合成蛋氨酸,机体内Hcy水平上升[19],同时其他以叶酸为辅因子的转甲基反应也会受到影响[20]。相关的研究指出[21],人体内Hcy水平上升时,很可能诱使细胞增殖性发生变化,如鳞状上皮化、角质化与不典型增生,可通过促进过氧化氢的形成、抑制内皮细胞呼吸、导致内皮细胞损伤,并刺激平滑肌细胞增殖。血浆Hcy水平升高还影响肿瘤患者体内凝血、抗凝血和纤溶系统的功能状态,有可能对肿瘤的生长和浸润产生促进作用[22-25]。
本研究结果表明,机体血清中叶酸的水平可影响汉族与维族NSCLC患者采用培美曲塞联合铂类化疗效果,汉族患者较维族患者预后好与血清叶酸水平相关,故在临床上可通过测定患者血清叶酸水平来预测患者的预后。有研究显示,即使大剂量补充叶酸及维生素B12(2 000 nmol/L),培美曲塞对肺癌细胞株(A549、H460及H1299)的抑制效果也明显增强[4]。因此本研究通过及时摄入叶酸,使血清叶酸水平维持在不减少培美曲塞化疗作用的高值,提高使用培美曲塞的化疗效果,帮助癌症患者尽快走出病魔的控制。不过,将维族与汉族NSCLC患者进行对比分析所得到的结论,还需要更多的实验数据支撑,有待进一步扩大样本量进行研究。
[1]WEI MING S U,DING HUI W U,LAN G C.The clinical effect observation of pemetrexed combined with cis-platinum complexes in the treatment of advanced lung adenocarcinoma[J].Chin J Clin Ration Drug Use,2016,9(10):17-20.
[2]王卫军,李冬雷,李润浦.培美曲塞联合顺铂同步放化疗治疗局部晚期肺腺癌的近期疗效观察[J].临床肺科杂志,2015,20(2):236-238
[3]潘燕,孙莉,李玲玲.新疆维吾尔族、汉族脑梗死患者高同型半胱氨酸与维生素 B12、叶酸的关系[J].临床荟萃,2015,30(2):376-378.
[4] YANG T Y,CHANG G C,HSU S L,et al.Effect of folic acid and vitamin B12on pemetrexed antifolate chemotherapy in nutrient lung cancer cells[J].Biomed Res International,2013,2013(1):389046.
[5]WALD N J,LAW M R,MORRIS J K,et al.Quantifying the effect of folic acid[J].Lancet,2001,358(9298):2069-2073.
[6]翟凤英,何宇纳,王志宏,等.中国12个少数民族居民的食物摄入状况及其特点[J].卫生研究,201036(5):539-541.
[8]寇军燕,洪卫,洪丹,等.MTHFR C677T基因多态性与晚期非小细胞肺癌化疗不良反应的关系[J].中国癌症杂志,2014,24(3):197-202.
[9]魏凯,黄毅超.血浆同型半胱氨酸、叶酸和维生素B12水平与非小细胞肺癌的关系[J].国际检验医学杂志,2012,33(6):699-701.
[10]焦海燕,薛雅丽.亚甲基四氢叶酸还原酶基因(C677T)多态性研究进展[J].国际遗传学杂志,2002,25(4):207-210.
[11]ZHANG X D,LI Y T,YANG S Y,et al.Meta analysis on MTHFR polymorphism and lung cancer susceptibility in East Asian populations[J].Biomedical Reports,2013,1(3):440-446
[12]邹小娟,丁卓伶,张标,等.亚甲基四氢叶酸还原酶基因多态性与癌症研究进展[J].新医学,2016,47(2):76-79.
[13]王丽娜.新疆维、汉族人群MTHFR C677T多态性遗传流行病学调查[D].乌鲁木齐:新疆医科大学,2011.
[14]高海翟.血清叶酸、维生素B12及同型半胱氨酸水平与乳腺癌的相关性研究[D].长春:吉林大学,2015.
[15]BLOUNT B C,MACK M M,WEHR C M,et al.Blount BC,Mack MM,Wehr WMFolate deficiency causes uracil misincorporation into human DNA and chromosomal breakage:Implications for cancer and neuronal damage[J].Proc Nati Acad Sci,1997,94(7):3290-3295.
[16]CROTT J W,MASHIYAMA S T,AMES B N,et al.The effect of folic acid deficiency and MTHFR C677T polymorphism on chromosome damage in human lymphocytes in vitro[J].Cancer Epidemiol Biomarkers Prev,2001,10(10):1089-1096.
[17] WAJED S A,LAIRD P W,DEMEESTER T R.DNA methylation:an alternative pathway to cancer[J].Ann Surg,2001,234(1):10-20.
[18] HUR K,CEJAS P,FELIU J,et al.Hypomethylation of long interspersed nuclear element-1(LINE-1) leads to activation of proto-oncogenes in human colorectal cancer metastasis[J].Gut,2014,63(4):635-646.
[19]李喜平,余早勤,刘东,等.亚甲基四氢叶酸还原酶基因多态性与个体化叶酸补充概述[J].药物流行病学杂志,2014,23(1):53-57.
[20]凌存保,吴隽松,滕飞翔.肺癌患者血清同型半胱氨酸变化的临床意义[J].中国老年保健医学,2014,12(4):16-17.
[21]乔云飞,李允模.同型半胱氨酸在呼吸系统疾病中的研究进展[J].医学综述,2016,22(6):1077-1080.
[22]于秀艳,王文龙,吴雪峰,等.非小细胞肺癌患者血清叶酸、同型半胱氨酸和维生素B12的检测及其临床意义[J].吉林大学学报(医学版),2015,41(6):1235-1238.
[23]王凌云,刘小芳,杜涛,等.恶性肿瘤血清叶酸、维生素B12水平测定的临床意义[J].重庆医学,2013,42(16):1870-1871.
[24]欧阳淑娟,吴白平.同型半胱氨酸水平与恶性肿瘤患者高凝状态关系的研究[J].中国医师杂志,2003,5(5):667-668.
[25]朱凡,张勤英,王毓明.恶性肿瘤患者血浆同型半胱氨酸和血清叶酸水平检测[J].苏州大学学报(医学版),2008,28(6):1041-1042.
