pSS患者血清TNF-α、TGF-β1水平与唇腺淋巴细胞浸润程度及ILD的相关性研究
2018-03-06梁胜翔洪梦琴
杨 敏,梁胜翔,洪梦琴,许 佳,林 静
(1.桂林医学院附属医院风湿免疫科,广西桂林 541001;2.第三军医大学预防医学院,重庆 400038;3.桂林医学院附属医院病理科,广西桂林 541001)
原发性干燥综合征(primary Sjogren′s syndrome,pSS)是一种主要累及全身外分泌腺的慢性自身免疫性疾病,病理上以淋巴细胞浸润为主要特征。随着病情进展可出现肺、肾、肝等多系统器官损害,以肺间质病变(interstitial lung disease,ILD)最为常见,发生率为9%~75%[1]。ILD发生早期往往无临床症状,难以察觉。目前,临床上主要通过肺高分辨率CT(HRCT)检查早期确诊ILD,费用较高,并可增加患者放射线暴露风险。因此,寻找一些简便易行的方法早期初筛ILD具有重要意义。既往研究发现,血清转化生长因子β1(TGF-β1)、肿瘤坏死因子α(TNF-α)水平与pSS发病密切相关[2-3]。但TNF-α、TGF-β1水平与pSS不同发展阶段的关系鲜有报道。本研究通过观察pSS患者血清TNF-α、TGF-β1水平的变化,并分析其与唇腺病理分级、ILD临床分期的关系,进而探讨外周血TNF-α、TGF-β1表达与pSS内脏损害的相关性,旨在为早期筛查ILD提供敏感、可靠的预测指标,为此类患者的早期干预治疗提供理论依据。
1 资料与方法
1.1一般资料 选择2013年6月至2016年6月在桂林医学院附属医院风湿免疫科住院初诊为pSS的患者116例,其中,男12例,女104例;年龄21~58岁,平均(44.8±11.4)岁。纳入标准:(1)均为首诊首治患者,未接受激素及免疫抑制剂治疗;(2)pSS诊断均符合2002年修订的pSS国际分类(诊断)标准[4];(3)均同意参加本课题及随访,并签署知情同意书;(4)pSS合并ILD(pSS-ILD)的诊断符合2000年美国胸科协会(ATS)和欧洲呼吸协会(ERS)提出的特发性肺纤维化(IPF)诊断标准[5];(5)医院伦理委员会批准。同时选择来自同期该院体检中心体检的健康志愿者20例(对照组),其中,男3例,女17例;年龄23~54岁,平均(36.3±13.7)岁,肝功能、肾功能检查均正常。排除标准如下,(1)继发性干燥综合征(sSS):具备干燥综合征临床症状和体征,同时也符合类风湿关节炎、系统性红斑狼疮、多发性肌炎、系统性硬化或者胆汁性肝硬化的诊断标准;(2)肺结核或结核感染,慢性支气管炎、慢性阻塞性肺病、支气管哮喘、支气管扩张症等呼吸系统疾病,类肉瘤病,发病早于干燥综合征的淋巴瘤,艾滋病,乙型或丙型肝炎,原发性纤维肌痛,以及其他已知可引起自主神经元病变、干燥性角膜炎或唾液腺肿大的疾病;(3)长期服用激素、金制剂、青霉胺、甲氨蝶呤等抗风湿药物的患者;(4)未通过医院伦理委员会批准的病例;(5)失访和随访资料不完整患者。将入选的116例pSS患者按以下分级及分期进行分组,(1)唇腺病理分级:Ⅰ级38例,Ⅱ级18例,Ⅲ级15例,Ⅳ级9例,Ⅰ、Ⅱ、Ⅲ、Ⅳ级为pSS浸润组(n=80);无淋巴细胞浸润36例(pSS无浸润组)。(2)ILD病变分期:0期68例(单纯pSS组);Ⅰ期23例,Ⅱ期15例,Ⅲ期10例,Ⅰ、Ⅱ、Ⅲ期为pSS-ILD组(n=48)。以上各组患者间年龄、性别比较,差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1唇腺病理分级 所有病例在唇腺活检过程中多点摘取唇腺3~4块,10%甲醛固定后送该院病理科,常规石蜡包埋、切片,经苏木素-伊红(HE)染色后在光学显微镜下观察,由经验丰富的病理科医师进行读片。唇腺标本中每50个或以上淋巴细胞聚集形成一个浸润灶,平均每4 mm2唇腺组织中浸润灶数目为浸润灶指数(focus score,FS)[4]。每例标本均由不同病理科医师检测3次,取平均值。按照CHSHOLM等[6]标准进行病理分级,Ⅰ级:浸润灶1个/4 mm2;Ⅱ级:浸润灶2个/4 mm2;Ⅲ级:浸润灶3个/4 mm2,Ⅳ级:浸润灶4个/4 mm2。
1.2.2肺间质纤维化病变分期 根据胸部HRCT,按肺间质纤维化病变严重程度分为4期,0期:无明显ILD;Ⅰ期:病变早期或活动期,表现有磨玻璃影、小叶内间质增多和小叶间隔增厚;Ⅱ期:病变的进展期,有Ⅰ期的表现及界面征、胸膜下弧线影、肺内片状实变和小结节影;Ⅲ期:病变晚期,有Ⅰ、Ⅱ期及网织影、纤维条索影、蜂窝状影、牵拉性支气管扩张和弥漫纤维化[7]。
1.2.3血清TNF-α、TGF-β1测定 于晨起空腹抽取研究对象外周静脉血约3 mL,3 000 r/min离心10 min,分离血清,置于-80 ℃冰箱备用。采用双抗夹心酶联免疫吸附测定(ELISA)检测外周血清中的TNF-α、TGF-β1水平,检测方法参照该科前期研究的方法进行[3]。

2 结 果
2.1对照组与不同ILD分期pSS患者血清TNF-α、TGF-β1表达水平比较 与对照组比较,单纯pSS组、pSS-ILD组血清TNF-α、TGF-β1水平明显升高(P<0.01),且pSS-ILD组高于单纯pSS组(P<0.01),见表1。
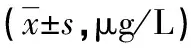
表1 对照组与不同ILD分期pSS患者血清TNF-α及TGF-β1表达水平比较
a:P<0.01,与对照组比较;b:P<0.01,与单纯pSS组比较
2.2对照组与不同唇腺病理分级pSS患者血清TNF-α、TGF-β1表达水平比较 与对照组比较,pSS无浸润组、pSS浸润组血清TNF-α、TGF-β1水平明显升高(P<0.01),且pSS浸润组高于pSS无浸润组(P<0.01),见表2。
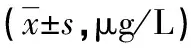
表2 各组对象血清TNF-α、TGF-β1表达水平比较
a:P<0.01,与对照组比较;b:P<0.01,与无浸润组比较
2.3不同唇腺病理分级pSS患者血清TNF-α、TGF-β1表达水平比较 不同唇腺病理分级的各组pSS患者血清TNF-α、TGF-β1水平比较差异有统计学意义(P<0.01)。与唇腺病理Ⅰ级比较,Ⅱ、Ⅲ、Ⅳ级pSS患者的血清TNF-α、TGF-β1水平均明显升高(P<0.01);Ⅲ级pSS患者的血清TNF-α、TGF-β1水平高于Ⅱ级(P<0.01),Ⅳ级pSS患者的血清TNF-α、TGF-β1水平高于Ⅲ级(P<0.01),见表3。
2.4不同ILD分期pSS患者血清TNF-α、TGF-β1表达水平比较 不同ILD分期的各组pSS患者血清TNF-α、TGF-β1水平比较差异有统计学意义(P<0.01)。与ILD 0期比较,Ⅰ、Ⅱ、Ⅲ期pSS患者的血清TNF-α、TGF-β1水平均明显升高(P<0.01);Ⅱ期pSS患者的血清TNF-α、TGF-β1水平高于Ⅰ期(P<0.01),Ⅲ期pSS患者的血清TNF-α、TGF-β1水平高于Ⅱ期(P<0.01),见表4。
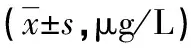
表3 不同唇腺病理分级pSS患者血清TNF-α、TGF-β1表达水平比较
a:P<0.01,与Ⅰ级比较;b:P<0.01,与Ⅱ级比较;c:P<0.01,与Ⅲ级比较
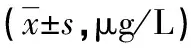
表4 不同ILD分期pSS患者血清TNF-α、TGF-β1表达的比较
a:P<0.01,与0期比较;b:P<0.01,与Ⅰ期比较;c:P<0.01,与Ⅱ期比较
2.5pSS患者血清TNF-α、TGF-β1表达水平与唇腺病理分级及ILD分期的相关性分析 Spearman等级相关分析发现,TNF-α、TGF-β1表达均与唇腺病理分级及ILD分期的严重程度呈正相关(P<0.01),唇腺淋巴细胞浸润程度越高,TNF-α、TGF-β1的表达水平赿高;ILD分期越高,TNF-α、TGF-β1的表达水平也越高,见表5。
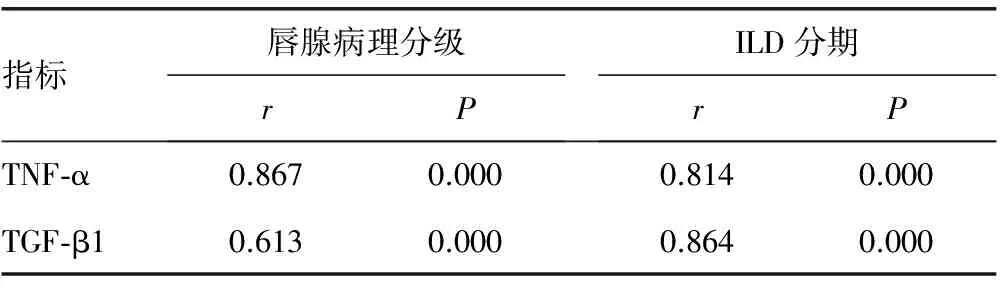
表5 TNF-α、TGF-β1与唇腺病理分级及ILD分期的相关分析
2.6pSS患者血清TNF-α与TGF-β1表达水平的相关性分析 Pearson相关分析显示,pSS患者血清TNF-α与TGF-β1的相对表达量呈正相关(r=0.857,P=0.000)。
3 讨 论
pSS患者合并多系统器官损害是临床治疗中的难点,其致病机制至今未明。深入了解pSS患者血清TNF-α、TGF-β1水平与唇腺病理分级及ILD临床分期的关系对pSS的诊断及治疗具有重要意义。本研究发现,pSS合并ILD患者及pSS合并唇腺淋巴细胞浸润患者血清TNF-α、TGF-β1水平均明显升高。提示TNF-α、TGF-β1在pSS疾病的发展过程中扮演重要角色,其与患者唇腺淋巴细胞浸润及疾病严重程度存在相关性。
近年来,能否应用新技术或方法来替代有创性的唇腺活检,一直是pSS诊断及病情判断方面亟待解决的问题。既往研究发现,TNF-α在pSS涎腺损害过程中发挥着关键作用,可促进腺泡细胞基质金属蛋白酶2(MMP-2)的分泌,从而引起基底膜降解和腺泡结构破裂[8]。WILLEKE等[9]的研究发现pSS患者外周血TNF-α明显升高,而且与口眼干燥、反复腮腺肿大等外分泌腺表现、腺体外系统受累症状、疾病持续时间及自身抗体滴度等均明显相关。上述研究表明,TNF-α在pSS患者腺体及腺外表现的发生、发展中起重要作用,并与病情严重程度密切相关。TGF-β1在pSS患者唇腺淋巴细胞浸润中所起的作用尚不明确。MASON等[10]用吸光度测量并用图像分析发现pSS患者唇腺导管全部TGF-β亚型的表达比正常对照组明显升高,提示TGF-β在淋巴细胞细胞增殖及淋巴浸润中起到重要作用。在小鼠动物模型中,TGF-β1的过表达会引发慢性炎症,从而导致唇腺间质纤维化,最终引起其分泌功能减退[11]。本研究发现,TNF-α、TGF-β1表达与唇腺病理分级呈正相关。结合上述研究分析,TNF-α、TGF-β1的过度表达可能加重淋巴细胞在pSS患者唇腺中的浸润,TNF-α、TGF-β1产生越多,腺体的破坏程度越严重。据此本研究推测,PSS患者唇腺病理分级越高,内脏受累更明显。因此,在临床治疗中,加强对TNF-α、TGF-β1水平的监测,可以了解患者唇腺淋巴细胞浸润程度,对指导临床治疗有重要意义。
有研究发现,在肺间质纤维化患者及纤维化动物的整个病程中均出现了血清TNF-α持续性高表达[12-13],TNF-α高表达的大鼠会发生特发性肺间质纤维化,而在博来霉素诱发试验中,TNF-α受体敲除的大鼠发生肺纤维化的程度则较轻[14]。TGF-β1是目前已知最强的致纤维化因子,其过表达可促进纤维细胞激活向肌成纤维细胞转化及肺成纤维细胞增殖,直接致肺纤维化[15]。本研究发现,pSS患者血清TNF-α、TGF-β1表达与ILD分期呈正相关。提示TNF-α、TGF-β1可能参与了pSS患者ILD的发生与发展,其表达水平在一定程度上可反映pSS-ILD患者肺部病变的严重程度。本课题组前期研究发现,环磷酰胺治疗后,pSS患者外周血及支气管肺泡灌洗液中TNF-α、TGF-β1浓度明显下降,ILD明显改善[3]。这也证明了TNF-α、TGF-β1在pSS合并ILD中扮演至关重要角色。因此,临床上应对TNF-α、TGF-β1高表达的pSS患者进行肺HRCT检查,可早期发现肺部病变并进行治疗干预。
本研究还发现TNF-α与TGF-β1的相对表达量呈正相关。SULLIVAN等[16]发现TNF-α能够激活ERK转导途径,同时,TNF-α还能诱导嗜酸性粒细胞和血小板在肺内聚集,从而上调TGF-β1的表达,另一方面,TGF-β1亦可通过对中性粒细胞、单核巨噬细胞、淋巴细胞等的趋化作用,促进肺纤维化相关细胞因子TNF-α、白细胞介素(IL)-1、IL-6、等的表达,诱导产生更多TGF-β1[17]。这可能是TNF-α、TGF-β1通过与其他细胞因子的交互作用产生叠加效应,共同参与pSS的发生与发展的机制之一。
综上所述,本研究发现血清TNF-α、TGF-β1在pSS患者血清中高表达,二者参与了pSS的发病过程。相关性分析发现,血清TNF-α、TGF-β1表达与唇腺病理分级及ILD分期呈正相关,提示pSS患者血清TNF-α、TGF-β1表达增加可能是唇腺结构破坏及合并ILD的原因,在临床治疗中对二者进行监测具有重要意义。但本研究样本数较少、病例观察时间短,具体机制尚有待多中心、大样本的临床研究进行明确。
[1]NANNINI C,JEBAKUMAR A J,CROWSON C S,et al.Primary Sjogren′s syndrome 1976-2005 and associated interstitial lung disease:a population-based study of incidence and mortality[J].BMJ Open,2013,3(11):e003569.
[2]LEE,S Y,HAN S J,NAM S M,et al.Analysis of tear cytokines and clinical correlations in Sjogren syndrome dry eye patients and non-Sjogren syndrome dry eye patients[J].Am J Ophthalmol,2013,156(2):247-253.
[3]ZHANG L,MO H,ZHU M,et al.Effect of cyclophosphamide on cytokines in patients with primary Sjögren′s syndrome-associated interstitial lung disease in South China[J].Rheumatol Int,2013,33(6):1403-1407.
[4]VITALI C,BOMBARDIERI S,JONSSON R,et al.Classification criteria for Sjogren′s syndrome:a revised version of the European criteria proposed by the American-European Consensus Group[J].Ann Rheum Dis,2002,61(6):554-558.
[5]KING T E,COSTABEL U,CORDIER J F,et al.Idiopathic pulmonary fibrosis:diagnosis and treatment.International consensus statement[J].Am J Respir Crit Care Med,1999,161(2 Pt 1):646-664.
[6]CHISHOLM D M,MASON D K.Labial salivary gland biopsy in sjögren′s disease[J].J Clin Pathol,1968,21(5):656-660.
[7]邱建国,潘解萍,喻少波,等.结缔组织病肺间质病变高分辨率CT分期的临床价值[J].实用放射学杂志,2008,24(9):1188-1190,1193.
[8]YOSHIMURA S,NAKAMURA H,HORAI Y,et al.Abnormal distribution of AQP5 in labial salivary glands is associated with poor saliva secretion in patients with Sjogren′s syndrome including neuromyelitis optica complicated patients[J].Mod Rheumatol,2016,26(3):384-390.
[9]WILLEKE P,SCHOTTE H,SCHLÜTER B,et al.Interleukin 1beta and tumour necrosis factor alpha secreting cells are increased in the peripheral blood of patients with primary Sjögren′s syndrome[J].Ann Rheum Dis,2003,62(4):359-362.
[10]MASON G I,HAMBURGER J,BOWMAN S,et al.Salivary gland expression of transforming growth factor beta isoforms in Sjogren′s syndrome and benign lymphoepithelial lesions[J].Mol Pathol,2003,56(1):52-59.
[11]WOODS L T,CAMDEN J M,EL-SAYED F G,et al.Increased expression of TGF-β signaling components in a mouse model of fibrosis induced by submandibular gland duct ligation[J].PLoS One,2015,10(5):e0123641.
[12]GONO T,KANEKO H,KAWAGUCHI Y,et al.Cytokine profiles in polymyositis and dermatomyositis complicated by rapidly progressive or chronic interstitial lung disease[J].Rheumatology(Oxford),2014,53(12):2196-2203.
[13]胡玉洁,李 理,李伟峰,等.依那西普抑制博来霉素诱导的小鼠肺纤维化[J].中国病理生理杂志,2013,29(6):1034-1038.
[14]LI X Y,XU X F,HANG J,et al.Effects of the water channel aquaporin 4 deficiency on bleomycin-induced lung fibrosis in mice[J].Zhejiang Da Xue Xue Bao Yi Xue Ban,2014,43(3):281-286.
[15]GHATAK S,BOGATKEVICH G S,ATNELISHVILI I,et al.Overexpression of c-Met and CD44v6 receptors contributes to autocrine TGF-beta1 signaling in interstitial lung disease[J].J Biol Chem,2014,289(11):7856-7872.
[16]SULLIVAN D E,FERRIS M,NGUYEN H,et al.TNF-alpha induces TGF-beta1 expression in lung fibroblasts at the transcriptional level via AP-1 activation[J].J Cell Mol Med,2009,13(8B):1866-1876.
[17]TAKEDA Y,TSUJINO K,KIJIMA T,et al.Efficacy and safety of pirfenidone for idiopathic pulmonary fibrosis[J].Patient Prefer Adherence,2014(8):361-370.
