含铂类联合方案治疗复发或难治性NHL的临床分析
2018-03-06王洪学陈梅林覃芳卉周文献贾昱娴谢裕安陆永奎谢伟敏
王洪学,陈梅林,覃芳卉,周文献,贾昱娴,陈 军,岑 洪,谢裕安,陆永奎,谢伟敏△
(1.广西医科大学附属肿瘤医院化疗五科,南宁 530021;2.钦州市第一人民医院肿瘤内科,广西钦州 535000;3.广西医科大学附属肿瘤医院病理科,南宁 530021;4.广西医科大学附属肿瘤医院化疗三科,南宁 530021;5.广西医科大学附属肿瘤医院实验研究部,南宁 530021)
CHOP方案(环磷酰胺、阿霉素、长春新碱和泼尼松)或CHOP样方案如EPOCH方案(多柔比星、长春新碱、依托泊苷和泼尼松)是治疗多种类型非霍奇金淋巴瘤(NHL)的标准方案,但CHOP方案或CHOP样方案治疗失败后的复发或难治性NHL患者预后较差。对此类患者,通过解救治疗获得完全缓解(CR)或部分缓解(PR)后实施自体干细胞移植(ASCT)是提高患者预后的有效方法[1-2]。但在目前国内外相关淋巴瘤实践指南中,在复发或难治性NHL的解救治疗方面,推荐意见并不一致[3]。欧洲肿瘤内科学会(ESMO)的相应指南中并无明确的推荐方案[4-6],而在美国国立综合癌症网络(NCCN)的指南中[1],则明确推荐了多种含铂类的联合方案如GDP方案、GemOx方案等。本研究中,作者回顾性分析接受含铂类方案化疗的复发或难治性NHL患者的临床资料,分析相关方案的疗效和安全性。
1 资料与方法
1.1一般资料 收集2008年1月至2014年12月在广西医科大学附属肿瘤医院肿瘤内科就治的NHL患者。入组标准:(1)接受CHOP方案或CHOP样(EPOCH、COP等)加减利妥昔单抗(R)方案化疗失败,符合复发或难治性NHL诊断标准[7],且未使用过含铂类药物解救治疗;(2)入组后使用含有铂类药物(顺铂或奥沙利铂)的方案进行治疗;(3)年龄18~75岁,美国东部癌症临床试验工作组(ECOG)评分0~2分,预计生存期大于或等于3个月;(4)有可测量病灶;(5)化疗前的血常规及肝、肾功能和心电图检查等指标均基本正常,无化疗禁忌证;(6)自愿接受治疗并签署知情同意书。结果有68例符合入组标准,男46例,女22例;年龄18~73岁,中位年龄51岁,≤60岁55例,>60岁13例。有B症状患者25例,14例患者在使用铂类方案前接受过局部放疗。B细胞性47例(弥漫大B细胞39例、富T细胞的弥漫大B细胞6例、滤泡型2例),T细胞性21例(外周T细胞12例、NK/T细胞8例、间变大细胞1例)。Ann Arbor分期:Ⅱ期5例,Ⅲ期31例,Ⅳ期32例。有节外侵犯(含骨髓侵犯12例)39例;血浆乳酸脱氢酶(LDH)水平升高36例。国际预后评分标准(IPI)评分0~1分(低危)14例,>1~2分(中低危)23例, >2~3分(中高危)21例,>3~5分(高危)10例。既往使用CHOP方案一线治疗的患者有60例,CHOP样方案8例。既往化疗方案数平均为2.6个/例(范围1~5个),其中接受过1个方案治疗的有23例,2个13例,3个26例,≥4个6例;既往化疗周期数平均为4.8个/例(范围1~8个)。B细胞淋巴瘤患者中既往使用(R)有18例。所有入组病例的病理组织学切片均经过病理科专家复核确诊,组织学分类、Ann Arbor分期及IPI均参照文献[1-2]标准。
1.2方法
1.2.1治疗方法 根据患者既往化疗方案的疗效和不良反应等情况选择以下相应含铂类方案:GDP、GemOx、DICE、DHAP和EP方案,其中有16例B细胞性NHL还联合利妥昔单抗。各方案的用法如下,(1)GDP方案:顺铂(DDP)25 mg/m2,避光静脉滴注, 第1~3天;吉西他滨(GEM)1 000 mg/m2,静脉滴注(≥30 min),第1、8天;地塞米松(DXM)40 mg/d,静脉滴注,第1~4天。(2)GemOx方案:GEM 1 000 mg/m2,静脉滴注,第1天;奥沙利铂(L-OHP)100 mg/m2,静脉滴注,第1天;DXM用法同GDP方案。(3)DICE方案:异环磷酰胺(IFO)1 000 mg/m2,静脉滴注,第1~4天;DDP和DXM用法同GDP方案;VP-16 60 mg/m2,静脉滴注,第1~4天。(4)DHAP方案:DDP和DXM用法同GDP方案;阿糖胞苷(Ara-C)2 g/m2,每天2次,静脉滴注,第2天。(5)EP方案:DDP用法同GDP方案;依托泊苷(VP-16)100 mg/m2,静脉滴注,第1~3天。(6)利妥昔单抗(R):375 mg/m2,化疗前1 d静脉注射。以上方案均以21 d为1个周期,每个周期评估不良反应;每2个周期进行临床体检并采用相同的影像学方法(CT、MRI或B超)检查以评价疗效。除非疾病进展或患者出现不可耐受的不良反应,否则化疗4~6个周期。化疗前后按常规方法防治相关不良反应,如使用5-羟色胺3受体(5-HT3R)拮抗剂(托烷司琼或帕洛诺司琼等)预防恶心呕吐;护肝治疗,适当水化保护肾功能,肿瘤负荷较大者给予碱化尿液;使用粒细胞集落刺激因子(G-CSF)防治中性粒细胞减少症等。化疗过程中根据患者的不良反应程度及恢复情况可适当下调下个周期化疗的剂量,但如果调整后的剂量低于标准剂量的50%则停止化疗。
1.2.2疗效和不良反应评价标准 疗效评价标准参照淋巴瘤专用Cheson评价标准(Lugano 2014)进行[8],分为CR、PR、稳定(SD)和进展(PD),有效率(ORR)=CR+PR/总例数×100%。首要评价指标为ORR,次要指标是无进展生存期(progress free survival,PFS)和不良反应。其中PFS是从开始含铂类方案化疗到肿瘤出现进展的时间。不良反应评价使用NCI-CTCAE 3.0标准[9],分为0 ~Ⅳ度。
1.2.3随访 在治疗结束后,根据患者定期复查的资料或电话随访,截止至2015年12月31日。
1.3统计学处理 应用SPSS16.0统计软件进行分析,计数资料以率表示,采用χ2检验,使用Kaplan Meier法计算中位PFS及其95%CI。以P<0.05为差异有统计学意义。
2 结 果
2.1临床疗效 全组患者共计化疗283个周期,中位化疗周期为4个周期/例(2~6个周期)。获得CR 11例(16.18%),PR 31例(45.59%),SD 16例(23.53%),PD 10例(14.70%),ORR为61.76%(42/68)。
2.2不同临床病理特征与含铂类联合方案疗效的关系 B细胞和T细胞淋巴瘤患者的ORR相近(P=0.600);在B细胞淋巴瘤中,化疗联合R的ORR高于单用化疗,但差异无统计学意义(P=0.074)。随着IPI评分升高,或既往化疗方案数量增多,ORR则不断降低,但组间比较均差异无统计学意义(P>0.05)。Ⅱ/Ⅲ期患者的ORR明显高于Ⅳ期患者(P=0.017);IPI≤2分患者的ORR为72.97%(27/37),>2分患者的ORR为48.39%(15/31),二者比较差异有统计学意义(χ2=4.317,P=0.038);既往只接受过1个方案化疗的患者组ORR高于既往化疗大于或等于2个方案的患者组(78.26%vs.53.33%,χ2=4.005,P=0.045)。有无节外侵犯、不同血浆LDH水平亚组间的ORR比较,均差异无统计学意义(P>0.05)。25例有B症状的患者中,18例(72.00%)患者的症状明显缓解或消失。复发或难治性NHL不同临床特征与含铂类联合方案治疗疗效的关系,见表1。
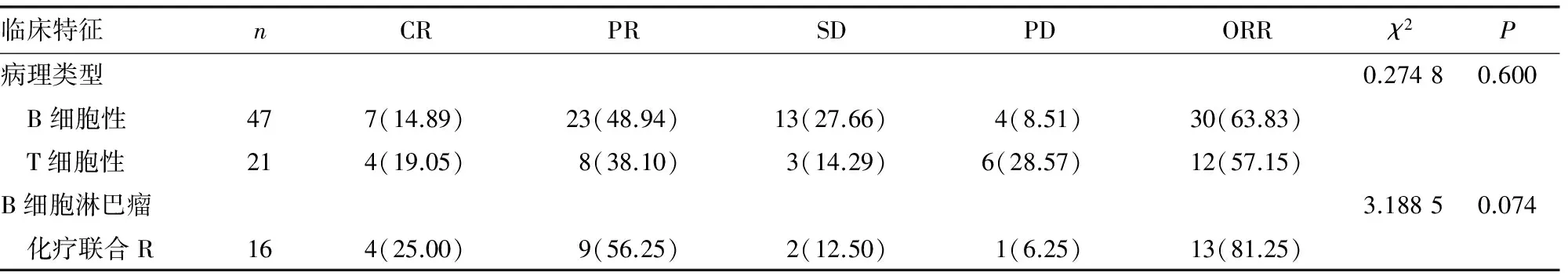
表1 复发或难治性NHL不同临床特征与含铂类联合方案治疗疗效的关系[n(%)]
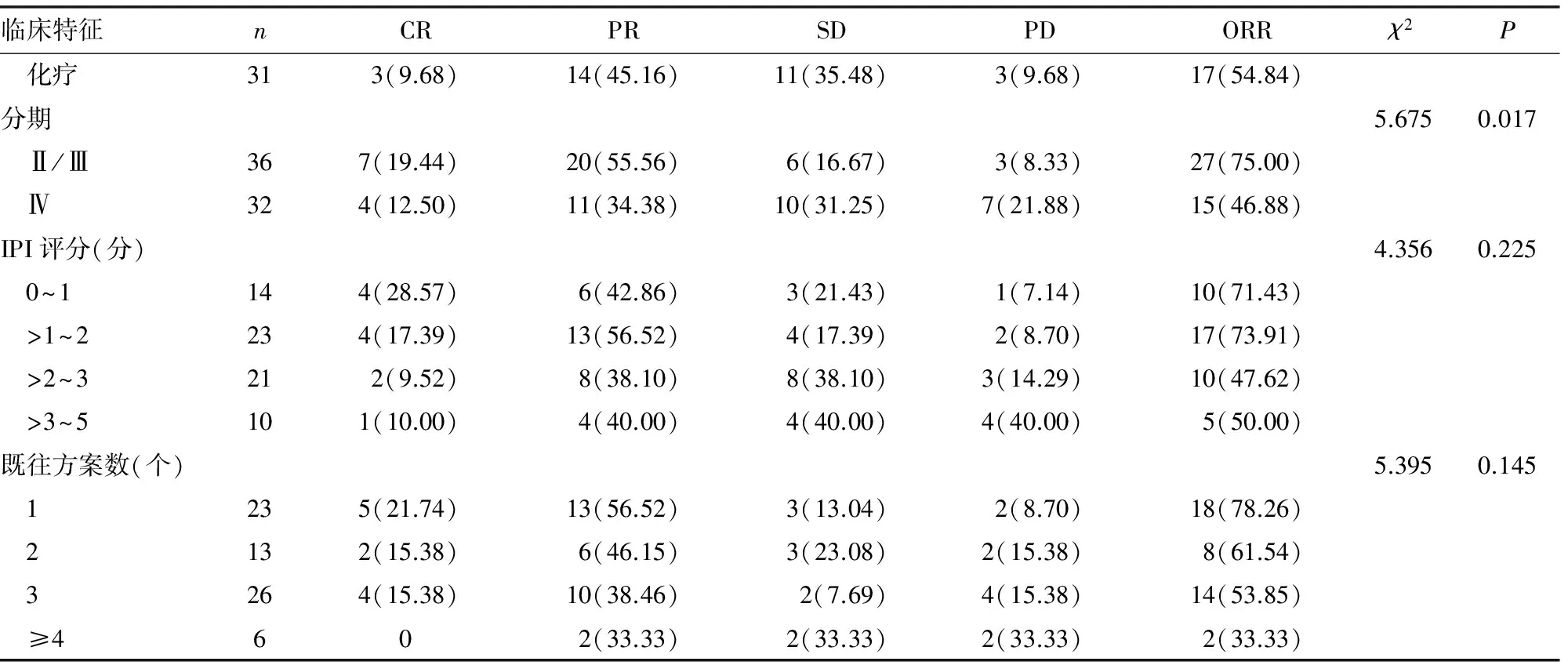
续表1 复发或难治性NHL不同临床特征与含铂类联合方案治疗疗效的关系[n(%)]
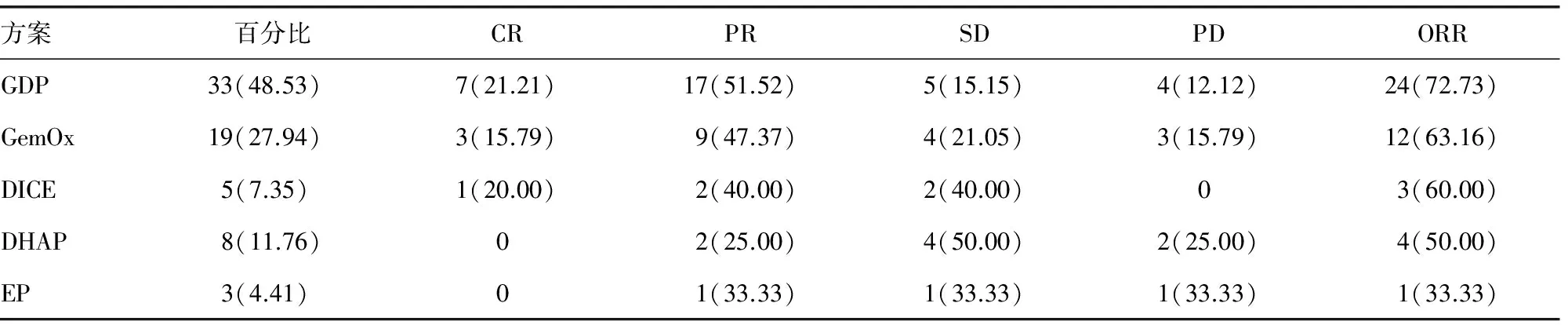
表2 不同含铂类联合方案的疗效比较[n(%),n=68]
2.3不同含铂类联合方案的疗效比较 本组中使用最多的方案是GDP,其次是GemOx方案,GDP方案与GemOx方案的ORR比较,差异无统计学意义(χ2=0.518,P=0.472),见表2。
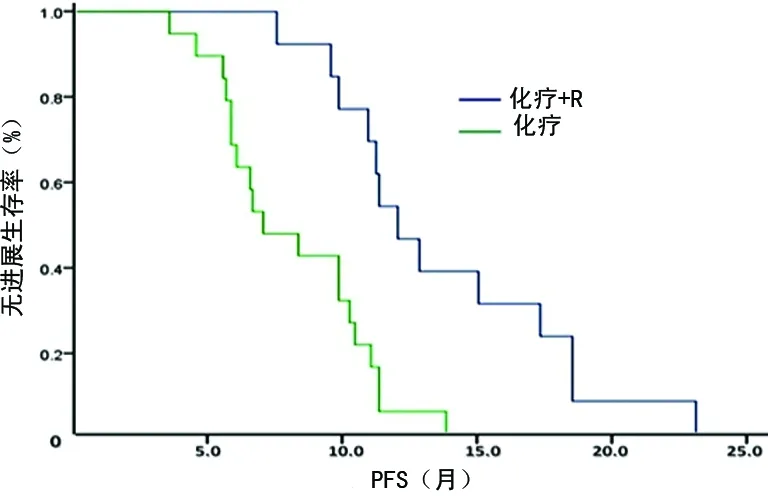
图1 化疗联合R与不联合R患者的PFS比较
2.4生存情况评价 68例患者均获得随访,中位PFS为6.51个月(95%CI:4.97~8.04)。CR、PR、SD、PD患者的中位PFS分别为10.91、7.48、4.56、2.02个月,差异有统计学意义(P=0.000)。在获得CR患者中,有2例序贯接受了ASCT,另有4例CR和12例PR患者接受了受累部位放疗(ISRT),这18例患者的中位PFS为9.72个月,而治疗有效(获得CR或PR)未序贯接受ASCT和(或)ISRT的患者的中位PFS为8.11个月,但二者比较差异无统计学意义(P=0.457)。B细胞和T细胞淋巴瘤患者的中位PFS分别为7.48和4.96个月,二者比较差异无统计学意义(P=0.441)。在B细胞淋巴瘤患者中,化疗联合R组的中位PFS为11.16个月,长于单用化疗组的5.84个月,差异有统计学意义(P=0.004),见图1。Ⅱ、Ⅲ、Ⅳ期患者的中位PFS分别为14.50、9.50、5.00个月,组间比较差异有统计学意义(P=0.000),见图2。IPI评分为0~1分、>1~2分、>2~3分、>3~5分的患者的中位PFS分别为10.18、9.15、4.63、3.52个月,组间比较差异有统计学意义(P=0.000),见图3。既往只接受过1个化疗方案的患者的中位PFS为10.88个月,2个方案的为6.46个月,≥3个方案的为5.04个月,组间差异有统计学意义(P=0.000),见图4。
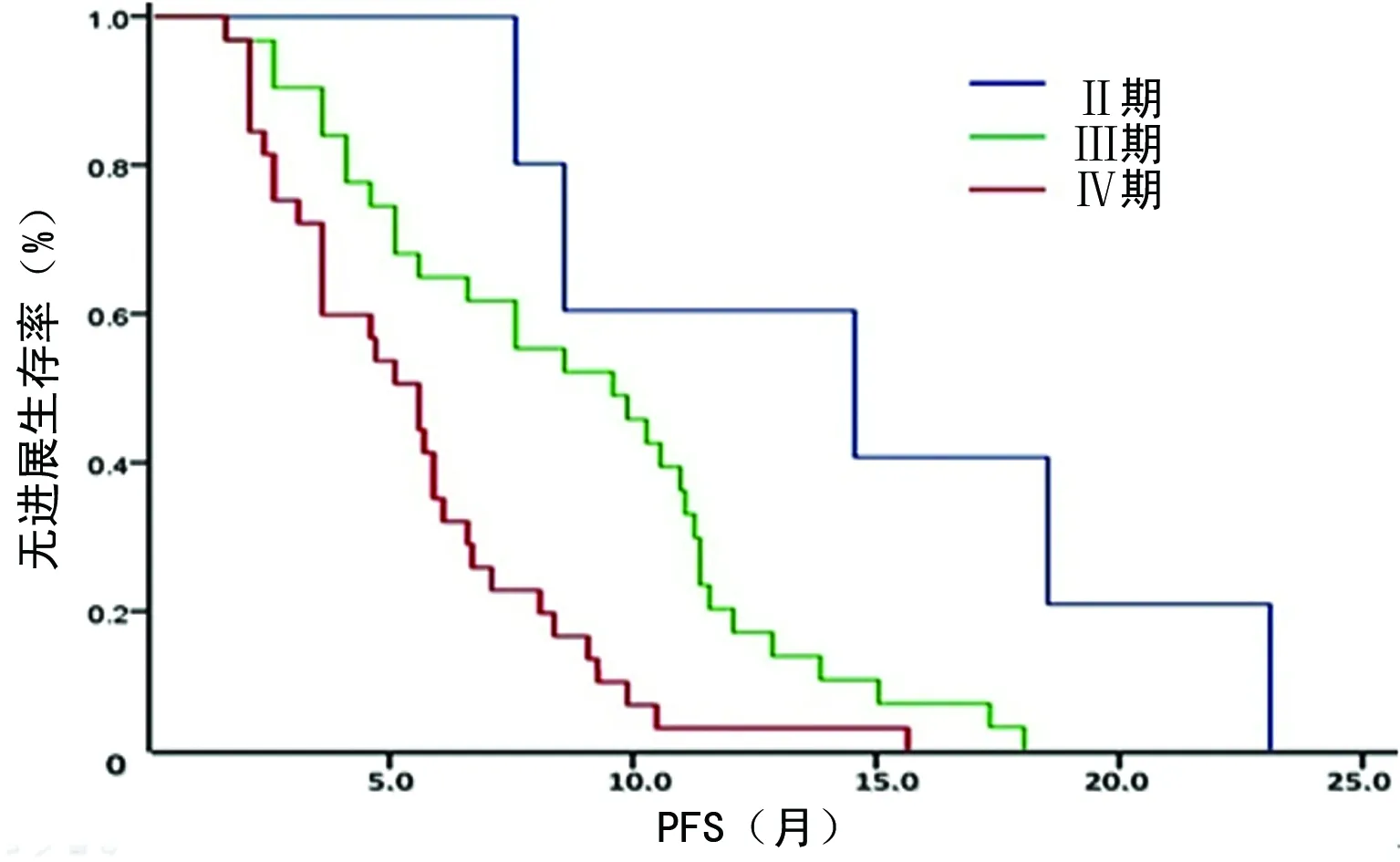
图2 不同An Arbor分期患者的PFS比较
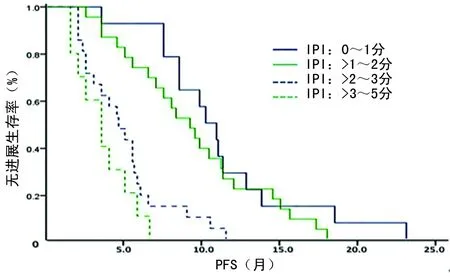
图3 不同IPI评分患者的PFS比较
2.5不良反应评价 以骨髓抑制最常见,其次为消化道反应,其他不良反应轻微(表3)。所有患者的不良反应经对症支持治疗后均恢复正常,全组无化疗相关性死亡。与GemOx方案比较,GDP方案的Ⅲ~Ⅳ度白细胞减少和血小板减少及大于或等于Ⅱ度恶心、呕吐发生率更高,但均差异无统计学意义(P>0.05);而周围神经毒性仅见于GemOx方案,见表4。
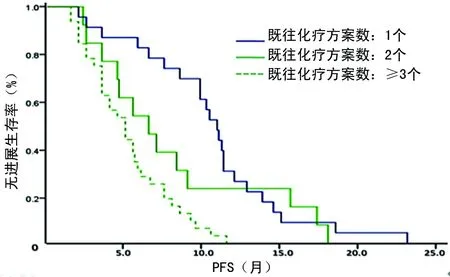
图4 既往不同化疗方案数量患者的PFS比较
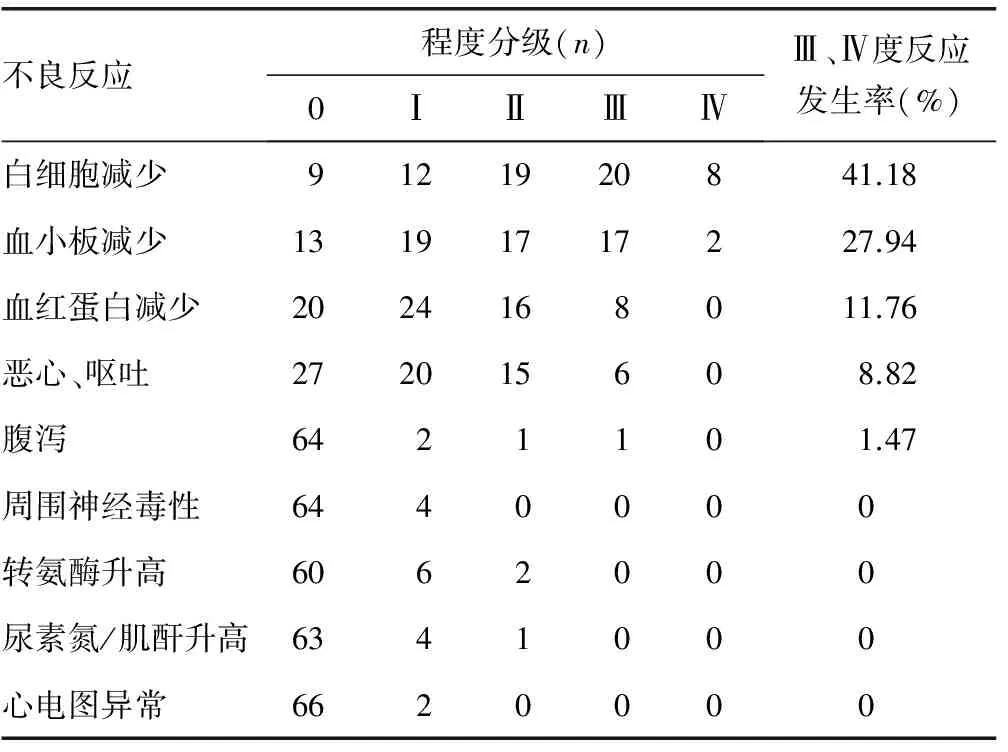
表3 含铂类联合方案治疗68例复发或难治性NHL的不良反应
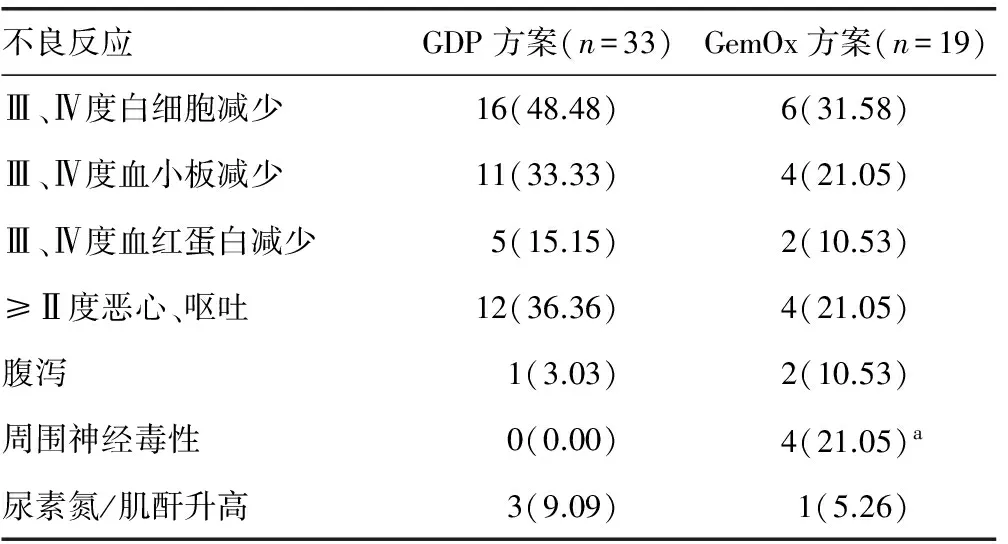
表4 GDP方案与GemOx方案的主要不良反应比较[n(%)]
a:校正χ2=4.853 4,P=0.027 6
3 讨 论
在复发或难治性NHL解救治疗中是否使用含铂类联合方案,相关临床指南的推荐意见并不一致。如在ESMO新近发布的指南中均无明确推荐方案[4-6],而在NCCN临床指南[1]和我国的《中国恶性淋巴瘤诊疗规范(2015年版)》[2]中,都推荐把GDP和GemOx等含铂类方案用于解救治疗。
NCIC-CTG LY.12研究比较了GDP方案与非含铂方案DHAP方案解救治疗619例NHL的疗效和安全性[10]。结果显示,两个方案的ORR、4年无事件生存期(EFS)和中位总生存期(OS)均无明显性差异,但DHAP方案总的Ⅲ~Ⅳ度毒性反应发生率高于GDP方案(P<0.01),患者生活质量评分也低于GDP方案组(P<0.01)。认为GDP方案与DHAP方案的疗效相当,但前者的毒性反应更轻。QI等[11]使用GDP方案治疗25例复发或难治性外周T细胞淋巴瘤,ORR为64.0%,中位PFS和OS分别为5.4、9.3个月;低IPI评分者预后更好。≥Ⅲ度不良反应包括中性粒细胞减少、血小板减少和贫血等。El GNAOUI等[12]采用GemOx联合R进行解救治疗46例B细胞淋巴瘤患者,ORR为83%,2年EFS和2年总生存率分别为43%和66%。有研究使用GemOx方案解救治疗经多种化疗方案治疗失败的27例患者,ORR为45.8%,中位PFS为8个月[13]。主要不良反应包括中性粒细胞减少率和血小板减少等。平凌燕等[14]使用DICE方案治疗97例复发或难治性NHL患者,ORR为47.42%;复发组的ORR高于难治组(67.6%vs. 35.0%,P=0.002);联合R组的中位OS长于不联合R组(P=0.041)。主要不良反应为骨髓抑制和消化道反应。
本研究使用GDP、GemOx等方案进行解救治疗,ORR为61.76%,中位PFS为6.51个月,说明含铂类方案治疗复发/难治性NHL有较好的疗效。其中,低分期(Ⅱ/Ⅲ期)、低IPI评分(≤2)患者的疗效更好,此与文献报道类似[11];而既往只接受过1个方案化疗患者的ORR和PFS均明显优于接受过多个方案化疗的患者,提示在CHOP或CHOP样方案失败后,应尽早使用含铂类方案进行解救治疗。本研究和文献[14]均表明,在B细胞性NHL的解救治疗中,使用含铂类方案联合利妥昔单抗能够明显延长患者的PFS。含铂类方案的主要不良反应为骨髓抑制和恶心呕吐,其他不良反应轻微。有研究显示,GDP方案和GemOx方案的疗效相当,而后者的胃肠道反应更轻[15];但在本研究中GDP方案和GemOx方案的疗效和不良反应比较差异均无统计学意义(P>0.05)。有研究证实,在解救治疗有效后序贯ASCT和(或)ISRT对提高患者预后有积极作用[1,2,16];本研究中接受了序贯治疗的患者其中位PFS较无序贯治疗患者延长,但差异无统计学意义(P>0.05),估计与相应病例数偏少有关。
综上所述,含铂类方案对复发或难治性NHL具有良好的疗效和安全性,是此类患者解救治疗的可选方案。
[1]HORWITZ S M,ZELENETZ A D,GORDON L I,et al.NCCN guidelines insights:Non-Hodgkin′s lymphomas,version 3.2016[J].J Natl Compr Canc Netw,2016,14(9):1067-1079.
[2]石远凯,孙燕,刘彤华.中国恶性淋巴瘤诊疗规范(2015年版)[J].中华肿瘤杂志,2015,37(2):148-158.
[3]李旭清,张俊伟,吕晶丽,等.我国复发难治性淋巴瘤治疗策略分析[J].中国肿瘤,2016,25(10):830-834.
[4]D′AMORE F,GAULARD P,TRÜMPER L,et al.Peripheral T-cell lymphomas:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2015,26 Suppl 5:108-115.
[5]VITOLO U,SEYMOUR J F,MARTELLI M,et al.Extranodal diffuse large B-cell lymphoma(DLBCL) and primary mediastinal B-cell lymphoma:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2016,27(5):91-102.
[6]TILLY H,VITOLO U,WALEWSKI J,et al.Diffuse large B-cell lymphoma(DLBCL):ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2012,23(7):78-82.
[7]陈碧玲,赵哲,覃仕海,等.吉西他滨联合奥沙利铂治疗淋巴瘤患者的疗效及安全性评价[J].中国实验血液学杂志,2015,23(2):445-449.
[8]BARRINGTON S F,MIKHAEEL N G,KOSTAKOGLU L,et al.Role of imaging in the staging and response assessment of lymphoma:consensus of the International Conference on Malignant Lymphomas Imaging Working Group[J].J Clin Oncol,2014,32(27):3048-3058.
[9]DUECK A C,MENDOZA T R,MITCHELL S A,et al.Validity and reliability of the US National cancer institute′s Patient-Reported outcomes version of the common terminology criteria for adverse events(PRO-CTCAE)[J].JAMA Oncol,2015,1(8):1051-1059.
[10]CRUMP M,KURUVILLA J,COUBAN S,et al.Randomized comparison of gemcitabine,dexamethasone,and cisplatin versus dexamethasone,cytarabine,and cisplatin chemotherapy before autologous Stem-Cell transplantation for relapsed and refractory aggressive lymphomas:NCIC-CTG LY.12[J].J Clin Oncol,2014,32(31):3490-3496.
[11]QI F,DONG M,HE X H,et al.Gemcitabine,dexamethasone,and cisplatin(GDP) as salvage chemotherapy for patients with relapsed or refractory peripheral T cell lymphoma-not otherwise specified[J].Ann Hematol,2017,96(2):245-251.
[12]EI GNAOUI T,DUPUIS J,BELHADJ K,et al.Rituximab,gemcitabine and oxaliplatin:an effective salvage regimen for patients with relapsed or refractory B-cell lymphoma not candidates for high-dose therapy[J].Ann Oncol,2007,18(8):1363-1368.
[13]杨建良,石远凯,何小慧,等.吉西他滨联合奥沙利铂对多种化疗方案治疗失败后淋巴瘤患者的疗效及安全性评价[J].中华肿瘤杂志,2014,36(2):137-140.
[14]平凌燕,宋玉琴,郑文,等.DICE方案治疗97例复发/难治非霍奇金淋巴瘤患者的疗效及生存分析[J].中华血液学杂志,2016,37(9):790-794.
[15]陆颖,黄海欣,李桂生.GEMOX方案与GDP方案治疗复发或难治性非霍奇金淋巴瘤的临床对比研究[J].中国癌症杂志,2011,21(8):621-625.
[16]彭翠翠,刘林,文静.利妥昔单抗联合APBSCT治疗B细胞性非霍奇金淋巴瘤的临床研究[J].重庆医学,2014,43(28):3718-3721.
