不同方式的轻度跑步机锻炼对阿尔茨海默鼠认知功能的影响
2018-03-06宋文颖张家薇刘俊保
宋文颖,张家薇,彭 芳,刘俊保
(1.河南应用技术职业学院护理学院,郑州 450042;2.郑州澍青医学高等专科学校临床医学系,郑州 450064;3.郑州大学人民医院中医科,郑州 450003)
阿尔茨海默病(Alzheimer′s disease,AD)是老年痴呆中最常见的类型,脑部以淀粉样蛋白(β-amyloid,Aβ)沉积形成的老年斑、因微管相关蛋白Tau蛋白过度磷酸化而形成神经原纤维缠结等为其主要病理特征,主要临床表现为进行性认知功能障碍、行为学改变等,病因十分复杂,目前无特效治疗方法[1]。临床上仍以药物治疗为主,但存在治疗效果不理想及药物不良反应等问题。有研究发现,跑步机锻炼可明显提高AD患者及AD动物模型的空间认知能力[2-3]。但也有研究表明,跑步机锻炼是一种强迫型运动方式,低强度的跑步机锻炼才更有益于改善AD认知及脑部病理,高强度的跑步机锻炼会对AD鼠形成压力而导致相反的效果[4-5]。而是否任何形式的轻度跑步机锻炼都可以改善AD的认知及病理,目前尚属未知。本研究采用3种不同形式的轻度跑步机锻炼方法干预AD小鼠模型,旨在从行为功能学水平、组织学水平及生化与分子生物学水平等方面来观察有规律和无规律轻度跑步机锻炼对AD鼠认知功能的影响及其可能的作用机制。
1 材料与方法
1.1材料 仪器及试剂:六跑道动物跑步机装置购自北京硕林苑科技有限公司,Aβ40、42 ELISA检测试剂盒购自赛默飞世尔公司,β-分泌酶与γ-分泌酶ELISA检测试剂盒购自江苏菲亚生物公司,匀浆器、1,3-双(4-氨基苯氧基)苯(TPER)试剂等购自北京鼎国昌盛生物公司,尼氏染色液购自碧云天生物公司,低温切片机、倒置显微镜等购自莱卡公司,RIPA和PMSF蛋白提取试剂、羊抗兔二抗、β-actin、脑源性神经营养因子(BDNF)、络氨酸激酶受体B(TrkB)、磷酸化TrkB(p-TrkB)兔抗鼠一抗、聚二氟乙烯(PVDF)膜、电泳液、转膜液、发光试剂等购自上海生工生物公司,垂直电泳槽、转膜仪、蛋白膜成像分析系统等购自BioRad生物公司,Trizol、PrimeScript反转录试剂盒、SYBR Green荧光定量试剂盒等购自TAKARA生物公司,β-actin、脑啡肽酶(NEP)、胰岛素降解酶(IDE)、基质金属蛋白酶9(MMP-9)定量PCR引物由上海生工合成。动物:清洁级C57BL/6 APP转基因AD模型小鼠购自中国协和医科大学动物所,合笼繁殖,饲养于独立送风隔离笼具(IVC)。同时期出生的24只雄性6月龄APP+小鼠经PCR分子鉴定后用于本实验。
1.2方法
1.2.1动物模型与分组 将24只雄性6月龄APP+小鼠分为4组,对照组、有规律锻炼组(RE组)、无规律不同时刻锻炼组(ITE组)和无规律不同持续时间锻炼组(IDDE组),每组6只。该小鼠模型在5~6月龄(发病早期)开始在脑部海马区出现Aβ,在8~9月龄(发病期)出现明显的Aβ沉淀和认知能力损害。
1.2.2跑步机锻炼 RE组、ITE组和IDDE组小鼠接受为期12周的跑步机锻炼(速度为10 m/min),每周5天(周一至周五)。RE组小鼠:固定时间段,每天上午8:00-9:00连续锻炼1 h;ITE组小鼠:不固定时间段,每天任意连续锻炼1 h;IDDE组小鼠:不固定持续时间,每天早晨8:00开始,随机锻炼0~1 h。各组小鼠正式锻炼前在跑步机上接受为期3 d的适应练习(每天1 h,速度为10 m/min)。在RE组小鼠进行锻炼的同时,将对照组小鼠放置在另一静止的跑步机上1 h。实验阶段为小鼠6~9月龄。
1.2.3Morris水迷宫检测小鼠空间认知能力 经过12周的跑步机锻炼,采用Morris水迷宫实验检测小鼠空间认知能力变化。小鼠专用Morris水迷宫参数:水池高度为40 cm、直径120 cm、分4个象限,平台高度为28 cm、直径为15 cm,水温控制在(25±1)℃。将平台置于第Ⅰ象限,略低于水面。正式实验前1周为适应练习阶段,各组小鼠每天在固定的时间进行入水练习,每次60 s。第8天开始正式测试。首先进行定位航行实验,每只小鼠从不同象限依次入水,采集器记录小鼠运动轨迹及逃避潜伏期、穿越平台次数。然后进行空间探索实验,撤去平台,每只小鼠从不同象限依次入水,记录上述参数。
1.2.4尼氏染色检测海马存活神经元 水迷宫实验结束,小鼠经水合氯醛麻醉、0.9%生理盐水灌注、4%多聚甲醛固定液灌注后分离脑组织,经过4 ℃、4%多聚甲醛过夜、30%蔗糖溶液孵育48 h,石蜡包埋后采用低温切片机切取10 μm冠状切片,每个组织切6张。染色步骤参照试剂盒说明书进行。封片后置于显微镜下观察,参照文献[6]的方法计数海马区存活的神经元,存在清晰细胞体及明显细胞核的细胞作为完整存活的神经元纳入计数。
1.2.5ELISA检测小鼠海马组织Aβ40、42水平及β-分泌酶、γ-分泌酶活性 水迷宫实验结束,断颈处死小鼠,立即分离海马组织并称取质量,在匀浆器中加入TPER(含蛋白酶抑制剂)制备脑组织匀浆。匀浆经4 ℃、16 000 r/m离心1 h,收集上清液用于检测可溶性Aβ40、42水平及β-分泌酶、γ分泌酶活性;沉淀物经70%甲酸重悬,4 ℃、16 000 r/m离心1 h后收集上清液用于检测不溶性Aβ40、42水平。实验方法参照ELISA检测试剂盒说明书。
1.2.6实时荧光定量PCR(qRT-PCR)检测小鼠海马组织相关基因mRNA水平 Trizol法提取海马组织总RNA,经浓度、纯度及完整性检测,利用反转录试剂盒将RNA反转录为cDNA。采用ABI 7500 实时定量PCR仪进行qRT-PCR反应,检测Aβ降解相关基因NEP、IDE和MMP-9 mRNA相对表达水平。每管20 μL反应体系。反应条件为:95 ℃预变性30 s;95 ℃变性3 s,60 ℃退火30 s,40个循环。每个反应重复3次。以β-actin作为内参基因,基因相对表达量计算采用比较Ct法,基因相对表达量倍数变化采用2-ΔΔCt进行计算。观察熔解曲线以确认PCR反应产物单一性。引物序列如下,见表1。
1.2.7Western blot检测小鼠海马组织BDNF、TrkB与p-TrkB蛋白水平 分离小鼠海马组织,提取总蛋白并测浓度,每个样本取适量总蛋白加入Loading Buffer,95 ℃水浴10 min使蛋白变性,置于-20 ℃保存。蛋白样品依次经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转PVDF膜,封闭,一抗及二抗杂交,加上发光试剂,PVDF膜上的蛋白条带由伯乐成像分析系统扫描并测灰度值。蛋白相对灰度值(%)=目的蛋白条带灰度值/内参蛋白条带灰度值×100%。
1.3统计学处理 采用SPSS17.0统计分析数据。多组间数据比较采用单因素方差分析,两组间比较采用t检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1各组小鼠空间认知能力比较 与对照组小鼠比较,锻炼各组小鼠的逃避潜伏期缩短、穿越平台次数增加;RE组逃避潜伏期、穿越平台次数明显优于其他3组(P<0.05),IDDE组穿越平台次数多于对照组(P<0.05);而对照组、ITE组、IDDE组组间逃避潜伏期比较,差异无统计学意义(P>0.05);对照组、ITE组组间穿越平台次数比较,差异无统计学意义(P>0.05)。见图1、表2。
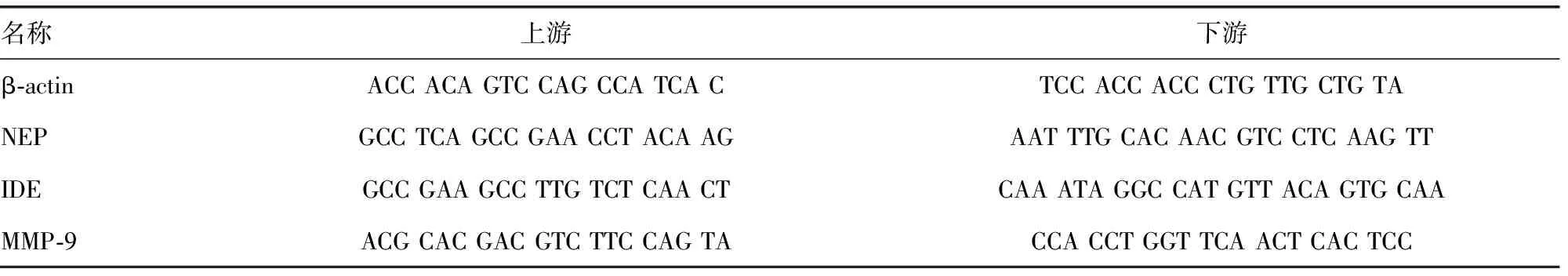
表1 相关基因qRT-PCR引物序列(5′-3′)
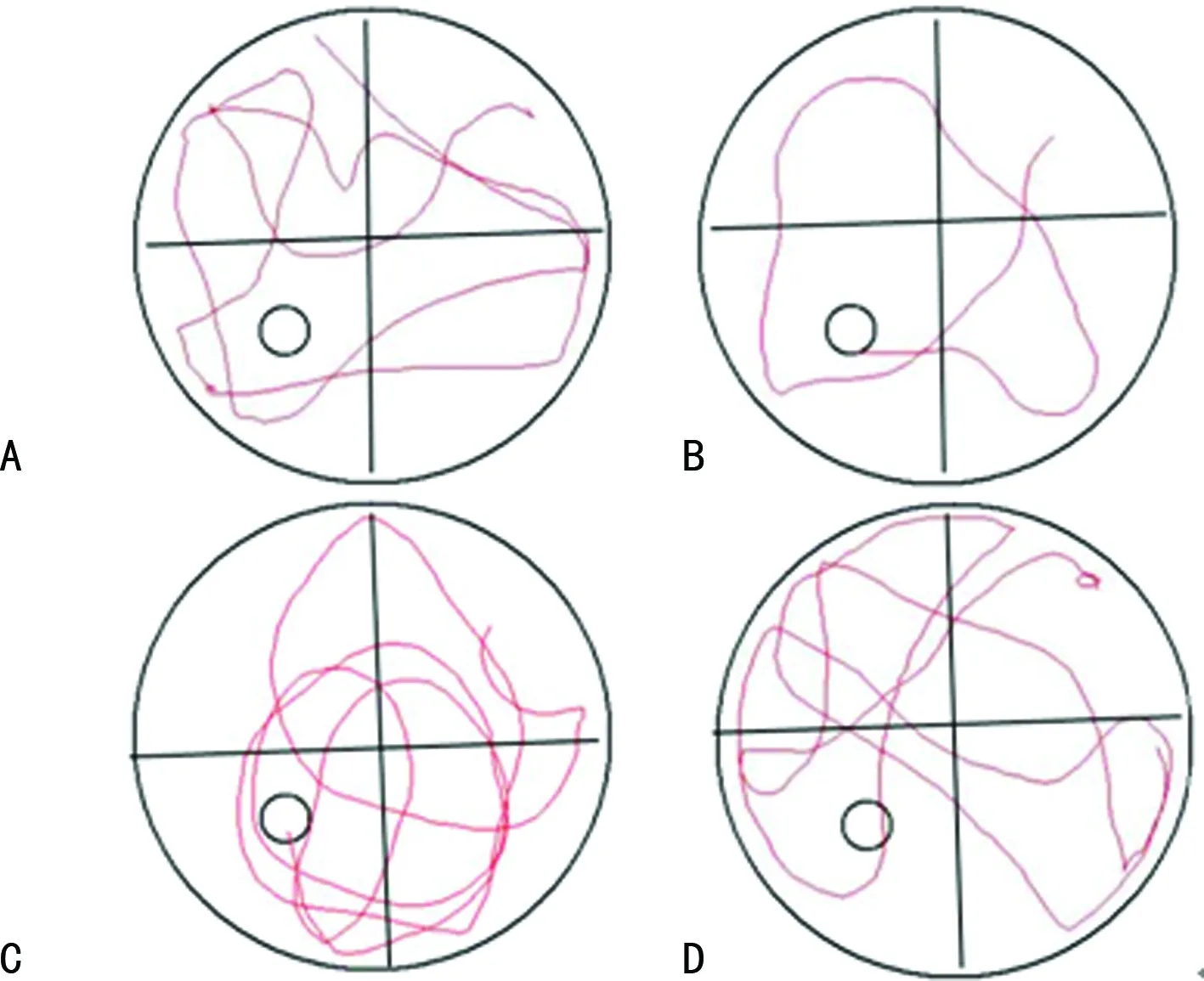
A:对照组;B:RE组;C:ITE组;D:IDDE组
图1 Morris水迷宫实验结果
2.2各组小鼠海马组织Aβ40、42水平及β-分泌酶、γ-分泌酶活性比较 与对照组比较,各锻炼组小鼠海马组织中可溶性与不溶性Aβ40、42水平及β-分泌酶、γ-分泌酶活性均有所下降;只有RE组Aβ40、42水平及β-分泌酶、γ-分泌酶活性与对照组比较,差异有统计学意义(P<0.05);ITE组、IDDE组与对照组比较,差异均无统计学意义(P>0.05),见表3。
表2 各组小鼠逃避潜伏期及穿越平台次数比较
a:P<0.05,与RE组比较;b:P<0.05,与对照组比较
表3 各组小鼠海马组织Aβ40、42水平及β-分泌酶、γ-分泌酶活性比较
a:P<0.05,与对照组比较
2.3各组小鼠海马组织NEP、IDE及MMP-9 mRNA水平比较 与对照组比较,其他3组小鼠海马组织中NEP、IDE及MMP-9 mRNA表达水平有所升高;但4组间各指标比较差异均无统计学意义(P>0.05),见表4。
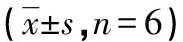
表4 各组小鼠海马组织NEP、IDE、MMP-9的qRT-PCR检测结果
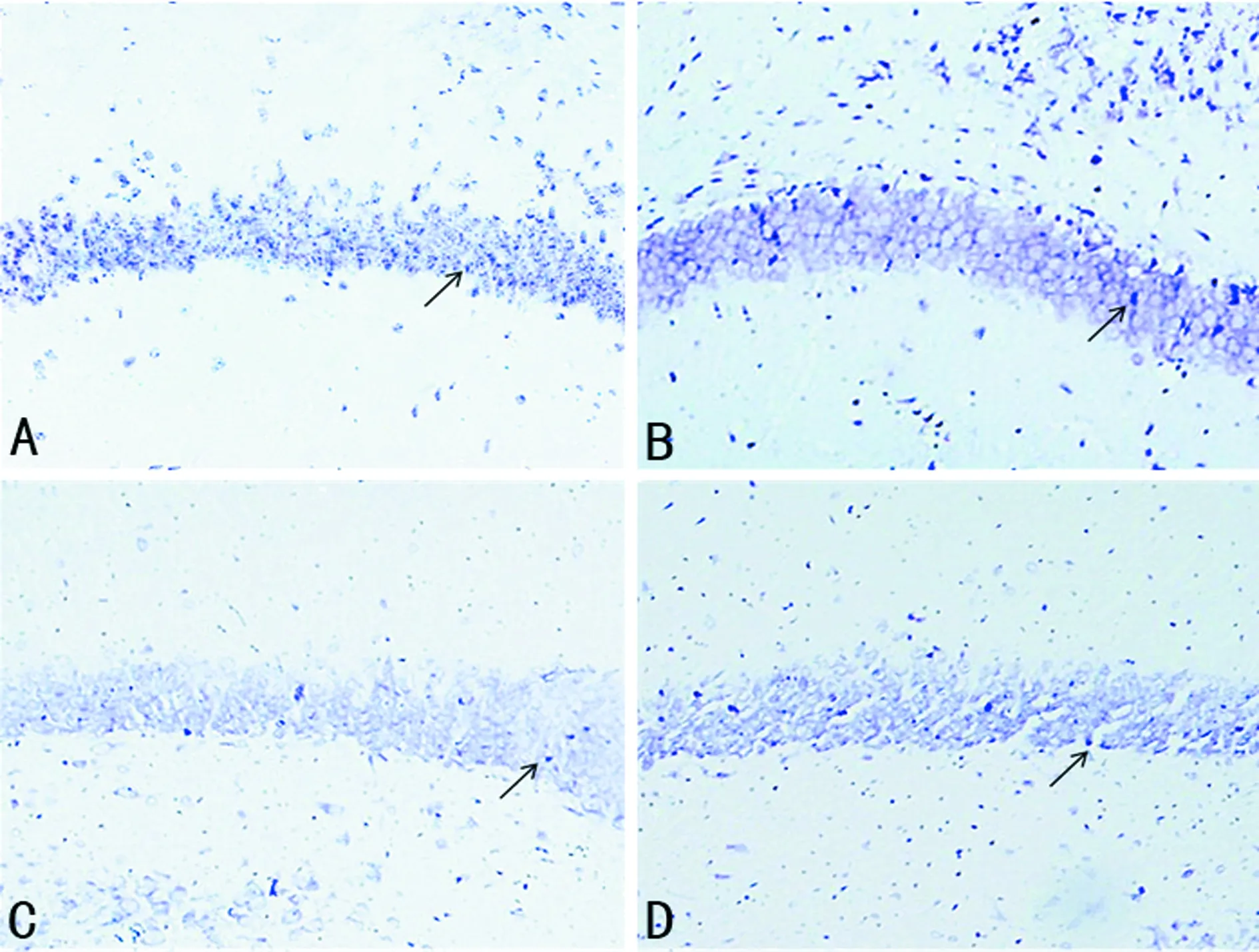
A:对照组;B:RE组;C:ITE组;D:IDDE组
图2小鼠海马CA1区尼氏染色结果(比例尺=100 μm)
2.4各组小鼠海马存活神经元比较 对照组、RE组、ITE组、IDDE组小鼠海马存活神经元数量分别为(96.00±29.00)、(164.00±43.00)、(98.00±16.00)、(113.00±11.00)个。对照组、ITE组和IDDE组小鼠均表现出明显的海马神经元损伤,神经元结构不完整,尼氏体明显减少;而RE组小鼠海马椎体细胞层致密排列,海马神经元数量明显增加,与对照组比较差异有统计学意义(P<0.05)。而ITE组与IDDE组小鼠海马神经元数量均多于对照组,但差异无统计学意义(P>0.05)。见图2。
2.5各组小鼠海马组织BDNF、TrkB及p-TrkB蛋白水平比较 与对照组比较,RE组小鼠海马组织中BDNF、p-TrkB蛋白水平均明显上调(P<0.05),TrkB蛋白水平无明显变化(P>0.05)。对照组、ITE组、IDDE组组间BDNF、TrkB及p-TrkB蛋白水平比较,差异均无统计学意义(P>0.05),见图3。
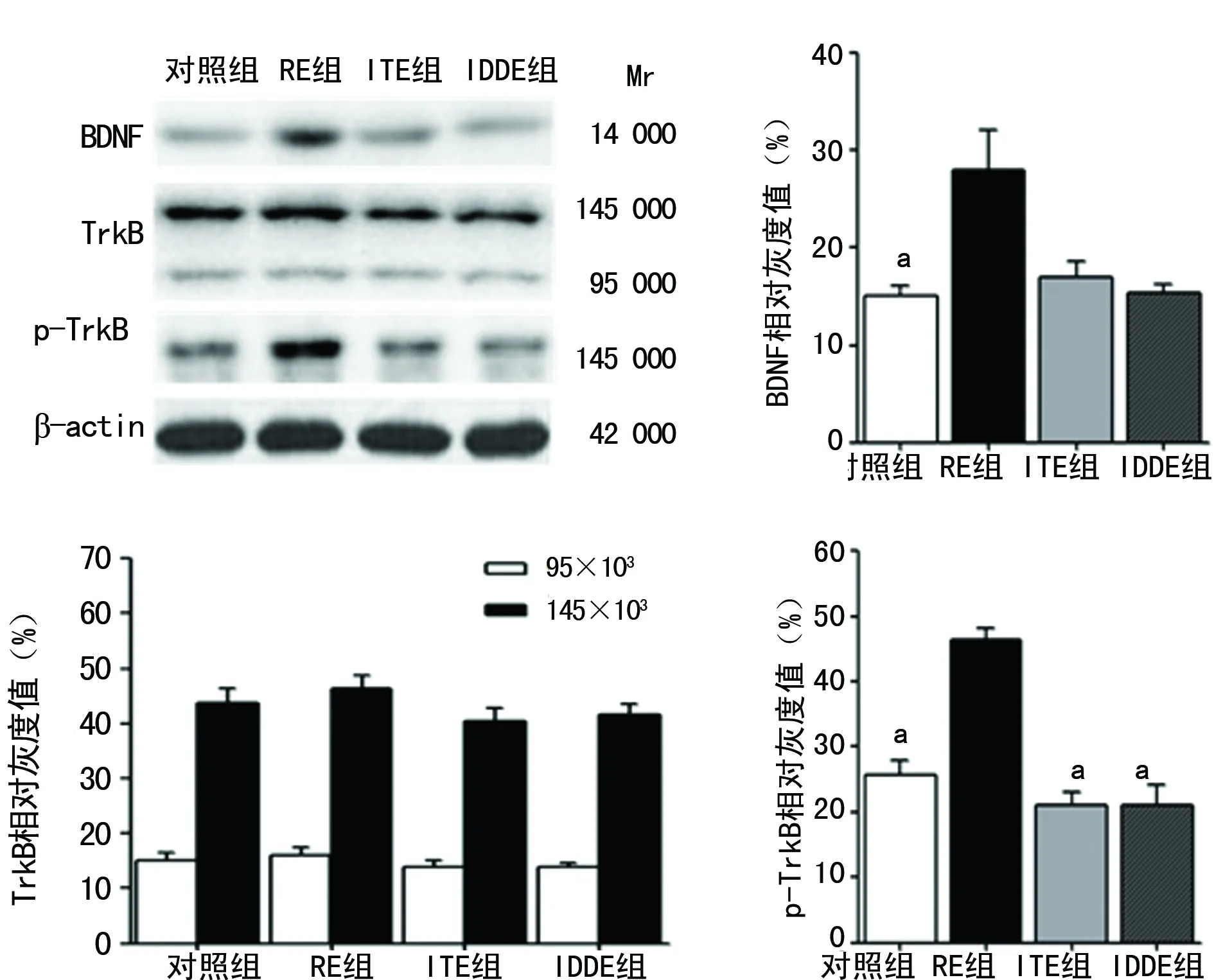
a:P<0.05,与RE组比较
图3小鼠海马组织Western blot检测结果
3 讨 论
近年来研究发现,跑步锻炼作为一种简单易行、经济实用的行为学方法可有效改善AD的认知功能。既往的动物实验研究中,常用的跑步锻炼方式有自由轮跑步锻炼和跑步机锻炼,前者已被证实可有效提高AD认知但临床应用受限,后者更易在临床上推广应用。但跑步机锻炼是一种强迫式被动性锻炼方式,其对AD的干预效果具有双重性,一方面因长期锻炼而提高认知能力,另一方面因对机体造成压力并影响机体内平衡而损害认知[7]。目前研究表明,相比于高强度的跑步机锻炼,轻度的跑步机锻炼因对机体产生的压力较小而更有效地提高AD的认知能力[8-9]。本研究旨在观察不同形式的轻度跑步机锻炼方法对AD鼠的干预效果并探讨可能的作用机制。
机体生理节奏紊乱会影响代谢平衡进而损害认知[10]。本研究结果显示,长期的轻度跑步机锻炼可提高AD鼠认知能力,且只有RE组干预效果明显。表明相比无规律的跑步机锻炼,有规律的跑步机锻炼可有效改善AD的认知能力。关于AD的发病机制,目前被普遍认可的是Aβ理论,该理论认为,淀粉样前体蛋白(amyloid precursor protein,APP)经β-分泌酶与γ-分泌酶切割产生毒性强的Aβ40与Aβ42,可溶性的Aβ40、42有效地削弱了突触的结构和功能,由其聚合形成的不溶性的Aβ则主要沉积在脑部海马区形成老年斑进而损伤神经元,导致认知功能逐渐减退等临床症状[11-12]。本研究发现,轻度有规律的跑步机锻炼有效降低了海马组织中可溶性与不溶性Aβ40、42水平及β-分泌酶与γ-分泌酶活性,而对3个降解Aβ相关基因IDE、NEP与MMP-9的mRNA表达水平并无明显影响。提示轻度有规律跑步机锻炼减少Aβ40、42是通过抑制Aβ40、42生成和聚合,而不是促进Aβ的降解。此外,本研究尼氏染色结果提示,轻度有规律跑步机锻炼相比于不规律锻炼方式对AD鼠海马神经元具有明显的保护作用。
BDNF/TrkB信号通路与神经保护及突触功能密切相关,在突触可塑性及神经再生中发挥重要的作用[13-14]。本研究结果表明,RE组BDNF和p-TrkB蛋白表达水平较其他3组均明显升高。提示轻度有规律跑步机锻炼对AD鼠的神经保护作用可能是通过调节BDNF/TrkB通路而实现。
综上所述,不同形式的轻度跑步机锻炼对AD的干预效果明显不同,轻度有规律跑步机锻炼可明显提高AD认知。改善Aβ病理及促进神经元保护可能是轻度有规律跑步机锻炼有效提高AD认知能力的作用机制。而无规律轻度跑步机锻炼对AD的干预作用不明显。该研究为临床采用跑步机锻炼来寻求防治AD的有效方法提供参考依据。
[1]MUCKE L.Neuroscience:Alzheimer′s disease[J].Nature,2009,461(15):895-897.
[2]LIN T,SHIH Y,CHEN S,et al.Running exercise delays neurodegeneration in amygdala and hippocampus of Alzheimer′s disease(APP/PS1) transgenic mice[J].Neurobiol Learn Mem,2015,118(2):189-197.
[3]ARCOVERDE C,DESLANDES A,MORAES H,et al.Treadmill training as an augmentation treatment for Alzheimer′s disease:a pilot randomized controlled study[J].Arq Neuropsiquiatr,2014,72(3):190-196.
[4]MOORE K M,GIRENS R E,LARSON SK,et al.A spectrum of exercise training reduces soluble Aβ in a dose-dependent manner in a mouse model of Alzheimer′s disease[J].Neurobiol Dis,2016,85(2):218-224.
[5]DAO A T,ZAGAAR M A,ALKADHI K A.Moderate treadmill exercise protects synaptic plasticity of the dentate gyrus and related signaling cascade in a rat model of alzheimer′s disease[J].Mol Neurobiol,2015,52(3):1067-1076.
[6]WANG H,LIAO Z,SUN X,et al.Intravenous administration of Honokiol provides neuroprotection and improves functional recovery after traumatic brain injury through cell cycle inhibition[J].Neuropharmacology,2014,86(1):9-21.
[7]YUEDE C M,ZIMMERMAN S D,DONG H,et al.Effects of voluntary and forced exercise on plaque deposition,hippocampal volume,and behavior in the Tg2576 mouse model of Alzheimer′s disease[J].Neurobiol Dis,2009,35(3):426-432.
[8]LIU H,ZHAO G,ZHANG H,et al.Long-term treadmill exercise inhibits the progression of Alzheimer′s disease-like neuropathology in the hippocampus of APP/PS1 transgenic mice[J].Behav Brain Res,2013,256(2):261-272.
[9]INOUE K,OKAMOTO M,SHIBATO J,et al.Long-term mild,rather than intense,exercise enhances adult hippocampal neurogenesis and greatly changes the transcriptomic profile of the hippocampus[J].PLoS One,2015,10(6):e0128720.
[10]COCHRANE A,ROBERTSON I H,COOGAN A N.Association between circadian rhythms,sleep and cognitive impairment in healthy older adults:an actigraphic study[J].J Neural Transm(Vienna),2012,119(10):1233-1239.
[11]FEMANDEZ F P,DE M L,RINCON L D.Modeling the complex pathology of Alzheimer′s disease in Drosophila[J].Exp Neurol,2015,27(4):58-71.
[12]PUNG L,WANG X,LI M,et al.The role of APP in Alzheimer′s disease[J].Adv Alzheimer Dis,2013,2(2):60-65.
[13]LIU H,XUE X,SHI H,et al.Osthole Upregulates BDNF to Enhance Adult Hippocampal Neurogenesis in APP/PS1 Transgenic Mice[J].Biol Pharm Bull,2015,38(10):1439-1449.
[14]LIAO G,BOUYER K,KAMITAKAHARA A,et al.Brain-derived neurotrophic factor is required for axonal growth of selective groups of neurons in the arcuate nucleus[J].Mol Metab,2015,4(6):471-482.
