可溶性ST2和半乳糖凝集素-3水平与室间隔心肌切除术后肥厚型梗阻性心肌病患者预后的相关性分析
2018-03-06鲁洁黄晓红伍熙崔颢王婧金肖明虎郭颖宋昌鹏郑欣馨房晓楠王水云
鲁洁,黄晓红,伍熙,崔颢,王婧金,肖明虎,郭颖,宋昌鹏,郑欣馨,房晓楠,王水云
ST2是白细胞介素1受体家族成员糖蛋白,包括两种形式,一种为跨膜受体,另一种为可溶的分泌型受体[1]。近年来研究发现,慢性收缩性心力衰竭(心衰)患者中可溶性ST2(sST2)水平升高是一种能加强危险分层的新型生物标志物[2]。2012年,Broch等[3]发现,在老年缺血性心衰患者中,基础血浆sST2水平与心衰加重导致的死亡和住院事件以及所有心血管住院事件相关。 一项纳入447例急性失代偿性心衰患者的多中心研究显示,不论左心室射血分数高低,sST2都是一年死亡率的独立预测因子[4]。
半乳糖凝集素-3(Gal-3)是一种由激活的巨噬细胞分泌、与β半乳糖结合的凝集素。Gal-3参与心衰的多个病理生理学过程,包括心肌纤维化、炎症以及心肌重构[5,6]。De Boer等[7]发现,血浆Gal-3水平是心衰患者全因死亡和心衰再住院复合终点事件的独立预测因素。根据Aldo-DHF研究结果, 射血分数保留心衰患者血浆Gal-3水平与不良预后相关,且独立于治疗措施和血N末端B型利钠肽原(NT-proBNP)水平[8]。
在肥厚型心肌病(HCM)患者中,心肌间质纤维化和左心室舒张功能受损普遍存在[9]。目前已有一些关于HCM生物标志物方面的研究,比如探讨微小RNA(miR)-29a 和NT-proBNP与HCM患者左心室肥厚程度、纤维化情况或临床预后的研究[10,11]。然而,血浆sST2和Gal-3水平与心肌切除术后肥厚型梗阻性心肌病(HOCM)患者临床预后的关系目前尚不明确。本研究旨在探讨HOCM患者血浆sST2和Gal-3水平的变化,并评估血浆sST2和Gal-3水平与室间隔心肌切除术后HOCM患者临床预后的关系。
1 资料与方法
研究对象:纳入2011-03至2016-02期间在我院行改良Morrow手术的HOCM患者200例。HCM定义:显著的左心室室壁节段性肥厚,左心室舒张末期最大室壁厚度≥15 mm,排除其他可引起心室肥厚的系统性或局部疾病[12]。手术指征:药物治疗效果不佳,静息状态下或活动后左心室流出道/左心室中部压力阶差≥50 mmHg(1 mmHg=0.133 kPa)[13]。排除标准:(1)既往心外科手术史;(2)既往行酒精化学消融术;(3)手术死亡;(4)严重肝、肾功能不全。患者的总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、NT-proBNP和心肌肌钙蛋白I(cTnI)水平均在我院中心实验室采用标准方法检测获得。研究另外收集了42例无心脏疾病的志愿者血液样本作为正常对照,并按照性别和年龄匹配了42例HOCM患者,比较两者血浆sST2与Gal-3水平的差异。另一方面,200例HOCM患者根据血浆sST2水平三分位数分为三组:低sST2组(< 9.05 ng/ml)、中 sST2 组(9.05~16.74 ng/ml)、高 sST2 组(>16.74 ng/ml);根据血浆Gal-3水平三分位数也分三组:低Gal-3组(< 6.19 ng/ml)、中Gal-3组(6.19~8.22 ng/ml)、高 Gal-3组(> 8.22 ng/ml)。主要终点为全因死亡和心血管住院的复合终点,心血管住院包括因心房颤动发作、心衰加重、心绞痛样症状发作及脑卒中而住院进行治疗。心衰加重定义为新发心衰以及既往有明确慢性心衰病史、本次心衰症状突然加重的急性失代偿心衰,心衰诊断参照我国心衰指南[14]。
研究方法:(1)每例患者于手术当日清晨留取血液样本,使用酶联免疫吸附法检测血清sST2与Gal-3水平。主要实验仪器采用-80℃深低温冰箱(Forma,美国)、台式低温离心机(Thermo,德国)、恒温水浴槽(Cole Parmer,美国)、酶标仪(BioRad,美国)、移液器(Eppendorf,芬兰)、去离子水制备仪(Milli-Q UF,美国)。主要实验试剂材料采用sST2酶联免疫试剂盒(R&D,美国)、Gal-3酶联免疫试剂盒(R&D,美国)。(2)超声心动图检查:经胸超声心动图检查采用通用公司的E9超声系统(挪威)。左心室流出道/左心室中部压差值采用连续多普勒超声估测。左心室舒张末期内径、室间隔厚度、室壁厚度和左心室射血分数采用美国超声心动图学会推荐的方法测量[15]。在胸骨旁长轴切面,采用M型超声测量舒张末期左心房内径。根据Devereux校正公式计算左心室质量[15],左心室质量= 0.8×1.04×[(室间隔厚度+左心室后壁厚度+左心室舒张末期内径)3-左心室舒张末期内径3]+0.6 g,左心室质量指数=左心室质量/体表面积。
统计学分析:应用SPSS 21.0软件进行所有统计学分析,计量资料符合正态分布用均值±标准差表示,非正态分布采用中位数(P25,P75)表示。连续变量间的比较采用独立样本t检验或者Mann-Whitney U非参数检验;分类变量以例数(比率) 表示,分类变量间的比较采用卡方检验或Fisher精确检验。生存曲线用Kaplan-Meier分析,采用GraphPad 5.0软件绘制,用对数秩和检验比较生存分布差异。为了评估临床终点的预测因素,采用Cox比例风险回归模型来计算风险比(HR)和95%可信区间(CI),P<0.05认为差异有统计学意义。
2 结果
根据血浆sST2和Gal-3水平三分位数分组的HOCM患者的临床基线资料及超声心动图特征(表1、表2):200例HOCM患者中,男性占64%,患者平均年龄为 43.7岁。随访时间中位数为26个月,随访形式包括门诊、电话随访及再次住院,失访率为6.5%。与低sST2组相比,中sST2组及高sST2组的男性比例更高,差异有统计学意义(P=0.009)。与低Gal-3组相比,中Gal-3组及高Gal-3组的患者年龄更大,男性比例更低,钙拮抗剂服用比例更高,NT-proBNP水平更高,差异均有统计学意义(P均 <0.05)。

表1 根据sST2水平三分位数分组的200例HOCM患者的临床资料及超声心动图特征比较[例(%)]

表2 根据Gal-3水平三分位数分组的200例HOCM患者的临床资料及超声心动图特征比较[例(%)]
42例HOCM患者和42例正常对照者的血浆sST2和Gal-3水平比较(图1):酶联免疫吸附法检测结果显示,HOCM患者血浆中sST2水平[12.7(8.8,18.8)ng/ml vs 8.1(5.8, 11.8)ng/ml,图 1A]和 Gal-3 水平 [7.5(6.4, 8.9)ng/ml vs 6.5(4.6, 7.9)ng/ml, 图1B]均明显高于正常对照者,差异均有统计学意义(P均 <0.001)。

图1 42例HOCM患者和42例正常对照者的血浆sST2(1A)和Gal-3水平(1B)比较
根据血浆sST2和Gal-3水平三分位数分组的HOCM患者终点事件比较及Kaplan-Meier生存分析结果(表3、图2):中位随访26个月时,根据血浆sST2 和Gal-3水平三分位数分组的HOCM患者之间的终点事件发生率无显著差异(P均>0.05)。Kaplan-Meier生存分析结果也显示,根据血浆sST2和Gal-3水平三分位数分组的HOCM患者在全因死亡和心血管住院的复合终点事件发生率上均无明显差异(log-rank P分别为 0.06和 0.68)。
Cox风险回归模型分析主要终点事件的预测因素(表4):Cox单因素回归生存分析结果显示,年龄越 大(HR=1.05,95% CI: 1.01~1.09,P=0.01)、心房颤动病史(HR=2.72,95% CI: 1.14~6.50,P=0.02)是全因死亡及心血管住院的复合终点事件的预测因素。然而,血浆sST2水平(HR=0.99,95% CI: 0.97~1.01,P=0.33)和 Gal-3水平(HR=1.07,95% CI: 0.95~1.20,P=0.70)均与全因死亡及心血管住院的复合终点事件无关。最终将年龄及心房颤动病史纳入Cox多因素风险回归模型中分析,结果表明,年龄(校正HR=1.06,95% CI:1.02~1.11,P<0.01)是室间隔心肌切除术后HOCM患者全因死亡及心血管住院复合终点事件的独立预测因子。
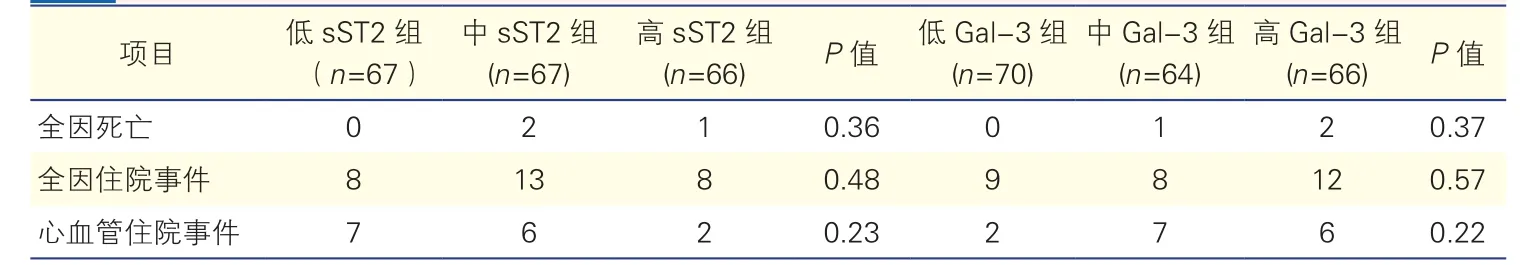
表3 根据血浆sST2和Gal-3水平三分位数分组的HOCM患者终点事件比较(例)
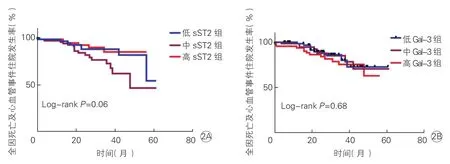
图2 根据血浆sST2水平(2A)和Gal-3水平(2B)三分位数分组的HOCM患者Kaplan-Meier生存分析结果

表4 Cox风险回归模型分析主要终点事件的预测因素
3 讨论
HOCM是严重威胁人类生命的心脏疾病,对于药物治疗无法有效缓解症状的HOCM患者而言,心肌切除手术是一种安全有效的治疗手段,几乎可以改善所有患者的临床症状和心功能[16]。探究心肌切除术后HOCM患者临床事件的危险因素,有助于术前对患者进行危险分层,以指导术后的临床管理。HCM患者存在心肌纤维化已经通过心肌活检得到证实,可作为HCM患者主要临床终点事件的独立预测因子[17]。近年来研究发现,ST2和Gal-3均涉及心肌纤维化和心肌重塑,是非常有前景的新型生物标记物。研究表明,血浆sST2和Gal-3水平能在既有危险因素基础上增强危险分层的能力,并预测临床事件。
本研究显示,尽管HOCM患者的血浆sST2与Gal-3水平升高,但中位随访26个月后发现,血浆sST2和Gal-3水平与心肌切除术后HOCM患者的临床预后无相关性。年龄增大是室间隔心肌切除术后HOCM患者全因死亡及心血管住院的复合终点事件的独立预测因子。
既往研究显示,对于慢性收缩性心衰患者,在利钠肽基础上,基线ST2水平能增加临床预后预测价值,连续监测ST2水平也可对患者的临床预后做出预测[18]。Meijers等[19]发现,血浆Gal-3水平>17.8 ng/ml的心衰患者再次因心衰住院的比例明显增高。尽管有研究表明,在预测心衰患者死亡事件方面,Gal-3 并不优于NT-proBNP和sST2,不过,将NT-proBNP与Gal-3联合起来进行危险分层,优于单个标志物[20]。综合27项研究的分析发现,与血浆Gal-3水平保持稳定或降低的患者相比,Gal-3水平随时间而升高者的心衰住院率和死亡率显著升高,而且独立于年龄、性别和左心室射血分数[21]。本研究中,血浆sST2及Gal-3水平与心肌切除术后HOCM患者的临床事件无相关性。分析原因,大多数接受室间隔心肌切除术的HOCM患者的预后会有明显改善[22],如在其他更严重的HCM人群中进行研究,也许能获得显著的关联结果。此外,中Gal-3组、高Gal-3组的NT-proBNP水平也较高,联合分析血浆Gal-3及NT-proBNP水平与临床终点事件的相关性,可能会得出有意义的结果。
既往也有研究显示,尽管在急性收缩性心衰患者中,血浆sST2水平升高与临床终点事件相关,但sST2并不是射血分数减少的急性心衰患者6个月内再住院事件的独立预测因素[23]。至今并无研究能提供充分的证据,证明sST2和Gal-3这两种标记物与组织活检评估的心肌纤维化存在关联[24]。
综上,我们认为,如对病情更加严重的HCM患者的血浆sST2和Gal-3水平进行连续监测,并联合NT-proBNP进行分析,可能结果更有意义。
[1] Pascual-Figal DA, Januzzi JL. The biology of ST2: the International ST2 Consensus Panel[J]. Am J Cardiol, 2015, 115(7 Suppl): 3B-7B.DOI: 10. 1016/j. amjcard. 2015. 01. 034.
[2] Ahmad T, Fiuzat M, Felker GM, et al. Novel biomarkers in chronic heart failure[J]. Nat Rev Cardiol, 2012, 9(6): 347-359. DOI: 10. 1038/nrcardio. 2012. 37.
[3] Broch K, Ueland T, Nymo SH, et al. Soluble ST2 is associated with adverse outcome in patients with heart failure of ischaemic aetiology[J].Eur J Heart Fail, 2012, 14(3): 268-277. DOI: 10. 1093/eurjhf/hfs006.
[4] Manzano-Fernández S, Mueller T, Pascual-Figal D, et al. Usefulness of soluble concentrations of interleukin family member ST2 as predictor of mortality in patients with acutely decompensated heart failure relative to left ventricular ejection fraction[J]. Am J Cardiol,2011, 107(2): 259-267. DOI: 10. 1016/j. amjcard. 2010. 09. 011.
[5] Dumic J, Dabelic S, Flogel M. Galectin-3: an open-ended story[J].Biochem Biophys Acta, 2006, 1760: 616-635.
[6] de Boer RA, Voors AA, Muntendam P, et al. Galectin-3: a novel mediator of heart failure development and progression[J]. Eur J Heart Fail, 2009, 11(9): 811-817. DOI: 10. 1093/eurjhf/hfp097.
[7] de Boer RA, Lok DJ, Jaarsma T, et al. Predictive value of plasma galectin-3 levels in heart failure with reduced and preserved ejection fraction[J]. Ann Med, 2011, 43(1): 60-68. DOI: 10. 3109/07853890.2010. 538080.
[8] Edelmann F, Holzendorf V, Wachter R, et al. Galectin-3 in patients with heart failure with preserved ejection fraction: results from the Aldo-DHF trial[J]. Eur J Heart Fail, 2015, 17(2): 214-223. DOI: 10.1002/ejhf. 203.
[9] Elliott PM, Anastasakis A, Borger MA, et al. 2014 ESC guidelines on diagnosis and management of hypertrophic cardiomyopathy:the Task Force for the diagnosis and management of hypertrophic cardiomyopathy of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2014, 35(39): 2733-2779. DOI: 10. 1093/eurheartj/ehu284.
[10] Roncarati R, Viviani AC, Losi MA, et al. Circulating miR-29a,among other up-regulated microRNAs, is the only biomarker for both hypertrophy and fibrosis in patients with hypertrophic cardiomyopathy[J]. J Am Coll Cardiol, 2014, 63(9): 920-927. DOI: 10.1016/j. jacc. 2013. 09. 041.
[11] D'Amato R, Tomberli B, Castelli G, et al. Prognostic value of N-terminal pro-brain natriuretic peptide in outpatients with hypertrophic cardiomyopathy[J]. Am J Cardiol, 2013, 112(8): 1190-1196. DOI: 10. 1016/j. amjcard. 2013. 06. 018.
[12] Gersh BJ, Maron BJ, Bonow RO, et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines[J]. Circulation, 2011,124(24): e783-e831. DOI: 10. 1161/CIR. 0b013e318223e230.
[13] Wang S, Cui H, Yu Q, et al. Excision of anomalous muscle bundles as an important addition to extended septal myectomy for treatment of left ventricular outflow tract obstruction[J]. J Thorac Cardiovasc Surg,2016, 152(2): 461-468. DOI: 10. 1016/j. jtcvs. 2016. 01. 051.
[14] 中华医学会心血管病学分会, 中华心血管病杂志编辑委员会.急性心力衰竭诊断和治疗指南[J].中华心血管病学杂志, 2010,38(3): 195-208. DOI: 10. 3760/cma. j. issn. 0253-3758. 2010. 03.002.
[15] Lang RM, Bierig M, Devereux RB, et al. Recommendations for chamber quantification: a report from the American Society of Echocardiography's Guidelines and Standards Committee and the Chamber Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology[J]. J Am Soc Echocardiogr, 2005,18(12): 1440-1463. DOI: 10. 1016/j. echo. 2005. 10. 005.
[16] Robbins RC, Stinson EB. Long-term results of left ventricular myotomy and myectomy for obstructive hypertrophic cardiomyopathy[J]. J Thorac Cardiovasc Surg, 1996, 111(3): 586-594.
[17] O'Hanlon R, Grasso A, Roughton M, et al. Prognostic significance of myocardial fibrosis in hypertrophic cardiomyopathy[J]. J Am Coll Cardiol, 2010, 56(11): 867-874. DOI: 10. 1016/j. jacc. 2010. 05. 010.
[18] Gaggin HK, Szymonifka J, Bhardwaj A, et al. Head-to-head comparison of serial soluble ST2, growth differentiation factor-15, and highly-sensitive troponin T measurements in patients with chronic heart failure[J]. JACC: Heart Failure, 2014, 2(1): 65-72. DOI: 10.1016/j. jchf. 2013. 10. 005.
[19] Meijers WC, Januzzi JL, Defilippi C, et al. Elevated plasma galectin-3 is associated with near-term rehospitalization in heart failure: a pooled analysis of 3 clinical trials[J]. Am Heart J, 2014, 167(6): 853-860.DOI: 10. 1016/j. ahj. 2014. 02. 011.
[20] Srivatsan V, George M, Shanmugam E. Utility of galectin-3 as a prognostic biomarker in heart failure: where do we stand?[J]. Eur J Prev Cardiol, 2015, 22(9): 1096-1110. DOI: 10. 1177/2047487314552797.
[21] van der Velde AR, Gullestad L, Ueland T, et al. Prognostic value of changes in galectin-3 levels over time in patients with heart failure:data from CORONA and COACH[J]. Circ Heart Fail, 2013, 6(2): 219-226. DOI: 10. 1161/CIRCHEARTFAILURE. 112. 000129.
[22] Nishimura RA, Seggewiss H, Schaff HV. Hypertrophic obstructive cardiomyopathy: surgical myectomy and septal ablation[J]. Circ Res,2017, 121(7): 771-783. DOI: 10. 1161/CIRCRESAHA. 116. 309348.
[23] Frioes F, Lourenco P, Laszczynska O, et al. Prognostic value of sST2 added to BNP in acute heart failure with preserved or reduced ejection fraction[J]. Clin Res Cardiol, 2015, 104(6): 491-499. DOI: 10. 1007/s00392-015-0811-x.
[24] López B, González A, Ravassa S, et al. Circulating biomarkers of myocardial fibrosis : the need for a reappraisal[J]. J Am Coll Cardiol,2015, 65(22): 2449-2456. DOI: 10.1016/j.jacc.2015.04.026.
