系统性硬化病患者的皮肤表现及其临床意义
2018-03-06崔祥祥杨骥屠文震李明
崔祥祥杨骥屠文震李明
200062上海市儿童医院皮肤科(崔祥祥);复旦大学附属中山医院皮肤科(杨骥、李明);上海市中西医结合医院硬皮病专科(屠文震)
系统性硬化病(systemic sclerosis,SSc)是一种以皮肤硬化和内脏器官纤维化为主要特征的自身免疫性结缔组织病,发病机制迄今尚不清楚,该病治疗困难,是皮肤科的一大顽症[1]。该病如能早期诊断、早期治疗,可以延缓或减轻心、肺、肾等重要脏器的损害,明显改善患者预后。SSc有许多皮肤表现,其中较多是该病的早期表现,甚至是首发表现。对SSc皮损进行研究,了解该病的早期皮损,对该病的早期诊断有重要意义。对SSc某些皮损与内脏器官损害之间的关系进行研究,则有助于通过观察皮损而了解某些重要脏器损害的发生,从而早期进行治疗干预,对改善患者预后有重要意义。我们对120例SSc患者的皮肤表现进行了研究,对该病的早期皮损和首发皮损进行了统计,并对某些皮损与重要内脏器官损害之间的关系进行了分析。
对象和方法
一、对象
2012—2014年于复旦大学附属中山医院皮肤科及上海市中西医结合医院硬皮病专科住院及门诊就诊的SSc患者120例,所有患者均符合2013年美国风湿病协会和欧洲抗风湿病联盟联合制定的SSc的分类标准[2]。SSc患者的临床分型依据LeRoy等在1988年提出的SSc临床分类标准[3],将患者分为弥漫皮肤型(diffuse cutaneous systemic sclerosis,dcSSc,除面部、肢体近端和远端受累外,皮肤硬化还见于躯干)、局限皮肤型(limited cutaneous systemic sclerosis,lcSSc,皮肤硬化局限于肘、膝远端部位,也可见于面颈部,该型即CREST综合征)、sine硬皮病(有典型的SSc内脏、血管和血清学异常,但无皮肤硬化)、重叠发生和未分化结缔组织病(UCTD)。
二、方法
1.皮肤科检查:详细填写SSc患者皮损和内脏器官损害记录表格,记录各种皮损的类型、发生部位、分布、表现和发生时间。dcSSc患者皮损进展快,通常在发病后3年内皮肤硬化和内脏器官损害充分显现;而lcSSc患者皮肤硬化进展相对缓慢,有些患者疾病早期仅有雷诺现象、手指硬化而没有内脏器官损害。为了解SSc患者早期皮损,将dcSSc患者病程3年归为早期患者,将lcSSc患者病程≤5年归为早期患者[4-5]。观察其皮肤表现和首发皮肤表现。
2.实验室检查:检查患者血尿粪常规、肾功能(肌酐参考值44~115U/L)、肺高分辨CT、肺功能、心脏超声、胃镜、钡餐、心电图等。其中肺功能检查包括:肺量计测量第一秒用力呼气容积(FEV1),用力肺活量(FVC),体指箱法测量肺总量(TLC),一口气法测量肺一氧化碳弥散量(DLCO)及弥漫率(KCO),数据用实际值占预计值的百分比(%pred)表示,肺功能检测根据美国科学会指南进行。肺功能异常定义为<80%的预计值。DLCO和TLC异常进一步分为轻度(70%~80%预计值),中度(50%~70%预计值)和重度(<50%预计值)。
3.重要内脏器官累及的定义:(1)心脏累及:表现为胸闷,气急,心悸、呼吸困难。心电图可表现为房颤、房扑、传导阻滞、低电压、ST段压低、T波倒置、窦性心动过缓、心室肥大、顺钟向转位等改变。心超可表现为肺动脉高压、心包积液、瓣膜返流、左室舒张功能减退等。(2)肺脏累及:①肺纤维化:高分辨CT出现小叶间隔增厚,小叶内间质增厚,网格影、索条征、磨玻璃密度影[6];②肺动脉高压:静息状态下,彩色多普勒超声心动检测跨左室流出道压力>30mmHg。(3)肾脏累及:肌酐>115 U/L,尿蛋白至少出现一个+或蛋白尿≥300mg/24 h或尿蛋白/肌酐比率>200mg/g。排除肾脏本身疾病及药物引起的肾损害。(4)食道累及:定义为吞咽困难及胃食管返流。吞咽食物有梗阻感和(或)结合钡餐和胃镜诊断为吞咽困难或胃食管返流。
4.统计学处理:采用SPSS 20.0统计软件分析。计量资料以±s表示,计数资料用χ2检验或Fisher精确概率检验,P<0.05为差异有统计学意义。
结 果
一、SSc患者一般情况和临床分型
120例中男21例,女99例,男∶女为1∶4.71;年龄9~83(50.02±14.61)岁,病程1个月至40年(6.36±7.76)。其中dcSSc 51例(42.5%),lcSSc 58例(48.3%),重叠发生7例(5.8%),UCTD 3例(2.5%)和sine硬皮病1例(0.8%)。3例UCTD均符合2013年的诊断标准。
二、SSc患者皮肤表现
120例患者中,有雷诺现象118例(98.3%),其中以雷诺现象为首发表现106例(88.3%),雷诺现象从发生到确诊该病的时间为1个月至20年(2.37±4.20)。其他皮损发生率依次为:皮肤硬化116例(96.7%),其中指背部硬化101例(84.2%);皮肤肿胀90例(75.0%),其中手指肿胀84例(70%);皮肤异色症77例(64.2%)、口唇变薄75例(62.5%)、毛细血管扩张74例(61.7%)、口周放射性条纹63例(52.5%)、面具脸57例(47.5%)、甲小皮增生49例(40.8%)、甲皱出血点35例(29.2%)、指尖凹陷 25例(20.8%)、指腹萎缩24例(20.0%)、指末节缩短24例(20.0%)和指尖溃疡15例(12.5%)。SSc患者典型皮损见图1~8。
三、SSc患者主要内脏器官损害
120例患者中内脏器官损害的发生率依次为肺间质病变50%(44/88)、心脏受累47.8%(55/115)、肺动脉高压35.7%(41/115)、食管受累28.3%(34/120)、肾脏受累9.2%(11/120)。dcSSc患者中肺间质病变发生率为47.1%(24/51),在lcSSc患者为31.0%(18/58),差异无统计学意义。dcSSc患者心脏受累发生率为58.8%(30/51)高于lcSSc患者为29.3%(17/58),χ2=9.638,P<0.01。dcSSc患者肺动脉高压发生率为37.3%(19/51),在lcSSc患者中为32.8%(19/58),差异无统计学意义。dcSSc患者食管受累发生率为33.3%(17/51),在lcSSc患者中为25.9%(15/58),差异无统计学意义。dcSSc患者肾脏累及发生率为11.8%(6/51),在lcSSc患者中为6.9%(4/58),差异无统计学意义。
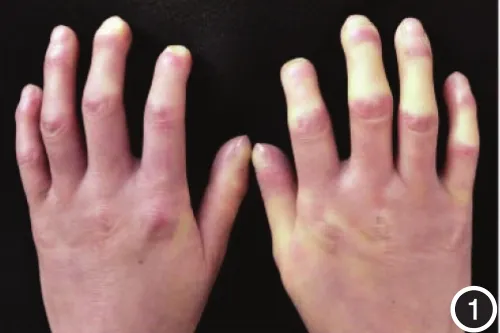
图1 系统性硬化病患者双手背、手指皮肤轻度肿胀硬化,指关节屈曲畸形,掌指关节、近端指尖关节伸侧有点状凹陷性瘢痕。手指处于雷诺现象变白相

图2 面具貌,下眼睑外翻,鼻背如削,鼻翼萎缩,口唇变薄,口唇周围放射状条纹,牙龈萎缩,面色黝黑,面部点状毛细血管扩张
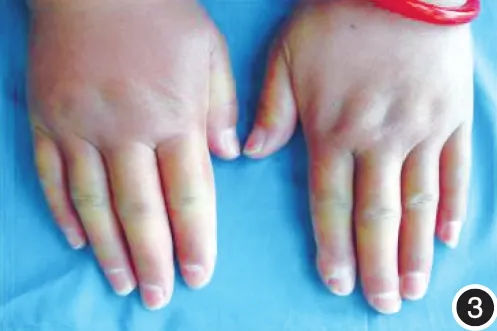
图3 早期手指、手背皮肤肿胀,轻度硬化,手指背皮肤横纹模糊
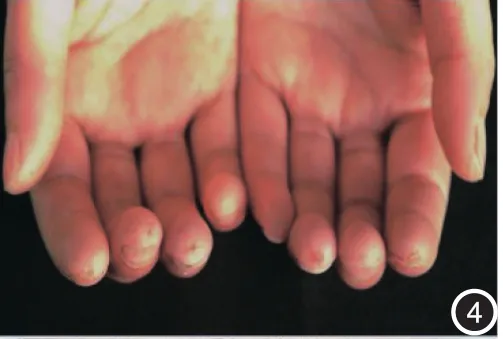
图4 双手指多个指尖有大小不一的凹陷性瘢痕
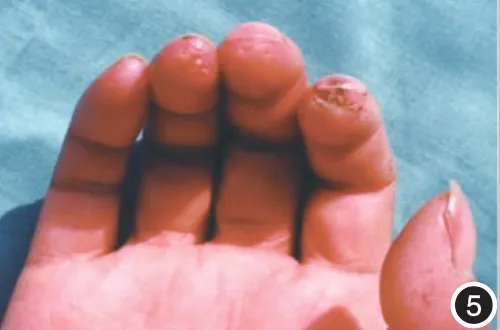
图5 手指尖点状萎缩,右食指有明显萎缩性瘢痕,右拇指指腹萎缩
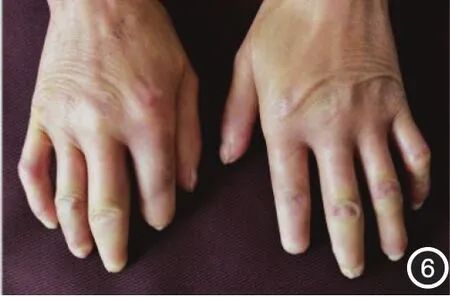
图6 双手背、指背皮肤硬化或增厚,末节手指缩短或整节缺失
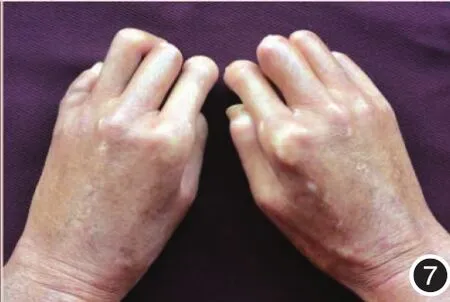
图7 双手指屈曲畸形,呈爪形手

图8 颈后、上背色素减退斑片,毛囊处色素沉着,毛囊周围色素减退,呈盐和胡椒征
四、SSc中dcSSc和lcSSc患者皮损的比较
将SSc患者中的dcSSc和lcSSc进行分组,这两组患者的皮肤表现见表1。dcSSc患者皮肤异色症发生率为88.2%,高于lcSSc患者的44.8%(χ2=22.517,P<0.01)。dcSSc患者张口困难的发生率为58.8%,高于 lcSSc患者的 32.8%(χ2=7.451,P<0.01),差异均有统计学意义。
五、SSc患者早期皮肤表现和首发皮损
dcSSc患者中,病程≤3年28例皮损发生率依次为皮肤异色症85.7%(24/28)、指背硬化64.3%(18/28)、口唇变薄60.7%(17/28)、毛细血管扩张50%(14/28)、口周放射状条纹50%(14/28)、张口困难50%(14/28)、舌系带挛缩46.4%(13/28)、爪型手32.1%(9/28)、指末节缩短17.9%(5/28)、指尖凹陷14.3%(4/28)、指腹萎缩 14.3%(4/28)、指尖溃疡14.3%(4/28)、手指肿胀10.7%(3/28)。lcSSc患者中,病程 ≤ 5年36例,指背硬化86.1%(31/36)、毛细血管扩张63.9%(23/36)、舌系带挛缩55.6%(20/36)、皮肤异色症50%(18/36)、口唇变薄38.9%(14/36)、口周放射状条纹38.9%(14/36)、指尖凹陷22.2%(8/36)、张口困难 22.2%(8/36)、指腹萎缩22.2%(8/36)、指尖溃疡16.7%(6/36)、爪型手13.9%(5/36)、手指肿胀13.9%(5/36)、指末节缩短13.9%(5/36)。120例患者中106例(88.3%)以雷诺现象为首发表现,以皮肤肿胀和(或)皮肤硬化为首发表现者8例(6.7%),以全身关节疼痛、面部红斑、左侧面部麻木、毛细血管扩张、吞咽困难、皮肤异色症为首发表现各1例。
六、SSc患者皮损与其特异性抗体相关性的分析
SSc抗Scl-70抗体阳性42例(35.0%),抗着丝点抗体阳性31例(25.8%)。将SSc患者的皮损与SSc特异性抗体进行相关性分析,见表2。手指肿胀、指腹萎缩在抗Scl-70抗体阳性组发生率分别为[90.5%(38/42),35.7%(15/42)]高于抗Scl-70抗体阴性组[58.9%(46/78),11.5%(9/78)],差异有统计学意义(χ2分别为12.901、9.973,P<0.01)。指尖溃疡在抗Scl-70抗体阳性组发生率为26.2%(11/42)高于抗Scl-70抗体阴性组5.1%(4/78),Fisher精确概率检验,P=0.002。皮肤异色症在抗Scl-70阳性组发生率为71.4%(30/42),高于抗着丝点抗体阳性组48.4%(15/31),差异有统计学意义(χ2=4.005,P<0.05)。指背硬化、指尖溃疡、指腹萎缩在抗Scl-70阳性组发生率分别为[92.9%(39/42),26.2%(11/42),35.7%(15/42)]高于抗着丝点抗体阳性组[58.1%(18/31),6.5%(2/31),9.7%(3/31)],Fisher精确概率检验,P值分别为0.001,0.034,0.013。抗着丝点抗体阳性组与抗着丝点抗体阴性组比较,差异无统计学意义。
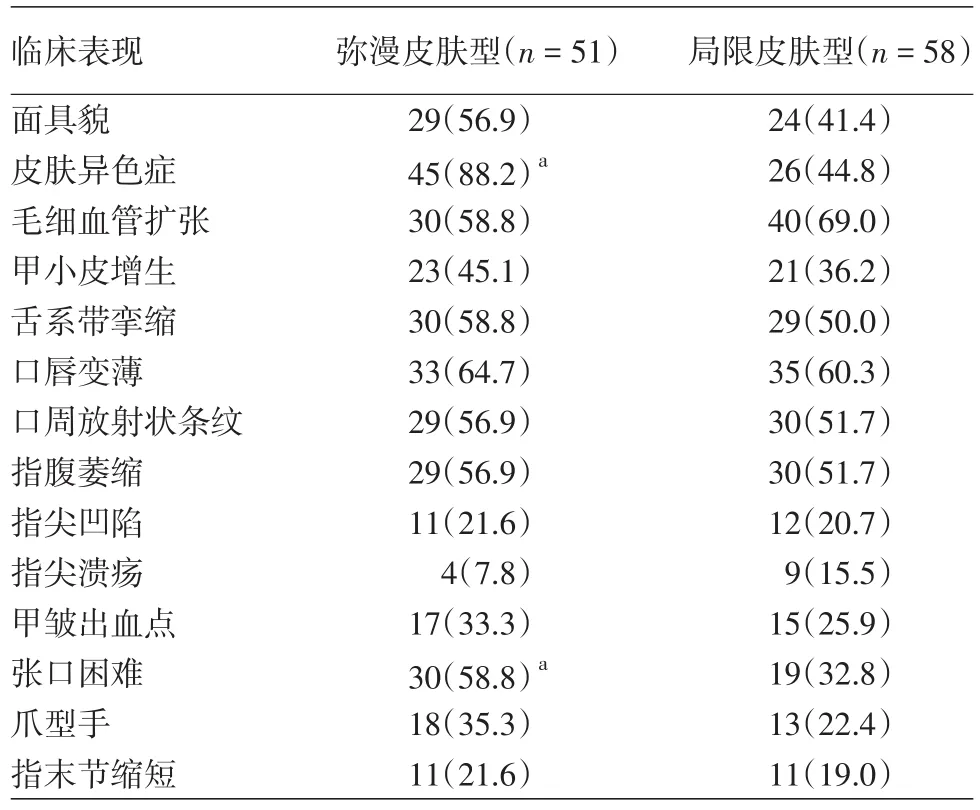
表1 系统性硬化病弥漫皮肤型与局限皮肤型患者皮损的比较[例(%)]
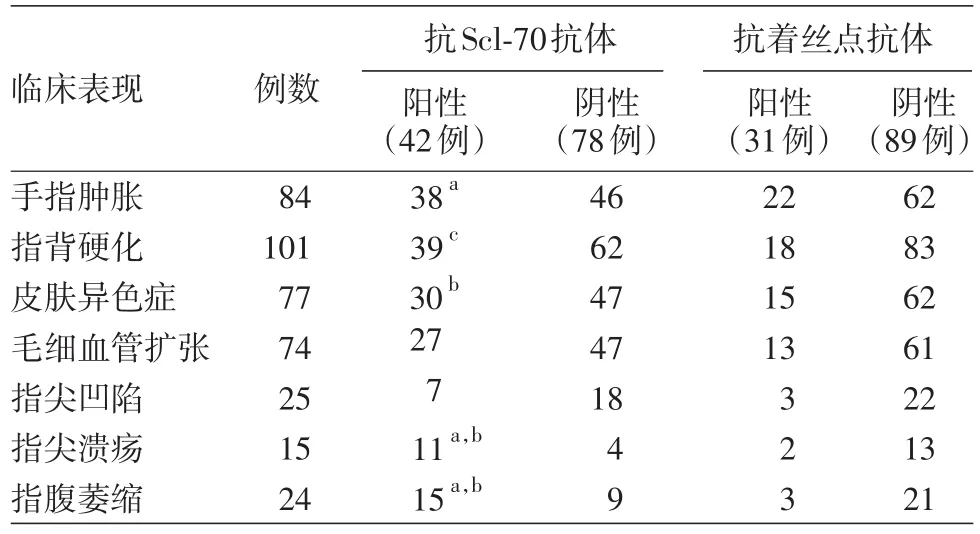
表2 系统性硬化病患者皮损与特异性抗体结果分析(例)
七、SSc患者皮损与内脏器官损害相关性的分析
将SSc患者皮损与内脏器官损害进行相关性分析,见表3。手指肿胀与肺动脉高压伴发率较高(χ2=7.051,P<0.01),指背硬化与肺动脉高压伴发率相关性较高(Fisher精确概率检验,P=0.018);毛细血管扩张、指尖凹陷、指尖溃疡与肺间质病变伴发率相关性较高(Fisher精确概率检验,P值分别为<0.01、<0.01、<0.05),差异均有统计学意义。指腹萎缩与心脏累及伴发率相关性较高,χ2=6.333,P<0.05P<0.05,差异有统计学意义。

表3 系统性硬化病患者皮损与内脏器官损害结果分析(例)
讨 论
SSc皮肤表现复杂,国内尚缺少对该病患者皮损细致的大样本研究。SSc患者的雷诺现象通常是该病最早出现的临床表现,在该病诊断前数年甚至数十年发生。临床上只要见到患者有肢端对称发生的雷诺现象,就应考虑到有该病的可能,可结合其他临床表现和自身抗体,如抗着丝点抗体、抗Scl-70抗体检测等作出早期诊断,且自身抗体阳性的SSc患者较自身抗体阴性的SSc患者内脏器官累及进展较快[7]。有报道,国内 419例 SSc患者中,59.7%dcSSc患者和40.3%的lcSSc患者抗Scl-70抗体阳性率为59.9%,抗着丝点抗体阳性率为13.4%;美国SSc患者中65.1%lcSSc和34.9%dcSSc,抗Scl-70抗体阳性率为18.7%,抗着丝点抗体阳性率为32.4%[8],而本组SSc患者,dcSSc占42.5%,lcSSc占48.3%;抗Scl-70抗体阳性者占35.0%,抗着丝点抗体阳性者占25.8%。本研究显示,国内SSc患者抗Scl-70抗体的阳性率比美国SSc患者该抗体的阳性率高,而抗着丝点抗体阳性率则相对较低,可能与本组患者多系住院患者,病情较重,弥漫型比例高有关。SSc患者的雷诺现象冬重夏轻,但不会消失,而系统性红斑狼疮的雷诺现象经过治疗可以消失并多年不发。Jaeger等[9]对695例SSc患者研究发现,雷诺现象发生2年后的SSc患者,约一半患者内脏器官损伤已经出现。此结果提示应积极对SSc患者的早期损害进行干预治疗,以改善患者预后。SSc患者的早期皮肤异色症样皮损与皮肌炎等的皮肤异色症样皮损难以区分,但经过一段时间,前者就会出现为以色素减退为主的皮肤异色症样皮损,毛囊处色素沉着(胡椒色),毛囊周围色素减退(盐的颜色),称为盐和胡椒征。SSc患者的毛细血管扩张好发于面颈部,躯干和上肢也常见,特点为绿豆或黄豆大小的小片状,云朵状,而不是通常的红血丝状。SSc患者的手指肿胀见于疾病早期,常同时有手指硬化,手指皮肤横纹可以消失。甲小皮增生不仅见于SSc患者,也见于其他结缔组织病患者,可能与手指组织缺氧有关。SSc患者的甲皱瘀点常见,在毛细血管镜或皮肤镜下,甲皱血管迂曲扩张,盘曲呈布袋样是其特点。SSc患者手部关节炎很容易发生指关节的屈曲畸形,形成爪形手,该畸形一旦形成则难以恢复,终生影响手部功能。所以,在SSc患者疾病早期积极治疗关节炎是避免手关节畸形的重要步骤。SSc患者的指尖凹陷、指尖溃疡、指尖萎缩性瘢痕和手指短缩都是手指反复发生雷诺现象导致手指缺血、缺氧引起的,是一个渐变的过程,严重的雷诺现象甚至能引起手指动脉的完全闭塞,不能舒张,导致一个或多个手指的部分或全部的缺血坏疽甚至脱落。除雷诺现象外,SSc患者的手指肿胀、指背硬化、皮肤异色症、毛细血管扩张、口唇变薄和口周放射状条纹、舌系带挛缩、张口困难、指尖凹陷、指尖溃疡、指腹萎缩、爪型手、指末节缩短也是该病的早期皮损,对于SSc诊断具有重要的提示作用,熟悉这些早期皮损,结合其他临床表现和实验室检查对SSc作出早期诊断,进而进行早期干预治疗,对于患者的预后很有帮助。
SSc患者可有心、肺、消化道、肾等内脏器官损害。部分内脏器官可发生于SSc早期。文献报道早期SSc患者可有肺间质病变[10],也可有食管、肛门直肠[11]及心脏累及[12]。2013 年美国风湿病学学会(ACR)和欧洲抗风湿病联盟(EULAR)联合制定的SSc新的分类标准中提出肺动脉高压和肺间质病变对于SSc诊断的重要性。肺间质病变或肺纤维化可累及 80%dcSSc[13]患者,而肺动脉高压可累及 15%SSc患者[14]。而我们观察到,120例SSc患者总肺间质病变发生率为50%(44/88),肺动脉高压发生率为35.7%(41/115)。SSc患者的皮损与内脏器官损害存在相关性,但迄今为止,国内外对SSc患者的皮损与内脏器官累及相关性研究少有报道,有报道指尖溃疡与胃肠道累及有显著相关性[15]。我们对SSc患者的某些皮损与内脏器官损害的相关性进行了研究,观察到肺动脉高压在疾病早期即会出现,指尖凹陷、指尖溃疡预示患者有肺间质病变的发生,指腹萎缩则预示有心脏累及的发生。这些提示临床,根据皮损去了解可能有相应的内脏器官损害发生,一旦确定,可尽早对脏器损害进行治疗,从而改善患者的预后。
[1] Denton CP,Khanna D.Systemic sclerosis[J].Lancet,2017,pii:S0140-6736(17)30933-9.DOI:10.1016/S0140-6736(17)30933-9.
[2] van den Hoogen F,Khanna D,Fransen J,etal.2013 classification criteria for systemic sclerosis:an American college of rheumatology/European league against rheumatism collaborative initiative[J].Arthritis Rheum,2013,65(11):2737-2747.DOI:10.1002/art.38098.
[3]LeRoy EC,Black C,Fleischmajer R,etal.Scleroderma(systemic sclerosis):classification,subsets and pathogenesis [J].J Rheumatol,1988,15(2):202-205.
[4] Steen VD,Medsger TA.Severe organ involvement in systemic sclerosiswith diffuse scleroderma[J].Arthritis Rheum,2000,43(11):2437-2444.DOI:10.1002/1529-0131(200011)43:11<2437:AID-ANR10>3.0.CO;2-U.
[5] Mathian A,Parizot C,Dorgham K,et al.Activated and resting regulatory Tcellexhaustion concurswith high levelsof interleukin-22 expression in systemic sclerosis lesions[J].Ann Rheum Dis,2012,71(7):1227-1234.DOI:10.1136/annrheumdis-2011-200709.
[6] Wangkaew S,Euathrongchit J,Wattanawittawas P,et al.Correlation of delta high-resolution computed tomography(HRCT)score with delta clinical variables in early systemic sclerosis(SSc)patients[J].Quant Imaging Med Surg,2016,6(4):381.DOI:10.21037/qims.2016.08.08.
[7] ValentiniG,Marcoccia A,CuomoG,etal.Early systemic sclerosis:analysis of the disease course in patients with marker autoantibody and/or capillaroscopic positivity[J].Arthritis Care Res(Hoboken),2014,66(10):1520-1527.DOI:10.1002/acr.22304.
[8]Wang J,Assassi S,Guo G,etal.Clinical and serological features of systemic sclerosis in a Chinese cohort[J].Clin Rheumatol,2013,32(5):617-621.DOI:10.1007/s10067-012-2145-7.
[9] Jaeger VK,Wirz EG,Allanore Y,etal.Incidencesand risk factors oforganmanifestations in the early course of systemic sclerosis:a longitudinal EUSTAR study[J].PLoS One,2016,11(10):e0163894.DOI:10.1371/journal.pone.0163894.
[10] Barskova T,Gargani L,Guiducci S,et al.Lung ultrasound for the screening of interstitial lung disease in very early systemic sclerosis[J].Ann Rheum Dis,2013,72(3):390-395.DOI:10.1136/annrheumdis-2011-201072.
[11] Lepri G,Guiducci S,Bellando-Randone S,et al.Evidence for oesophageal and anorectal involvement in very early systemic sclerosis(VEDOSS):report from a single VEDOSS/EUSTAR centre[J].Ann Rheum Dis,2015,74(1):124-128.DOI:10.1136/annrheumdis-2013-203889.
[12] ValentiniG,Cuomo G,Abignano G,etal.Early systemic sclerosis:assessment of clinical and pre-clinical organ involvement in patients with different disease features [J].Rheumatology(Oxford),2011,50(2):317-323.DOI:10.1093/rheumatology/keq176.
[13]Khanna D,Nagaraja V,Tseng C,etal.Predictors of lung function decline in scleroderma-related interstitial lung disease based on high-resolution computed tomography:implications for cohort enrichment in systemic sclerosis-associated interstitial lung disease trials[J].Arthritis Res Ther,2015,17(1):372.DOI:10.1186/s13075-015-0872-2.
[14] Nihtyanova SI,Schreiber BE,Ong VH,et al.Prediction of pulmonary complications and long-term survival in systemic sclerosis[J].Arthritis Rheumatol,2014,66(6):1625-1635.DOI:10.1002/art.38390.
[15]BruniC,Guiducci S,Bellando-Randone S,et al.Digital ulcers as a sentinel sign for early internal organ involvement in very early systemic sclerosis[J].Rheumatology(Oxford),2015,54(1):72-76.DOI:10.1093/rheumatology/keu296.
