不同分型二叶式主动脉瓣间超声与临床特征比较
2018-03-06魏丽群李一丹孔令云孙兰兰姜维吕秀章
魏丽群,李一丹,孔令云,孙兰兰,姜维,吕秀章
二叶式主动脉瓣(BAV)是最常见的先天性心脏病,也是遗传性心脏病中最常见的类型,在主动脉瓣膜置换术中居首位,其患病率约0.5%~2%,男女发病比例约为3:1[1,2]。BAV并非表现为瓣膜畸形的单一特征疾病,而是常伴各种主动脉相关并发症,导致了不同的临床转归和预后,如:主动脉瓣钙化、狭窄(AS)、反流(AR)、感染性心内膜炎、主动脉增宽、主动脉瘤、主动脉夹层等[3,4]。最近,国外研究将BAV根据主动脉瓣膜融合类型分为:右冠瓣和无冠瓣融合(R-N型)、左冠瓣和右冠瓣融合(R-L型)及左冠瓣和无冠瓣融合(L-N型),发现不同瓣膜融合类型BAV对并发主动脉瓣膜功能障碍类型和主动脉增宽部位具有潜在预测价值[5,6]。本研究通过回顾分析北京朝阳医院230例BAV患者的相关临床及超声心动图数据,统计研究三种不同瓣膜融合类型BAV患者的潜在差异,旨在为临床管理分层提供参考,减低BAV患者的病残率和死亡率。
1 资料和方法
1.1 研究对象 回顾分析2011年1月~2017年1月期间于北京朝阳医院门诊、急诊及住院部诊断为二叶式主动脉瓣畸形的256例患者,工作站系统内收集其临床资料及超声心动图参数。纳入标准:经胸超声心动图明确诊断为二叶式主动脉瓣畸形且对主动脉瓣瓣叶融合方式有明确描述者,收集临床资料及超声心动图参数包括:年龄、性别、血压、心腔及大血管内径、瓣膜形态及功能、心室舒缩功能及多普勒血流等。排除标准:①左室收缩功能(LVEF)<50%者;②瓣膜融合类型诊断不明确及未确定二叶式主动脉瓣狭窄/反流程度者;③图像不清晰或超声心动图资料不完整者。本研究最终入选患者230例,年龄10~85岁,平均(52.62±15.08)岁,其中男性132例、女性98例。多次行超声心动图检查者资料以其首次结果为准。
1.2 仪器和方法 采用PHILIPS EPIQ 7C、PHILIPS iE 33、Siemens SC 2000等彩色多普勒超声诊断仪,经胸超声心动图探头频率2.5~3.5 MHz。嘱患者取左侧卧位,在胸骨旁左室长轴、大动脉短轴及心尖四腔、心尖五腔及剑下大动脉根部等多切面扫查,观察主动脉瓣瓣膜的形态、数目、结构及启闭情况,应用彩色多普勒及频谱多普勒观察AS及AR情况并判断其程度,测量主动脉窦部直径和升主动脉内径等。
1.3 诊断标准及分组
1.3.1 依据二叶式主动脉瓣膜融合类型分为三组右冠瓣与无冠瓣融合(R-N)型127例、左冠瓣与右冠瓣融合(R-L)型89例和左冠瓣与右冠瓣融合(L-N)型14例(图1~3)。
1.3.2 依据年龄将患者分为两组 低龄(<50岁)组83例和高龄(≥50岁)组147例。
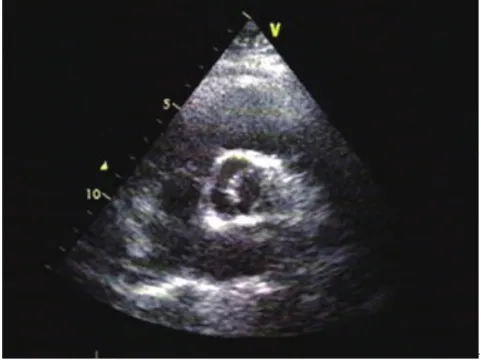
图1 右冠瓣与无冠瓣融合(R-N)型BAV患者主动脉瓣短轴切面
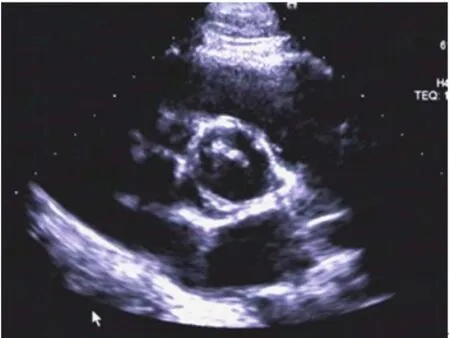
图2 左冠瓣与右冠瓣融合(R-L)型BAV患者主动脉瓣短轴切面
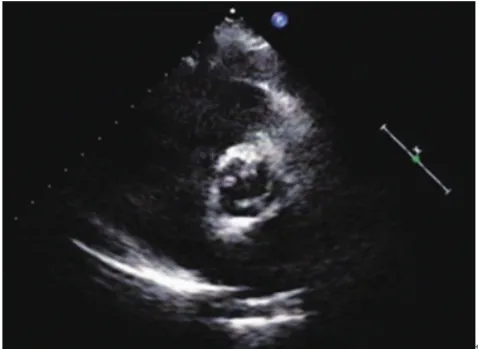
图3 左冠瓣与无冠瓣融合(L-N)型BAV患者主动脉瓣短轴切面
1.3.3 依据2014美国心脏病学会基金会/美国超声心动图学会(AHA/ACC)超声心动图指南 AR评估标准根据反流束宽度与左心室流出道直径比值分级:轻度(<25%)、中度(25%~64%)、重度(>65%)。AS评估标准根据最大跨瓣膜速度(Vmax)和平均跨主动脉瓣压力阶差分级:轻度AS:Vmax 2.0~2.9 m/s、平均跨瓣压差<20 mmHg(1 mmHg=0.133 kPa);中度AS:Vmax3.0~3.9 m/s、平均跨瓣压差20~39 mmHg;严重AS:Vmax>4.0 m/s、平均跨瓣压差≥40 mmHg[7]。
1.3.4 依据主动脉窦直径(DSTJ)和升主动脉直径(Dasc)分为两组 DSTJ≥Dasc为Type N(Normal shape)组40例;DSTJ<Dasc为Type A(Ascending distension)组190例。在标准左室长轴切面测量的升主动脉内径>36 mm为升主动脉增宽,在标准左室长轴切面测量的主动脉窦部内径>36 mm为主动脉窦部增宽[8]。统计并分析比较各组患者间临床及超声心动图检查资料。
1.4 统计学处理 使用SPSS 17.0统计软件进行数据分析,定量资料以均数±标准差(±s)表示,组间比较正态分布采用t检验和单因素方差分析,非正态分布采用秩和检验。计数资料采用例数(构成比)表示,组间比较采用χ2检验或Fisher检验。采用双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况比较 本研究最终纳入患者230例,年龄10~85岁,平均(52.62±15.08)岁,其中男性132例,平均年龄为(51.23±15.34)岁,女性98例,平均年龄为(54.45±14.01)岁,男女比为1.35:1。
BAV患者R-N型、R-L型及L-N型间年龄、性别、血压均无显著统计学差异(表1)。全组中,年龄与主动脉窦部内径、升主动脉内径、室间隔厚度、左室后壁厚度及收缩期主动脉瓣最大流速均呈低度相关(r=0.357/P=0.000、r=0.493/P=0.000、r=0.408/P=0.000、r=0.338/P=0.000、r=0.456/P=0.000)(表1)。
R-L型主动脉窦部内径较R-N型显著增宽(t=-2.663,P=0.008),R-N型升主动脉内径宽于R-L型,但并无显著差异(t=0.122,P=0.125)。L-N型与另外两组间各项基本资料均无显著差异(P>0.05)(表1)。
2.2 BAV患者不同瓣膜融合类型间AS和AR的比较 230例BAV患者中,并发AS者158例(68.7%),平均年龄(56.85±12.94)岁,其中男性86例(54.4%);并发AR者83例(36.1%),平均年龄(51.08±16.36)岁,其中男性52例(62.7%);无AS或AR者39例(17.0%)。BAV患者中并发AR者比并发AS者更年轻(t=2.788,P=0.006)。AR、AS组内均男性较多,但组间性别差异无统计学意义(χ2=1.502,P=0.220)。
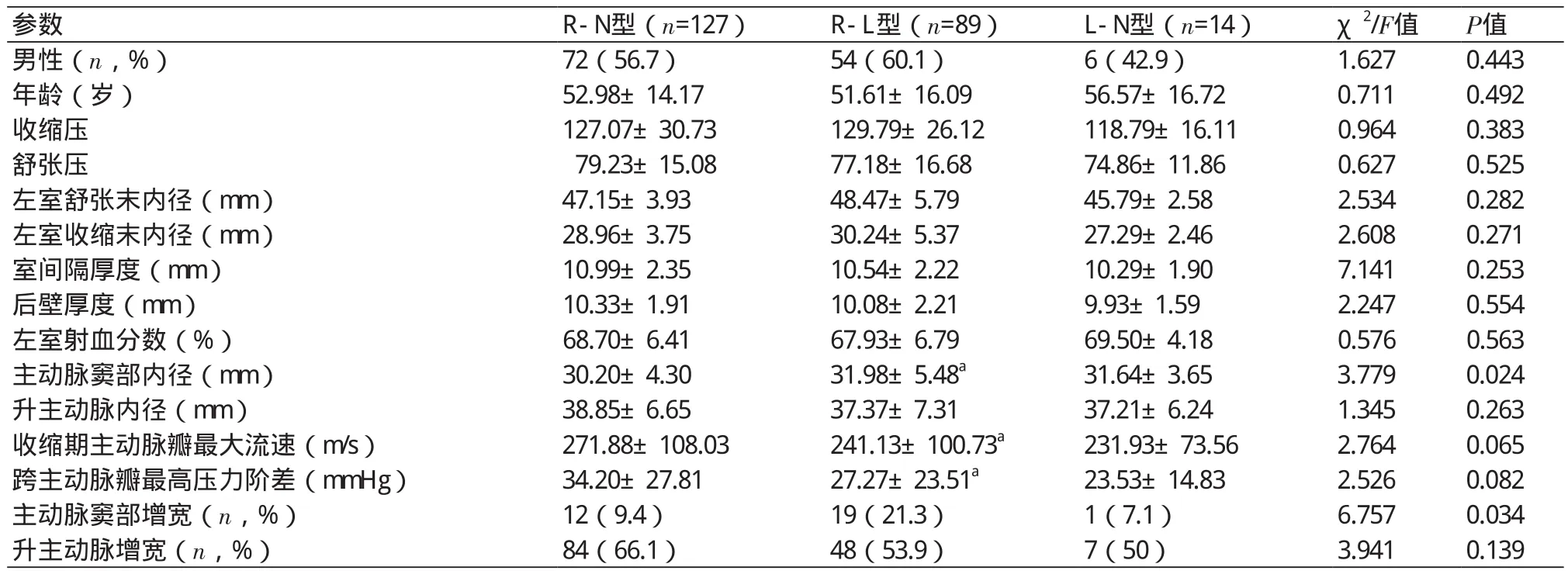
表1 BAV患者不同分型间基线临床与超声资料比较
低龄组83例,并发AS者37例(44.6%)、AR者37例(44.6%);高龄组147例,并发AS者121例(82.3%)、AR者36例(24.5%)。高龄组中AS(轻、中或重度)的占比显著高于低龄组(χ2=39.522,P=0.001)。低龄组AR(轻度)占比高于高龄组,而高龄组中AR(无、中或重度)者占比显著高于低龄组(χ2=8.697,P=0.034)(表2)。
R-N型127例,并发AS者93例(73.2%)、AR者36例(28.3%);R-L型89例,并发AS者55例(61.8%)、AR者44例(49.4%);L-N型14例,并发AS者10例(71.4%)、AR者3例(21.4%)。R-L型AR(轻、中或重度)的占比均显著高于R-N型(χ2=10.612,P=0.014)。R-N型AS(轻、中或重度)患者的占比均高于R-L型,但并无统计学意义(χ2=5.990,P=0.424)。但R-N型患者收缩期主动脉瓣最大流速、跨主动脉瓣最高压力阶差均显著高于R-L型(P=0.036)。而R-N型升主动脉内径、左室舒张末内径、左室收缩末内径、室间隔厚度、后壁厚度、左室射血分数均与R-L型均无显著差异(P均>0.05)。L-N型AS、AR各程度占比均与R-N型或R-L型无明显差异(χ2=0.968,P=0.809;χ2=1.384,P=0.223)(表2)。
2.3 主动脉Type分组间BAV患者情况 Type N组40例,平均年龄为(45.28±15.33)岁,男女比例为2.08:1;Type A组190例,平均年龄为(54.23±14.59)岁,男女比例为1.24:1。Type A组年龄较Type N组更大(t=-3.498,P=0.001)。Type N组主动脉窦部内径及增宽例数显著大于Type A组,Type A组中升主动脉增宽内径及增宽例数显著大于Type N组(P<0.05)。
R-N、R-L及L-N型患者中,Type A(111例/87.4%,68例/76.4%,11例/78.6%)分别较Type N(16例/12.6%,21例/23.6%,3例/21.4%)更常见,但组间分布并无统计学意义(χ2=4.574,P=0.102)。R-N型Type A组患者例数最多,且主动脉窦增宽占比最少、升主动脉增宽占比最多(表3、图4)。
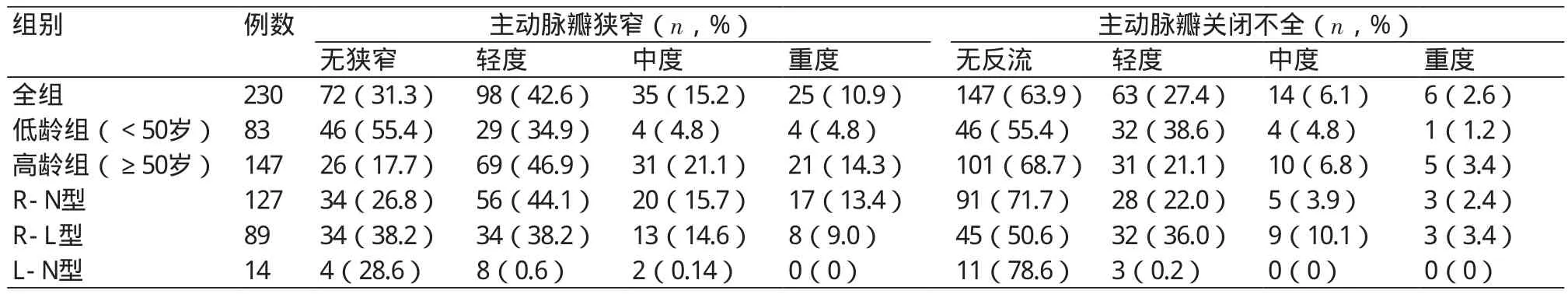
表2 不同瓣膜融合类型BAV患者间主动脉瓣狭窄(AS)和主动脉瓣关闭不全(AR)程度比较
3 讨论
二叶式主动脉瓣(BAV)遗传机制复杂,为进一步研究其发病机制和临床表现的差异,近年来有关BAV分型的临床研究愈来愈成为国际热点。超声心动图以其无创、易行、重复性好的优点,是临床上筛查、诊断与随访BAV患者的首选影像学检查。其观察范围包括主动脉瓣膜形态及病变程度、主动脉增宽范围及扩张程度等,对BAV患者的分层管理、治疗决策等尤为重要。本研究收集230例患者的超声心动图和相关临床资料参数,探究不同瓣膜融合类型间的差异。
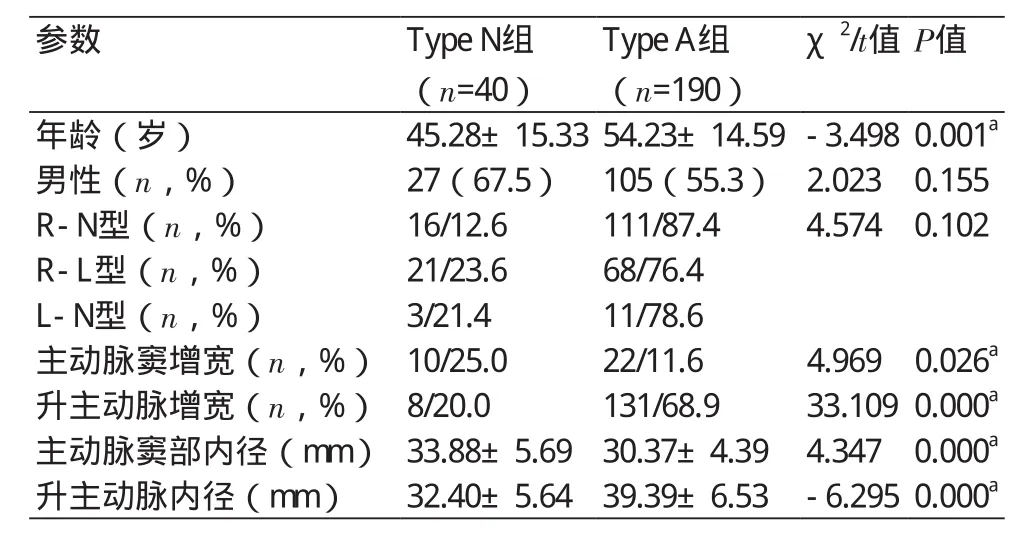
表3 Type N组与Type A组间BAV患者情况比较
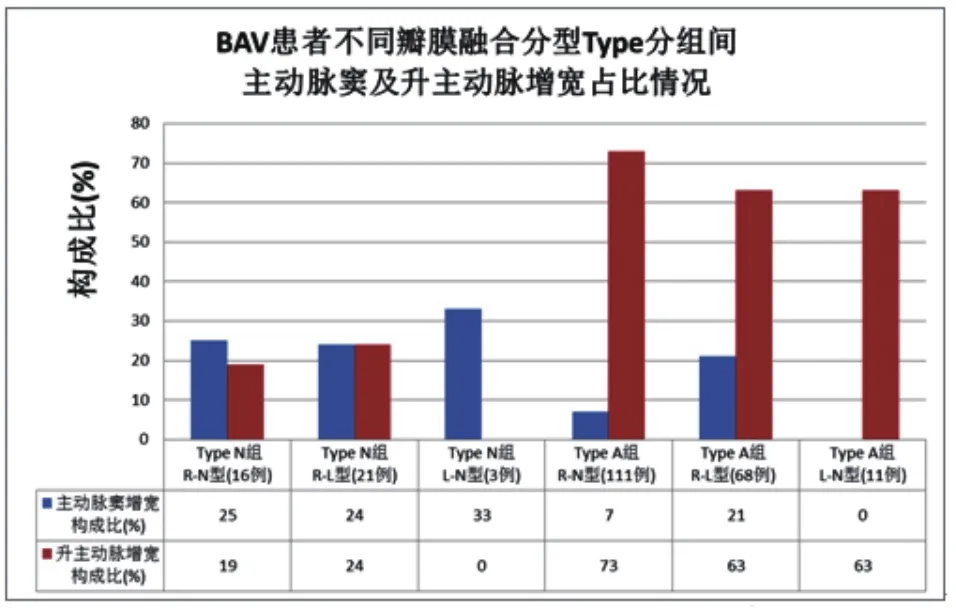
图4 BAV患者不同瓣膜融合分型Type分组间主动脉窦及升主动脉增宽占比情况
以往将二叶式主动脉瓣分为前后、左右型,分型较为粗略。目前,国外研究将BAV患者分型依据瓣膜融合嵴或瓣叶位置,分为右冠瓣与无冠瓣融合(R-N)型、左冠瓣与右冠瓣融合(R-L)型及左冠瓣与无冠瓣融合(L-N)型。国外以R-L型居多,其次为R-N型,而L-N型仅占3%,男女比例约为3:1[8-10]。本研究BAV患者230例,包括R-N型127例、R-L型89例及L-N型14例,男女比例为1.35:1,构成本差异可能与种族遗传或入组偏倚性有关。
年龄是影响BAV患者病情进展的重要因素。多数BAV患者年幼时并无瓣膜损害,但瓣叶形态异常、位置偏移及血流受阻,易出现湍流而致流速增高,随年龄增长,瓣膜受血流冲击,致内皮细胞受损、炎症反应及脂蛋白沉积等,引起瓣膜增厚,逐渐纤维化、钙化,产生主动脉瓣狭窄或反流,加重血流动力学及形态学变化,并影响左室及主动脉形态[11,12]。本研究中年龄与主动脉窦部内径、升主动脉内径、室间隔厚度、左室后壁厚度、收缩期主动脉瓣最大流速均呈低度相关,高龄组AS(轻、中或重度)及AR(中、重度)占比显著高于低龄组,考虑与增龄性瓣膜及主动脉扩张有关。
近年来有研究显示,BAV患者病程进展各异,不同瓣膜融合类型的主动脉瓣并发症发病率和主动脉增宽位置有显著差异[14,15]。
首先,BAV患者瓣膜分型的差异可能在一定程度预测瓣膜潜在的功能障碍,有研究报道R-L型BAV患者多发AR,而R-N型者多发AS[14]。本研究中,BAV患者并发AS者158例(68.7%),平均年龄(56.85±12.94)岁,男性占54.4%;并发AR者83例(36.1%),平均年龄(51.08±16.36)岁,男性占62.6%。可见BAV患者并发AS者更常见,并发AR者相较AS更年轻且男性更多,与国外报道相一致[1,13]。本研究显示,R-L型中AR(轻、中或重度)均显著多于R-N型。R-N型AS(轻、中或重度)均多于R-L型,但无统计学意义,可能与各型BAV患者主动脉瓣钙化均较正常人进展性更快,而瓣膜狭窄比反流更容易受到瓣膜钙化影响有关。由于L-N型BAV患者极少,国外研究甚少,而本研究显示,L-N型BAV的AS、AR各程度占比均与R-N型或R-L型无明显差异。
其次,近年研究认为胚胎期BAV的形成源于基因突变所致的细胞迁移、信号转换的改变及非遗传因素如主动脉瓣血流动力学异常等,而升主动脉和主动脉瓣都来源于神经脊细胞,它的异常迁徙可能同时导致BAV不单为瓣膜畸形,其临床病症涉及主动脉瓣环、主动脉窦、升主动脉及左室流出道[11,15]。BAV患者中主动脉扩张者占35%~84%,发生主动脉夹层或破裂的风险为正常人的5~10倍,升主动脉进行性扩张率为0.2~1.9 mm/年,而主动脉瓣形态正常时仅为0.07~0.2 mm/年,即便BAV患者行主动脉瓣置换术后,改善了高速湍流的血流动力学,升主动脉仍会进行性扩张[16-18]。本研究结果中,收缩期主动脉瓣最大流速与主动脉窦部内径无相关性,与升主动脉内径相关性极低,考虑BAV患者不仅存在后天进行性血流动力学障碍,更与先天基因突变导致主动脉发育缺陷有关,致使升主动脉管壁出现中层平滑肌细胞过早凋零以及弹性纤维不规则变性、坏死及黏液性退变有关。目前,国内外研究提出BAV患者不同瓣膜融合类型导致主动脉不同部位管壁剪切应力的增加与血管壁重塑:R-L型向主动脉右前侧壁射血,致主动脉根部(包括主动脉瓣环、窦部及窦管交界)扩张及管状升主动脉非对称性扩张;R-N型向主动脉壁右后侧射血,使后方主动脉壁剪切应力增加致升主动脉及主动脉弓扩张, R-N型比R-L型过瓣湍流偏心性更大,管壁剪切应力更大,震荡剪切应力更低[19-21]。Schaefer等研究发现R-L型BAV主动脉窦部更宽,而R-N型升主动脉更宽[22]。本研究显示,R-L型主动脉窦部较R-N型患者显著增宽,R-N型患者升主动脉宽于R-L型,但无显著差异,可能与升主动脉内径较主动脉窦部内径更容易受到患者年龄、血压等因素影响有关。
最后,本研究为进一步探究BAV不同瓣膜融合分型组内不同主动脉增宽位置的占比,将患者分为主动脉窦部较宽组和升主动脉较宽组。可见,BAV患者不同瓣膜融合分型(R-N、R-L及L-N型)中,患者升主动脉内径大于主动脉窦部(Type A组)均更常见,Type A组年龄较Type N组更大。全组中R-N型Type A的患者占比最多,且该组主动脉窦增宽最少、升主动脉增宽最多。本研究的局限性在于:①超声心动图检查参数仅涉及主动脉窦及升主动脉,未采集主动脉瓣环、主动脉弓、胸主动脉及腹主动脉数据,但据Cecconi等[23]研究, BAV患者主动脉扩张部位多为主动脉根部和升主动脉,由于血流速度减低等原因涉及主动脉弓及胸腹主动脉增宽较少;②本研究未对主动脉瓣融合嵴的有无进一步分类,但据Keane等[24]报道,BAV患者瓣膜融合嵴存在与否与升主动脉内径无显著相关性;③本研究为单中心近六年来检查回顾,有一定选择偏倚性,且LN型BAV患者样本量较少,有待未来大规模临床多中心实验的进一步前瞻性研究。
本研究显示,BAV患者R-L型较R-N型更易发主动脉瓣反流及主动脉窦增宽,L-N型与前两者比较均未见明显差异,BAV患者中R-N型Type A组最常见。准确判断BAV患者的解剖分型,对主动脉瓣膜合并症类型及主动脉增宽位置有一定预测价值,为不同瓣膜融合分型BAV患者的主动脉疾病危险分层和管理干预提供了重要依据。
[1]Sabet HY,Edwards WD,Tazelaar HD,et al. Congenitally bicuspid aortic valves: a surgical pathology study of 542 cases (1991 through 1996) and a literature review of 2,715 additional cases[J]. Mayo Clin Proc,1999,74(1):14-26.
[2]Wang L,Ming Wang L,Chen W,et al. Bicuspid Aortic Valve: A Review of its Genetics and Clinical Significance[J]. J Heart Valve Dis,2016,25(5):568-73.
[3]Roberts WC,Vowels TJ,Ko JM. Natural history of adults with congenitally malformed aortic valves (unicuspid or bicuspid) [J].Medicine,2012,91(6):287-308.
[4]Alegret JM,Duran I,Palazon O,et al. Prevalence of and predictors of bicuspid aortic valves in patients with dilated aortic roots[J]. Am J Cardiol,2003,91(5):619-22.
[5]DeCampli WM. Ascending aortopathy with bicuspid aortic valve: More,but not enough, evidence for the hemodynamic theory[J]. J Thorac Cardiovasc Surg,2017,153(1):6-7.
[6]Cannata A,Russo CF,Martinelli L. Relationship between bicuspid aortic valve morphology and aortic wall degeneration: further evidence is emerging[J]. Echocardiography,2010,27(8):1028.
[7]Nishimura RA,Otto CM,Bonow RO,et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J]. Circulation,2014,129(23):e521-643.
[8]Goldstein SA,Evangelista A,Abbara S,et al. Multimodality imaging of diseases of the thoracic aorta in adults: from the American Society of Echocardiography and theEuropean Association of Cardiovascular Imaging: endorsed by the Society of Cardiovascular Computed Tomography and Societyfor Cardiovascular Magnetic Resonance[J]. J Am Soc Echocardiogr,2015,28(2):119-82.
[9]Merkx R,Duijnhouwer AL,Vink E,et al. Aortic diameter growth in children with a bicuspid aortic valve[J]. Am J Cardiol,2017,120(1):131-6.
[10]Yijian Li,Xin Wei,Zhengang Zhao,et al. Prevalence and Complications of Bicuspid Aortic Valve in Chinese According to Echocardiographic Database[J]. Am J Cardiol,2017,120(2):287-91.
[11]Padang R,Bannon PG,Jeremy R,et al. The genetic and molecular basis of bicuspid aortic valve associated thoracic aortopathy: a link to phenotype heterogeneity[J]. Ann Cardiothorac Surg,2013,2(1):83-91.
[12]Rajamannan NM. Bicuspid aortic valve disease:the role of oxidative stress in Lrp5 bone formation[J]. Cardiovasc Pathol,2011,20(3):168-76.
[13]Michelena HI,Suri RM,Katan O,et al. Sex differences and survival in adults with bicuspid aortic valves:verification in 3 contemporary echocardiographic cohorts[J]. J Am Heart Assoc,2016,5(10): e004211.
[14]Huang FQ,Le Tan J. Pattern of aortic dilatation in different bicuspid aortic valve phenotypes and its association with aortic valvular dysfunction and elasticity[J]. Heart Lung Circ,2014,23(1):32-8.
[15]Verma S,Siu SC. Aortic dilatation in patients with bicuspid aortic valve[J]. N Engl J Med,2014,370(20):1920-9.
[16]Losenno KL,Goodman RL,Chu MW. Bicuspid aortic valve disease and ascending aortic aneurysms: gaps in knowledge[J]. Cardiol Res Pract,2012,2012:145202.
[17]Patel HJ,Deeb GM. Ascending and arch aorta: pathology, natural history, and treatment[J]. Circulation,2008,118(2):188-95.
[18]Kumar GV,Mathew L. Effects of design parameters on the radial force of percutaneous aortic valve stents[J]. Cardiovasc Revasc Med,2010,11(2):101-4.
[19]Mahadevia R,Barker AJ,Schnell S,et al. Bicuspid aortic cusp fusion morphology alters aortic 3D outflow patterns,wall shear stress and expression of aortopathy[J]. Circulation,2014,129(6):673-82.
[20]Hope MD,Hope TA,Crook SE,et al. 4D flow CMR in assessment of valve-related ascending aortic disease[J]. JACC Cardiovasc Imaging.2011, 4(7):781-7.
[21]Longobardo L, Jain R, Carerj S,et al. Bicuspid Aortic Valve: Unlocking the Morphogenetic Puzzle[J]. Am J Med,2016,129(8):796-805.
[22]Miskowiec DL,Lipiec P,Kasprzak JD. Bicuspid aortic valve morphology and its association with aortic diameter: an echocardiographic study[J].Kardiol Pol,2016, 74(2):151-8.
[23]Cecconi M,Manfrin M,Moraca A,et al. Aortic dimensions in patients with bicuspid aortic valve without significant valve dysfunction[J]. Am J Cardiol,2005,95(2):292-4.
[24]Keane MG,Wiegers SE,Plappert T,et al. Bicuspid aortic valves are associated with aortic dilatation out of proportion to coexistent valvular lesions[J]. Circulation, 2000,102(19 Suppl 3):III35-9.
