植物油中邻苯二甲酸酯类化合物的一步萃取方法
2018-03-05金香子高汉勇邹依霖李婉莹郭子钰孙华泽赵锦花李东浩
金香子, 高汉勇, 王 钊, 邹依霖, 李婉莹, 郭子钰, 孙华泽, 赵锦花, 李东浩
(延边大学化学系, 长白山生物资源与功能分子教育部重点实验室, 吉林 延吉 133002)
邻苯二甲酸酯(phthalate esters, PAEs)是一类广泛应用于工业高分子材料的塑化剂,在生产过程中添加可增加材料的柔软性,是必不可少的材料助剂。因其添加过程不属于化学键结合,在产品的生产、运输、销售过程中极易从包装材料中迁移,污染食品。PAEs可导致人体内分泌紊乱、生殖系统异常、畸胎、癌症等安全问题[1]。此类物质具有亲脂性,食用油更易受到PAEs的污染,已有研究报道植物油中PAEs超标率达20.8%[2],因此检测食用油中的PAEs尤为重要。
植物油的基质特殊,含有大量的甘油三酯与其他脂肪类伴随物。此类物质溶于有机溶剂,与目标物共萃取,随之进入色谱柱快速饱和并降解,影响PAEs的准确定量分析。因此干扰物质的净化被认为是检测植物油中PAEs的重点与难点。植物油样品中PAEs等有机污染物的常用前处理方法有基制分散固相萃取[3]、固相萃取[4-6]、凝胶渗透色谱法[7,8]等,但普遍存在检测时间长、操作繁琐、基质干扰强、使用有机溶剂量大等不足[9-11],无法实现植物油中PAEs等痕量有机污染物的快速检测,急需建立一种高效、快速、实用的一步检测方法。气液微萃取(GLME)是基于气流吹扫微萃取技术(GP-MSE)[12]的一种集萃取、净化、浓缩为一步的前处理方法,利用目标物与干扰物质的沸点差异进行萃取及富集,其原理与色谱相似,可以对复杂样品中挥发性及半挥发性成分进行分析[13-15]。
本研究通过气液微萃取技术联用GC-MS,建立了植物油中PAEs的快速检测方法,旨在实现植物油中PAEs等有机污染物的一步快速分析,满足此类样品的现场快速检测要求,为我国食品安全检测提供新方法。
1 实验部分
1.1 仪器与试剂
QP2010-Ultra气相色谱-质谱仪,日本岛津公司;ME-101气液微萃取仪,北本电器(中国)有限公司。
正己烷,色谱纯,美国Thermo Fisher公司;邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二异丁酯(DIBP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸(2-甲氧基)乙酯(DMEP)、邻苯二甲酸二(4-甲基-2-戊基)酯(BMPP)、邻苯二甲酸二(2-乙氧基)乙酯(DEEP)、邻苯二甲酸二戊酯(DPP)、邻苯二甲酸二己酯(DHXP)、邻苯二甲酸丁基苄基酯(BBP)、邻苯二甲酸二(2-丁氧基)乙酯(DBEP)、邻苯二甲酸二环己酯(DCHP)、邻苯二甲酸二(2-乙基)己酯(DEHP)、邻苯二甲酸二正辛酯(DNOP)、邻苯二甲酸二壬酯(DNP)等15种邻苯二甲酸酯混合标准溶液(质量浓度为100 mg/L),德国Dr. Ehrenstorfer公司;磷酸三苯酯(triphenyl phosphate, TPP)为替代内标,氘代菲(phenanthrene-D10,Phe-D10)为仪器内标,其质量浓度均为100 mg/L,美国Accustandard公司。
1.2 供试样品
大豆油、调和油、香油与橄榄油样品均购自当地市场,常温密封保存,备用。
1.3 实验方法
1.3.1 标准溶液配制
移取100 mg/L的15种邻苯二甲酸酯混合标准溶液1.00 mL,用正己烷定容至10 mL,配制成10 mg/L标准储备液。移取TPP标准品1.00 mL,用正己烷定容至10 mL,配制成10 mg/L内标标准溶液。准确移取仪器内标Phe-D10标准品1.0 mL,用正己烷定容至10 mL与100 mL,各配制成10 mg/L与1 mg/L标准储备液。配制的标准储备液均于4 ℃冰箱保存备用。
准确吸取混合标准储备液(10 mg/L),用正己烷逐级稀释,配制成质量浓度分别为1、5、10、50、100、200、500、1 000、2 000 μg/L的系列标准溶液,同时加入替代内标与仪器内标储备液(10 mg/L),使内标质量浓度均为200 μg/L,采用内标法定量。
1.3.2 样品前处理
称取0.1 g试样(精确至0.001 g),加入到样品管中,加入替代内标20 μL,取50 μL正己烷加入到200 μL衬管里作为接收相。设定萃取温度300 ℃、气流流速2 mL/min、冷凝温度-4 ℃、萃取时间5 min等条件,萃取结束后样液体积约为80 μL,加入20 μL 1 mg/L的仪器内标,定容至100 μL,混匀,用于气相色谱-质谱测定。
1.3.3 GC-MS条件
色谱柱:DB-5MS石英毛细管色谱柱(30 m×0.25 mm×0.25 μm);载气:高纯(99.999%)氦气,柱流速1.34 mL/min;进样量:2.00 μL,不分流进样;进样口温度:260 ℃;电离模式:电子轰击(EI),轰击能量:70 eV;色谱柱温度程序:60 ℃保持1 min,然后以20 ℃/min程序升温至220 ℃,保持1 min,再以5 ℃/min升温至250 ℃,保持1 min,再以20 ℃/min升温至290 ℃,保持7.5 min。选择离子监测(SIM):每种化合物分别选择一个定量离子,2个定性离子。每组所有需要检测的离子按出峰顺序,分时段分别检测见表1。

图 1 加热温度及萃取时间对萃取效果的影响Fig. 1 Effects of heating temperature and extraction time on the extraction
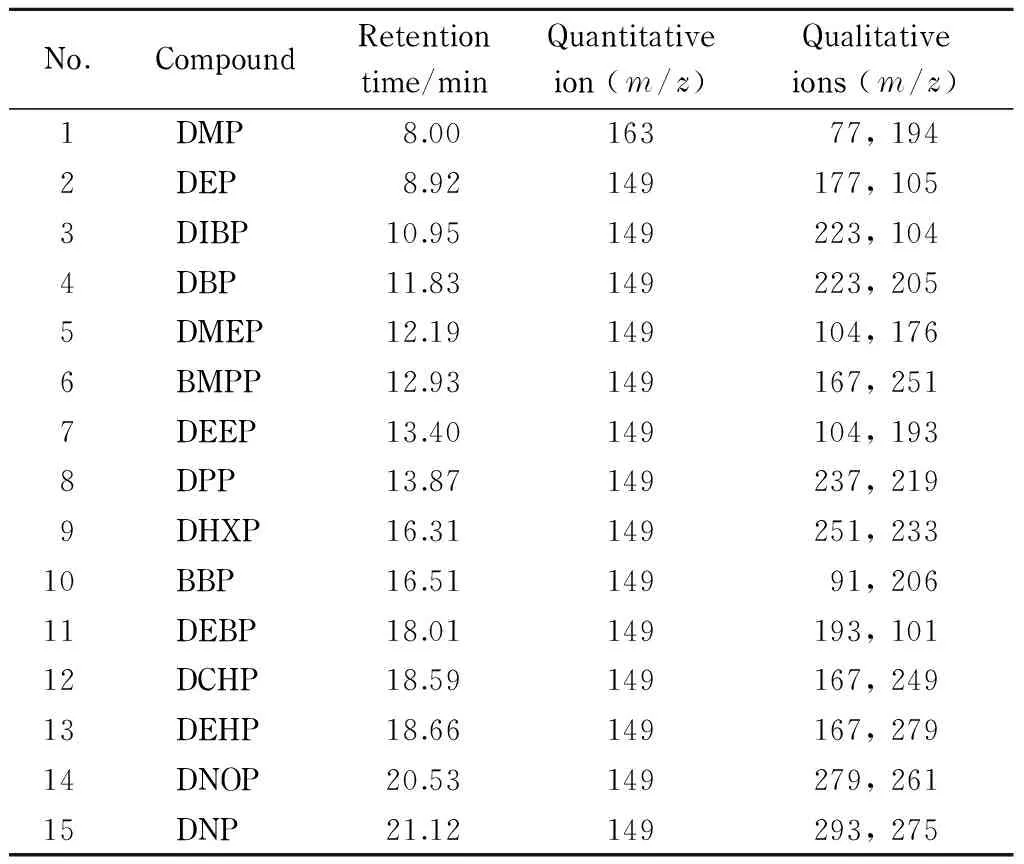
No.CompoundRetentiontime/minQuantitativeion(m/z)Qualitativeions(m/z)1DMP8.0016377,1942DEP8.92149177,1053DIBP10.95149223,1044DBP11.83149223,2055DMEP12.19149104,1766BMPP12.93149167,2517DEEP13.40149104,1938DPP13.87149237,2199DHXP16.31149251,23310BBP16.5114991,20611DEBP18.01149193,10112DCHP18.59149167,24913DEHP18.66149167,27914DNOP20.53149279,26115DNP21.12149293,275
DMP: dimethyl phthalate; DEP: diethyl phthalate; DIBP: diisobutyl phthalate; DBP: dibutyl phthalate; DMEP: bis(2-methoxyethyl) phthalate; BMPP: bis(4-methyl-2-pentyl) phthalate; DEEP: bis(2-ethoxyethyl) phthalate; DPP: dipentyl phthalate; DHXP: dihexyl phthalate; BBP: benzyl butyl phthalate; DBEP: bis(2-n-butoxyethyl) phthalate; DCHP: dicyclohexyl phthalate; DEHP: bis(2-ethylhexyl) phthalate; DNOP: di-n-octyl phthalate; DNP: dinonyl phthalate.
1.3.4 基质加标试验
称取样品并加入20 ng 15种PAEs混合标准溶液,按照1.3.2节和1.3.3节进行前处理与分析。每个样品重复3次,计算回收率与相对标准偏差(RSD)。
2 结果与讨论
2.1 萃取条件的优化
采用加标回收率试验考察加热温度及萃取时间对4种代表性PAEs萃取效果的影响,结果见图1。由图1可知,在300 ℃条件下DMP、DBP、DEHP及DNP在萃取时间为5 min内即可达到85%以上的回收率(87.6%~96.7%),因此选择萃取加热温度为300 ℃,萃取时间为5 min。
2.2 GLME净化效果
图2是调和油加标样品的总离子流色谱图(TIC)。从图2可见GLME可以有效减少调和油样品中的干扰物质,达到良好的萃取效果。通过SIM监测(见图3),15种目标化合物峰形良好,可以满足定性及定量要求。

图 2 未萃取及采用GLME技术一步萃取15种PAEs加标样品的总离子流色谱图Fig. 2 Total ion chromatograms (TIC) of a sample spiked with the 15 PAEs with or without one-step extraction of gas-liquid micro-extraction (GLME)

图 3 采用GLME技术一步萃取15种PAEs加标样品的选择离子流色谱图Fig. 3 Selected ion chromatograms of the 15 PAEs in a spiked blend sample with GLME
2.3 15种PAEs的线性关系及检出限
15种PAEs的线性回归方程、相关系数(r2)、线性范围、仪器检出限(LOD,S/N=3)及定量限(LOQ,S/N=10)见表2。

表 2 15种PAEs的回归方程、相关系数、线性范围、仪器检出限及定量限Table 2 Regression equations, correlation coefficients (r2), linear ranges, instrument limits of detection (LODs) and limits of quantification (LOQs) of the 15 PAEs
y: the peak area ratio between the target analyte and the internal standard;x: the mass concentration ratio between the target analyte and the internal standard.
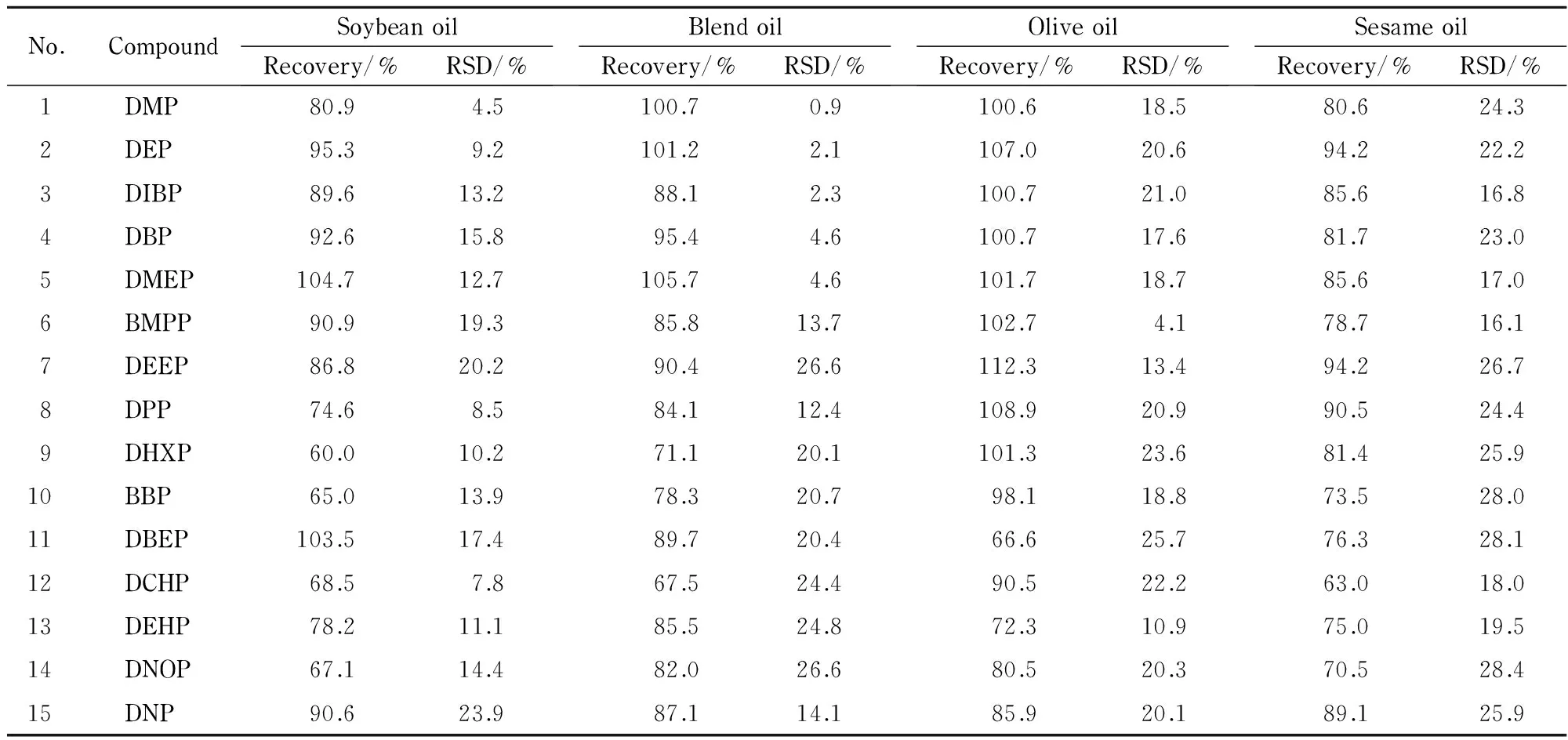
表 3 15种PAEs在4种植物油基质中0.2 mg/kg加标水平下的平均回收率和RSD(n=3)Table 3 Average recoveries and relative standard deviations (RSDs) of the 15 PAEs spiked in four vegetable oils at the level of 0.2 mg/kg (n=3)
2.4 回收率试验
表3给出了15种PAEs在4种植物油基质中0.2 mg/kg加标水平下的平均回收率和RSD,可以看出,15种PAEs的基质加标回收率为60.0%~112.3%,RSD为0.9%~28.4%。与传统凝胶渗透色谱净化[8]与固相萃取方法[5]相比,本方法在较短时间(5 min)内即可完成食用油中PAEs的萃取及净化,并得到了满意的回收率。
2.5 实际样品检测
将本方法应用于市售的4种植物油样品中PAEs的检测,替代内标的回收率范围为70.6%~118.2%,样品检测结果见表4。
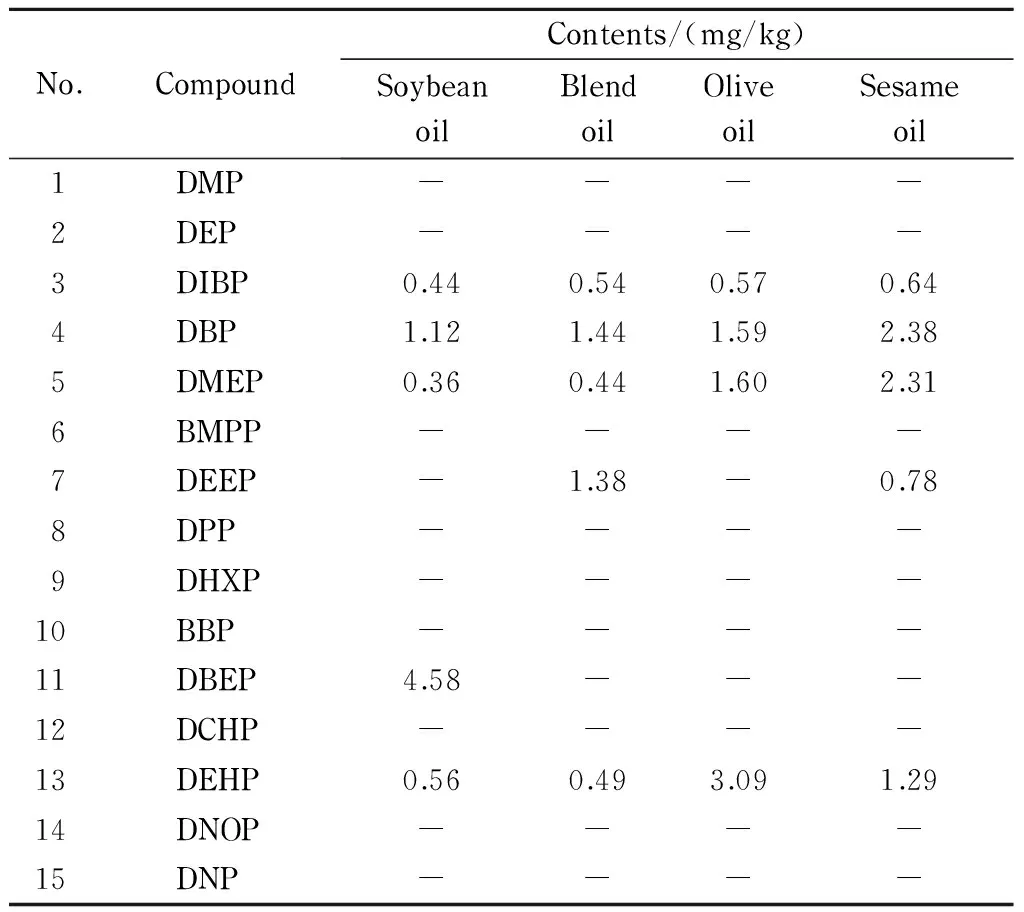
表 4 4种植物油样品中15种PAEs的含量Table 4 Contents of the 15 PAEs in the four vegetable oils
-: not detected.
3 结论
本文利用气液微萃取技术在5 min内完成了植物油样品中PAEs的萃取、净化、浓缩,与GC-MS联用建立了植物油中15种邻苯二甲酸酯类塑化剂的一步萃取检测方法。本方法快速、高效、准确,为油脂样品中15种常用塑化剂的快速检测提供了新方法,为保障食品安全提供了技术支持。
[1] Yao W R, Yu Y, Yan W, et al. China Oils and Fats, 2010, 35(6): 38
姚卫蓉, 俞晔, 阎微, 等. 中国油脂, 2010, 35(6): 38
[2] Liu X Q, Modern Food, 2016(16): 87
刘秀清. 现代食品, 2016(16): 87
[3] GB 5009.271-2016
[4] Ding L P, Cai C P, Wang D H. Chinese Journal of Chromatography, 2014, 32(11): 1266
丁立平, 蔡春平, 王丹红. 色谱, 2014, 32(11): 1266
[5] Shi J E, Liu B, Shao Q R, et al. Chinese Journal of Food Hygiene, 2015, 27(5): 538
石金娥, 刘斌, 邵秋荣, 等. 中国食品卫生杂志, 2015, 27(5): 538
[6] Wu P G, Yang D J, Zhang L Q, et al. J Sep Sci, 2012, 35(21): 2932
[7] Zhang L, Li J G, Zhao Y F, et al. Environmental Chemistry, 2007, 26(2): 197
张磊, 李敬光, 赵云峰, 等. 环境化学, 2007, 26(2): 197
[8] Zhang C Y, Wang H, Zhang X H, et al. Chinese Journal of Chromatography, 2011, 29(12): 1236
张春雨, 王辉, 张晓辉, 等. 色谱, 2011, 29(12): 1236
[9] Zhang Z, Wang F, Wang W, et al. Food Science and Technology, 2012, 37(4): 296
张征, 王峰, 王宛, 等. 食品科技, 2012, 37(4): 296
[10] Wang L Q, Huang C L, Chen H T, et al. China Oils and Fats, 2012, 37(6): 43
王力清, 黄翠莉, 陈洪涛, 等. 中国油脂, 2012, 37(6): 43
[11] Du P C, Jiang T X, Gong B, Chinese Journal of Health Laboratory Technology, 2014, 24(5): 620
杜鹏程, 姜童祥, 巩飚. 中国卫生检验杂志, 2014, 24(5): 620
[12] Yang C, Piao X F, Qiu J X, et al. J Chromatogr A, 2011, 1218: 1549
[13] Zheng X, Yang Y, Liu M, et al. Sci Total Environ, 2014, 557/558: 688
[14] He M, Yang C, Geng R J, et al. Anal Chim Acta, 2015, 879: 63
[15] Nan J X, Wang J, Piao X F, et al. Talanta, 2015, 142: 64
