基于不同提取方法的水稻叶片蛋白质组的二维液相色谱分离及高分辨质谱分析
2018-03-05柴爽爽马有宁高欢欢秦美玲张涵彤林晓燕
柴爽爽, 马有宁, 高欢欢,2, 秦美玲,杨 欢, 张涵彤, 何 巧, 林晓燕*
(1. 中国水稻研究所, 农业部稻米及制品质量监督检验测试中心, 农业部稻米产品质量安全风险评估实验室, 浙江 杭州 310006; 2.浙江工业大学化学工程学院, 浙江 杭州 310014)
鸟枪法是将蛋白质酶解消化得到蛋白质多肽片断并利用质谱测定肽序的策略,是分析复杂蛋白质组学的有力工具[1,2]。水稻蛋白质的提取是水稻蛋白质组学分析的关键步骤[3]。与拟南芥和其他的有机体蛋白质组分析相比,水稻蛋白质组分析存在很多问题。因为水稻组织中包含大量的次级物质如酚类、脂肪、有机酸、糖类、萜烯和色素等[4-6],当这些次级物质与蛋白质发生共沉淀时,会对蛋白质组分析造成严重的干扰作用[7,8]。因此,为了得到植物组织中的全蛋白,选择高效的提取方法非常必要。
近年来,多维液相色谱分离技术迅速发展。其中二维液相色谱(2D LC)是鸟枪法蛋白质组研究的主流方法,不仅补充了双向电泳技术本身存在的分离蛋白质范围有限、存在歧视效应以及无法与质谱直接联用等缺陷[9,10],也弥补了一维分离模式峰容量低、分辨率低、分离能力差的局限性[11]。目前,二维液相色谱已广泛应用于各领域的蛋白质组研究,如人体血清[12]、中药[13-15]、聚合物[16]、小麦[10]、黑杨[17]、拟南芥[18]等。因为需要减少一维液相色谱组分中的乙腈且消除高盐浓度对系统鲁棒性的影响[19],离线反相-反相二维液相分离系统成为常用的适用于蛋白质组分析的多维液相色谱分离系统。但迄今尚未见将离线反相-反相二维液相色谱用于水稻器官、组织或亚细胞水平蛋白质组分析的相关研究报道。
本文通过比较水稻叶片蛋白质的提取方法(酚法、十二烷基硫酸钠法(SDS法)和三氯乙酸/丙酮法(TCA/丙酮法))和液相色谱分离系统(一维液相色谱与二维液相色谱)对水稻叶片蛋白质鉴定结果的影响,最终建立了以酚法提取、二维液相色谱分离、线性离子阱/静电场轨道阱组合式高分辨质谱(LTQ/Orbitrap MS)分析水稻叶片蛋白质组的方法。本方法有助于更深入地研究水稻叶片蛋白质组,并为其他植物叶片蛋白质组学研究提供参考。
1 实验部分
1.1 仪器与设备
Agilent 1200型高效液相色谱仪(美国Agilent公司), Easy nLC 1000纳升级液相色谱仪和LTQ-Orbitrap组合高分辨质谱仪(附纳喷雾离子源)(美国Thermo Fisher公司)、CentriVap®离心浓缩仪(美国Labconco公司); Milli-Q超纯水系统(美国Millipore公司);分光光度计(上海光谱仪器有限公司); PHS-3C精密pH计(上海仪电科学仪器股份有限公司);DK2-28电热恒温振荡水槽(上海精宏实验设备有限公司)。
1.2 试剂与材料
三羟甲基氨基甲烷盐酸盐(Tris-HCl)、十二烷基硫酸钠(SDS)、碘代乙酰胺(iodoacetamide, IAA)、磷酸盐缓冲液、胰蛋白酶(trypsin)、KCl、尿素和蛋白酶抑制剂均购于Sigma公司;蔗糖(纯度≥ 99%)购于阿拉丁试剂有限公司;乙二胺四乙酸(EDTA)、碳酸氢铵购于Acros Organics公司;甲酸、氢氧化铵购于Fluka公司;二硫苏糖醇(dithiothreitol, DTT)购于Promega公司;20x PBS缓冲液购于生工生物工程(上海)股份有限公司;乙腈、甲醇、丙酮购于德国Merck公司;Tris-饱和酚购于Sangon公司;以上试剂均为分析纯或色谱纯。实验室用水为Milli-Q超纯水(18.2 MΩ5cm);除盐固相萃取柱(MILI-SPE extraction disk cartridge, 3 mL, C18-SD小柱)购自Agilent公司。
采集齐穗期水稻叶片,用液氮速冻并在-80 ℃冰箱中保存,待用。
1.3 样品制备
1.3.1 叶片总蛋白质的提取及裂解
1.3.1.1 酚法
参考Kilambi等[20]报道的方法:称取3 g经液氮研磨的水稻叶片样品于50 mL离心管中,加入20 mL 4 ℃预冷的提取缓冲液(0.1 mol/L KCl, 0.7 mol/L蔗糖,0.5 mol/L Tris-HCl, pH 7.5, 50 mmol/L EDTA),再加入50 μL蛋白酶抑制剂和1 mL 1 mol/L DTT(终浓度为50 mmol/L),振荡混匀;加入等体积于4 ℃条件下预冷的pH 7.5的Tris-HCl饱和酚,混匀后于4 ℃振荡30 min;然后于4 ℃、10 000 g条件下离心30 min。收集上层酚相,弃去下层水相;在收集的上层酚相中加入等体积的于4 ℃条件下预冷的提取缓冲液,混匀后于4 ℃条件下振荡30 min;于4 ℃、10 000 g条件下离心30 min,收集上层酚相,弃去下层水相,再重复提取1次;加入5倍体积的预冷的0.1 mol/L乙酸铵的甲醇溶液,于-20 ℃条件下沉淀过夜;于4 ℃、10 000 g条件下离心30 min,弃去上清液;加入2倍体积的预冷的甲醇(基于最后收集的酚相体积),轻轻混匀,于4 ℃、10 000 g条件下离心15 min,弃去上清液,重复2次;用预冷的丙酮替代甲醇,清洗沉淀2次,并将沉淀晾干。在晾干的沉淀中加入1.5 mL蛋白质裂解液(8 mol/L尿素、40 g/L 3-[(3-胆固醇氨丙基)二甲基氨基]-1-丙磺酸(CHAPS)、40 mmol/L Tris),振荡混匀使之充分溶解,于4 ℃、10 000 g条件下离心30 min,上清液即为粗蛋白质溶液,于-80 ℃条件下保存。
1.3.1.2 SDS法
参考An等[21]报道的方法:称取3 g经液氮研磨的水稻叶片样品于50 mL离心管中,加入30 mL PBS缓冲液(100 mmol/L, pH 7.4),冰浴下高速匀浆超声30 s,于4 ℃、10 000 g条件下离心30 min,取上清液;加入适量100 g/L SDS的PBS缓冲溶液,使SDS的最终质量浓度为10 g/L(pH 7.0~8.5);加入适量1 mol/L DTT使其终浓度为10 mmol/L,于56 ℃条件下反应30 min;加入适量1 mol/L IAA使其终浓度为25 mmol/L,于37 ℃条件下避光30 min;将上述溶液分成5等份,分别逐步加入5倍体积的预冷丙酮,涡旋振荡后,于-20 ℃过夜沉淀;在4 ℃下,以10 000 g离心30 min,弃去上清液;加入等体积的丙酮-水(6∶1,v/v)洗涤,将沉淀自然晾干。在5份晾干的沉淀中分别加入0.3 mL蛋白质裂解液(8 mol/L尿素、40 g/L CHAPS、40 mmol/L Tris),振荡混匀使之充分溶解,于4 ℃、10 000 g条件下离心30 min,取上清液合并于同一个2 mL离心管中于-80 ℃条件下保存。
1.3.1.3 TCA/丙酮法
参考Ippoushi等[22]报道的方法:称取3 g经液氮研磨的水稻叶片样品于50 mL离心管中,加入30 mL于4 ℃条件下预冷的TCA提取液(100 g/L TCA/丙酮溶液)和1.5 mL 1 mol/L DTT(终浓度为50 mmol/L);振荡混匀,于-20 ℃条件下沉淀过夜;于4 ℃、10 000 g条件下离心30 min,弃去上清液;于收集的沉淀中加入20 mL预冷的丙酮,并轻轻混匀;于4 ℃、10 000 g条件下离心20 min。重复上述步骤两次;收集沉淀并将沉淀晾干。蛋白质裂解及保存同酚法。
1.3.2 蛋白质定量
以Bradford法[23]测定蛋白质浓度,采用BSA作标准曲线。
1.3.3 蛋白质的酶解
取适量(一维液相色谱取100 μg,二维液相色谱取2 mg)的粗蛋白质样品放入离心管中,加入1 mol/L DTT溶液至其终浓度约为10 mmol/L,将上述离心管恒温在37 ℃条件下反应2.5 h;加入适量1 mol/L的IAA至终浓度为50 mmol/L,室温,避光40 min;用50 mmol/L NH4HCO3溶液定容使尿素终浓度小于2 mol/L,按m(酶)∶m(蛋白质)=1∶50的比例加入胰蛋白酶,于37 ℃水浴条件下酶解过夜(16~20 h);加入甲酸溶液,终止反应。
1.3.4 脱盐
将C18-SD固相萃取柱装入15 mL离心管中,加入1 mL甲醇于1 500 g条件下离心1 min,加入0.5 mL 70%(体积分数,下同)乙腈水溶液(含0.1%(体积分数,下同)甲酸), 以1 500 g离心1 min;加入0.5 mL 0.1%甲酸,以1 500 g离心1 min;上样,以150 g离心3 min;加入0.5 mL 0.1%甲酸水溶液,以150 g离心3 min;将固相萃取小柱取出,装入新的离心管,加入0.5 mL 70%乙腈水溶液(含0.1%甲酸),以150 g离心3 min,重复一次;洗脱液即为脱盐肽段,将洗脱液离心浓缩。一维液相色谱分析时,用100 μL 0.1%甲酸水溶液溶解,以10 000 g离心30 min,取上清液用于纳升级液相色谱-LTQ-Orbitrap组合高分辨质谱仪检测。二维液相色谱分析时,用100 μL 5 mmol/L氢氧化氨溶解,于10 000 g条件下离心30 min,取上清液用Agilent 1200型高效液相色谱仪进行组分收集,收集的组分经离心浓缩后溶于100 μL 0.1%甲酸水溶液中,用于第二维液相色谱(纳升级液相色谱)分离,并用LTQ-Orbitrap组合高分辨质谱仪检测。
1.4 仪器条件
1.4.1 高效液相色谱
第一维液相色谱采用xBridge Peptide BEH C18柱(250 mm×4.6 mm, 5 μm);流动相A为5 mmol/L氢氧化铵,流动相B为90%乙腈水溶液(含5 mmol/L氢氧化铵);检测波长为214 nm;流速为1 mL/min;进样量50 μL。多肽洗脱梯度:0~5 min, 0~2%B; 5~10 min, 2%B ~5%B; 10~70 min, 5%B ~25%B; 70~75 min, 25%B ~40%B; 75~85 min, 40%B~70%B; 85~95 min, 70%B。从第11 min开始收集,每隔10 min收集一次,最终收集10个组分。
1.4.2 纳升级液相色谱
色谱分析柱为Acclaim Pep Map RSLC(C18, 15 cm×50 μm, 2 μm);预柱为Acclaim Pep Map 100(C18, 2 cm×75 μm, 3 μm);流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈。多肽梯度洗脱:0~120 min, 0~65%B; 120~140 min, 65%B~95%B; 140~160 min, 95%B。流速为300 nL/min;进样量为2 μL。
1.4.3 LTQ-Orbitrap质谱分析
设置电喷雾电压为1.9 kV,离子传输毛细管温度为300 ℃。以数据依赖模式进行MS/MS图谱采集。一级质谱采用Orbitrap采集,扫描范围为m/z300~20 000,分辨率设为60 000;对全扫描中丰度最高的前10个离子峰用LTQ进行二级碎片采集,裂解模式为碰撞诱导解离,归一化碰撞能量为35%,离子活化时间为30 ms。动态排除设置:重复次数为1,重复间隔时间为60 s,动态排除时间为30 s。采用Xcalibur软件(Version 2.07, Thermo公司)进行系统控制和数据收集。
1.4.4 数据库检索
质谱采集的数据采用Proteome Discoverer (Version 2.0.0.802, Thermo公司)分析,在水稻蛋白质数据库(Oryza sative subsp.japonica(Rice).fasta)中进行检索;酶切方式设置为胰蛋白酶全酶切,最高允许两个漏切位点;设定半胱氨酸残基C端为固定修饰+57 Da, Met(M)为动态修饰+15.995 Da;前体离子的质量容忍度设置为20 ppm(10-6),碎片离子的质量容忍度设置为0.6 Da。假阳性率控制在1%以内,以此获取更为可靠的鉴定结果。
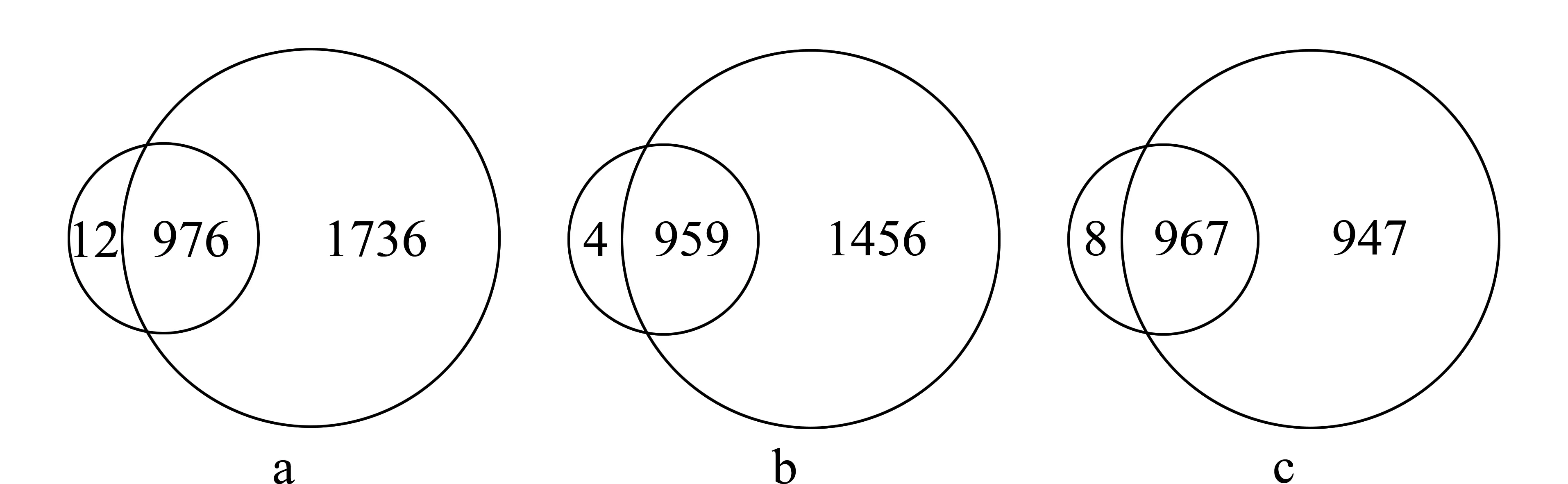
图 1 不同提取方法提取的蛋白质在一维和二维液相色谱条件下鉴定到的蛋白质数目比较Fig. 1 Comparison of the number of proteins identifiedby 1D LC and 2D LC followed the extraction with three different methods a, b, c represent phenol method, SDS method and TCA/acetone method, respectively. Smaller circles represent one-dimensional liquid chromatography (1D LC), and larger circles represent two-dimensional liquid chromatography (2D LC).
2 结果与讨论
2.1 不同色谱分离系统对蛋白质鉴定结果的影响
水稻叶片蛋白质经酚法、SDS法和TCA/丙酮法提取后,分别用一维液相色谱分离系统和二维液相色谱分离系统对蛋白质样品进行分离。在一维液相色谱条件下,酚法、SDS法和TCA/丙酮法鉴定的蛋白质数目分别是988、966和975,虽然酚法比其他两种方法鉴定的蛋白质数目多,但3种方法鉴定到的蛋白质数目差别不大。但在二维液相色谱条件下,酚法、SDS法和TCA/丙酮法鉴定的蛋白质数目分别为2 712、2 415和1 914,分别是一维液相色谱条件下鉴定到的蛋白质数目的2.7、2.5和1.9倍。图1分别为酚法、SDS法和TCA/丙酮法提取的蛋白质经一维和二维液相色谱分离后鉴定到的蛋白质所做的韦恩图。由图1可见,一维液相色谱鉴定到的蛋白质基本上在二维液相色谱中也可以鉴定到,且二维液相色谱中可以鉴定到多种一维液相色谱中不能鉴定到的新的蛋白质。以上结果说明二维液相色谱分离水稻叶片蛋白质有明显的优越性,主要原因是一维液相色谱系统提供的峰容量和分辨率难以满足高效分离的要求[24],而二维液相色谱系统先后对肽段混合物进行2次分离,大大提高了系统的分辨率和峰容量[25,26],有利于低丰度蛋白质的检测[3,10]。
2.2 二维液相色谱条件下不同蛋白质提取方法对蛋白质鉴定结果的影响
在二维液相色谱条件下,酚法鉴定到的蛋白质数目最多,高达2 712,分别比SDS法和TCA/丙酮法多鉴定出297和798个蛋白质(见图1)。因此,酚法为最佳的水稻蛋白质提取方法,此结果与Kilambi等[3]的研究结果一致。可能是因为水稻叶片中的干扰物质进入水相而蛋白质保留在酚相,两相分离后,使酚法产生最佳的蛋白质提取效果[27]。而SDS法和TCA/丙酮法因蛋白质沉淀不充分而造成蛋白质损失[2,3],且有报道指出TCA/丙酮法能够使多糖与蛋白质发生共沉淀[28],对下游的蛋白质组分析造成严重的干扰。
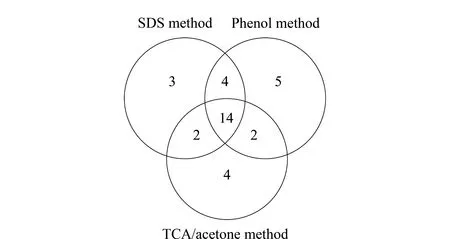
图 3 3种蛋白质提取方法鉴定到的蛋白质功能种类的韦恩图Fig. 3 Venn diagram of the identified protein functionalcategories by three different extraction methods
2.3 不同蛋白质提取方法对蛋白质的相对分子质量(Mr)和等电点(pI)分布的影响
蛋白质的Mr和pI含有生物学与病理学中生物标记物和信号分子的重要信息[29],因此在蛋白质组学中对蛋白质Mr和pI的研究引起了广泛关注。为此,本文对酚法、SDS法和TCA/丙酮法在二维液相色谱条件下鉴定到的蛋白质按照Mr和pI进行分析比较,以反映这3种蛋白质提取方法对不同Mr和pI蛋白质的偏好性。
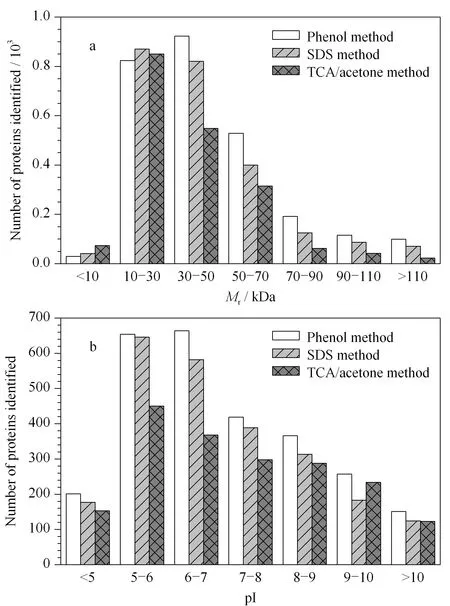
图 2 3种提取方法鉴定到的蛋白质在不同(a)相对分子质量区间和(b)等电点区间的分布Fig. 2 Distributions of the identified proteins in differentintervals of (a) relatively molecular mass and (b) pI by three different extraction methods SDS method: sodium dodecyl sulfate method; TCA/acetone method: trichloroacetic acid/acetone method.
图2a、2b分别是3种蛋白质提取方法在二维液相色谱条件下鉴定到的蛋白质在不同Mr和pI区间的数目。由图2可见,3种蛋白质提取方法所鉴定蛋白质的Mr和pI占各自蛋白质鉴定总数的比例总体上没有明显差异。鉴定到的水稻叶片蛋白质的Mr主要集中在10~70 kDa,pI主要集中在5~10。从等电点的分布可以看出,酚法在不同pI区间鉴定到的蛋白质均多于SDS法和TCA/丙酮法。与SDS法和TCA/丙酮法相比,酚法能够鉴定到一些酸性、碱性及高等电点极端蛋白质,如等电点值为11.43的核糖体蛋白L36(Q6L510)。因此,酚法对不同等电点区间的蛋白质均有较好的提取效果,而SDS法和TCA/丙酮法对不同等电点区间的蛋白质造成了不同程度的损失。
2.4 水稻叶片蛋白质的质谱鉴定及功能分析
水稻叶片蛋白质在酚法、SDS法和TCA/丙酮法提取条件下,酶解肽段经二维液相色谱分离系统分离和高分辨质谱分析,再经Protein Discover 2.0.0.802软件进行数据分析,可鉴定的蛋白质数目分别为2 712、2 415和1 914,其中肽段≥2的蛋白质各有1 905、1 661、1 247个,分别占其总数的70.2%、68.7%和65.1%。采用DAVID数据库对肽段≥2的蛋白质按代谢功能途径中基因的功能及其位置进行分类,酚法、SDS法和TCA/丙酮法鉴定到的蛋白质种类分别有25、23和22种(见图3),可以看出,3种方法鉴定到的蛋白质种类存在互补性,但酚法鉴定到的蛋白质种类最多。
图4为酚法鉴定到的25种功能种类,包括光合作用活性、结合活性、酶活性、转移运输活性、生物合成活性、类囊体活性等。其中,具有结合活性的蛋白质最多,这些蛋白质可与三磷酸腺苷(ATP)、三磷酸鸟苷(GTP)、金属离子(镁离子、铜离子、钙离子)结合。ATP结合蛋白的主要功能是利用ATP水解产生的能量促进与其结合的底物进行跨膜转运,其转运底物包括糖、氨基酸、金属离子、多肽、蛋白质、细胞代谢产物和药物等[30]。GTP结合蛋白通过在细胞质中结合二磷酸鸟苷(GDP)和在细胞膜中结合GTP的构象转换来完成囊泡分泌和运输的作用[31]。金属离子在蛋白质中的生物功能多种多样,主要包括结构维持、电子转移、分子识别与催化、信号转导、基因转录及表达调控等[32]。金属离子的存在对于维持蛋白质空间结构的稳定性,保持其生理活性等方面具有极其重要的意义。因此,水稻叶片蛋白质中鉴定到的具有结合活性的蛋白质与水稻的生命活动具有密切的相关性。
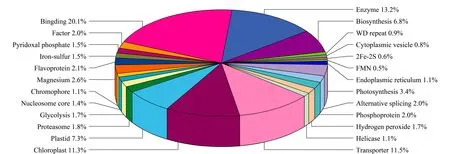
图 4 酚法提取的水稻叶片蛋白质按代谢功能途径中基因的功能及其位置分类情况Fig. 4 Distribution of the proteins in rice leaves extracted by phenol method according to the classification of the gene functions and positions in metabolic pathway
3 结论
本文建立了酚法提取-二维液相色谱系统分离-高分辨质谱鉴定水稻叶片蛋白质的方法。比较了水稻叶片的提取方法(酚法、SDS法和TCA/丙酮法)和液相色谱分离系统(一维液相色谱与二维液相色谱)对蛋白质鉴定结果的影响,结果表明,与SDS法和TCA/丙酮法相比,酚法能够鉴定到一些极端蛋白质,如酸性、碱性及高等电点蛋白质。对二维液相色谱条件下酚法、SDS法和TCA/丙酮法提取的蛋白质按代谢功能途径中基因的功能及其位置进行分类,发现3种方法鉴定到的蛋白质种类存在互补性,但酚法鉴定到的蛋白质种类最多。本方法为水稻蛋白质组学研究提供了技术支撑,同时也为其他作物的蛋白质组学研究技术提供重要的借鉴。
[1] Liu Y J. [PhD Dissertation]. Wuhan: Huazhong Agricultural College, 2014: 7
刘怡君. [博士学位论文]. 武汉: 华中农业大学, 2014: 7
[2] Cao X L, Gong J D, Chen M X, et al. Chinese Journal of Chromatography, 2014, 32(11): 1181
曹晓林, 巩佳第, 陈铭学, 等. 色谱, 2014, 32(11): 1181
[3] Kilambi H V, Manda K, Sanivarapu H, et al. Front Plant Sci, 2016, 7: 969
[4] Cánovas F M, Dumas-Gaudot E, Recorbet G, et al. Proteomics, 2004, 4(2): 285
[5] Wang W, Tai F, Chen S. J Sep Sci, 2008, 31(11): 2032
[6] Saravanan R S, Rose J K C. Proteomics, 2004, 4(9): 2522
[7] Valcu C M, Schlink K. Proteomics, 2010, 6(5): 1599
[8] Wu X, Xiong E, Wang W, et al. Nat Protoc, 2014, 9(2): 362
[9] Jorrín J V, Maldonado A M, Angeles Castillejo M. Proteomics, 2007, 7(16): 2947
[10] Liu J, Pan Y H, Xu Q, et al. Scientia Agricultura Sinica, 2009, 42(3): 772
刘静, 潘映红, 徐琴, 等. 中国农业科学. 2009, 42(3): 772
[11] Qi H. [MS Dissertation]. Beijing: Chinese Academy of Agricultural Sciences, 2013: 5
齐慧. [硕士学位论文]. 北京: 中国农业科学院, 2013: 5
[12] Guerrier L, Lomas L, Boschetti E. J Chromatogr A, 2005, 1073(1/2): 25
[13] Teng Z, Dai R, Meng W, et al. Chromatographia, 2011, 74(3/4): 313
[14] Jin G, Dai Y, Feng J, et al. J Sep Sci, 2010, 33(4/5): 564
[15] Su X, Kong L, Li X, et al. J Chromatogr A, 2005, 1076(1/2): 118
[16] Im K, Park H W, Lee S, et al. J Chromatogr A, 2009, 1216(21): 4606
[17] Visioli G, Marmiroli M, Marmiroli N. Biomed Res Int, 2010, 2010(2): 567510
[18] Szponarski W, Sommerer N, Boyer J C, et al. Proteomics, 2004, 4(2): 397
[19] Spicer V, Ezzati P, Neustaeter H, et al. Anal Chem, 2016, 88(5): 2847
[20] Kilambi H V, Kumar R, Sharma R, et al. Plant Physiol, 2013, 161(4): 2085
[21] An B, Zhang M, Johnson R W, et al. Anal Chem, 2015, 87(7): 4023
[22] Ippoushi K, Sasanuma M, Oike H, et al. Food Chem, 2015, 173: 238
[23] Bradford M M. Anal Biochem, 1976, 72(s1/2): 248
[24] Li D X. [PhD Dissertation]. Shanghai: East China University of Science and Technology, 2011: 1
李笃信. [博士学位论文]. 上海: 华东理工大学, 2011: 1
[25] Liu W X.[MS Dissertation]. Xi’an: Shaanxi Normal University, 2011: 7
刘文翔. [硕士学位论文]. 西安: 陕西师范大学, 2011: 7
[26] Li X L.[MS Dissertation]. Tianjin: Tianjin University of Science & Technology, 2010: 11
李晓龙. [硕士学位论文]. 天津: 天津科技大学, 2010: 11
[27] Isaacson T, Damasceno C M B, Saravanan R S, et al. Nat Protoc, 2006, 1(2): 1769
[28] Wu X, Gong F, Wang W. Proteomics, 2014, 14(6): 645
[29] Min Q, Wu R, Zhao L, et al. Chem Commun, 2010, 46(33): 6144
[30] Niu B X, He F R, He M, et al. Acta Bot Sin, 2013, 55(8): 710
[31] Lin H X, Liu X B, Li F Q, et al. Chinese High Technology Letters, 2001, 11(3): 9
林慧贤, 刘筱斌, 李发强, 等. 高技术通讯, 2001, 11(3): 9
[32] Zheng C. [MS Dissertation]. Beijing: University of Chinese Academy of Sciences, 2013: 2
郑程. [硕士学位论文]. 北京: 中国科学院大学, 2013: 2
