CD44分子的体外岩藻糖基化修饰对兔骨髓间充质干细胞归巢能力的影响
2018-03-05肖飞焦竞黄玉成徐海左伟王俊文
肖飞,焦竞,黄玉成,徐海,左伟,王俊文
(武汉市普爱医院,湖北 武汉 430000)
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)的增殖异常活跃,且具有多向分化潜能,在不同诱导环境下,能向成骨细胞、成软骨细胞、脂肪细胞、神经细胞等多类细胞分化,是组织工程相关研究被广泛应用的种子细胞[1]。现已证实BMSCs可以作为支架载体材料或复合生物材料应用于动物骨缺损模型的治疗中[2]。然而在临床应用中的效果并不理想,其中最重要的一个原因便是该细胞在体内定向归巢能力较差,无法进一步发挥高效的修复作用。
肖飞,焦竞,黄玉成,等.CD44分子的体外岩藻糖基化修饰对兔骨髓间充质干细胞归巢能力的影响[J].实用骨科杂志,2018,24(2):143-147.
体外培养的BMSCs注射到受体外周血后,若想定向到达受损的骨区域,必须经过两个阶段:第一,必须要克服血管内血流的剪切力,滚动到靶组织血管内皮细胞表面;第二,BMSCs需要通过一系列黏附分子牢固的结合到内皮细胞表面,进而迁移到受损的组织[3]。而在血液中BMSCs的滚动和黏附能力取决于BMSCs表面归巢相关因子造血细胞E和L受体(hematopoietic cellE-selectin/L-selectin ligand,HCELL)与广泛表达于骨髓微血管内表皮的P/E-选择素相耦合作用[4]。HCELL在其半乳糖端连接有α-2,3-唾液酸基团,N-乙酰胺基葡萄糖端连接有α-1,3-岩藻糖基团,形成一个唾液酸化LewisX(sialyl-LewisX,sLeX)的结构,这种sLeX结构正是与E-选择素耦合的分子基础[5-6]。而CD44分子的N-乙酰胺基葡聚糖端缺乏α-1,3-岩藻糖基团的修饰,于是设想如果将α-1,3-岩藻糖基团连接于CD44分子N-乙酰胺基葡萄糖端,将使BMSCs表面具有足够多类似HCELL分子结构,从而增强BMSCs在血液中的滚动和黏附能力,促进其定向归巢作用。
本研究采用兔BMSCs为研究对象,构建稳定表达增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的BMSCs,后通过体外岩藻糖基化修饰处理稳定表达EGFP的兔BMSCs,骨损伤兔体内注射BMSCs后,检测处理前后BMSCs归巢能力的变化情况,这将为BMSCs在细胞治疗、基因治疗、组织工程和再生医学中的应用奠定一定的理论基础,且具有重要的理论意义和较大的应用前景。
1 资料与方法
1.1 实验动物选取2个月龄左右的新西兰大白兔20只,体重1.5~2.0 kg,在相同条件下分笼饲养。实验过程中对动物处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》标准。
1.2 主要实验试剂及材料 含EDFP的慢病毒由华中科技大学同济医学院实验室馈赠;GDP-岩藻酸购自美国Santa Cruz公司;α-1,3-岩藻糖转移酶VI(FTVI)购自美国R&D公司;DMEM培养基、胎牛血清购自Gibco公司;嘌呤酶素、胰蛋白酶、青霉素和链霉素购自Sigma公司;FITC标记的小鼠抗兔CD29抗体、CD34抗体、CD44抗体、CD45抗体购自美国BD公司;兔血清基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1)以及单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)的ELISA检测试剂盒、全蛋白提取试剂盒购自南京建成生物工程研究所;小鼠抗兔一抗SDF-1,MCP-1以及山羊抗小鼠IgG二抗均购自Abcam公司;小鼠抗EGFP一抗购自Millipore公司;SP免疫组化二抗试剂盒-通用型购自Invitrogen公司;其他常用化学试剂均购自国药集团化学试剂有限公司。
1.3 兔BMSCs的原代分离、培养及形态学鉴定 取新西兰大白兔一只,以3%戊巴比妥钠(35 mg/kg)经耳缘静脉注射麻醉,从兔股骨粗隆处使用16号骨穿针穿刺,12号腰穿针钻入骨髓腔后,使用15 mL含肝素钠的生理盐水(1 200 U/mL)自12号针注入,从16号针处接取冲出物,将冲出物与1×PBS按1︰1混匀稀释,等比例加入含percoll的分离液,2 000 r/mim离心15 min,吸取含单个核细胞的乳白色界面层置于另一个离心管中,1×PBS洗涤1次后,用5 mL DMEM培养基(10%胎牛血清+100 U/mL青霉素+100 U/mL链霉素)重悬并转移至25 cm2培养瓶中,置于37℃、含5% CO2的培养箱中培养。48 h后进行首次换液,以后间隔3 d换液。待原代细胞生长至80%汇合时消化传代,按1︰3的比例进行传代接种培养,并记作P1;传代培养过程中隔日更换培养基,直至贴壁细胞彼此融合至80%时,再重复以上操作进行下一代传代接种培养,并记为P2,依次类推,传至P3,为实验备用。原代培养过程中每日采用倒置显微镜对兔BMSCs进行拍照,观察其生长状况并做相关记录。
1.4 流式细胞仪检测兔BMSCs表面标志物 生长状态较好的P3代细胞,弃培养基使用0.2%的胰酶消化1 min,收集于15 mL离心管中,1 200 r/mim离心5 min,使用1×PBS洗涤细胞1次后,细胞计数分管,各管中加入单克隆抗体CD29、CD34、CD44、CD45,同时每管设置阴性对照组,避光孵育40 min。使用1×PBS洗涤细胞2次后,500 μL1×PBS重悬,流式细胞仪上机检测。
1.5 稳定表达EGFP的兔BMSCs的筛选 取生长良好的P3代BMSCs以1.0×105个/mL接种于6孔板中,待细胞生长到约80%汇合时,加入3 mL DMEM培养基和1 mL的含EDFP的慢病毒液(滴度:1.25×108TU/mL),置入5% CO2,37℃恒温培养箱中培养,期间使用含0.5 μg/mL的嘌呤霉素的DMEM培养基进行细胞筛选培养。首次培养24 h后,每日在倒置荧光显微镜下进行细胞生长状态以及EGFP的表达情况观察。
1.6 兔BMSCs的体外岩藻糖基化处理 收集生长状态良好稳定表达EGFP的兔BMSCs,使用HBSS清洗2次,加入提前配置好的α-1,3-岩藻糖转移酶Ⅵ反应体系(将60 mU/mL α-1,3-岩藻糖转移酶Ⅵ溶于5 mL含有20 mM HEPES、1%HAS及1mMGDP-岩藻酸的HBSS),37℃孵育40 min。4℃,1 200 r/mim离心5 min,弃上清,使用HBSS清洗一次,重悬细胞于2% PBS至浓度约为5.0×106个/mL备用。
1.7 兔胫骨骨折模型构建与实验分组 选取新西兰大白兔15只,适应性暂养1周后开始实验。依次开通耳缘静脉,注射3%戊巴比妥钠(35 mg/kg),麻醉起效后将兔仰卧位固定于手术台上,左后肢脱毛、碘伏消毒、铺巾。取小腿前内侧切口4~5 cm,钝性分离胫前肌,暴露兔胫骨,以摆锯于胫骨中段人为造成横形骨折,后用7孔微型解剖钢板1枚,螺丝钉6枚固定骨折端,骨折线上下各3枚螺丝钉。以生理盐水冲洗后分层关闭切口。术后将兔随机分成三组:对照组(Control)5只,每只尾静脉注射2 mL生理盐水作为对照;BMSCs治疗组(BMSCs)5只,每只尾静脉注射2 mL未经岩藻糖基化处理的BMSCs(5.0×106个/mL);岩藻糖基化处理的BMSCs治疗组(BMSCs+Fuc)5只,每只尾静脉注射2 mL经岩藻糖基化处理的BMSCs(5.0×106个/mL)。兔麻醉苏醒后按分组放入笼内同条件继续饲养,所有兔均予20万U的青霉素一次肌肉注射,持续3d。术后6周处死各组兔,取样进行相应检测。
1.8 ELISA进行兔血清中SDF-1、MCP-1水平检测 术后6周处死各组兔,采取3组兔血液样本,血液样本采集后在室温下放置20 min,离心,吸取上清液,-20℃保存待测,待所有血清样本收集完后,分别采用兔血清SDF-1和MCP-1的ELISA检测试剂盒,按照说明书操作方法进行相应检测,根据标准品和样品的吸光度值,计算三组血清样本中SDF-1、MCP-1水平。
1.9 损伤骨组织SDF-1、MCP-1的Western Blot检测 术后6周处死各组兔,取手术损伤处骨组织提取总蛋白、BCA试剂盒对蛋白进行浓度测定后进行Western Blot检测。操作步骤如下:取20 μg蛋白和4 μL 2×SDS上样缓冲液混合均匀,100℃变性10 min;上样,SDS-PAGE凝胶电泳分离后转至PVDF膜上;PBS洗膜;用5%脱脂牛奶封闭1 h;PBS洗膜后加入对应一抗(SDF-1,1︰2 000;MCP-1,1︰2 000)4℃,孵育过夜;PBS洗膜;加入辣根过氧化物酶标记的二抗羊抗小鼠IgG(1︰5 000)孵育0.5 h;PBS洗膜;用DAB化学放光进行显色。以GAPDH为内参蛋白,后采用Quantity One图像分析软件进行半定量分析。
1.10 免疫组化检测损伤骨组织EGFP的表达 术后6周处死各组兔,取手术损伤处骨组织。固定后,EDTA脱钙、脱水、石蜡包埋,制作切片;将制作好的切片置于pH 6.0的柠檬酸钠缓冲液中进行抗原修复,PBS冲洗,滴加小鼠抗EGFP一抗(1︰1 000),4℃孵育过夜;按照免疫组织化学试剂盒中指示滴加二抗,孵育30 min;PBS冲洗3次,DAB显色,中性树胶封片,显微镜下观察结果,以出现棕黄色染色判定为阳性结果。后采用IPP 6.0计算机图像分析系统计算EGFP阳性染色百分比,后进行统计分析。

2 结 果
2.1 BMSCs的形态学鉴定 倒置显微镜下观察(见图1),原代培养48 h换液,可见部分细胞贴壁生长,呈梭形或多边形状(见图1a);培养至3 d时,细胞呈现梭形,集落逐渐增大,呈漩涡状;培养至9 d时,细胞逐渐融合成片,形成单层细胞,细胞形态均一,呈梭形生长,细胞生长旺盛;传代培养至P3代时,BMSCs在形态学上更加趋于一致,为排列更加有序的成纤维细胞样细胞,纯度达90%以上(见图1b)。

a 原代分离48 h b 传代培养3 d
图1 不同时期BMSCs的形态学观察(×200)
2.2 BMSCs的流式鉴定 流式细胞术对分离培养的兔BMSCs表面标志物的检测结果显示见图2,CD29,CD44成阳性(见图2a,2c),阳性率分别为97.81%,95.24%;CD34和CD45均成阴性(见图2b,2d),阳性率仅为1.85%和2.89%,符合BMSCs表面标志物的表达特征。
2.3 稳定表达EGFP的BMSCs的筛选 荧光显微镜下的观察结果显示见图3,培养48 h后即可在转染了带EGFP慢病毒的BMSCs中看见明亮的EGFP表达(见图3a),继续筛选到3周后,可在BMSCs中看见大量明亮的EGFP表达(见图3b),说明筛选培养得到了持续稳定表达EGFP的兔BMSCs,为后续实验提供了可靠的实验材料。
2.4 血清中SDF-1、MCP-1水平检测(ELISA) 手术6周后处死各组兔,采集血液,收集上清,ELISA检测结果显示见图4,与对照组相比,普通BMSCs治疗组SDF-1、MCP-1的分泌水平均显著上升(见图4a,P<0.05);与普通BMSCs治疗组相比,经体外岩藻糖基化处理的BMSCs治疗组SDF-1、MCP-1的分泌水平均极显著上升(见图4b,P<0.01)。
2.5 Western Blot检测SDF-1、MCP-1蛋白表达水平 手术6周后处死各组兔,取损伤处骨组织,提取全蛋白,Western Blot检测结果显示见图5a,与对照组相比,普通BMSCs治疗组SDF-1、MCP-1蛋白的表达水平均显著上升见图5b~5c,P<0.05);与普通BMSCs治疗组相比,经体外岩藻糖基化处理的BMSCs治疗组SDF-1、MCP-1蛋白的表达水平均极显著上升(见图5b~5c;P<0.01)。
2.6 免疫组化检测损伤骨组织EGFP的表达 手术6周后处死各组兔,取损伤处骨组织,制作切片,EGFP免疫组化染色结果显示(见图6),相对于未经岩藻糖基化处理的BMSCs治疗组而言,经岩藻糖基化处理过的BMSCs治疗组兔损伤骨组织处的EGFP阳性面积比值较多,且二者差异显著(P<0.05),说明BMSCs经岩藻糖基化处理后,到达损伤骨组织处的BMSCs明显增多,归巢能力明显增强。
3 讨 论
目前研究表明,临床骨损伤修复的主要难题为体内成骨缓慢。BMSCs作为一种具有多向分化能力的干细胞,在骨损伤修复方面具备极大的发展前景[7]。干细胞定向到达损伤部位跟其归巢能力密切相关,干细胞归巢是指自体的或外源性的干细胞在多种因素的作用下穿过内皮细胞定向迁移至靶向组织血管并定植的过程[8-9]。这一过程中,BMSCs需跨越血管内皮细胞和细胞外基质并在多种趋化因子、生长因子及黏附分子作用下实现归巢和植入,从而进一步发挥修复作用[8]。
尽管目前对BMSCs向炎症或损伤组织归巢的具体机制尚不清楚。但已有研究表明,这可能与炎症或损伤组织表达能够诱发并导致与迁移、黏附及穿出相关的特异性受体和配体的调节作用密切相关[10]。对于如何有效地增强BMSCs向靶向组织归巢的能力,主要有以下几种途径:a)合适的培养环境:为了获取足够数量的BMSCs,往往需要在体外对其进行培养扩增。这就不可避免的导致BMSCs在培养过程中发生老化或氧化损伤,从而影响细胞的增殖、多向分化和归巢潜能。Bolno等[11]人研究发现,粒细胞集落刺激因子可通过影响其表面CD44与其受体的结合能力从而来提高BMSCs的归巢能力;b)转染有利于归巢的基因至BMSCs:主要是将一些能够影响BMSCs归巢能力和活性的趋化因子、黏附分子等基因分子转染或转导至BMSCs,从而增强它们的表达并发挥相应作用。例如,Zhou等[12]人证明转染了SDF-1基因的BMSCs能明显强化BMSCs的动员、迁徙、穿出和定植能力。刘举等[13]人的研究表明MCP-1的体外诱导能显著提升小鼠BMSCs的静脉移植效率;c)提高BMSCs对血管内皮的黏附能力;回输的BMSCs黏附于血管内皮上是其归巢至靶向组织行使修复功能的前提。Sarkar等[14]人通过生物素-链霉亲和素化学结合法将包含sLeX结构的纳米级聚合物结合至BMSCs表面,从而使其具有与E选择素和P选择素紧密结合的能力。并通过体内实验证明高表达sLeX的BMSCs对于炎性组织归巢能力显著强于对照组。Sackstein[15]则通过研究证明了糖基化工程酶化处理BMSCs表面CD44分子,将其转化为具有向骨归巢能力的HCELL分子,从而提高其对血管内皮细胞表面E选择素的结合能力,并通过体内实验证明了岩藻糖基化处理后的BMSCs向骨髓归巢的能力显著增强,且仍保持其多向分化能力。说明通过体外特定方式处理BMSCs,提高其对血管内皮的黏附能力,能够有效促进BMSCs回输体内后的靶向归巢能力。

a CD29表达的流式检测 b CD34表达的流式检测 c CD44表达的流式检测 b CD45表达的流式检测
图2 流式细胞术检测BMSCs表面标记物
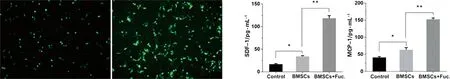
a 转染EGFP慢病毒48h b 转染EGFP慢病毒3周 a SDF-1 b MCP-1
图3 稳定表达EGFP的BMSCs的筛选 图4 血清中SDF-1和MCP-1的ELISA检测

a 免疫印迹结果 b SDF-1 c MCP-1
图5 损伤骨组织中SDF-1和MCP-1蛋白水平的Western Blot检测

a BMSCs b BMSCs+Fuc c EGFP免疫组化阳性率比较
图6 不同BMSCs治疗情况下损伤骨组织EGFP的表达
本研究采用EGFP作为标记物探究经岩藻糖基化处理的BMSCs在缺损部位的归巢情况。结果显示,骨损伤兔血清及损伤骨组织处的SDF-1和MCP-1均有显著增加,且到达损伤骨组织处的BMSCs明显增多。证明经岩藻糖基化处理的BMSCs的归巢能力得到显著提升,这一过程可能与SDF-1和MCP-1的相关通路的调节作用密切相关,这将为临床上干细胞的骨损伤修复研究奠定可靠的理论基础。
[1]Derubeis AR,Cancedda R.Bone marrow stromal cells (BMSCs) in bone engineering:limitations and recent advances[J].Ann Biomed Eng,2004,32(1):160-165.
[2]Wang H,He XQ,Jin T,et al.Wnt 11 plays an important role in the osteogenesis of human mesenchymal stem cells in a PHA/FN/ALG composite scaffold:possible treatment for infected bone defect[J].Stem Cell Res Ther,2016,7(1):1-13.
[3]彭敏锋,李剑.骨髓间充质干细胞与组织损伤修复的研究进展[J].中国组织工程研究,2008,12(8):1517-1520.
[4]Zhang LX,Shen LL,Ge SH,et al.Systemic BMSC homing in the regeneration of pulp-like tissue and the enhancing effect of stromal cell-derived factor-1 on BMSC homing[J].Int J Clin Exp Pathol,2015,8(9):10261-10271.
[5]Krause DS,Lazarides K,Van Etten RA,et al.Requirement for CD44 in homing and engraftment of BCR-ABL-expressing leukemic stem cells[J].Nat Med,2006,12(10):1175-1180.
[6]Dimitroff CJ,Lee JY,Rafii S,et al.CD44 is a major E-selectin ligand on human hematopoietic progenitor cells[J].J Cell Biol,2001,153(6):1277-1286.
[7]谢文鹏,毕荣修.骨髓间充质干细胞治疗骨折的临床研究进展[J].中国民族民间医药,2015,24(16):32-32.
[8]Ponte AL,Marais E,Gallay N,et al.The in vitro migration capacity of human bone marrow mesenchymal stem cells:comparison of chemokine and growth factor chemotactic activities[J].Stem Cells,2007,25(7):1737-1745.
[9]Huang H,Zhang X,Hu X,et al.A functional biphasic biomaterial homing mesenchymal stem cells for in vivo cartilage regeneration[J].Biomaterials,2014,35(36):9608-9619.
[10]Sackstein R,Merzaban JS,Cain DW,et al.Ex vivo glycan engineering of CD44 programs human multipotent mesenchymal stromal cell trafficking to bone[J].Nat Med,2008,14(2):181-187.
[11]Bolno PB,Morgan D,Wechsler A,et al.Chemokine induced migration of human mesenchymal stem cells:A strategy for directing cardiac repair[J].J Am Coll,2004,199(3):33.
[12]Zhou B,Han ZC,Poon MC,et al.Mesenchymal stem/stromal cells (MSC) transfected with stromal derived factor 1 (SDF-1) for therapeutic neovascularization:enhancement of cell recruitment and entrapment[J].Med Hypotheses,2007,68(6):1268-1271.
[13]刘举,周红雨,刘立斌,等.单核细胞趋化蛋白1体外趋化经成肌诱导分化后的小鼠BMSCs实验研究[J].中国修复重建外科杂志,2010,24(7):834-837.
[14]Sarkar D,Vemula PK,Zhao W,et al.Engineered mesenchymal stem cells with self-assembled vesicles for systemic cell targeting[J].Biomaterials,2010,31(19):5266-5274.
[15]Sackstein R.Glycoengineering of HCELL,the human bone marrow homing receptor:sweetly programming cell migration[J].Ann Biomed Eng,2012,40(4):766-776.
