肿瘤发展过程中自噬与凋亡的相互作用
2018-03-05阚月一王娅杰李玉洁翁小刚蔡维艳朱晓新
阚月一,,王娅杰,李 琦,李玉洁,杨 庆,翁小刚,陈 颖,蔡维艳,朱晓新
(1.安徽中医药大学,合肥 230038; 2.中国中医科学院中药研究所,北京 100700)
细胞凋亡通常被分为内源性凋亡、外源性凋亡、以及内质网应激诱导的凋亡。其形态特征主要体现在细胞体积的变小、染色质凝集、胞质浓缩以及DNA降解,最后形成凋亡小体而被吞噬[1]。自噬则是通过自噬溶酶体途径实现细胞内一些成分进行自我降解的过程[2]。自噬可分为大自噬、小自噬和分子伴侣介导的自噬。通常意义上的自噬,是指大自噬。其特征主要是通过细胞质组分形成杯状的双层膜结构,进而形成自噬体。自噬体的外层膜能够与溶酶体相融合形成单层膜的结构,即自噬溶酶体,进一步降解其所包裹的内容物[3]。自噬体的内膜及其所包被的内容物被消化,从而诱导自噬性细胞死亡,即II型程序性死亡。它是一种不同于凋亡的,且不依赖于caspase途径的程序性细胞死亡。本文将从如下几个方面对自噬与凋亡的关系进行归纳:1、自噬和凋亡共同作用,促进细胞死亡。2、自噬与凋亡相互拮抗,自噬为肿瘤细胞提供生存所必须的能量,抑制其凋亡。3、自噬促进细胞向凋亡的转化[4]。
1 参与细胞凋亡的蛋白分子
细胞凋亡是指受基因控制的程序性主动死亡。目前,对凋亡的研究主要集中于caspase3蛋白酶、Bcl-2、Bax、P53、Fas死亡受体等[5]。其中,Bcl-2家族是内源性凋亡的主要调控者。其可分为3类,(1)Bcl-2亚家族,主要包含一些抗凋亡蛋白,如Bcl-xl、Bcl-2、Bcl-w等。(2)Bax亚家族,主要为促凋亡蛋白如Bax、Bak、Bok等,其具有3个BH结构域。(3)BH3-only亚家族,它主要是促进细胞的凋亡,主要成员如:Bid、Bik、Bim和Bad等[6]。而外源性死亡受体途径涉及多种死亡受体,较为典型的如Fas、DR3和TNFRs受体等。当死亡受体与死亡配体结合后,死亡受体上的死亡结构域将召集相应的衔接蛋白,形成死亡诱导信号复合体,进而诱导细胞凋亡[7]。内质网应激诱导的凋亡有多种诱导因素,如:氧化应激、缺血、缺氧等造成内质网腔内错误折叠蛋白蓄积。目前,有文献认为内质网应激可通过PERK通路诱导细胞凋亡,而PERK通路主要是通过增加CHOP的表达发挥作用,当内质网处于非应激状态时,CHOP表达水平低。然而当产生内质网应激时,CHOP的表达将被诱导[8]。此外,c-Jun氨基末端激酶(JNK)的激活通路、半胱氨酸蛋白酶caspase12的激活通路等也对细胞凋亡发挥着重要作用[9]。
2 自噬相关标志物及调控
自噬的相关的蛋白主要包括Beclin1、P62、LC3、Atg5等。其中,LC3是研究最多的分子标志物,它包括两种形式,即LC3I和LC3II,两种形式可相互转化。LC3参与了自噬体膜的形成,细胞内新合成的LC3经加工,成为LC3I,LC3I又经泛素化加工修饰形成LC3II,LC3II定位于自噬体,是自噬体的形成标志[10]。目前,研究普遍认为自噬基因Atg5可与Atg12形成复合物,Atg12-Atg5复合物的结构和功能对研究自噬的形成至关重要。其缺失将导致自噬缺陷[11]。此外,雷帕霉素靶蛋白(mTOR)被认为是调节细胞自噬上游信号转导通路的汇合点。且mTOR存在两种不同的复合物形式,分别为对mTOR敏感的复合物mTORC1和对mTOR不敏感的mTORC2[12]。mTORC1的活性主要受亮氨酸浓度的调节,细胞内亮氨酸的浓度升高,则促进mTORC1的激活,进而抑制自噬的发生。当降低亮氨酸的浓度时,则mTORC1的活性也随之被抑制,从而自噬水平上调[13]。同时,其他信号转导通路也参与自噬的发生,如PI3K/Akt信号通路、ROS信号转导通路、JNK以及P53信号通路等都参与了自噬的发生[14]。
3 凋亡与自噬共同的分子机制
3.1 Beclin1的调节所介导的凋亡和自噬
自噬基因Beclin1为酵母基因Atg6/Vps30的同源基因,是自噬形成的重要参与者[15]。且Beclin1作为一个重要的抑癌蛋白,亦能够与凋亡相关的细胞调节因子相互作用。由于Beclin1上有BH3结构域的存在,一方面,Bcl-2、Bcl-xl等凋亡因子可通过与BH3结合而影响自噬和凋亡活性,如BH3通过与Bcl-2家族成员的结合,消除了其抗凋亡的作用[16]。另一方面,BH3可通过解除与Beclin1的作用而与促凋亡蛋白Bcl-2相互作用,从而影响细胞自噬[17]。且研究证明,Beclin1基因在细胞自噬过程中的重要调节作用,主要是通过BH3结构域与Bcl-2家族蛋白相互作用而实现的[18-19]。另有研究表明,Beclin1不仅可与Bcl-2结合,还能与PI3KC3等相作用,最终促进自噬的发生[16]。Beclin1作为caspase的底物,能被caspase所剪切,剪切后的Beclin1自噬功能丧失,却促进了细胞的凋亡[20]。同时,Beclin1不仅可以与凋亡相关基因Bcl-2、caspase-9等相互作用,还参与自噬体双层膜的形成[21],共同参与凋亡和自噬的调控。且有研究表示,Beclin1基因与抗凋亡蛋白Bcl-2家族成员结合的现象普遍存在于人和小鼠身上[22]。相关实验发现,Becllin1在结直肠癌细胞SW620的自噬和凋亡中扮演重要角色,其可通过促进自噬而促进SW620存活。而抑制Beclin1的表达促进了SW620的凋亡[23]。
同时,也有报道指出Bcl2除具有抗凋亡作用外,也能够抑制自噬的激活[24]。其与Beclin1结合后,抑制自噬的发生。相关实验通过加入自噬抑制剂,检测自噬阻断时Bcl-2表达的变化,结果显示Bcl-2的表达下调[25]。因而推测Bcl-2表达的变化与自噬功能密切相关。另有研究指出,在Bcl-2的调节下,钙既参与凋亡的发生,同样也与自噬的发生密切相关[26]。这进一步说明了Bcl-2家族成员在抑制细胞凋亡的同时,也可通过阻断自噬的发生来发挥原癌基因的作用。又如caspase-3作为Bcl-2家族成员,参与了长春新碱诱导的人肝癌HepG2细胞自噬性凋亡,caspase-3基因也可能是自噬性凋亡的关键因素[27]。
另外,自噬向凋亡的转变还与其他诸多因素有关,如选择性降低mRNA水平、survivin、和cIAP2蛋白表达水平以及提高Bimel等。如抗凋亡蛋白cIAPs的减少,促凋亡蛋白Bimel的增加也将诱导细胞在长期饥饿时由自噬向凋亡的转变[28]。
3.2 P53与凋亡和自噬的相关性
在细胞凋亡方面,P53的促凋亡活性可分为有转录依赖性和非转录依赖性两方面。其诱导的基因转录主要包括外源性通路和内源性通路,相关凋亡因子主要为Fas、Trail以及Bax、Bid等。而另一部分定位于胞质的P53不依赖转录活性抑制相关抑凋亡蛋白,如Bcl-2及Bcl-xl等[29]。P53在自噬方面,对细胞的影响同样具有两面性。在细胞核中,P53具有转录依赖性,自噬水平的上调与P53抑制m-TOR通路有关。而在细胞质中,P53则与细胞自噬被抑制密切相关[30]。细胞自噬是一个自我分解的过程,这个过程是当细胞在营养缺乏时,通过降解大分子并循环利用降解的能量来实现存活的机制。而有研究指出[31],P53与细胞营养的缺乏、细胞毒性压力等诱导的自噬有关。也有相关实验表明P53可调节Beclin1与Bcl-2的相互关系,进而来调控自噬与凋亡之间的相互转换[32]。
3.3 ROS对自噬与凋亡的调节作用
有研究显示,自噬与ROS/RNS存在一定关系,通过自噬抑制剂3-MA抑制自噬,能够显著提高ROS/RNS的水平。同时相关实验表明清除ROS/RNS能显著诱导细胞死亡[33]。越来越多的研究显示自噬可促进细胞凋亡。最近,研究指出ROS是与细胞凋亡和自噬相关的中心分子。ROS调节细胞的生长和存活[34],然而,ROS的过度产生可造成不可逆的细胞损伤,诱导细胞凋亡和自噬。此外,ROS可抑制PI3K/Akt信号通路,但能激活丝裂原活化蛋白激酶(MAPK)信号通路[35]。研究显示,在癌症治疗中,ROS调节自噬具有正面和负面作用。ROS不仅与自噬相关,也是影响细胞凋亡和增殖的关键因素。当内质网出现错误折叠或未折叠蛋白的聚集等平衡紊乱的现象,便会产生内质网应激。研究表明内质网应激与活性氧具有相关性。改变细胞内氧化还原状态将影响ROS的产生。反之,ROS的产生也将对细胞内氧化还原水平产生影响。这也提示了细胞内氧化还原水平在内质网应激所介导的细胞凋亡中起重要作用[36]。亦有报道提出,衰老过程中ROS积累,会导致免疫衰老和自噬缺陷。进而转化成细胞免疫逃逸形成肿瘤。而肿瘤细胞产生的ROS作用于间质细胞,诱导间质产生高能代谢产物,为肿瘤细胞生存提供能量[37]。此外,一些研究者认为ROS与诱导肿瘤形成存在一定的量效关系。研究认为高浓度的ROS会造成DNA、蛋白质等的损伤,诱导细胞凋亡。中浓度ROS引起细胞周期阻滞,诱导细胞分化。而低浓度ROS能够促进细胞有丝分裂和增殖[38]。因此,ROS体内含量必须控制在一定范围之内,以维持内环境的相对稳定,过多或过少都会引发相关疾病。实验表明葡萄籽原花青素(grape seed proanthocyanidin, GSP)可通过ROS表达变化诱导凋亡和自噬。当应用自噬抑制剂3-MA阻断自噬时,GSP诱导细胞凋亡的能力下降。这提示了,GSP诱导的自噬对细胞的凋亡具有促进作用[39]。也有实验指出从极细枝孢霉中提取的次级代谢产物Cladosporol A能够触发ROS介导的细胞死亡,包括释放细胞色素C、调节Bax表达和下调Bcl-2蛋白以及促进自噬相关蛋白LC3-I向LC3-II转换等[40]。
3.4 其他相关机制
在脊椎动物中,ambra1是含1300个氨基酸的蛋白质,它被认为是积极的自噬调节者,其在自噬调节和选择性自噬中发挥着关键作用[41]。特别是ambra1与线粒体自噬也密切相关。其可通过调节线粒体自噬来调节细胞内环境的稳定[42]。研究表明ambra1还参与了细胞增殖、分化、和凋亡等一些相关疾病的过程。在ambra1缺陷的小鼠中,存在着大量的凋亡细胞。因此,ambra1被认为是一种抑癌基因。它在肿瘤发生过程中发挥着关键作用[43]。此外,ambra1中的BH3结构域在细胞凋亡和自噬的转变中发挥着关键性作用。其他如RNA结合结构域5(RBM5),它也是一种抑癌基因,其抑制肿瘤细胞的生长且通过诱导细胞凋亡提高药物化学敏感性。但研究结果表明,RBM5过度表达将造成人肺腺癌细胞自噬被诱导,这可能与上调Beclin1,NF-κB /p65κ,并下调Bcl-2有关[44]。
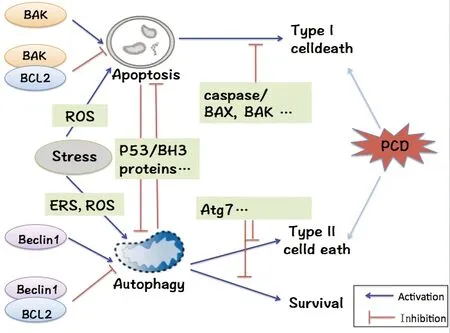
图1 自噬与凋亡关系Fig.1 Relationship between autophagy and apoptosis
自噬通过溶酶体途径进行自我降解,对细胞的生存、发育、平衡和分化等有重要意义,对机体有着保护性的作用。在肿瘤局部低氧的微环境下,将促进自噬的发生。自噬可通过P62的降解、信号转导子和转录激活子(STAT)3磷酸化来实现保护肿瘤细胞在自噬环境下不被细胞毒性T淋巴细胞(CTL)杀伤[45]的目的。
有研究显示,漆树酸能够诱导前列腺癌细胞凋亡,其作用机制是通过激活内质网应激/ DAPK3/Akt信号通路从而诱导自噬的产生,进而促进了细胞的凋亡[46]。又如,银杏性外种皮提取物可以通过AMPK /mTOR/p70S6k信号通路诱导lewis肺癌细胞凋亡和自噬,从而达到抑制肿瘤细胞生长的作用[47]。
此外,研究表明内质网应激与自噬和凋亡也存在相关性。如内质网应激相关基因DDIT3,其能够上调TNFRSF10 A与TNFRSF10B的表达从而影响肿瘤细胞凋亡,且可作为转录因子或与ATG5相结合进而发挥对肿瘤细胞自噬的调控作用[48]。另外,自噬相关蛋白Atg9b的缺失,也将引起肝癌发生过程中的自噬抑制以及增强内质网应激相关肝癌细胞的凋亡[49]。
4 自噬与凋亡的关系
正常生理条件下,为维持细胞合成与分解的代谢平衡,使细胞保持稳定状态,自噬在细胞中应保持基础水平。而当细胞发生各种应激时,自噬作常为促细胞存活机制被激活。自噬能通过降解各种代谢废物、损伤蛋白等并防止其累积,进而来维持细胞内环境稳态,抑制细胞癌变。然而,肿瘤一旦形成,或外界环境刺激过强超出细胞的调节能力时,细胞自噬可通过降解细胞质的溶酶体为癌细胞提供更丰富的营养和能量从而促进细胞存活。一方面,自噬在一定条件下可促进细胞生存,起到保护性作用。另一方面,自噬将诱导细胞II型程序性死亡,其不同于I型程序性死亡即细胞凋亡。总之,自噬与凋亡虽有区别,但因一些共同蛋白分子的调控又相互联系,如图1所示。且自噬根据不同病理类型起着不同的作用,在白血病细胞中,已经证明自噬可能是有害的,可作为增强癌细胞增殖和存活的关键。又如盐霉素能够诱导凋亡和自噬的产生,但自噬起相反的作用,其能起到保护肿瘤细胞的作用[50]。因此,了解自噬和凋亡的关系显得十分重要,这为生化和药理靶点的发现开发了新的治疗方法。
4.1 自噬诱导细胞凋亡
有研究指出自噬发生于凋亡之前,自噬是凋亡发生的必须条件。当自噬被过度激活时,溶酶体降解细胞成分并诱导细胞死亡[51]。因而,自噬性细胞死亡可能是实现凋亡耐受的肿瘤细胞死亡的一种方式。相关实验[52]通过自噬抑制剂3-MA抑制自噬,发现细胞的凋亡作用也被抑制。研究证明自噬抑制剂elaiophylin可通过内质网应激诱导细胞凋亡,发挥对多发性骨髓瘤的抑制作用[53]。细胞自噬既可通过调控癌基因的表达、清除致瘤代谢产物等途径抑制肿瘤的发生,又可通过干预凋亡因子等作用,对肿瘤细胞的凋亡产生影响,进而抑制肿瘤的发展。相关研究通过蛋白质印迹法、吖啶橙等方法观察姜黄素对膀胱癌细胞的作用,发现药物能够显著促进LC3II蛋白的表达,下调P62的表达,吖啶橙染色观察到自噬囊泡显著增加,进一步说明了药物诱导自噬的作用。但给予自噬抑制剂3-MA干预后,药物能够逆转对细胞的杀伤作用。这表明了药物通过激活自噬来发挥促凋亡的作用[54]。实验表明广木香乙醇提取物通过诱导凋亡和自噬发挥抑制肿瘤的作用。其主要通过阻断人前列腺癌细胞LNCaP自噬进而促进了细胞的凋亡,据此被认为是治疗前列腺癌的潜在药物[55]。
4.2 自噬抑制细胞凋亡
在肿瘤治疗中,患者常产生肿瘤耐药现象,而凋亡耐受是其产生的重要机制。自噬与肿瘤耐药密切相关。细胞自噬可对抗肿瘤药诱导细胞凋亡的过程产生影响,导致肿瘤耐药。自噬可为肿瘤细胞在营养缺乏和低氧环境时提供营养,保护肿瘤细胞逃避凋亡而存活,是肿瘤细胞的一种存活机制。其主要是通过降解凋亡相关蛋白,进而起到抗凋亡的作用。内质网应激可通过CHOP 途径、 ASK1-JNK途径和 caspase-12 途径等诱导细胞凋亡[56]。而作为自噬的诱导因素,内质网应激在自噬过程中发挥重要作用,反之,自噬对内质网应激也具有重要影响,其能平衡内质网应激所诱导的内质网膨胀,从而促进细胞的存活。尤其在肿瘤晚期,自噬是促进肿瘤细胞耐药的重要因素,有利于肿瘤细胞存活,发挥着促进肿瘤细胞生长的作用。相关实验[57]通过自噬抑制剂进行的干预,观察自噬被抑制后对细胞凋亡的影响。结果显示,药物单独作用于肿瘤细胞时,自噬水平有所上升,而自噬抑制剂增加了药物对肿瘤细胞凋亡的诱导。
4.3 自噬与凋亡在特定条件下相互转化或协同作用
不仅自噬能够促进或抑制凋亡。同时,也有研究指出,凋亡与自噬能够同时发生,共同促进细胞死亡[58]。相关实验通过将白头翁皂苷作用于结肠癌细胞HT-29,发现其既能通过抑制AKT活性导致细胞凋亡,又可通过抑制AKT/mTOR通路,诱导人结肠癌细胞产生自噬[59]。此外,凋亡也能促进细胞向自噬性死亡转化[60]。因此,有人提出,自噬发生在凋亡之前,是发生凋亡所必须的[61]。当凋亡或自噬的某一方出现缺陷时,另一方仍将发挥诱导细胞凋亡的作用。如在Bak和Bax缺陷的细胞中,内质网应激诱导的细胞凋亡将被抑制,然而持续性自噬能够引起氧化损伤,诱导细胞死亡[62]。
5 展望
在肿瘤的发生发展过程中,肿瘤微环境对其影响较大。而自噬与凋亡被认为是影响肿瘤微环境的重要因素。自噬不仅作为细胞生存的一种保护机制,也是一种细胞死亡方式。随着研究的深入,越来越多的研究都证明凋亡与自噬之间存在一定关系。自噬能否被调节,与肿瘤细胞的生长与凋亡密切相关。
目前,肿瘤化疗和放疗仍是治疗癌症的主要手段,但都增加氧化应激和DNA损伤,具有明显的细胞毒性。一方面,由于肿瘤细胞能够依赖自噬功能对放化疗和相关药物的压力产生耐受而利于自身存活。在应用化疗和放疗的同时,结合给予自噬抑制剂被视为癌症治疗的一种新手段。另一方面,诱导自噬也可以维持细胞内蛋白质及细胞器等的更新、抑制DNA的损伤和累积,从而维持细胞内环境的稳态。因而,诱导自噬在癌症的预防和治疗中扮演着重要的角色。但自噬与凋亡是通过何种方式发挥作用,对不同类型的肿瘤细胞影响是否相同,这些都有待进一步的探索。深入研究凋亡与自噬之间的关系,对相关疾病的预防和治疗具有重大意义。
此外,在肿瘤的生存、复发乃至转移的过程中会耗损脾肾之精,导致脾肾亏虚,免疫缺陷,自噬失调。健脾补肾中药对改善肿瘤微环境起重要作用。但中医药能否通过促进肿瘤细胞自噬性死亡达到抑制肿瘤的目的,成为中医药抗肿瘤研究的新方向,尤其是中药复方在肿瘤治疗中对肿瘤细胞自噬是否具有干预作用,这些都需要通过大量的实验进行深入的研究验证。利用好凋亡与自噬的关系,促进肿瘤细胞的凋亡,进而提高抗癌效果,将成为日后的研究热点。
[1] Grasso S, Menendez-Gutierrez P, Carrasco-Garccia E, et al. Cell Death and Cancer, Novel Therapeutic Strategiess,Apoptosis and Medicine[M].2012,Tobias Ntuli(Ed.).In Tech.DoI:105772151282.
[2] Fahie K, Zachara NE. Molecular functions of glycoconjugates in autophagy [J]. J Mol Biol, 2016, 428(16): 3305-3324.
[3] Shin KD, Han NL, Chung T. A revised assay for monitoring autophagic flux in arabidopsis thaliana reveals involvement of AUTOPHAGY-RELATED9 in autophagy [J]. Mol Cells, 2014, 37(5): 399-405.
[4] Eisenberg-Lerner A, Bialik S, Simon HU, et al. Life and death partners: apoptosis, autophagy and the cross-talk between them [J]. Cell Death Differ, 2009, 16(7): 966-975.
[5] Ng AY, Bales W, Veltri RW. Phenylbutyrate-induced apoptosis and differential expression of Bcl-2, Bax, p53 and Fas in human prostate cancer cell lines [J]. Anal Quant Cytol Histol, 2000, 22(1): 45-54.
[6] Peng J, Lapolla SM, Zhang Z, et al. The cytosolic domain of Bcl-2 oligomerizes to form pores in model mitochondrial outer membrane at acidic pH [J]. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi, 2009, 26(3): 631-637. (Text in Engl)
[7] Bremer E. Targeting of the tumor necrosis factor receptor superfamily for cancer immunotherapy [J]. ISRN Oncol, 2013, 2013: 371854.
[8] Liu MQ, Chen Z, Chen LX. Endoplasmic reticulum stress: a novel mechanism and therapeutic target for cardiovascular diseases [J]. Acta Pharmacol Sin, 2016, 37(4): 425-443.
[9] Obeng EA, Boise LH. Caspase-12 and caspase- 4 are not required for caspase-dependent endoplasmic reticulum stress-induced apoptosis [J]. J Biol Chem, 2005, 280(33): 29578-29587.
[10] Shaid S, Brandts CH, Serve H, et al. Ubiquitination and selective autophagy [J]. Cell Death Differ, 2013, 20(1): 21-30.
[11] Walczak M, Martens S. Dissecting the role of the Atg12-Atg5-Atg16 complex during autophagosome formation [J]. Autophagy, 2013, 9(3): 424-425.
[12] Julien LA, Carriere A, Moreau J, et al. mTORC1-activated S6K1 phosphorylates Rictor on threonine 1135 and regulates mTORC2 signaling [J]. Mol Cell Biol, 2010, 30(4): 908-921.
[13] Abraham RT. Toward a molecular definition of leucine-dependent mTORC1 activation [J]. Cell Metab, 2016, 23(3): 397-398.
[14] Yuan L, Wei S, Wang J, et al. Isoorientin induces apoptosis and autophagy simultaneously by reactive oxygen species (ROS)-related p53, PI3K/Akt, JNK, and p38 signaling pathways in HepG2 cancer cells [J]. J Agric Food Chem, 2014, 62(23): 5390-5400.
[15] Fogel AI, Dlouhy BJ, Wang C, et al. Role of membrane association and Atg14-dependent phosphorylation in beclin-1-mediated autophagy [J]. Mol Cell Biol, 2013, 33(18): 3675-3688.
[16] Wirawan E, Vande Walle L, Kersse K, et al. Caspase-mediated cleavage of Beclin-1 inactivates Beclin-1-induced autophagy and enhances apoptosis by promoting the release of proapoptotic factors from mitochondria [J]. Cell Death Dis, 2010, 1(1): e18.
[17] Liu Q, Leber B, Andrews DW. Interactions of pro-apoptotic BH3 proteins with anti-apoptotic Bcl-2 family proteins measured in live MCF-7 cells using FLIM FRET [J]. Cell Cycle, 2012, 11(19): 3536-3542.
[18] Lee JA, Gao FB. Regulation of Aβ pathology by beclin 1: a protective role for autophagy? [J]. J Clin Invest, 2008, 118(6): 2015-2018.
[19] Hosseini A, Espona-Fiedler M, Soto-Cerrato V, et al. Molecular interactions of prodiginines with the BH3 domain of anti-apoptotic Bcl-2 family members [J]. PLoS One, 2013, 8(2): e57562.
[20] Djavaheri-Mergny M, Maiuri MC, Kroemer G. Cross talk between apoptosis and autophagy by caspase-mediated cleavage of Beclin 1[J]. Oncogene, 2010, 29(12): 1717-1719.
[21] Huang X, Qi Q, Hua X, et al. Beclin 1, an autophagy-related gene, augments apoptosis in U87 glioblastoma cells [J]. Oncol Rep, 2014, 31(4): 1761-1767.
[22] 董琳, 童煜, 毛萌. Bcl-2蛋白对自噬和凋亡的调控及其相关机制 [J]. 医学研究杂志, 2012, 41(8): 174-177.
[23] 吕梦, 陆航. Beclin1基因在SW620细胞自噬和凋亡中作用[J]. 南方医科大学学报,2017,3(3): 373-377.
[24] Pattingre S, Levine B. Bcl-2 inhibition of autophagy: A new route to cancer? [J] Cancer Res, 2006, 66(6): 2885-2888.
[25] Oh S, Xiaofei E, Ni D, et al. Downregulation of autophagy by Bcl-2 promotes MCF7 breast cancer cell growth independent of its inhibition of apoptosis [J]. Cell Death Differ, 2011,18(3): 452-464.
[26] Zhou F, Yang Y, Xing D. Bcl-2 and Bcl-xL play important roles in the crosstalk between autophagy and apoptosis [J]. FEBS J, 2011, 278(3): 403-413.
[27] Peng XZ, Chen Y. Cloning and identification of caspase-3 gene from HepG2 cells that underwent autophagic apoptosis [J]. Cancer Res Prev Treat, 2006,33(5): 349-351.
[28] Hay-Koren A1, Bialik S1, Levin-Salomon V, et al. Changes in cIAP2, survivin and BimEL expression characterize the switch from autophagy to apoptosis in prolonged starvation [J]. J Inter Med, 2017, 281(5): 458-470.
[29] Morselli E, Tasdemir E, Maiuri MC, et al. Mutant p53 protein localized in the cytoplasm inhibits autophagy [J]. Cell Cycle, 2008, 7(19): 3056-3061.
[30] Guglielmelli T, Giugliano E, Brunetto V, et al. mTOR pathway activation in multiple myeloma cell lines and primary tumour cells: pomalidomide enhances cytoplasmic-nuclear shuttling of mTOR protein [J]. Oncoscience, 2015, 2(4): 382-394.
[31] Vakifahmetoglu-Norberg H, Kim M, Xia HG, et al. Chaperone-mediated autophagy degrades mutant p53 [J]. Genes Dev, 2013, 27(15): 1718-1730.
[32] Coker-Gürkan A, Arisan ED, Obakan P, et al. Lack of functional p53 renders DENSpm-induced autophagy and apoptosis in time dependent manner in colon cancer cells [J]. Amino Acids, 2015, 47(1): 87-100.
[33] Zheng N, Liu L, Liu WW, et al. Crosstalk of ROS/RNS and autophagy in silibinin-induced apoptosis of MCF-7 human breast cancer cells in vitro [J]. Acta Pharmacol Sin, 2017, 38(2): 277-289.
[34] Li L, Tan J, Miao Y, et al. ROS and autophagy: interactions and molecular regulatory mechanisms [J] Cell Mol Neurobiol, 2015, 35(5): 615-621.
[35] Zhong WF, Wang XH, Pan B, et al. Eupatilin induces human renal cancer cell apoptosis via ROS-mediated MAPK and PI3K/AKT signaling pathways [J]. Oncol Lett, 2016, 12(4): 2894-2899.
[36] Itoh T, Ohguchi K, Nozawa Y, et al. Intracellular glutathione regulates sesquiterpene lactone-induced conversion of autophagy to apoptosis in human leukemia HL60 cells [J]. Anticancer Res, 2009, 29(4): 1449-1457.
[37] 靖林林, 龚先玲, 孙学刚. 自噬的中医属性及其在人体衰老和肿瘤发病中的意义 [J]. 中医杂志, 2014, 55(22): 1891-1893.
[38] Zhu C, Hu W, Wu H, et al. No evident dose-response relationship between cellular ROS level and its cytotoxicity-a paradoxical issue in ROS-based cancer therapy [J]. Sci Rep, 2014, 4(4): 5029.
[39] Hah YS,, Kim JG, Cho HY, et al. Procyanidins from Vitisvinifera seeds induce apoptotic and autophagic cell death via generation of reactive oxygen species in squamous cell carcinoma cells [J]. Oncol Lett, 2017, 14(2): 1925-1932.
[40] Koul M, Kumar A, Deshidi R, et al. Cladosporol A triggers apoptosis sensitivity by ROS-mediated autophagic flux in human breast cancer cells [J]. BMC Cell Biol, 2017, 18(1): 26.
[41] Cianfanelli V, Nazio F, Cecconi F. Connecting autophagy: AMBRA1 and its network of regulation [J]. Mol Cell Oncol, 2015, 2(1): e970059.
[42] Strappazzon F, Vietri-Rudan M, Campello S, et al. Mitochondrial BCL-2 inhibits AMBRA1-induced autophagy [J]. EMBO J, 2011, 30(7): 1195-1208.
[43] Cianfanelli V, Fuoco C, Lorente M, et al. AMBRA1 links autophagy to cell proliferation and tumorigenesis by promoting c-MYC dephosphorylation and degradation [J]. Nat Cell Biol, 2015, 17(1): 20-30.
[44] Su Z, Wang K, Li R, et al. Overexpression of RBM5 induces autophagy in human lung adenocarcinoma cells [J]. World J Sur Oncol, 2016, 14: 57.
[45] Noman MZ, Janji B, Kaminska B, et al. Blocking hypoxia-induced autophagy in tumors restores cytotoxic T-cell activity and promotes regression [J]. Cancer Res, 2011, 71(18): 5976-5986.
[46] Tan J, Jiang X, Yin G, et al. Anacardic acid induces cell apoptosis of prostatic cancer through autophagy by ER stress/DAPK3/Akt signaling pathway [J]. Oncol Rep, 2017, 38(3): 1373-1382.
[47] Cao C, Han D, Su Y, et al. Ginkgo biloba exocarp extracts induces autophagy in Lewis lung cancer cells involving AMPK / mTOR / p70S6k signaling pathway [J]. Biomed Pharmacother, 2017, 93: 1128-1135.
[48] Zheng X, Jin X, Li F, et al. Inhibiting autophagy with chloroquine enhances the anti-tumor effect of high-LET carbon ions via ER stress-related apoptosis [J]. Med Oncol, 2017, 34(2): 25.
[49] Wang N, Tan HY, Li S, et al. Atg9b deficiency suppresses autophagy and potentiates endoplasmic reticulum stress-associated hepatocyte apoptosis in hepatocarcinogenesis[J]. Theranostics, 2017, 7(8): 2325-2338.
[50] Takahashi H, Inoue J, Sakaguchi K, et al. Autophagy is required for cell survival under L-asparaginase-induced metabolic stress in acute lymphoblastic leukemia cells [J]. Oncogene, 2017, 36(30): 4267-4276.
[51] Denton D, Shravage B, Simin R, et al. Autophagy, not apoptosis, is essential for midgut cell death in Drosophila [J]. Curr Biol, 2009, 19(20): 1741-1746.
[52] Park SH, Chi GY, Eom HS, et al. Role of autophagy in apoptosis induction by methylene chloride extracts, of Mori cortex in NCI-H460 human lung carcinoma cells [J]. Int J Oncol, 2012, 40(6): 1929-1940.
[53] Wang G, Zhou P, Chen X, et al. The novel autophagy inhibitor elaiophylin exerts antitumor activity against multiple myeloma with mutant TP53 in part through endoplasmic reticulum stress-induced apoptosis [J]. Cancer Biol Ther, 2017, 18(8): 584-595.
[54] Li J, Yang D, Wang W, et al. Inhibition of autophagy by 3-MA enhances IL-24-induced apoptosis in human oral squamous cell carcinoma cells[J].J ExpClin Cancer Res,2015,34:97.
[55] Tian X, Song HS, Cho YM, et al. Anticancer effect of Saussurealappa extract via dual control of apoptosis and autophagy in prostate cancer cells [J]. Medicine (Baltimore), 2017, 96(30): e7606.
[56] Xu XC, Liu TT, Zhang AM, et al. Retraction for reactive oxygen species-triggered trophoblast apoptosis is initiated by endoplasmic reticulum stress via activation of caspase-12, CHOP, and the JNK pathway in Toxoplasma gondii infection in mice [J]. Infect Immun, 2015, 83(4): 1735.
[57] Sung B, Chung HY, Kim ND. Role of apigenin in cancer prevention via the induction of apoptosis and autophagy [J]. J Cancer Prev, 2016, 21(4): 216-226.
[58] Ryter SW, Mizumura K, Choi AM. The impact of autophagy on cell death modalities [J]. Int J Cell Biol, 2014, 2014: 502676.
[59] 罗颖颖. 白头翁皂苷抗肿瘤作用及机制研究 [D]. 湖南中医药大学, 2014.
[60] Jo GH, Bögler O, Chwae YJ, et al. Radiation-induced autophagy contributes to cell death and induces apoptosis partly in malignant glioma cells [J]. Cancer Res Treat, 2015, 47(2): 221-241.
[61] Inoue K, Kuwana H, Shimamura Y, et al. Cisplatin-induced macroautophagy occurs prior to apoptosis in proximal tubules in vivo [J]. Clin Exp Nephrol, 2010, 14(2): 112-122.
[62] Kepp O, Rajalingam K, Kimmig S, et al. Bak and Bax are non-redundant during infection-and DNA damage-induced apoptosis [J]. EMBO J, 2007, 26(3): 825-834.
