树鼩粪便中沙门氏菌LAMP检测方法建立及应用
2018-03-05张志成刘城秀宋庆凯孙晓梅
王 璇,袁 园,张志成,刘城秀,宋庆凯,孙晓梅
(中国医学科学院/北京协和医学院医学生物学研究所树鼩种质资源中心,中国医学科学院医学生物学研究所实验树鼩标准化与应用研究省创新团队,云南省眼科疾病防治研究重点实验室,昆明 650118)
沙门氏菌(Salmonella)属于γ-变形菌纲、肠杆菌科、沙门氏菌属,为革兰氏阴性菌。是重要的人兽共患病病原菌之一,引起人兽感染后可能表现为无症状带菌状态,也会出现有症状的致死疾病,能加重病态或死亡率, 或者降低动物的繁殖生产力[1],对实验动物的影响较严重;是所有实验动物微生物质量控制中必须排除的病原菌。肠炎沙门氏菌(Salmonellaenteritidis)和伤寒沙门氏菌(Salmonellatyphimurium) 是全世界流行的主要沙门氏菌[2],感染后通常引起呕吐、腹泻、肠炎等症状。
环介导等温扩增技术是由Notomi等[3]在2000年最早发明的一种新型的核酸扩增方法。其原理是针对靶基因保守序列的6~8区域设计4~6条引物,包括外引物、内引物、环引物各一对,其中内引物和外引物是反应必需的,加入环引物可通过与茎环DNA杂交,并促进链置换和扩增[4-5],以加速LAMP反应,在具链置换活性的DNA 聚合酶(如Bst)作用下,即可在60℃~66℃的恒温条件下短时间内实现大量扩增,反应结果可通过直接观察是否产生焦磷酸镁白色沉淀来判断[6-7],也可在反应前后加入显色剂(如钙黄绿素,SYBR Green I等)根据颜色变化来判断,还可在紫外光下通过观察荧光情况判断[8-9];对扩增产物进行凝胶电泳为梯状条带。LAMP法检测具有特异、灵敏、快速、便携等特点,在恒温条件下40 min内即可完成高效扩增反应,可肉眼观察反应结果,被广泛应用病原菌和寄生虫的检测中[10]。
树鼩作为一种实验动物,其在进化上接近于灵长类动物,在生理、生化及解剖学等生物学特性方面与人类有着相似之处,被广泛引用于人类病毒性疾病[11]、眼科疾病[12]、生殖生物学及免疫学[13]等疾病研究中。利用树鼩进行实验前需要检测沙门氏菌以排除其对实验的干扰,因此,建立快速、简便、特异的方法对于树鼩沙门氏菌检测具有重要意义。本研究旨在建立一种具有上述特点的可大规模检测树鼩粪便沙门氏菌的LAMP方法。
1 材料和方法
1.1 实验菌株
本研究使用的两个阳性菌株即肠炎沙门氏菌(CMCC50041株,冻干粉)和乙型副伤寒沙门氏菌(CMCC50094株,冻干粉)来自于中国食品药品鉴定研究院;其它菌株即普通变形杆菌、粪肠球菌等8株均为前期从野生来源树鼩肠道中分离、鉴定、保存的菌株[14],见表1中3~10号样品,由中国医学科学院医学生物学研究所的李建芳老师惠赠。

表1 实验菌株及来源
1.2 树鼩粪便样本
利用肛拭子采集野生来源、腹泻树鼩的稀便,于1.5 mL离心管中,4℃保存。
1.3 主要仪器与试剂
高速离心机(HIMAC);nanophotometer N50超微量分光光度仪(Implen); PCR 扩增仪(Bio-Rad);凝胶成像仪(Bio-Rad);电泳仪和电泳槽(Bio-Rad);细菌全基因组提取试剂盒(TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0);金牌Mix(擎科生物);WarmStart®LAMP 试剂盒(New England Biolabs Inc);GelRed凝胶核酸染料(Biotium)。
1.4 实验方法
1.4.1 菌种培养
首先将试验菌株接种于LB液体培养基内,恒温振荡器内37℃ 250 r/min过夜培养,以活化和增殖细菌。然后将肠炎沙门氏菌和乙型副伤寒沙门氏菌分别接种于SS培养基上,其余菌种接种于营养琼脂,37℃恒温培养箱倒置培养24 h。
1.4.2 菌液浓度测定
将纯培养的肠炎沙门氏菌用无菌水10倍梯度稀释后接种,按平板菌落计数法计数。
1.4.3 细菌DNA提取
纯培养的实验菌株参照细菌全基因组提取试剂盒说明书提取DNA;粪便样品中细菌DNA提取参考LaMontagne[15]、骞宇[16]的细菌基因组提取方法并略微改变。
1.4.4 引物设计
利用沙门氏菌的invA基因,参考Rahn等[17]的文献合成普通PCR引物(invA-F、invA-R);参考Yang等[18]的研究合成LAMP引物(F3、B3、FIP、BIP、Loop-F、Loop-B),引物由擎科生物合成,引物序列见表2。
1.4.5 LAMP检测方法建立和条件优化
利用经普通PCR检测为阳性的上述样本进行LAMP方法建立及优化。按照WarmStart® LAMP 试剂盒说明书,采用25 μL的反应体系,包括WarmStart LAMP 2X Master Mix 12.5 μL,40 pmol FIP/BIP各1 μL,10 pmol F3/B3各1 μL, 20 pmol LB/LF 各1 μL,LAMP Fluorescent Dye (50X) 0.5 μL,模板DNA 1 μL,ddH2O补足25 L。对反应温度和反应时间进行优化,其中设置温度梯度57℃、58℃、59℃、60℃、61℃、62℃、63℃、64℃、65℃、66℃;设置时间梯度24、26、28、30、32、34、36、38、40、42 min,以筛选最佳反应温度和反应时间。
1.4.6 LAMP产物检测
直接肉眼观察判断,管中出现白色浑浊为阳性,无明显浑浊为阴性。另外,反应前在体系中加入钙黄绿素,反应结束后阳性为绿色,阴性为橙色,紫外光照射下阳性发出绿色荧光,阴性不发荧光。取LAMP产物3 μL用2%的琼脂糖进行凝胶电泳,在凝胶成像系统中成像, 阳性为梯状条带;阴性无明显条带。
1.4.7 灵敏度测试
用上述建立的LAMP方法对2株沙门氏菌标准株和8株非沙门氏菌进行检测,同时进行普通PCR扩增(其中PCR反应条件为:94℃预变性5 min;94℃变性40 s,60℃退火40 s,72℃延伸50 s,35个循环;72℃延伸5 min;保存于4℃)。取扩增产物3 μL于2%的琼脂糖进行凝胶电泳。
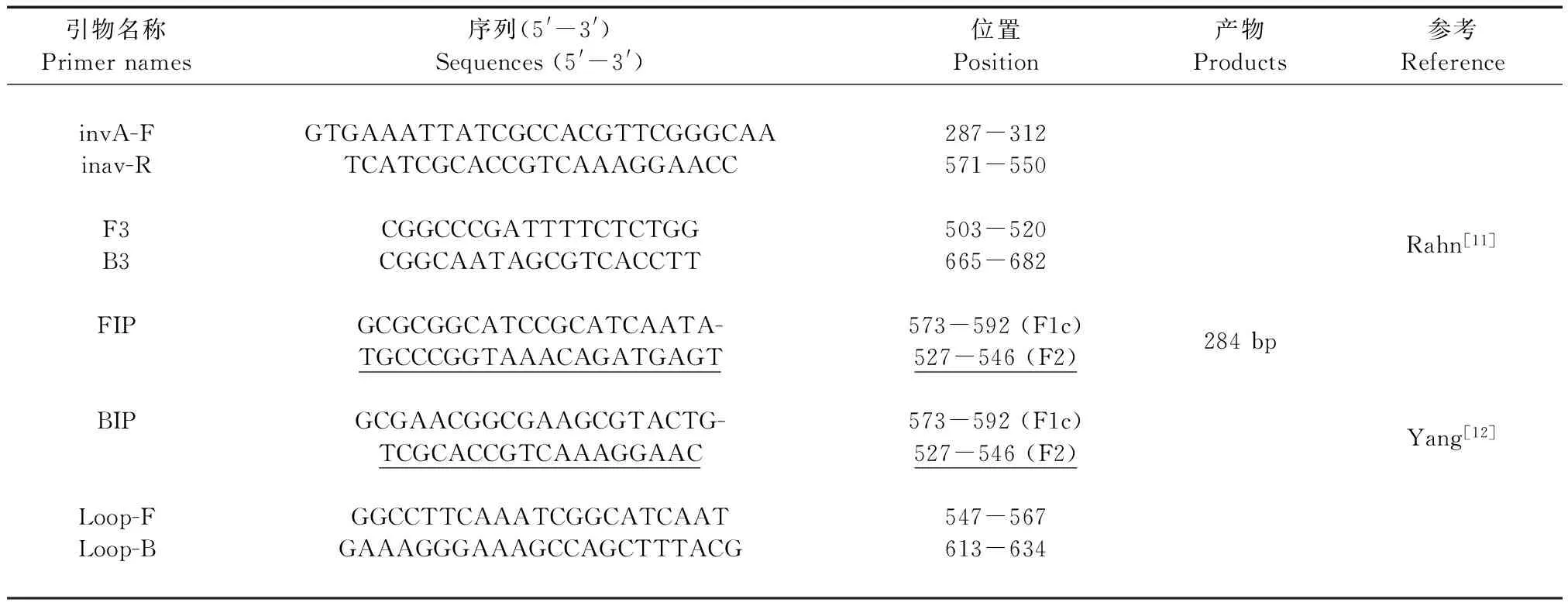
表2 引物序列
1.4.8 灵敏度测试
用无菌水10倍梯度稀释纯培养的沙门氏菌,每个稀释梯度取5 mL菌液提取DNA。分别进行PCR和LAMP法扩增、电泳,比较两种方法的灵敏度。
1.4.9 LAMP法在快速检测树鼩粪便中沙门氏菌的应用
对91份野生树鼩新鲜稀便提取的DNA样品用建立的LAMP法进行检测,同时用普通PCR法进行对比,比较两种方法的检出率。
2 结果
2.1 沙门氏菌标准株检测
纯培养的沙门氏菌初始浓度为3.36×108CFU/mL。PCR扩增后凝胶电泳结果显示在284 bp处有目的条带(见图 1),表明为沙门氏菌阳性。LAMP试验结束后反应管内液体为绿色,无模板对照为橙色,凝胶电泳结果显示为梯状条带,是LAMP扩增的典型特征(见图2)。
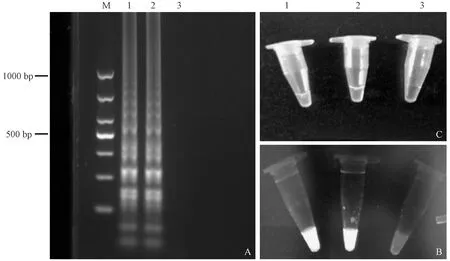
注:(A) 凝胶电泳(阳性为梯状条带);(B) 凝胶成像系统拍照;(C) 肉眼观察(阳性为绿色);(M) DL1000 DNA marker;(1) 肠炎沙门氏菌标准株;(2) 乙型副伤寒沙门氏菌标准株;(3) 无模板对照。图2 沙门氏菌标准株LAMP检测结果Note.(A) Gel electrophoresis (Positive samples show ladder strips). (B) Pictures taken by the gel imaging system. (C) Visual observation (positive samples are green). (M) DL1000 DNA marker;(1) Salmonella enteritidis standard strain. (2) Salmonella paratyphi B standard strain;(3) No template control.Fig.2 The results of Salmonella standard strain LAMP test
2.2 LAMP 反应条件优化结果
条件优化结果显示在所有温度梯度下均出现条带,且条带亮度差异较小,选取62℃作为后续实验的反应温度;反应时间在34 min以前条带亮度逐渐增强,34 min以后条带无明显差异,因此确定最佳反应时间34 min。
2.3 LAMP特异性试验结果
利用优化好的LAMP法检测特异性,结果显示只在两个沙门氏菌标准株中出现了绿色,且在紫外光下有绿色荧光,凝胶电泳结果呈梯状扩增条带,

注:(M) DL500 DNA marker;(1)肠炎沙门氏菌标准株;(2)乙型副伤寒沙门氏菌标准株;(3)无模板对照。图1 沙门氏菌标准株PCR检测结果电泳图Note:(M) DL500 DNA marker.(1) Salmonella enteritidis standard strain.(2) Salmonella paratyphi B standard strain.(3) No template control.Fig.1 The electrophoresis chart of Salmonella standard strain PCR test
而在其他8株非沙门氏菌内无明显条带。与PCR结果一致,说明建立的LAMP法对沙门氏菌具有特异性。(见图 3)
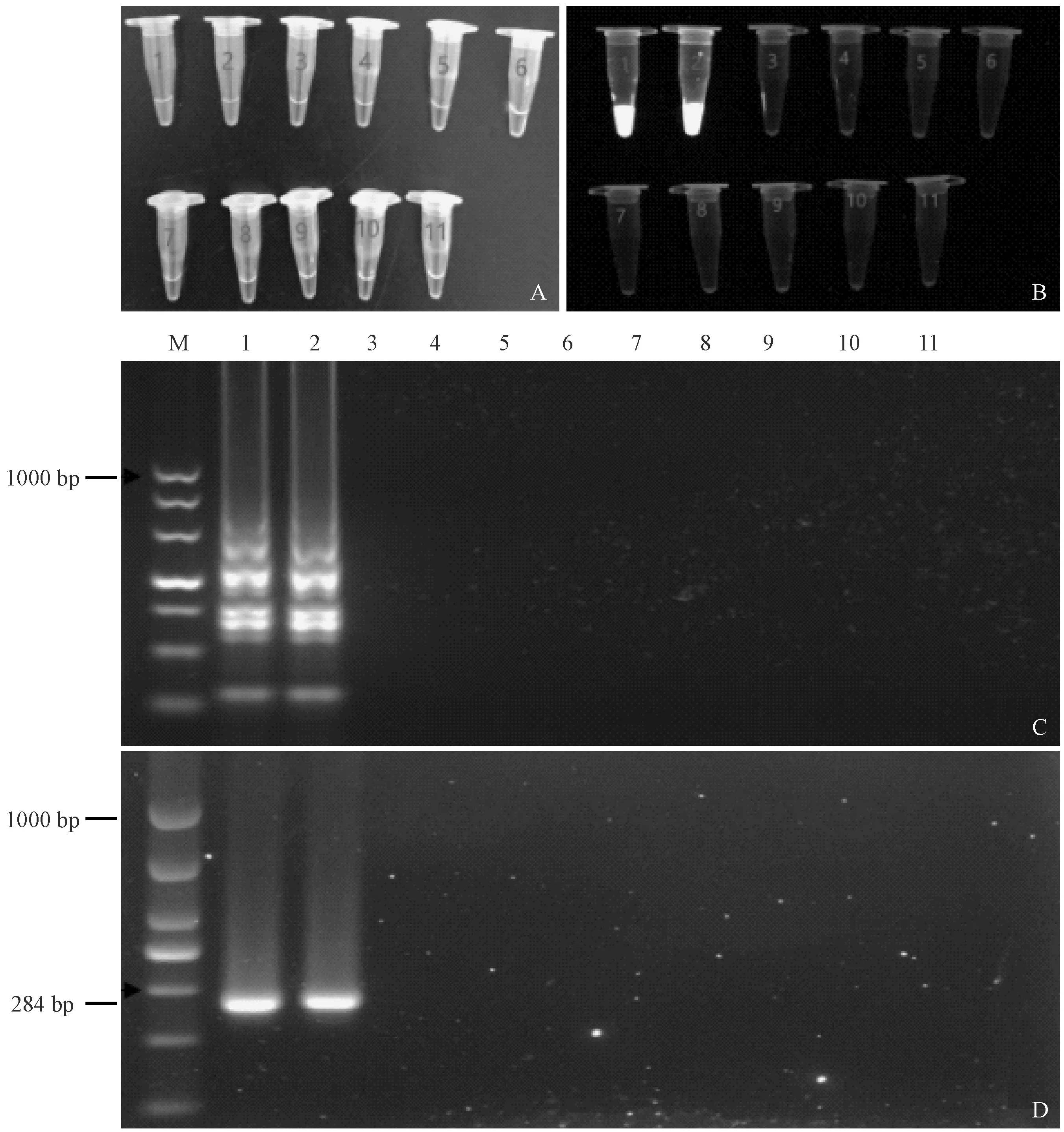
注:(A) 肉眼观察;(B) 凝胶成像系统拍照;(C) LAMP检测特异性;(D) PCR检测特异性;(M) DL1000 DNA marker;(1) 肠炎沙门氏菌;(2) 乙型副伤寒沙门氏菌;(3) 普通变形杆菌;(4) 粪肠球菌;(5) 屎肠球菌;(6) 费格森埃希菌;(7) 弗氏志贺菌;(8) 索氏志贺氏菌;(9) 大肠埃希菌;(10) 金黄色葡萄球菌;(11) 无模板对照。图3 LAMP和PCR检测特异性Note.(A) Visual observation. (B) Pictures taken by the gel imaging system. (C) The specificity test results of LAMP. (D) The specificity test results of PCR. (M) DL1000 DNA marker. (1) Salmonella enteritidis. (2) Salmonella paratyphi B. (3) Proteus vulgaris. (4) Enterococcus faecalis. (5) Enterococcus faecium. (6) Escherichia fergusonii. (7)Shigella flexneri.(8) Shigella sonnei. (9) Escherichia coli. (10) Staphylococcus aureus. (11) No template control.Fig.3 The specificity of LAMP and PCR detection
2.4 LAMP检测沙门氏菌的灵敏度及PCR比较结果
对纯培养的肠炎沙门氏菌进行梯度稀释,浓度依次为:3.36×108~3.36×100CFU/mL。然后进行LAMP和PCR检测,凝胶电泳结果显示LAMP产物在3.36×108~3.36×101CFU/mL有明显梯状条带;PCR产物在3.36×108~3.36×103CFU/mL有明显条带(见图 4)。因此,LAMP法的检测限在3.36×101~3.36×100CFU/mL之间,PCR的检测限在1×103~3.36×102CFU/mL之间,LAMP检测沙门氏菌的灵敏度是PCR检测的10~100倍。
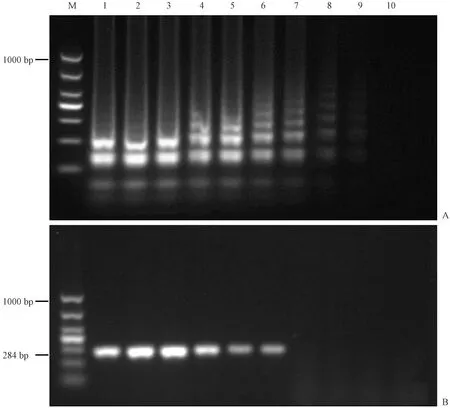
注:(A) LAMP检测灵敏度;(B) PCR检测灵敏度;(M) DL1000 DNA marker;(1~9号) 3.36×108~3.36×100 CFU/mL;(10) 无模板对照。图4 LAMP和PCR检测灵敏度Note.(A) LAMP assay. (B) PCR assay. (M) DL1000 DNA marker. (No.1-No.9) 3.36×108 to 3.36×100 CFU/mL; (10) No template control.Fig.4 Sensitivity of the LAMP and PCR assays
2.5 LAMP法在快速检测树鼩粪便中沙门氏菌的应用
对采集的91份新鲜树鼩粪便样品提取DNA进行LAMP检测,同时进行普通PCR验证,LAMP结果显示阳性样本数为19份,阳性检出率为20.88%;PCR结果显示阳性样本数为18份,阳性检出率为19.78%,且PCR和LAMP检出的阳性样品完全吻合。LAMP及PCR产物凝胶电泳部分结果(见图5)。对PCR检测阳性的样品随机抽取三份进行测序,测序结果与目的序列的吻合度均达到99%以上,因此可以确定LAMP结果的可靠性。
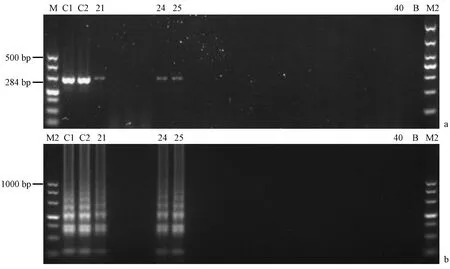
注:(a) PCR产物凝胶电泳;(b) LAMP产物凝胶电泳;(M) DNA marker;(M2) DL1000 DNA marker;(C1)肠炎沙门氏菌;(C2) 乙型副伤寒沙门氏菌;(21~40号) 树鼩粪便样品21~40号;(B) 无模板对照。图5 树鼩粪便样品部分LAMP检测结果Note.(a) The gel electrophoresis results of PCR products. (b) The gel electrophoresis results of LAMP products.(M) DL500 DNA marker. (M2) DL1000 DNA marker. (C1) Salmonella enteritidis. (C2) Salmonella paratyphi B. (No.21-40) Tree shrew fecal samples No.21-No.40. (B) No template control.Fig.5 The results of LAMP test of a part of the tree shrew stool samples
3 讨论
实验动物致病菌的筛查和检测方法通常需要具备简便、快速、特异、灵敏等特性。沙门氏菌作为一种致病性强、流行范围广的病原,目前常用的检测方法主要有传统的培养鉴定、免疫学(如ELISA试验)及分子生物学(PCR,qPCR等)方法。虽然传统的培养鉴定法仍然是沙门氏菌检测的金标准,但通常需要耗费较长的时间(3 d以上),不利于快速检测诊断[19];免疫学方法使用方便、检测快速,但其较低的特异性限制了应用[20],并且针对于树鼩这一新的实验动物品种,目前还没有可使用的市售免疫试剂盒;基于分子生物学基础的PCR和qPCR方法被广泛用于沙门氏菌检测,具有较高特异性和灵敏度,但是需要复杂的仪器设备,且结果必须通过凝胶电泳才能观察,耗时较长,不适用于大规模快速检测。LAMP方法针对目的基因的6~8个区域设计4~6条引物,只有同时存在所有引物才能启动扩增,这保证了LAMP法的特异性;LAMP法对仪器要求较低,不需要昂贵的PCR仪,在恒温水浴锅中就可以完成全部反应,避免了升降温循环的时间消耗,而且实验结果直接肉眼可视。因此,相比于传统的细菌培养、免疫学方法、PCR方法,LAMP法具有操作简便、耗时短、不需要特殊设备、结果可视等优点,更适用于现场快速检测和基层样品初筛[21-22]。
沙门氏菌invA基因编码侵袭蛋白A,与细菌吸附侵入有关[23],侵袭蛋白决定沙门氏菌对肠黏膜细胞的侵袭力,与其致病性密切相关[24],invA基因高度保守且具有种属特异性,常被用作沙门氏菌检测的靶基因。另外,虽然FimY,bcfD[25]等基因也常被用于沙门氏菌检测的靶基因,但是FimY基因作为LAMP法的靶基因时不能检测邦戈沙门菌(Salmonellabongori),所以FimY基因不适用于沙门氏菌属的所有种的检测[26]。本方法选取了invA基因作为LAMP法检测的目的基因,在其保守区设计引物,结果显示在2株沙门氏菌菌株表现出阳性,非沙门氏菌的8种细菌检测为阴性,扩增产物经测序验证,与预期一致,说明具有较好的特异性。
在本研究中建立的沙门氏菌LAMP法的检测限为3.36×101CFU/mL,是普通PCR法的10~100倍,反应时间为34 min。吴家林等[27]利用invA基因建立的沙门氏菌LAMP法检测限为4.8×101CFU/mL,反应时间60 min;邱索平等[28]利用FimY基因建立的实验猴沙门氏菌检测方法的检测限1.35×101CFU/mL,反应时间60 min;Zhuang等[25]利用bcfD基因建立的LAMP的检测限5×100,反应时间25 min;马晨等[29]比较了传统的细菌分离培养鉴定方法,其检测限是0.5×105CFU/mL,低于这一剂量的样品都将无法被检测,并且检出时间需要1 d以上,抗杂菌干扰能力较分子生物学方法低,样品中微生物污染背景较高且沙门氏菌剂量较低时,检测结果易被干扰。本研究建立的树鼩粪便中沙门氏菌的LAMP检测方法的灵敏度与其他的研究报道的LAMP方法相近,而高于传统的培养鉴定方法;反应时间明显低于传统培养鉴定方法和不含LF/LB引物的LAMP方法,说明加入LF/LB引物能通过促进链置换和扩增从而大大加速LAMP反应[4-5]。
由于LAMP法较高的灵敏度和扩增效率,极易因污染而出现假阳性[26],因此在加样过程中应该尽量避免交叉污染和产生气溶胶污染,阳性模板和其他样品模板加样区域应分离。在本试验中使用的显色剂是钙黄绿素,在反应前加入到反应体系,反应过程中不需开盖,避免了反应后开盖加入显色剂时引起的气溶胶污染,保证了实验的特异性。
利用建立的LAMP法对91份野生来源树鼩新鲜稀便样品检测,结果显示LAMP法检测的阳性率为20.88%,PCR检测的阳性率为19.78%,阳性样品完全一致,表明所建立LAMP方法可用于树鼩粪便样品的检测。邢进等[30]曾对树鼩肠道内容物进行细菌分离培养,并进行生化、药敏和16SrRNA 测序鉴定,最终得出树鼩沙门氏菌携带率为3.3%;高家红等[31]的树鼩正常肠道细菌的培养分离鉴定及其药敏试验研究结果显示沙门氏菌携带率8.41%。本研究的沙门氏菌阳性检出率高于上述研究结果,原因之一是样品来源不同,本次实验检测的粪便样品均来自于野生、待检疫的腹泻树鼩,并且采样时间为夏季,湿热的环境易于沙门氏菌滋生。原因之二是分子生物学检测方法的灵敏性。本实验研究为实验树鼩沙门氏菌病原的检测提供了又一种简单、快捷、有效的方法。
[1] 彭丽萍, 陈博文, 徐建超, 等. 食品沙门氏菌检测方法进展[J]. 中国人兽共患病杂志, 1999, 16(5): 89-91.
[2] 徐桂云,樊世杰. 家禽沙门氏菌感染现状及不同国家的防治策略[J]. 中国家禽,2012,34(9): 7-12.
[3] Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12): e63.
[4] Nagamine K, Hase T, Notomi T, et al. Accelerated reaction by loop mediated isothermal amplification using loop primers[J]. Mol Cell Probes, 2002, 16(3): 223-229.
[5] Fukuta S, Ohishi K, Yoshida K, et al. Development of immunocapture reverse transcription loop-mediated isothermal amplification for the detection of tomato spotted wilt virus from chrysanthemum[J]. J Virol Methods, 2004, 121(1): 49-55.
[6] Mori Y, Nagamine K, Tomita N, et al. Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J]. Biochem Biophys Res Commun, 2001, 289(1): 150-154.
[7] Tomita N, Mori Y, Kanda H, et al. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products[J]. Nat Protoc, 2008, 3(5): 877-882.
[8] Gao H, Lei Z, Jia J, et al. Application of loop-mediated isothermal amplification for detection of Yersinia enterocolitica in pork meat[J].J Microbiol Methods, 2009, 77(2): 198-201.
[9] Lu CC, Dai TT, Zhang HF, et al. Development of a loop-mediated isothermal amplification assay to detect Fusarium oxysporum[J]. J Phytopathol, 2015, 163(1): 63-66.
[10] 戴婷婷, 陆辰晨, 郑小波, 等. 环介导等温扩增技术在病原物检测上的应用研究进展[J].南京农业大学学报, 2015, 38(5): 695-703.
[11] 殷安国, 匡德宣, 李晓飞, 等. 树鼩模型在人类病毒性疾病研究中的应用进展[J]. 中国实验动物学报, 2014, 22(2): 86-89.
[12] 周广龙, 朱勤, 李振宇, 等. 树鼩在眼科学的基础研究进展[J]. 中国实验动物学报, 2015, 23(6): 652-655.
[13] 徐新平, 陈红波, 贲昆龙. 树鼩在医学生物学中的应用[J]. 中国实验动物学报, 2005, 13(3): 187-190.
[14] 刘丽君,余柄廷,胡凝珠, 等. 树鼩粪便细菌分离培养与鉴定[J]. 中国比较医学杂志. 2015, 25(210): 64-68.
[15] LaMontagne MG, Michel FC Jr, Holden PA, et al. Evaluation of extraction and purification methods for obtaining PCR-amplifiable DNA from compost for microbial community analysis[J]. J Microbiol Methods, 2002, 49(3): 255-264.
[16] 骞宇, 赵欣. 大鼠粪便中细菌基因组DNA提取方法的比较[J]. 食品工业科技, 2014, 35(4): 166-169.
[17] Rahn K, De Grandis SA, Clarke RC, et al. Amplification of an invA gene sequence of Salmonella typhimurium by polymerase chain reaction as a specific method of detection of Salmonella[J]. Mol Cell Probes, 1992, 6(4): 271-279.
[18] Yang Q, Domesle KJ, Wang F, et al. Rapid detection of Salmonella in food and feed by coupling loop-mediated isothermal amplification with bioluminescent assay in real-time[J]. BMC Microbiol, 2016, 16(1): 112.
[19] GB4789.4-2010,食品微生物学检验沙门氏菌检验[S].
[20] Eriksson E, Aspan A. Comparison of culture, ELISA and PCR techniques for Salmonella detection in faecal samples for cattle, pig and poultry[J]. BMC Vet Res, 2007, 3: 21.
[21] 张凤玉, 胡丹, 吕恒, 等. 2型猪链球菌89K毒力岛Ⅳ型分泌系统LAMP检测方法的建立[J]. 中国病原生物学杂志, 2014, 9(2): 113-116,121.
[22] 熊春蓉, 殷旭仁, 宋丽君, 等. 环介导同温DNA扩增法(LAMP)与解剖-显微镜检法检测血吸虫感染性钉螺效果的比较[J]. 中国病原生物学杂志, 2014, 9(12): 1084-1087.
[23] Ashida H, Toyotome T, Nagai T, et al. Shigella chromosomal IpaH proteins are secreted via the type III secretion system and act as effectors[J]. Mol Microbiol,2007, 63(3): 680-693.
[24] Galán JE, Curtiss R. Distribution of the invA, -B, -C, and -D genes of Salmonella typhimurium among other Salmonella serovars: invA mutants of Salmonella typhi are deficient for entry into mammalian cells[J]. Infect Immun,1991, 59(9), 2901-2908.
[25] Zhuang L,Gong J, Li Q, et al. Detection of Salmonella spp. by a loop-mediated isothermal amplification (LAMP) method targeting bcfD gene[J]. Lett Appl Microbiol. 2014, 59(6): 658-664.
[26] Boyd EF, Hartl DL. Analysis of the type 1 Pilin gene cluster fim in Salmonella: its distinct evolutionary histories in the 5’ and 3’ regions[J]. J Bacteriol, 1999, 181(4): 1301-1308.
[27] 吴家林, 沙丹, 马广源, 等. 沙门氏菌LAMP检测方法的建立[J]. 中国病原生物学杂志, 2015, 10(7): 611-614.
[28] 邱索平, 林志雄, 游勇来, 等. 实验猴粪便样品中沙门氏菌LAMP检测方法的建立及应用[J]. 中国畜牧兽医, 2014, 41(1): 51-56.
[29] 马晨, 陈雪华, 李建国. 国标法与快速法检测沙门氏菌的结果比较[J]. 食品科技, 2015, 40(9): 276-282.
[30] 邢进, 冯育芳, 付瑞, 等. 野生树鼩可培养细菌和真菌携带情况的调查[J]实验动物科学, 2012, 29(3): 34-38.
[31] 高家红, 江勤芳, 罗志武, 等. 树鼩正常肠道细菌的培养分离鉴定及其药敏试验研究[J]. 中国比较医学杂志, 2009, 19(12): 24-26,34.
