髓芯减压联合富血小板血浆对兔激素性股骨头坏死的疗效及对金属蛋白酶/基质金属蛋白酶组织抑制剂系统的影响
2018-03-05纪志华贾丙申周立义
于 鹏,纪志华,贾丙申*,周立义,付 昆
(海南医学院第一附属医院关节创伤外科,海口 570102)
激素性股骨头(steroid-induced necrosis of the femoral head,SANFH)坏死是一种由于激素诱导致使股骨头发生循环障碍而变性、坏死的非创伤性损伤。髓心减压术可以降低因股骨头中骨组织水肿而引起的骨内压增高,是治疗早中期SANFH的常用微创术式。富血小板血浆(platelet-rich plasma, PRP)含有丰富的生长因子,其配合髓心减压术能够促进非创伤性股骨头坏死组织的成骨和骨再生[1];而相关研究也表明,基质金属蛋白酶(matrix metalloproteinase,MMP)及其特异性抑制因子基质金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinase,TIMP)与SANFH 的发生也存在一定关系[2],即当机体长期承受大剂量激素时,糖皮质激素可以通过影响钙离子的代谢、干扰内分泌系统等导致患者破骨细胞分化因子(receptor activator of nuclear factor-κB ligand,RANKL)上调并抑制骨保护素(osteoprotegerin, OPG),使破骨细胞前体大量表达MMP-9及MMP-2,并抑制TIMP-1,TIMP-2 mRNA的表达。由于目前国内外均未见到髓芯减压联合PRP在治疗激素性股骨头坏死中对机体MMP/TIMP系统影响的研究,故本组研究拟探讨髓芯减压联合PRP对兔激素性股骨头坏死模型疗效及股骨头骨组织中MMP-2、MMP-9、TIMP-1、TIMP-2 mRNA 表达的影响,现将结果报道如下:
1 材料和方法
1.1 实验动物
5月龄SPF级新西兰大白兔46只,雌雄各半,体质量2.5~3.0 kg,均购于海南省农业科学院畜牧兽医研究所[SCXK(琼)2014-0006]。采用实验室啮齿类动物标准饲料饲养,室温及湿度分别控制在20℃~25℃,70%。动物实验操作程序经本院动物伦理委员会审议批准[SYXK(琼)2014-0017]。
1.2 主要试剂与仪器
醋酸泼尼松龙及生理盐水由湖北制药有限公司提供;大肠杆菌内毒素由武汉博士德生物工程公司提供;Trizol 试剂盒由美国Invitrogen 公司提供;RT-PCR 试剂盒由立陶宛Fermentas公司提供;酶免分析仪由美国Thermo Forma 公司提供;ABI 7000 型实时定量PCR 仪及ABI Prism 7000 SDS 软件均由美国ABI公司提供;Image-Pro Plus 5.0计算机图像分析系统来自于美国Media Cybernetics 公司;MDGS图像分析系统来自于德国Zeiss 公司;兔自体血液富集提取富血小板血浆。
1.3 实验方法
1.3.1 模型建立与分组
按随机数字法选取32只试验兔,建立股骨头无菌性坏死动物模型,即静脉注射10 μg/kg 大肠杆菌内毒素(LPS)2次,注射间隔为24 h,在第2次注射LPS后,臀肌注射醋酸泼尼松龙20 mg/kg,注射3次,每次注射间隔为24 h。注射3次后第4周,对32只试验兔进行核磁共振成像检查股骨头坏死模型情况,根据世界骨循环研究会制定的国际骨坏死分期标准[3],选取其中处于I、II期阶段骨坏死的试验兔共28只,按随机数字法分为减压组、联合组各14只,另取剩下的14只未进行造模的试验兔设为对照组。对联合组静脉取血5 mL,采用改良Appel法制备PRP(浓度均3%)备用,制备方法如下[4]:装有枸橼酸钠溶液的10 mL 注射器从兔耳中央动脉采集血液 5 mL,置入离心管,将其摇匀,首先以 2400 r/min 低速离心 10 min,可见离心管中分为上层的清液及下层的红细胞,吸取上清液,交界层下少部分细胞置入另一离心管,以3600 r/min 高速离心 15 min,离心后弃去上清液上 3/4, 然后轻轻摇匀剩余液体,PRP 即制备完成。对减压组和联合组两侧股骨头采取单纯髓芯减压和髓芯减压联合股骨头内注射1 mL 3% PRP的处置。术后常规饮食。完全负重继续单笼饲养,术后连续3 d每天减压组及联合组每只兔均臀大肌肌注硫酸庆大霉素2 mL,以预防术后感染。

表1 定量PCR序列
1.3.2 影像学检查
术后2、6、10周对减压组及联合组实验兔以3%戊巴比妥钠耳缘静脉注射(30 mg/kg),麻醉后仰卧位拍摄髋关节正位X线,观察灶骨骨缺损及密度变化,Lane-Sandhu X线评分判断成骨情况。
1.3.3 免疫生化指标
第10周拍片完毕后统一抽取减压、联合和空白对照组兔空腹静脉血5 mL,离心分离,ELISA法检测外周血IL-6浓度,并统一切除三组兔双侧股骨头,其中先取100 mg右侧股骨头骨组织(取圆韧带周围骨组织)进行酶联免疫ELISA法检测组织中MMP-2、MMP-9、TIMP-1、TIMP-2蛋白含量,再使用余下右侧股骨头骨组织检测MMP-2、MMP-9、TIMP-1、TIMP-2的 mRNA表达水平,即首先取各组右侧股骨头,剔除软骨,参照Trizol 试剂盒说明提取总RNA,电泳鉴定显示提取总RNA 完整。取总RNA 500 ng加入随机引物1 μL,参照RT-PCR 试剂盒合成cDNA 第1链,然后根据目的基因在GenBank 中的己知序列,采用Primer 5.0 软件自行设计引物(见表1)。再采用三步法,反应条件均为:预变性95℃、35 s,1 个循环;变性95℃、5 s,退火58℃、20 s,延伸72℃、35 s,45 个循环。通过ABI Prism 7000 SDS 软件对各组MMP-2、MMP-9、TIMP-1 和TIMP-2 目的基因作相对定量。
1.3.4 组织病理指标
将三组切下的左侧股骨头统一固定、包埋、切片、观察病理学变化,股骨头坏死诊断标准参照2006 年我国制定的《股骨头坏死诊断与治疗的专家建议》[5]鉴定是否发生骨坏死:以骨小梁的骨细胞空陷窝> 50%,且累及邻近多处骨小梁,有骨髓坏死,确定为骨坏死;同时判断三组骨陷窝空缺率。
1.4 统计学方法

2 结果
2.1 三组骨组织MMPs、TIMs的mRNA表达及IL-6水平和骨陷窝空缺率比较
三组目的基因RT-PCR结果见图1。单因素方差分析显示三组MMP-2表达两两比较q检验显示,减压组显著高于联合组和对照组(P< 0.05);三组MMP-9表达两两比较q检验显示,减压组显著高于联合组和对照组(q=4.05, 5.06;P< 0.05);三组TIMP-1表达两两比较q检验显示,减压组显著低于联合组和对照组(q=6.67, 8.89;P< 0.05);三组TIMP-2表达两两比较减压组显著低于联合组和对照组(q=6.70, 7.19;P< 0.05);三组IL-6水平两两比较减压组显著高于联合组和对照组(q=8.99, 13.09;P< 0.05),同时联合组也高于对照组(q=4.09;P< 0.05)(见表2);三组骨陷窝空缺率减压组显著高于联合组和对照组(q=32.60, 39.36;P< 0.05),同时联合组也高于对照组(q=6.75;P< 0.05) (见表2);
2.2 减压组、联合组术后组间X线评分及新生骨面积百分比分析
影像学分析,术后2周两组缺损区均呈现低密度,但联合组密度高于减压组。6周联合组密度仍高于减压组且缺损区有散在骨小梁出现。10周后减压组灶骨下软骨出现囊性变而联合组密度接近正常(详见图2)。两组X线评分示,术后6周和10周,联合组均高于减压组,差异有显著性(P< 0.05);而新生骨面积百分比,术后2周、6周、10周联合组均高于减压组(P< 0.05)(见表3)。

注:(1)减压组;(2)联合组;(3)对照组。图1 三组MMPs和TIMPs的mRNA表达Note.(1)Decompression group;(2)Combined group;(3)Control group.Fig.1 mRNA expressions of MMP-2, MMP-9, TIMP-1 and TIMP-2 in bone tissues of the femoral head

组别GroupsMMP-2(ng/mL)MMP-9(ng/mL)TIMP-1(ng/mL)TIMP-2(ng/mL)IL-6(pg/mL)骨陷窝空缺率(%)Rateofemptyosseouslacunae减压组Decompressiongroup0.15±0.030.14±0.03*#0.09±0.03*#0.41±0.13*#8.88±1.55*#20.33±1.41*#联合组Combinationgroup0.10±0.040.10±0.040.15±0.040.68±0.155.32±1.43#9.27±1.32#对照组Controlgroup0.09±0.030.09±0.040.17±0.030.70±0.173.70±1.466.98±1.05F12.767.17 21.41 16.13 44.83 442.90 P0.0000.0020.0000.0000.0000.000
注:与联合组比较,*P< 0.05;与对照组比较,#P< 0.05。
Note.Compared with the combination group,*P< 0.05;Compared with the control group,#P< 0.05.

表3 减压组、联合组术后X线评分及新生骨面积比较
注:与联合组比较,*P< 0.05。
Note.Compared with the combination group,*P< 0.05.

注:(A)减压组术后2周;(B)联合组术后2周;(C)减压组术后6周;(D)联合组术后6周;(E)减压组术后10周;(F)联合组术后10周。图2 两组术后2、6、10周影像学检查情况Note.(A)Decompression group at 2 weeks.(B)Combination group at 2 weeks.(C)Decompression group at 6 weeks.(D)Combination group at 6 weeks.(E)Decompression group at 10 weeks.(F)Combination group at 10 weeks.Fig.2 X-ray films in each group at different time points after operation
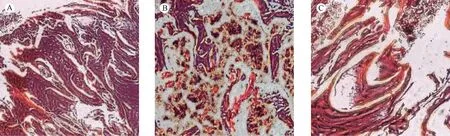
注:(A)对照组;(B)减压组;(C)联合组。图3 三组模型兔术后10周左侧股骨头HE染色结果(×200)Note.(A)Control group.(B)Decompression group.(C)Combination group.Fig.3 Histological observation of the bone tissues of the 3 groups at 10 weeks after operation. HE staining
2.3 组织病理学评价
对照组股骨头骨组织可见骨小梁致密,期间为血管和骨髓,大部分骨陷窝内可见骨细胞;减压组表现为骨小梁稀疏,周边有骨壁形成,骨陷窝内骨细胞大部分消失,周围有大量炎性肉芽组织,缺损中心为纤维组织,骨小梁有断裂征象;联合组轻度炎性细胞浸润,但已可见成熟骨小梁及骨髓组织,多数小梁骨陷窝内可见骨细胞(见图3)。
3 讨论
髓芯减压能够在骨坏死后股骨头内血流减少且伴有骨内压增高时开放骨坏死腔,其降低骨内压、改善骨内微循环、排除坏死组织、减轻骨髓水肿的效果较好,但由于SANFH患者坏死股骨头内前体细胞增殖能力低,病损区成骨细胞缺乏导致单纯的髓芯减压并不能提升坏死区骨组织的再生[6-7],且减压后的组织其破骨和骨吸收的速度常大于骨结构的重建,反而会加速股骨头的塌陷。PRP是通过离心从外周血得到的白细胞和血小板浓缩物,由于是用自体血制备,故不存在免疫原性。其含有丰富的纤维蛋白网络、各型生长因子及炎性因子抑制物,能够有效调整成骨细胞与破骨细胞的分化以及刺激新生血管和新骨的形成,除能增进组织修复、抑制炎症反应、控制感染外还能构建生物支架[8],同时由于其能促进局部骨髓间充质干细胞成骨分化,并抑制其向脂肪分化的作用,且两种物质间存在生物协同效应。故本组研究会出现联合组无论是影像学表现还是X评分,新生骨面积百分比,骨陷窝空缺率,骨组织病理学检查均明显优于减压组的结果。
MMPs中MMP-2 和MMP-9在破骨细胞有大量表达,被认为是骨吸收过程中降解骨基质有机物成分的主要蛋白酶。同时在炎症发生时,MMPs还能调控成骨细胞分化与破骨细胞的骨吸收从而进行病骨修复[9]。TIMP是MMPS 最重要的抑制因子,当MMPS降解骨及软骨的病理改变发生时,可产生多种细胞因子,这些细胞因子能够诱导产生TIMP对MMPS的酶活性进行抑制以达到平衡,因此MMPS/TIMP始终维持在一个动态平衡[10]。当机体长期承受大剂量激素时患者骨量丢失,激素也能直接或间接通过上调破骨细胞分化因子(RANKL)并抑制骨保护素(OPG),导致破骨细胞前体的MMP-9及MMP-2大量的表达,并抑制TIMP-1TI、MP-2 mRNA的表达,即出现MMP/TIMP失衡变大,而MMP-9也可以通过机体出现激素性骨坏死产生的大量IL-6反馈性的上调RANKL,形成恶性循环,并且IL-6本身是炎性因子,也是主要的破骨细胞调节因子之一,可以上调MMP-2 的表达和分泌。故大剂量激素可以通过上述途径直接或间接的上调MMP/TIMP[11]是ANFH发生的重要因素。本组研究结果显示,术后联合组MMP-2,MMP-9,IL-6显著高于减压组,而 TIMP-1,TIMP-2的表达显著低于减压组,同时其在MMP-2,MMP-9及TIMP-1,TIMP-2等指标表达上已与对照组相近,提示髓芯减压联合PRP在物理减压消除水肿的同时可以通过抗炎、促进成骨细胞增殖等方式对MMP/TIMP系统起到“正性”干预作用,来拮抗糖皮质激素的“负性”作用,同时病理学检查也能看到,联合组股骨头骨组织较单纯减压的骨组织有明显好转,已趋于正常组织的形态学表现,这也为临床应用该联合治疗技术治疗激素性股骨头坏死提供了实验依据。
虽然本组研究结果显示髓芯减压联合PRP在治疗激素性股骨头坏死中,对组织MMP/TIMP系统的积极修复作用,但本实验也有一些需要进一步研究的地方, 如无法证实生长因子的浓度与骨诱导的关系,同时,虽然兔作为SANFH模型的研究较多,但其在病程及病理变化上仍然与人类有较大差别[12],并且因动物的体内环境与人体的生理环境并不相同,找到能够与人体的生理环境相适应的生长因子的合理搭配比例以及更加适用于人体的支架材料仍有待于进一步解决。
[1] 杨富强, 杨晓明, 葛建健, 等. 髓芯减压植骨联合富血小板血浆治疗股骨头缺血性坏死的前瞻随机对照研究 [J]. 中华关节外科杂志, 2016, 10(2): 140-144.
[2] 王建忠, 武永刚, 董慧珍. 阿托伐他汀对糖皮质激素性股骨头坏死骨组织MMP/TIMP 系统的影响 [J]. 中国骨与关节杂志, 2014, 3(11): 865-870.
[3] 王秀利, 王义生, 吴学建, 等. 自体骨髓干细胞种植骨诱导活性材料移植联合髓芯减压术治疗早期股骨头坏死 [J]. 中华显微外科杂志, 2017, 40(2): 142-145.
[4] 冯鑫. 复合PRP与BMP-4的Nano-HA并髓心减压治疗兔股骨头坏死 [D]. 青岛大学,2015:1-37.
[5] 王建忠, 王春生, 王坤正, 等. 阿仑膦酸钠对长期应用糖皮质激素大鼠股骨组织MMP/TIMP系统的影响 [J]. 中国骨与关节外科, 2011, 4(6): 484-489.
[6] 方家刘, 尹宗生, 王伟, 等. 富白细胞和血小板血浆对BMSCs在兔股骨头缺血性坏死中成骨作用的影响 [J]. 中国修复重建外科杂志, 2015, 29(2): 227-233.
[7] 崔泳, 方国正, 凯赛尔江·艾合买提. 富血小板血浆凝胶联合髓芯减压修复兔股骨头无菌性坏死 [J]. 中国组织工程研究, 2014, 18(27): 4383-4388.
[8] 谢雪涛, 施忠民, 张长青. 富血小板血浆的制备与临床应用研究进展 [J]. 中华创伤骨科杂志, 2014, 16(4): 311-315.
[9] Meszaros E, Malemud CJ. Prospects for treating osteoarthritis: enzyme-protein interactions regulating matrix metalloproteinase activity [J]. Ther Adv Chronic Dis, 2012, 3(5): 219-229.
[10] 贺占坤, 沈杰威. MMP-2, MMP-3, MMP-9和TIMP-1评价膝关节骨性关节炎的临床研究 [J]. 重庆医学, 2013, 42(32): 3872-3874.
[11] Kesanakurti D, Chetty C, Dinh DH, et al. Role of MMP-2 in the regulation of IL-6/Stat3 survival signaling via interaction with α5β1integrin in glioma [J]. Oncogene, 2013, 32(3): 327-340.
[12] 张成龙, 尹华, 章建华. 股骨头坏死动物模型研究进展 [J]. 中国比较医学杂志, 2013, 23(3): 58-62.
