维生素D缺乏对自发性糖尿病大鼠发病的影响
2018-03-05李艳艳刘妍妍郝丽萍
李艳艳,王 宁,刘妍妍,于 微,刘 涛,郝丽萍,王 俊*
(1.深圳市慢性病防治中心,广东 深圳 518020; 2.华中科技大学同济医学院公共卫生学院营养与食品卫生学系,武汉 430030)
2型糖尿病(type 2 diabetes mellitus,T 2DM)是当前严重威胁人类健康的世界性公共卫生问题。据国际糖尿病联盟(IDF)统计,全球有4.15亿糖尿病患者,其中90%以上为T 2DM,我国的形势更为严峻,带来沉重的疾病与经济负担[1]。维生素D(VD)是一种脂溶性维生素,通过与维生素D受体(VDR)结合发挥多种生物学效应。研究发现VD不仅在调节钙磷代谢及维持骨稳态方面发挥重要作用,而且参与糖脂代谢,维持正常的胰岛β细胞功能与胰岛素敏感性[2-3]。人群研究表明,肥胖及T 2DM患者普遍存在VD缺乏,VD缺乏已作为重要的影响因子成为T 2DM近年来研究的热点。
T 2DM发病机制异常复杂,动物模型在T 2DM机制的研究中发挥着重要的作用。Zucker糖尿病肥胖大鼠(Zucker diabetic fatty rat,ZDF)是从出现糖尿病表型的Zucker大鼠中筛选并近亲杂交培育出的一种自发性T 2DM模型鼠[4],ZDF大鼠经高血脂高血糖、糖耐量异常、胰岛素抵抗等程序化发展为T 2DM,与人类T 2DM发病进程相似,被认为是T 2DM研究的理想模型[5-6]。建立VD缺乏ZDF大鼠T 2DM模型有利于深入探讨VD在肥胖型糖尿病发病进程中的作用及相关机制。VD缺乏对ZDF大鼠糖尿病的发病是否有重要的影响目前尚不清楚,因此,本研究去除ZDF大鼠专用饲料Purina #5008中添加的VD,建立VD缺乏ZDF大鼠T 2DM模型,与正常饲料喂养的ZDF大鼠作比较,探讨VD缺乏状态下ZDF大鼠T 2DM的发病特点及VD缺乏对ZDF大鼠糖尿病发病的影响,对于研究VD在T 2DM防治中的作用具有重要的意义。
1 材料和方法
1.1 实验动物
SPF级雄性自发性肥胖型2型糖尿病大鼠(zucker diabetic fatty rat,ZDF)20只,体重(125.8±11.7)g,5~6周龄;Zucker瘦型大鼠(zucker lean,ZL)20只,体重(113.9±6.6)g,5~6周龄,购于维通利华实验动物技术有限公司[SCXK(京)2012-0001],动物饲养于华中科技大学实验动物中心[SYXK(鄂)2016-0057],通过华中科技大学同济医学院实验动物医学伦理委员会审批(IACUC Number: 432)。
1.2 主要试剂及仪器
罗氏卓越型血糖仪;血糖试纸;尿糖试纸(高尔宝);葡萄糖测定试剂盒(北京中生北控科技股份有限公司);苏木素、伊红(北京索莱宝公司);二甲苯;梯度乙醇(100%、95%、90%、80%、70%);倒置显微镜(奥林巴斯)。
1.3 实验方法
1.3.1 动物分组
适应性喂养1周后,瘦型及胖型鼠按照体重随机分共分为4组:瘦型鼠体重为104~127 g,分为104~110、110~115、116~120、120~127 g 四个等级,每个等级大鼠随机分为2组即正常对照组(ZL)、VD缺乏对照组(ZL+VD.Def);胖型鼠体重为105~152 g,分为105~110、111~120、121~130、130~140、141~152 g五个等级,然后将每个等级的大鼠随机分为2组即:模型组(ZDF)、VD缺乏模型组(ZDF+VD.Def)。喂养Zucker大鼠专用饲料Purina #5008(营养成分见表1,北京科奥协力饲料有限公司提供),VD 缺乏组饲料是在原饲料配方基础上去除添加的VD。各组大鼠喂养至12周龄,喂养期间,记录每天进食量,每周测量一次体重、记录饮水量及收集24 h尿样并监测尿糖,每两周监测空腹血糖。
1.3.2 大鼠能量利用率
能量利用率(g/kcal)=[末期体重 - 初始体重(g)]/同期热能摄入量(kcal)×100 %。
同期热能摄入量(kcal)=喂养期间大鼠的进食总量(g)× Purina #5008饲料的能量(4.15 kcal/g)。
1.3.3 饮水量、尿量及尿糖监测
各组大鼠每周在代谢笼中喂养2 d,记录每只大鼠饮水量,收集24 h尿样,并用尿糖试纸监测是否出现尿糖。
1.3.4 血糖检测及糖耐量试验
每两周测定各组大鼠空腹血糖(隔夜禁食10 h);于11周龄进行口服糖耐量(OGTT)实验:各组大鼠隔夜禁食10 h,测定空腹血糖后,根据体重灌胃葡萄糖(1 g/kg),并于30、60、90、120 min监测血糖变化,绘制血糖变化曲线,计算曲线下面积(AUC)。
1.3.5 胰腺HE染色
大鼠处死后,迅速分离胰腺,胰腺相同部位组织于4% 多聚甲醛固定24 h后制备石蜡切片。石蜡切片经过二甲苯脱蜡、梯度乙醇脱水,苏木素、伊红染色,脱水、二甲苯透明后,中性树胶封片,显微镜下观察并拍照(×400)。
1.4 统计学方法

2 结果
2.1 VD缺乏对ZDF大鼠体重及能量利用率的影响
如表2所示:喂养结束时,T 2DM模型组(ZDF)体重显著高于正常对照组(ZL),VD缺乏模型组(ZDF+VD.Def)大鼠体重显著高于ZDF组,有趣的是,VD缺乏对照组(ZL+ VD.Def)大鼠体重较ZL组明显增加。此外,VD缺乏组大鼠能量利用率相对较高但无统计学差异,说明膳食中VD缺乏可能会加快ZDF大鼠体重的增加。
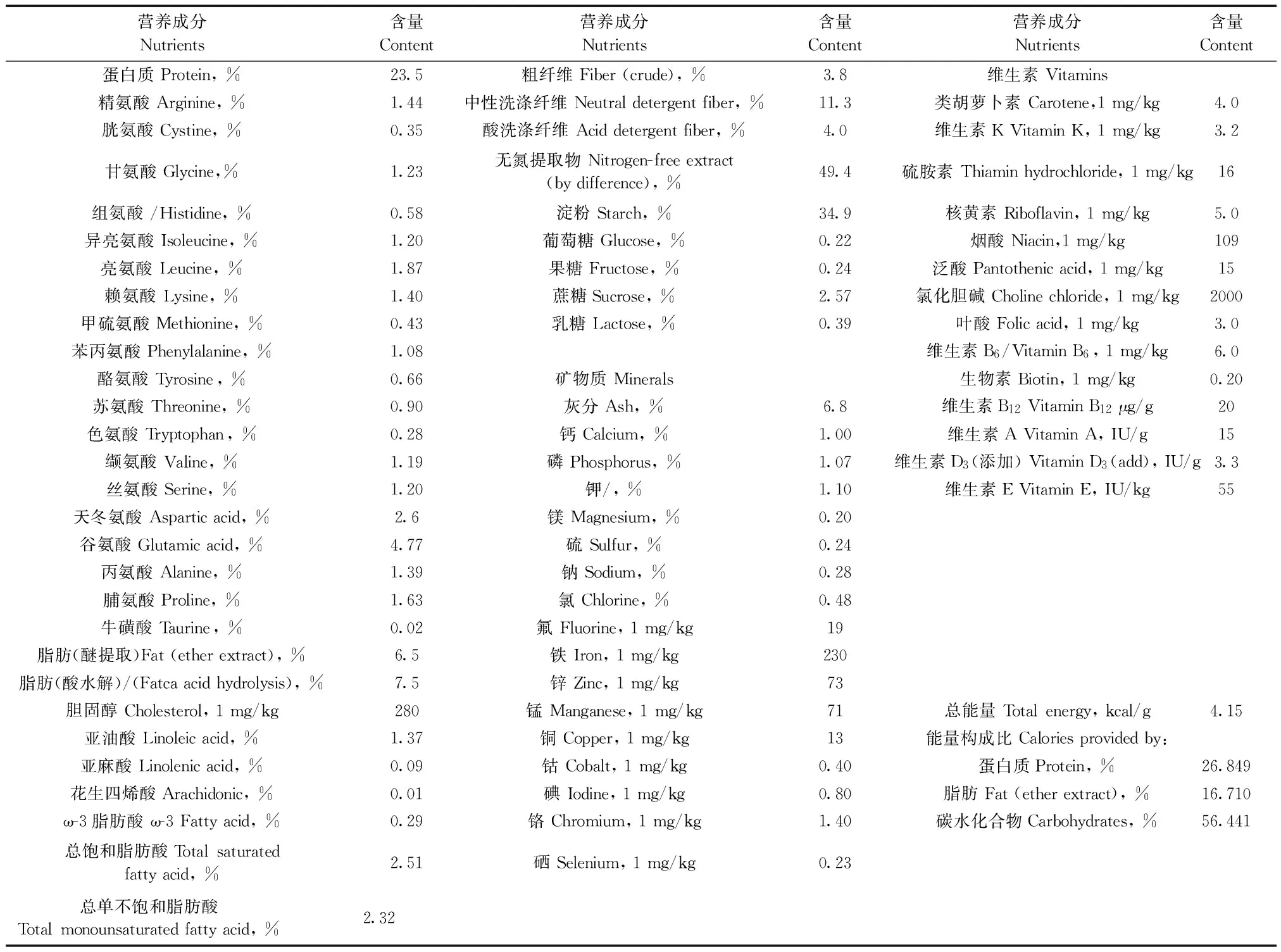
表1 Purina #5008 饲料营养成分表

表2 ZDF大鼠体重增长及能量利用率
注:与ZL组比较,aP< 0.05;与ZL+VD.Def组比较,bP< 0.05;与ZDF组比较,cP< 0.05。
Note.Compared with the ZL group,aP< 0.05. Compared with the ZL+VD.Def group,bP< 0.05. Compared with the ZDF group,cP< 0.05.
2.2 VD缺乏对ZDF大鼠饮水量、尿量及尿糖的影响
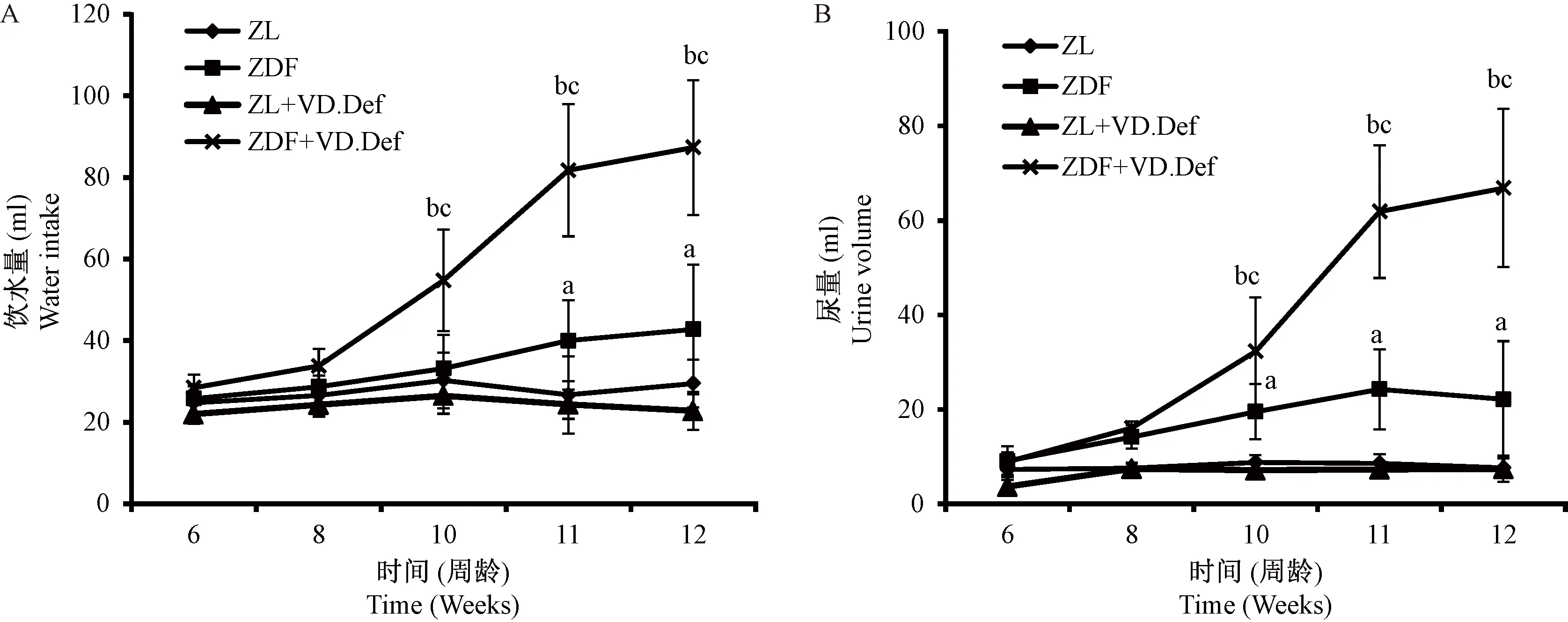
注:与ZL组比较,aP< 0.05;与ZL+VD.Def组比较,bP< 0.05;与ZDF组比较,cP< 0.05。图1 各组大鼠随周龄饮水量及尿量的变化情况Note.Compared with the ZL group, aP< 0.05. Compared with the ZL+VD.Def group, bP< 0.05. Compared with the ZDF group, cP< 0.05.Fig.1 Water intake and urine volume in the ZDF rats
饲养过程中,各组大鼠每周进代谢笼中一次,记录其饮水量、收集24 h尿样及检测尿糖。如图1所示,自10周龄开始,VD缺乏模型组(ZDF+VD.Def)大鼠饮水量及尿量迅速增加,而ZDF组则在11周龄才开始显著增高,并且远低于ZDF+VD.Def组。到12周龄,ZDF+VD.Def组饮水量为ZDF组的2.1倍,尿量为ZDF组的3.0倍,说明VD缺乏加快并加重了ZDF大鼠“多饮多尿”的状况。随着尿量的增加,自8周龄开始,ZDF+VD.Def组大鼠开始出现尿糖,伴随着尿量的增加,尿糖愈加严重。ZDF组大鼠自10周龄出现尿糖,但其尿糖含量大大低于ZDF+VD.Def组(尿糖检测由尿糖试纸测定,根据颜色深浅判定,结果未在文中显示)。VD缺乏对对照组大鼠的饮水量、尿量及尿糖没有影响。
2.3 VD缺乏对ZDF大鼠血糖变化的影响
饲养过程中,每两周监测各组大鼠的空腹血糖(禁食10 h)。由图2所示,ZL和ZL+VD.Def两对照组大鼠自始至终血糖没有明显的变化,与对照组相比,ZDF组大鼠自10周龄血糖明显升高,而ZL+VD.Def组大鼠自8周龄开始血糖明显升高,并随大鼠周龄的增加而大幅增高,12周龄时,ZL+VD.Def组大鼠空腹血糖达到19.5 mmol/L,约为ZDF组大鼠的2.0倍。
2.4 VD缺乏对ZDF大鼠口服糖耐量的影响
各组大鼠于11周龄进行口服糖耐量(OGTT)实验,以评估糖耐量受损情况。各组大鼠禁食10 h,测定空腹血糖后,根据体重灌胃葡萄糖(1 g/kg),并于30、60、90、120 min监测血糖变化。如图3所示,各组大鼠血糖在口服葡萄糖30 min时达到峰值,ZL、ZL+VD.Def、ZDF组大鼠血糖在60 min开始下降,120 min时恢复在初始血糖水平,而ZDF+VD.Def组大鼠血糖在60 min时依然处于高值,90 min才有所降低。ZDF+VD.Def组曲线下面积(AUC)明显高于ZDF组,约为2.0倍,说明VD缺乏加重了ZDF大鼠糖耐量受损。
2.5 VD缺乏对ZDF大鼠胰腺损伤的影响
如图4所示,ZL及 ZL+VD.Def组大鼠胰腺外分泌腺与胰岛之间边界清楚,胰岛形态完整规则,胰岛内细胞数较多,排列紧密,分布均匀;核圆形、胞浆丰富、结构清楚,无变性坏死;ZDF组大鼠胰腺外分泌腺与胰岛之间边界尚清楚,部分细胞出现肿胀、变性,与ZDF相比,ZDF+VD.Def组大鼠胰腺外分泌腺与胰岛之间边界模糊,胰岛形态极不规则、胰岛β细胞排列紊乱,细胞肿胀、胞核呈溶解状,胞质疏松淡染。
3 讨论

注:与ZL组比较,aP< 0.05;与ZL+VD.Def组比较,bP< 0.05;与ZDF组比较,cP< 0.05。图2 各组大鼠血糖随周龄的变化情况Note.Compared with the ZL group,aP< 0.05. Compared with the ZL+VD.Def group, bP< 0.05. Compared with the ZDF group, cP< 0.05.Fig.2 Changes of serum glucose with age of the ZDF rats

注:与ZL组比较,aP< 0.05;与ZL+VD.Def组比较,bP< 0.05;与ZDF组比较,cP< 0.05。图3 各组大鼠口服糖耐量Note.Compared with the ZL group,aP< 0.05. Compared with the ZL+VD.Def group, bP< 0.05. Compared with the ZDF group, cP< 0.05.Fig.3 Glucose tolerance of the ZDF rats in each group
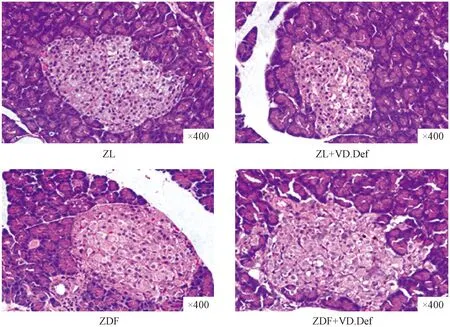
图4 各组大鼠胰腺HE染色(×400)Fig.4 The pancreatic islet structures of the ZDF rats in each group
流行病学调查发现,目前全球近10亿人处于VD缺乏或者不足状态[7]。VD缺乏不仅增加佝偻病及骨折风险,还与肥胖、糖尿病等疾病的发生密切相关[8]。我们的实验发现,VD缺乏会加快Zucker大鼠体重的增长,这可能与VD缺乏影响脂代谢有关。许多研究表明,体内VD的水平与肥胖程度呈负相关。Robinson等[9]人发现,VD缺乏会增加儿童肥胖风险。Gonzalez-Molero等[10]对1226名志愿者进行为期11年的队列研究发现,低VD水平与肥胖及未来发生肥胖的风险密切相关。有趣的是,本研究中VD缺乏也会引起正常对照组大鼠体重的增加、能量利用率提高,相关的机制仍未阐明,需要进一步深入研究。
越来越多的研究证明,VD缺乏会增加糖尿病的发病风险[11-12]。一项对9841名受试者进行的为期29年的随访,矫正年龄、性别、吸烟、饮酒、BMI、血脂等危险因素后,发现最低水平的VD与最高水平VD人群发生糖尿病的风险比值为1.22,表明血清低VD水平是发生T 2DM的重要危险因素[13]。与以往的研究一致,本实验中,与正常Purina #5008饲料喂养相比,饲料中VD缺乏会导致ZDF大鼠“多饮多尿”症状提前出现,血糖尿糖显著升高,糖耐量受损更为严重,而VD缺乏对对照鼠(ZL)的糖代谢没有明显的影响,这些结果表明VD缺乏加快并加重了ZDF大鼠T 2DM病情发展,VD缺乏可能是肥胖型T 2DM发生发展的关键因素。
本实验采用ZDF大鼠为实验对象,该大鼠是由于瘦素受体突变使得瘦素对食欲控制及产热作用受损,导致多食、肥胖,表现为糖耐量异常、高脂血症、高胰岛素血症、胰岛素抵抗等特点[14-16]。研究发现,在肥胖及糖尿病人群中瘦素抵抗普遍存在[17],ZDF大鼠病情的发展复制了人类T 2DM的进程[18]。我们的研究结果提示,VD缺乏影响ZDF大鼠的糖脂代谢导致肥胖及糖尿病的发生或不仅仅依赖瘦素受体途径,潜在的通路需要进一步研究加以证实。
T 2DM胰岛β细胞损伤是造成功能受损的主要原因,最终引起血糖控制失调。VDR存在胰岛β细胞内,VD经肝脏、肾脏转化成活性形式 1, 25(OH)2VD3后与VDR结合,维持正常的胰岛β细胞功能及胰岛素敏感性。有研究表明,糖尿病小鼠模型中,VD缺乏可导致胰岛功能受损、抑制胰岛素的分泌[19-20]。VD可通过上调或下调β细胞内的VDR数量和维生素D依赖性钙结合蛋白(DBP)水平,从而促进胰岛β细胞合成与分泌胰岛素。此外,VD可通过调控细胞因子的作用保护胰岛β细胞[21]。本研究中,VD缺乏饲料喂养的ZDF大鼠胰岛损伤更为严重,胰岛β细胞肿胀、空泡化病变,细胞核溶解,表明VD缺乏会加重肥胖型T 2DM胰岛β细胞结构破坏,功能受损,相关的机制需要进一步深入研究。
综上所述,本研究成功建立了VD缺乏的ZDF大鼠T 2DM模型,并发现VD缺乏加快并加重T 2DM的病情,VD缺乏是肥胖型T 2DM发病的关键因素,相关的机制正在运用代谢组学及蛋白组学的技术进行深入的研究。本实验为VD缺乏与糖尿病的关系及相关机制的研究提供了良好的动物模型,对于探讨VD在T 2DM的防治中的作用具有重要的意义。
致谢:感谢华中科技大学同济医学院的老师和同学在动物饲养中给予的帮助,感谢科室领导、同事对实验的支持与付出。
[1] Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China [J]. N Engl J Med, 2010, 362(12): 1090-1101.
[2] Van Belle TL, Gysemans C, Mathieu C. Vitamin D and diabetes: the odd couple [J]. Trends Endocrinol Metab, 2013, 24(11): 561-568.
[3] Al-Shoumer KA, Al-Essa TM. Is there a relationship between vitamin D with insulin resistance and diabetes mellitus? [J]. World J Diabetes, 2015, 6(8): 1057-1064.
[4] Shiota M, Printz RL. Diabetes in Zucker diabetic fatty rat [J]. Methods Mol Biol, 2012, 933:103-123.
[5] 高秀莹, 周迎生. 2型糖尿病鼠类模型的研究进展 [J]. 中国实验动物学报,2014,22(4): 71-76.
[6] 宋丹, 冉丽媛, 姜如娇, 等. 糖尿病研究中的动物模型进展 [J]. 中国比较医学杂志,2016, 26(9): 83-87.
[7] Rosen CJ. Vitamin D Insufficiency [J]. N Engl J Med, 2011, 364(3): 248-254.
[8] Li YX, Zhou L. Vitamin D deficiency, obesity and diabetes [J]. Cell Mol Biol (Noisy-le-grand), 2015, 61(3): 35-38.
[9] Robinson C, Chiang M, Thompson SN, et al. Occurrence of vitamin D deficiency in pediatric patients at high risk in West Virginia [J]. South Med J, 2012, 105(10): 504-507.
[10] González-Molero I, Rojo-Martínez G, Morcillo S, et al. Hypovitaminosis D and incidence of obesity: a prospective study [J]. Eur J Clin Nutr, 2013, 67(6): 680-682.
[11] Zhang MX, Pan GT, Guo JF, et al. Vitamin D deficiency increases the risk of gestational diabetes mellitus: a meta-analysis of observational studies [J]. Nutrients, 2015, 7(10): 8366-8375.
[12] Iqbal K, Islam N, Mehboobali N, et al. Association of vitamin D deficiency with poor glycaemic control in diabetic patients [J]. J Pak Med Assoc, 2016, 66(12): 1562-1565.
[13] Afzal S, Bojesen SE, Nordestgaard BG. Low 25-hydroxyvitamin D and risk of type 2 diabetes: a prospective cohort study and meta analysis [J]. Clin Chem, 2013, 59(2): 381-391.
[14] 陈小真, 戎亦骊, 马全鑫, 等. 糖尿病ZDF大鼠早期微血管并发症的生化指标及病理组织学变化 [J]. 中国比较医学杂志,2016, 26(5): 63-70.
[15] 奚赛飞, 斯徐伟, 朱科燕, 等. ZDF(fa/fa) 大鼠的糖脂代谢特点与胰岛素抵抗特性 [J].实验动物与比较医学, 2014, 34(2): 102-106.
[16] 朱超, 朱莹莹, 李二妮. 等. 糖尿病合并冠心病ZDF大鼠模型的构建 [J]. 中国实验动物学报, 2016, 24 (2): 111-115.
[17] Leonard BL, Watson RN, Loomes KM, et al. Insulin resistance in the Zucker diabetic fatty rat: a metabolic characterisation of obese and lean phenotypes [J]. Acta Diabetol, 2005, 42(4): 162-170.
[18] Crujeiras AB, Carreira MC, Cabia B, et al. Leptin resistance in obesity: An epigenetic landscape [J]. Life Sci, 2015, 140: 57-63.
[19] Norman AW. Minireview: vitamin D receptor: new assignments for an already busy receptor [J]. Endocrinology, 2006, 147(12): 5542-5548.
[20] Berridge MJ. Vitamin D deficiency and diabetes [J]. Biochem J, 2017, 474(8): 1321-1332.
[21] Denburg MR, Bhan I. Vitamin D-binding protein in health and chronic kidney disease [J]. Semin Dial, 2015, 28(6): 636-644.
