A型肉毒素重链干预对大鼠脊髓损伤后生长相关蛋白表达的影响
2018-03-05王亚芳李夏青
王亚芳,兰 婧,刘 福,白 娟,李夏青
(山西医科大学基础医学院病理生理教研室,太原 030001)
脊髓损伤(spinal cord injury,SCI)是指各种创伤或非创伤因素引起的损伤平面以下运动、感觉和自主神经功能不同程度的丧失。由于成年哺乳动物脊髓损伤后再生能力极为有限[1-2],损伤后再生障碍,脊髓损伤后致残率极高,严重影响病人的生存质量[3]。脊髓损伤后之所以不能再生的原因归结于脊髓损伤后局部大量轴突再生抑制因子的产生及损伤脊髓组织内轴突再生相关基因不能上调或激活、细胞或轴突再生相关蛋白合成障碍[4-5]。
A型肉毒杆菌毒素(botulinum neurotoxin serotype A,BoNT/A)是由肉毒杆菌产生的神经毒素之一[6-7]。A型肉毒素的毒性机理主要基于其可选择性地与运动终板神经突触前膜上相应受体结合入胞、导致突触囊泡蛋白25(synaptosomal-associated protein 25, SNAP-25)裂解、阻断囊泡内神经递质(乙酰胆碱)的释放[8-9],致使所支配的骨骼肌收缩障碍发生麻痹[10]。除影响乙酰胆碱外,肉毒素也可抑制或阻止突触囊泡内其它物质的释放,譬如:降钙素基因相关多肽(CGRP)、P物质等[11]。从化学结构上,A型肉毒素是由二硫键相连的双肽链,其中较长的一条位于毒素氨基端,称为重链(heavy chain,HC), 负责与靶细胞膜结合及介导毒素的内吞;较短的一条位于毒素的氨基侧,称为轻链(light chain,LC)。轻链部分具有Zn+依赖的蛋白水解酶活性,是毒素的毒性催化单位[12-13]。一些在体实验发现A型肉毒素引起肌肉麻痹的恢复期(注射后3~4月),随着肌肉功能的逐渐恢复,局部组织内可见运动终板样神经末梢结构[14]。因此,根据BoNT/A化学结构的功能特征,在去除轻链的毒性作用后,BoNT/A重链本身也可能影响神经细胞的多种功能及其结构变化[15]。
为此,本文拟在大鼠脊髓损伤模型的基础是,采用人工重组的 BoNT/A重链进行髓腔内间断性给药,探讨其对脊髓损伤后生长相关蛋白表达的影响及其促进神经突起再生的机制。
1 材料和方法
1.1 实验动物
SPF级雄性SD大鼠,6~7周龄,体重200~220 g, 由北京海淀实验动物养殖场提供[SCXK(京) 2014-0013]。所有动物在本实验室独立动物房饲养[SYXK(晋)2015-0001],室温(24±1)℃,12 h光照/12 h黑暗循环,每日提供充足的标准食物与饮水。动物的使用及操作按照本校动物管理委员会(IACUC2017-001)的规定执行,在使用动物的过程中充分考虑动物福利原则,尊重动物,善待动物,最大程度减少对动物的伤害和痛苦。
1.2 主要试剂和仪器
A型肉毒素重链购自美国List Biological Laboratories, Inc;PE-10(RWD Life Science,62324,China);多功能酶标仪(Molecular Devices, SpectraMax@190,USA);多功能电泳仪(Bio-Rad, USA); Bradford 法蛋白浓度测定试剂盒 (Sangon Biotech, C503031,China);EasySee Western blot kit (TRAN, DW101, China);兔抗磷酸化GAP43单克隆抗体(Thermo Fisher, PAI-4626,USA);兔抗SCG 10多克隆抗体(Thermo Fisher, 720178, USA);兔抗-GAPDH 多克隆抗体 (Bioword, AP0063, China);辣根过氧化物酶(HRP)标记的羊抗兔二抗(Bioword, AP0063, China);凝胶成像系统(Bio-Rad,USA);冰冻切片机(Leica, 1950-Cryostat, Germany);兔抗磷酸化GAP 43单克隆抗体(Bioword, BS4791, China);Alexa Fluor 594结合的羊抗兔IgG 二抗 (Lifetechnologies, A11012, USA); Alexa Fluor 488结合的驴抗兔IgG 二抗(Lifetechnologies, A21206, USA);抗衰变荧光封片剂 (Invitrogen,P36931, USA);荧光倒置显微镜(Olympus IX71,Japan)。
1.3 实验方法
1.3.1 腰段脊髓半横断损伤模型建立
将全身麻醉后的大鼠后背位固定于鼠台,剃去背部被毛,以髂前上棘确定L3~L4椎间隙,并依次向上确定T9~T10椎间隙。以T9~T10为中心,沿背部正中皮肤切开2~3 cm的切口,分离脊柱周围肌肉筋膜,暴露椎板,剪去T9棘突并用咬骨钳移除T9椎板,暴露脊髓。以脊髓正中静脉为标志,在显微镜下,用眼科镊子从脊髓正中静脉左侧插入直至椎板,横向夹断脊髓。止血消毒后逐层缝合肌肉筋膜及皮肤。苏醒后的大鼠呈现左后肢拖地行走、抓力显著下降、热痛敏时间无限延长。动物置于温暖环境中常规饲养至实验终止。
1.3.2 BoNT/A重链给药及实验分组
通过两个部位间断给予BoNT/A重链制剂:(1)损伤局部给药:于损伤同时局部给予BoNT/A重链4 μg(4 μg/4 μL);(2)腰骶部鞘内置管给药[16]:模型建立后每周给予BoNT/A重链2 μg(2 μg/2 μL)。BoNT/A重链制剂配置:50 μL 0.9%的医用无菌生理盐水溶入一支A型肉毒素重链冻干粉中(50 μg),震荡摇匀,即可配置成A型肉毒素重链注射液(1 μL /μg),每次以20 μL总容量用药。实验分为3组(每组6只):(1)假手术组(Control组):切开皮肤,剪去椎板、暴露脊髓,但不损伤脊髓;(2)单纯损伤组(Injury组):切开皮肤,剪去椎板、暴露脊髓并行一侧脊髓离断术;(3)脊髓损伤 + BoNT/A重链干预组 (BoNT/A HC 组):单侧腰段脊髓离断同时局部给予及随后每周鞘内给予BoNT/A重链制剂。根据时间点,单纯损伤组和脊髓损伤 + BoNT/A 重链干预组又分为2 d、7 d、14 d和28 d组。
1.3.3 双向电泳—硝酸银染色检测脊髓蛋白总体表达
各实验组大鼠分别在不同时间点(2、7、14、28 d)用1%的戊巴比妥钠深度麻醉,沿原手术部位切开背部皮肤,打开L3~L4以上椎板至脊髓损伤部位,充分暴露脊髓。用剃须刀片切取包括损伤中心、距损伤中心上下各0.5 cm的损伤侧脊髓组织。
将标本置于预冷的蛋白裂解液(蛋白裂解液配方:尿素:21 g,硫脲:7.9 g,二硫赤鲜醇(dithioerythritol,DTE): 0.5 g, Tris: 0.5 g纯水定容至50 mL)内,用剪刀剪碎,并于玻璃研磨器内进行研磨制备组织悬液,随后将组织悬液用超声粉碎机进一步破碎。组织悬液充分混匀后采用Bradford法测定蛋白浓度。每组标本取150 mg蛋白,上样于 pH 3~10 的NL IPG 预制干胶条进行第一向等电聚焦; 将聚焦完成的胶条用2D equilibration buffer [6 mol/L尿素,50 mmol/Tris-HCl (pH 8.8),30%甘油,2% SDS,1% DTT,痕量溴酚蓝]进行充分清洗和平衡后进行第二向电泳(12.5%的聚丙烯酰胺凝胶)。对完成电泳后的凝胶进行硝酸银染色。采用Bio-Rad 凝胶成像系统对0.1%硝酸银染色后的胶条进行成像及分析处理。
1.3.4 选择性生长相关蛋白的Western blot检测
每组样本取20 μg蛋白样品上样15% SDS-聚丙烯酰胺凝胶。将蛋白转至PVDF膜上,5%的脱脂奶粉封闭1 h,加入选择性生长相关蛋白抗体:兔抗磷酸化GAP 43单克隆抗体(1∶3000,Thermo Fisher, PAI-4626, USA)或兔抗SCG 10多克隆抗体(1∶1000), 及兔抗-GAPDH 多克隆抗体 (1∶5000),4℃冰箱摇床过夜;TBST充分洗膜后,加入辣根过氧化物酶(HRP)标记的羊抗兔二抗(1∶1000),室温孵育1 h,充分洗涤后加入新鲜配置发光工作液反应3 min,暗室曝光显影后,于凝胶成像分析系统上对胶片上的蛋白条带进行扫描及摄像分析。
1.3.5 免疫荧光检测
各实验组大鼠分别在不同时间点(2、7、14、28 d)时在1%的戊巴比妥钠深度麻醉下用4%多聚甲醛经心插管灌注固定后,取出以损伤脊髓为中心长约0.5 cm的脊髓置于相同固定液中后固定1 h,移入30%的蔗糖溶液中4℃过夜。OCT包埋,制作冰冻切片。由背部向前面的额状纵切面连续切片,厚度为16 μm。0.1% TritonX-100 穿透10 min,0.1 mol/L 的 PBS洗涤(5 min×3次),10%正常血清封闭1 h,分别加入选择性生长相关蛋白抗体:兔抗磷酸化GAP 43单克隆抗体(p-GAP 43,1∶100, Bioword, BS4791, China)或兔抗SCG 10多克隆抗体(1∶500),4℃ 冰箱孵育过夜。弃去1抗,PBS 充分冲洗(5 min×3 次) 后加入二抗:Alexa Fluor 594结合的羊抗兔IgG 二抗(1∶500) 或Alexa Fluor 488结合的驴抗兔IgG 二抗(1∶500),室温避光孵育 1 h,PBS充分冲洗后加入含有抗衰变荧光封片剂,置于荧光倒置显微镜下进行观察并采集图片。
1.4 统计学方法


注:A:只行椎板切除术,暴露的脊髓及正中静脉;B:行椎板切除术,且脊髓半横断;C:大鼠麻醉苏醒后手术侧后肢拖地行走;D:取出脊髓可见横断的断端;A、B图中箭头指示暴露的脊髓和正中静脉的位置;C图中箭头指示手术侧后肢;D图中箭头指示横断脊髓的断口。图1 大鼠脊髓腰部半横断术大体及体态特征Note.A: Only laminectomy, spinal cord and median vein were exposed. B: Laminectomy and spinal cord hemisection. C: After anesthesia the surgery side dragging the hind leg walking. D: Hemisection of the spinal cord was visible. The arrow points to the spinal cord and the median vein (A,B). The arrow in C points to the surgical side of the hind limb. The arrow in D points to the spinal cord incision.Fig.1 Photos of the exposed spinal cord and median vein during surgery in the SCI group and the movement of the hind limb post-SCI and visible spinal cord incision
2 结果
2.1 单侧腰段脊髓损伤模型的大体观察及术后体态特征
本实验通过髂嵴解剖学标志定位T9~T10椎骨,并去除第9 椎板暴露腰髓,用眼科镊子沿脊髓正中静脉左侧夹断一侧腰髓。术后动物呈现左侧后肢瘫痪、拖地行走,抓力及热痛敏感觉实验表明大鼠运动功能及感觉功能障碍,脊髓损伤模型成功。另外,脊髓大体特征也显示损伤基本位于腰膨大部位(图1)。
2.2 BoNT/A重链对脊髓损伤后局部蛋白总体表达谱的影响
双向电泳及硝酸银染色结果表明单纯脊髓损伤后局部蛋白表达与正常呈现明显不同。损伤后脊髓局部有些蛋白表达下降或升高,这些蛋白表达的增高和降低呈现单独的蛋白表达点的变化,亦或者是数个点的变化趋势;给予BoNT/A重链后局部蛋白表达的最大特点是:不论单纯损伤时蛋白表达的变化如何,BoNT/A重链作用下蛋白表达皆呈现升高趋势, 譬如:分子量35~45 kDa之间、等电点在4~5及分子量在18~25 kDa之间、等电点在7左右的蛋白表达点在单纯损伤时较正常对照组增多,而采用BoNT/A重链后其表达进一步增多(图2中红、绿箭头所示)。

注:图中红绿箭头指向差异表达的两个蛋白点。图2 分子量在18.4~45 kD左右的蛋白表达变化Note.Positions of the differentially expressed spots are indicated with red and green arrows.Fig.2 The differentially expressed proteins whose molecular weight is between 18.4-45 kD
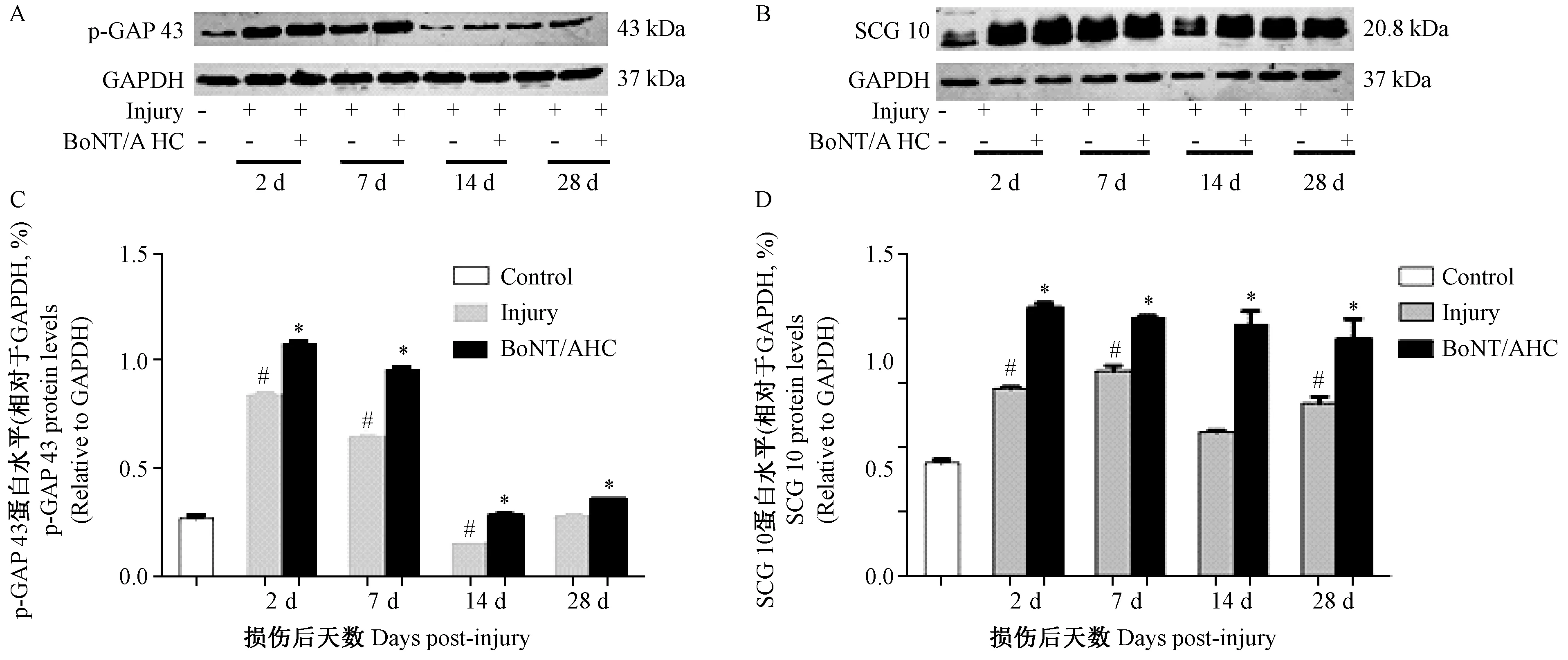
注:与正常对照组相比,#P< 0.05;与单纯损伤组相比,*P< 0.05。图3 BoNT/A 重链对p-GAP 43和SCG 10表达的影响Note.Compared with the control group,#P< 0.05. Compared with the injury group, *P < 0.05.Fig.3 Effects of BoNT/A HC on the expression of p-GAP 43 and SCG 10
2.3 BoNT/A重链对选择性生长相关蛋白表达的影响
根据双向电泳蛋白表达谱的变化,我们选取分子量接近45 kDa的磷酸化GAP-43(p-GAP 43)和分子量位于18.4~25 kDa的SCG 10作为目标蛋白进行免疫蛋白印迹检测验证。结果显示单纯脊髓损伤2~7 d时,p-GAP 43和SCG 10的表达皆较正常偏高,而给予BoNT/A重链后两个时间点,局部p-GAP 43和SCG 10的表达增高的趋势更为明显,与单纯损伤组相比差异有显著性 (P< 0.05)。随着损伤时间的延长及连续给予BoNT/A重链,当损伤时间达到14 d以上,单纯损伤组和BoNT/A重链干预组p-GAP 43的表达皆较正常对照组下降,但BoNT/A重链干预组的p-GAP 43表达仍较单纯损伤组为高(P< 0.05);而对于SCG 10,当损伤达到14 d和28 d时,其表达略有下降,而给予BoNT/A重链的大鼠损伤的SCG 10 表达仍呈明显增高的现象(图3)。上述结果表明脊髓损伤后给予BoNT/A重链可增强两种选择性生长相关蛋白的表达,其变化特征与双向电泳结果一致。
2.4 BoNT/A 重链用药后p-GAP-43和SCG 10在损伤局部的分布

注:Control、Injury和BoNT/A HC中的Bar=500 μm;Caudal和Rostral中的Bar=20 μm。图4 BoNT/A HC对p-GAP 43和SCG 10分布的影响Note.Scale bar=500 μm in the control (left), Injury and BoNT/A HC sites. Scale bar=20 μm in the control (right), caudal and rostral sites.Fig.4 Effects of BoNT/A HC on the distribution of p-GAP 43 and SCG 10
采用免疫荧光技术分别对p-GAP 43和SCG 10在脊髓损伤局部的分布变化进行了观察。与western blot结果相似:在损伤后2、7 d时,脊髓损伤局部的头尾两端p-GAP 43和SCG 10的荧光强度都有所增强,免疫荧光阳性的部位主要分布与细胞体;但在损伤14 d后逐渐减弱;采用BoNT/A 重链连续给药后,同时间点损伤局部头尾端的荧光强度比单纯损伤组更为增强(图4)。高倍镜下的荧光特征显示采用BoNT/A重链干预的动物,脊髓损伤局部p-GAP 43和SCG 10阳性荧光染色不仅分布于细胞胞浆,同时细胞突起也呈现阳性反应,由此而使细胞突起显而易见。免疫荧光结果也提示BoNT/A 重链干预的脊髓损伤组织,p-GAP 43和SCG 10局部分布特征相似,皆主要以损伤周边表达增强。由于细胞突起显而易见,因此,可以认为BoNT/A 重链干预脊髓损伤周边组织内神经突起的长度和数目(图4)。
3 讨论
本研究主要通过单侧腰段脊髓损伤基础上局部和鞘内间断性给予BoNT/A 重链,以此观察BoNT/A重链对脊髓损伤局部生长相关蛋白表达的影响。实验结果表明,BoNT/A 重链可干预脊髓损伤后蛋白表达,对于选择性生长相关蛋白p-GAP 43和SCG 10则具有增强其表达、增加其在神经细胞及其突起内的分布。
与周围神经系统(PNS)相比,中枢神经系统(CNS)损伤后通常不能再生[17-18],其原因主要归结于损伤的成熟CNS处于富含抑制蛋白和糖蛋白的抑制环境。此外,损伤的成熟CNS神经元内在的生长程序的启动非常有限[7]。因此,作为CNS之一的脊髓发生损伤后的再生修复是非常有限的。大多数SCI患者面临着神经功能障碍和终身残疾的问题。因此,通过各种方式激活CNS的内在生长程序[19]、或通过提供一个允许的环境来促进CNS的神经细胞或轴突再生,积极探讨促进脊髓损伤后的再生修复的策略和方法是再生医学的焦点之一。
本实验中所采纳的BoNT/A重链为人工重组的多肽链,保留了BoNT/A与宿主细胞结合的功能结构。我们前期的体外实验已经证明,将人工重组的BoNT/A 重链加入培养的Neuro-2a细胞内,可促进该细胞神经突起增长、突起数目增多等,具有促神经生长的作用[20-21]。因此可以推论在体应用BoNT/A重链时,只要能够保持重链进入体内不被分解、维持有效浓度,则可发挥其在体外类似的促神经突起生长作用。本实验采用损伤当时局部给予BoNT/A重链及术后经腰骶部插管进行鞘内间断性给药的方法,尽可能保证将BoNT/A重链直接导入损伤局部、维持一定药物浓度,避免其被外周抗体中和单核吞噬细胞吞噬的结局,可以保证药物在实验观察阶段持续有效。因此,此种给药方法适合用于观察干预脊髓损伤后再生修复的一些药物/制剂的长期疗效。
损伤轴突的最终成功再生依赖于再生相关基因(regeneration-associated genes, RAGs)及其对应蛋白质在神经细胞内的转录和翻译合成[22]。研究者曾经观察外周神经损伤早期的细胞体反应时发现,外周神经损伤后所属神经元的mRNA及其相关蛋白的合成明显增加,这种反应呈现了损伤后的积极主动的再生修复过程[23-24],譬如:损伤后轴突特异生长相关蛋白-43(GAP-43)的表达上调被认为积极参与轴突再生[25-26]。除GAP-43外,本实验中所选择的另一个生长相关蛋白(颈上神经节蛋白10,SCG 10)亦是参与神经轴突再生的主要结构蛋白。GAP-43主要以磷酸化形式参与成熟神经轴突发芽和再生,在神经损伤时表达上调;而SCG 10,也被称为STMN蛋白2(STMN2),属于stathmin家族蛋白,主要参与轴突内的微管动力学和蛋白质转运[27-28],是神经轴突再生的标志蛋白之一[29]。本研究之所以选择GAP-43及SCG 10作为BoNT/A重链是是否干预脊髓损伤后再生修复的标志蛋白主要是基于上述两种蛋白的促神经生长作用,同时还由于二者的分子量恰好位于双向电泳结果中呈现变化的蛋白点水平范围内。针对这两种选择性性生长相关蛋白的SDS-PAGE及Western Blot 结果显示:不论p-GAP-43或SCG 10,在单纯脊髓损伤时二者的表达均有所增多;不论二者在损伤后随时间变化的特征有何差异,损伤基础上的BoNT/A重链应用皆可促进二者的表达进一步增强。本研究的实验结果提示:脊髓损伤后的p-GAP 43和SCG 10的表达增加是脊髓组织对损伤做出的有限再生反应,由于中枢神经系统损伤后局部还有大量的髓磷脂抑制因子的产生及对神经轴突再生的抑制作用,因此单纯损伤后的p-GAP 43和SCG 10的表达增加并不能代表神经轴突可以进行有效再生;BoNT/A 重链对p-GAP 43和SCG 10表达的进一步促进可以看做是BoNT/A 重链在体发挥干预作用的一部分。事实亦是如此,BoNT/A 重链对神经细胞的干预作用并不仅限于干预生长相关蛋白的表达。我们同期的实验研究已观察到BoNT/A 重链可以抑制髓鞘相关糖蛋白(myelin associated glycoprotein, MAG)的表达,并可拮抗MAG促ROCK的磷酸化(另文发表)。
结合本实验结果可以推断:在体脊髓损伤后局部给予BoNT/A重链通过其促进多种生长相关蛋白的表达等最终发挥其促损伤后神经再生修复的作用。然而,由于本实验仅仅观察了BoNT/A重链对p-GAP 43 和SCG 10的表达,其对在体CNS(包括脊髓)损伤后更多参与再生修复蛋白的影响尚需进一步的研究。
[1] Silver J, Miller JH. Regeneration beyond the glial scar [J]. Nat Rev Neurosci, 2004, 5(2): 146-156.
[2] Giger RJ, Hollis ER, Tuszynski MH. Guidance molecules in axon regeneration [J]. Cold Spring Harb Perspect Biol, 2010, 2(7): a001867.
[3] Simpson LA, Eng JJ, Hsieh JT, et al. The health and life priorities of individuals with spinal cord injury: A systematic review [J]. J Neurotrauma, 2012, 29(8): 1548-1555.
[4] Ferguson TA, Son YJ. Extrinsic and intrinsic determinants of nerve regeneration [J]. J Tissue Eng, 2011, 2(1): 204173141 1418392.
[5] He Z. Intrinsic control of axon regeneration [J]. J Biomed Res, 2010, 24(1):2-5.
[6] Burgen AS, Dickens F, Zatman LJ. The action of botulinum toxin on the neuro-muscular junction [J]. J Physiol, 1949, 109(1-2): 10-24.
[7] Schiavo G, Rossetto O, Benfenati F, et al. Tetanus and botulinum neurotoxins are zinc proteases specific for components of the neuroexocytosis apparatus [J]. Ann N Y Acad Sci, 1994, 710: 65-75.
[8] Navarrete AL, Rafferty KL, Liu ZJ, et al. Botulinum neurotoxin type A in the masseter muscle: effects on incisor eruption in rabbits [J]. Am J Orthod Dentofacial Orthop, 2013, 143(4): 499-506.
[9] Park SY, Park YW, Ji YJ, et al. Effects of a botulinum toxin type A injection on the masseter muscle: An animal model study [J]. Maxillofac Plast Reconstr Surg, 2015, 37(1): 10.
[10] Ansved T, Odergren T, Borg K. Muscle fiber atrophy in leg muscles after botulinum toxin type A treatment of cervical dystonia [J]. Neurol, 1997, 48(5): 1440-1442.
[11] Durham PL, Cady R, Cady R. Regulation of calcitonin gene-related peptide secretion from trigeminal nerve cells by botulinum toxin type A: implications for migraine therapy [J]. Headache, 2004, 44(1): 35-42.
[12] Schiavo G, Matteoli M, Montecucco C. Neurotoxins affecting neuroexocytosis [J]. Physiol Rev, 2000, 80(2): 717-766.
[13] Lacy DB, Tepp W, Cohen AC, et al. Crystal structure of botulinum neurotoxin type A and implications for toxicity [J]. Nat Struct Biol, 1998, 5(10): 898-902.
[14] 李夏青.肉毒杆菌毒素的临床应用及其前景[M]. 北京:知识产权出版社,2012: 1-200.
[15] Ayyar BV, Tajhya RB, Beeton C, et al. Antigenic sites on the HN domain of botulinum neurotoxin A stimulate protective antibody responses against active toxin [J]. Sci Rep, 2015, 5: 15776.
[16] 邓亚南, 刘艳芳, 陈建平, 等. 经大鼠腰骶部鞘内置管给药技术的研究 [J]. 中国医学创新, 2014, 11(18): 33-35.
[17] Goldberg JL, Klassen MP, Hua Y, et al. Amacrine-signaled loss of intrinsic axon growth ability by retinal ganglion cells [J]. Science, 2002, 296(5574): 1860-1864.
[18] Fernandes KJ, Fan DP, Tsui BJ, et al. Influence of the axotomy to cell body distance in rat rubrospinal and spinal motoneurons: differential regulation of GAP-43, tubulins, and neurofilament-M [J]. J Comp Neurol, 1999, 414(4): 495-510.
[19] Fagoe ND, van Heest J, Verhaagen J. Spinal cord injury and the neuron-intrinsic regeneration-associated gene program [J]. Neuromolecular Med, 2014, 16(4): 799-813.
[20] 高美玲, 王红, 张彩云, 等. 血清型A肉毒杆菌神经毒素重链对 Neuro-2a 细胞的促神经突起再生作用 [J]. 中国病理生理杂志, 2015, 31(12): 2221-2227.
[21] 王红, 高美玲, 兰婧, 等. 小鼠神经母细胞瘤细胞株用于A 型肉毒毒素重链体外实验的可行性研究 [J]. 中华细胞与干细胞杂志:电子版, 2015, 5(4): 23-28.
[22] Ma TC, Willis DE. What makes a RAG regeneration associated? [J]. Front Mol Neurosci, 2015, 8: 43.
[23] Lieberman AR. The axon reaction: a review of the principal features of perikaryal responses to axon injury [J]. Int Rev Neurobiol, 1971, 14: 49-124.
[24] Grafstein B. The nerve cell body response to axotomy [J]. Exp Neurol, 1975, 48 (3 pt.2): 32-51.
[25] Skene JH, Willard M. Axonally transported proteins associated with axon growth in rabbit central and peripheral nervous systems[J]. J Cell Biol, 1981, 89(1): 96-103
[26] Skene JH. Axonal growth-associated proteins [J]. Annu Rev Neurosci, 1989, 12: 127-156.
[27] Ozon S, Maucuer A, Sobel A. The stathmin family — molecular and biological characterization of novel mammalian proteins expressed in the nervous system [J]. Eur J Biochem, 1997, 248(3):794-806.
[28] Wang J, Shan C, Cao W, et al. SCG 10 promotes non-amyloidogenic processing of amyloid precursor protein by facilitating its trafficking to the cell surface [J]. Hum Mol Genet, 2013, 22(24): 4888-4900.
[29] Shin JE, Geisler S, Diantonio A. Dynamic regulation of SCG 10 in regenerating axons after injury [J]. Exp Neurol, 2014, 252(3): 1-11.
