超声造影评价肝癌消融疗效的价值
2018-03-05王树松
王树松
(山东省青岛市黄岛区第二人民医院超声科,青岛 266400)
近几年来,经皮肝穿刺微波、射频和激光等局部消融技术日臻成熟,在肝脏肿瘤的治疗中越来越受到重视[1],如何评价消融效果是医患双方关注的重点。尽管增强CT(contrast-enhanced CT,CECT)、超声造影(contrast-enhanced ultrasound,CEUS)发现动脉期有强化,彩色多普勒血流成像(color Doppler flow imaging,CDFI)发现肿瘤内血流信号都可诊断消融不全,但选择哪种方法进行评价更加安全和实用,令患者和临床医生颇为困惑。本文通过对2008年5月~2016年10月资料完整的46例60个肝癌微波消融治疗1个月CDFI、CEUS与CECT检查结果进行回顾性比较,探讨CEUS在肿瘤消融后疗效评价中的临床价值,为临床医师的诊断治疗提供帮助。
1 临床资料与方法
1.1 一般资料
本组46例60个病灶,男30例,女16例。年龄40~71岁,(54.0±4.4)岁。肿瘤最大直径24~58 mm,(40.5±17.5)mm。病灶位于左肝外叶12个、内叶9个,右肝前叶23个、后叶16个。均经CT、超声或MRI等影像学检查并结合病史和血清肿瘤标志物水平诊断肝癌,患者自愿选择微波消融治疗,消融前均行穿刺活检并明确诊断,其中原发性肝癌26例31个病灶,转移性肝癌16例25个病灶(胃癌转移8例14个病灶,结直肠癌转移6例9个病灶,肺癌转移2例2个病灶),胆管细胞性肝癌4例4个病灶。均于微波消融治疗1个月后行CDFI、CEUS及CECT检查。
微波消融病例选择标准:①单发肿瘤直径<50 mm;②多发肿瘤<3个,最大直径<40 mm;③无血管、胆管等癌栓或肝外转移;④肿瘤距离肝门部胆总管、左右肝管>5 mm;⑤肝功能Child分级为A、B级,无腹水或有少量腹水。
1.2 方法
使用美国GE公司Voluesion E8彩色多普勒超声诊断仪并匹配实时超声造影软件,C1-5宽频探头,频率2.5~5.0 MHz。超声造影剂使用Bracco公司生产的注射用六氟化硫微泡(SonoVue,国药准字J20130045),用5 ml生理盐水溶解25 mg造影剂冻干粉并震荡摇匀备用。先对消融病灶进行常规CDFI检查,记录病灶形态、大小、内部回声和血流情况,确定消融病灶内和边缘有无血流信号,若未出现血流信号视为阴性,出现血流信号视为肿瘤残留(图1)。然后行CEUS,每次抽取2.4 ml造影剂,经肘静脉快速团注后再推注5 ml生理盐水冲管,推注造影剂的同时启动造影程序并录像保存,仔细观察动脉相、门脉相、延迟相病灶内部或周边有无异常增强区,连续观察时间6 min,若各期均未增强提示为阴性,若动脉期肿瘤内或边缘增强、实质期肿瘤边缘提前消退,提示肿瘤残留(图2)。造影结束后回放录像并对消融区形态及造影增强特点进一步分析诊断[2]。CEUS后立刻进行CECT检查,若消融区域无强化视为阴性,若病灶内或边缘出现强化则为肿瘤残留(图3)。判断标准:CDFI、CEUS与CECT三项检查结果均为阴性时诊断为完全灭活,任一检查结果为阳性时诊断为未完全灭活,对可疑部位进行穿刺活检,以病理结果为准。
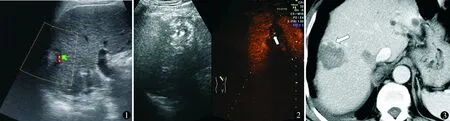
图1 彩色多普勒超声(CDFI)显示消融病灶边缘残留肿瘤血流信号(绿箭头) 图2 超声造影(CEUS)显示消融病灶边缘残留肿瘤造影剂聚集(白箭头)及穿刺引导线 图3 增强CT(CECT)显示消融病灶边缘的残留肿瘤组织强化(白箭头)
2 结果
本组60个肝脏病灶消融术后1个月行CDFI、CEUS、CECT检查,诊断未完全灭活病灶12个。对12个可疑病灶进行穿刺组织活检证实均为肿瘤残留。其中CDFI阳性8个(漏诊率33.3%,4/12),CEUS阳性11个(包含CDFI阳性8个)(漏诊率8.3%,1/12),CECT阳性12个(包含CEUS阳性11个)(漏诊率0%,0/12),均无假阳性。
对12个病理证实的肿瘤残留病灶进行消融治疗,继续随访3~24个月,复查CDFI、CEUS和CECT,在消融病灶内均未再现阳性表现。
3 讨论
消融技术是通过各种物理或化学方法使肿瘤组织发生不可逆转细胞变性和坏死,是肝脏肿瘤的局部治疗,可以最大限度地保留正常肝脏组织和功能。随着设备和技术的发展,近几年肝脏肿瘤的消融已经达到了精确的水平,如何判断这些微创技术的疗效则是衡量治疗成败的关键。CECT受人为因素干扰少,是肝脏肿瘤消融疗效判断的“金标准”[3],但CECT检查时患者要受到X线辐射,部分患者对造影剂过敏,消融早期不适合CECT检查,为早期疗效评价带来困难[4]。随着SonoVue超声造影剂的出现,CEUS在肝脏肿瘤和外伤诊断方面的应用越来越广泛,在肝脏肿瘤消融治疗方面的应用越来越受到重视[5]。本组结果显示,CEUS与CECT具有较高的一致性,说明CEUS能够准确评价肝脏肿瘤消融的疗效。
经肘静脉团注SonoVue进行肝脏造影是一种血池造影,能准确显示肿瘤内血供情况,且能动态观察整个灌注的过程。超声造影剂可作为红细胞示踪剂判断肿瘤消融区的组织活性,消融后的肿瘤组织及瘤内血管受理化因素均发生不可逆的凝固坏死,不存在血液循环,有血流灌注的组织则为活性组织[5],消融后CEUS增加消融区与周围未消融区的对比,肿瘤病灶较造影前显示更加清晰,能够更加准确地反映肿瘤位置、大小及浸润范围[6],因此CEUS能够较好地判断肝脏肿瘤消融的疗效。
CDFI能直观显示肿瘤的血供情况,但由于受探头频率、血流速度、血管与声束的角度等多种制约,部分病灶不能检测出血流信号,特别是微小血管的低速血流更难显示,而肝脏肿瘤特别是肝癌内血管表现为增生紊乱、形态不规则、盘绕、扭曲、拉直、易位、动静脉短路等恶性特征,消融区肿瘤组织和血管均凝固坏死,即使肿瘤残留,内部血管也受到不同程度的破坏,残存血管的血流紊乱,流速较低,因此使用CDFI检查尽管也能检出部分残余肿瘤,但容易漏诊。CEUS改善灰阶超声图像的质量,增加信噪比,通过血管内造影剂可完全显示肿瘤内的血管分布形态,补偿病灶内微小血管低速血流显示不佳的缺陷,提高残留肿瘤和复发肿瘤的检出率。本组12个消融后残留病灶CDFI仅检出8个,CEUS则检出11个,CEUS较CDFI评价肿瘤的消融效果具有明显的优势。
与CDFI比较,CEUS能克服肿瘤内血流速度、角度及频率的影响,准确反映肿瘤的血流灌注情况,明确显示肿瘤的消融范围及肿瘤灭活程度,提高消融后残余肿瘤的检出率,与此同时,造影时显示肿瘤内残存瘤组织明显增强,可为穿刺活检和再次消融提供参考和引导。与CECT比较,CEUS残余肿瘤的检出率与其相当,但CEUS具有操作简单,不用过敏试验且能实时监测的独特优势。然而超声显示的是病灶的断面信息,造影时一般固定在某一断面或者在小范围内摆动探头观察消融瘤区的造影变化,无法对肿瘤整体和瘤体外病灶进行全面判断,气体或肋骨的干扰也影响一些特殊区域的病灶显示,而CECT则是整体扫描、断层阅片,不遗漏某些断面的显像。目前实时三维超声已经能够立体实时显示脏器和病灶,超声造影与实时三维技术融合,将进一步提高肿瘤消融效果的判断价值。
综上所述,CEUS评价肝脏肿瘤消融的价值接近CECT,且操作方法简单,过程安全无辐射,能精准引导肿瘤残留病灶的穿刺活检和局部治疗,可作为肝脏肿瘤消融治疗后疗效判断的常规方法。
1 沈 强,许 赟,王 能,等.射频消融治疗超过米兰标准肝细胞肝癌的长期疗效研究.中国微创外科杂志,2016,16(9):774-776,794.
2 蓝思荣,张淼源,周剑辉.超声造影在肝脏恶性肿瘤微波消融治疗后近期疗效评估的应用价值.齐齐哈尔医学院学报,2015,36(15):2205-2207.
3 Tsuda M,Majima K,Yamada T,et al.Hepatocellular carcinoma after radiofrequency ablation therapy:dynamic CT evaluation of treatment.Clin Imaging,2001,25(6):409-415.
4 Kisaka Y,Hirooka M,Kumagi T,et al.Usefulness of contrast enhanced ultrasonography with abdominal virtual ultrasonographic assessing therapeutic response in hepatocellular carcinoma treated with radiofrequency ablation.Liver Int,2006,26(10):1241-1247.
5 周平安,林礼务,薛恩生,等.超声造影引导肝脏局灶性病变穿刺活检的临床应用价值.中国介入影像与治疗学,2009,6(2):159-163.
6 肖 彬,王春瑜,曹 阳,等.超声造影与增强CT评价经皮射频消融治疗肝癌术后近期疗效的对比研究.广西医学,2015,37(7):931-934.
