重金属对日本楤木内渗透调节物质的影响
2018-03-05李德生
李德生,何 安,彭 玲,王 硕,王 静
(天津理工大学环境科学与安全工程学院,天津 300381)
土壤重金属污染是一个严重且普遍存在的问题,尤其是重金属对农田和作物的影响日趋严重[1-2]。由于重金属具有毒性和不易被生物降解的特性[3-4],一旦土壤被其污染,会长期停留在土壤中并且对生态系统造成严重的威胁,甚至会通过食物链被人体吸收而致病[1-2,5],因此解决土壤重金属污染问题已成为全球性的任务[6]。不少学者发现,利用植物来治理重金属污染土壤比物理方法、化学方法更具有经济、生态等效益[7-8],然而重金属会对植物的生长和代谢产生不利影响,甚至会导致植物死亡。因此植物自身对重金属的抵抗能力成为学者研究的热点。
目前,学者们将研究方向主要集中在重金属对植物体内的渗透调节物质[9]、抗氧化系统[10]的影响方面,但大部分偏向于蔬菜[11]、大型木本植物[12]的研究,很少针对木本蔬菜的研究。日本楤木是一种重要的木本蔬菜,其根系发达、抗逆性强、容易栽培[13]。另外,日本楤木的嫩芽中含有9种人体必需的氨基酸和微量元素,含量比人参中的含量高,还具有提高人体免疫力、防治老年性疾病的作用,增强脑功能、延缓衰老等功能,是食用兼药用于一身的植物。因此,研究重金属对日本楤木的影响具有重要的意义,能为日本楤木的安全生产提供参考。
本研究采用盆栽试验法,研究单一(Pb、Cd、Zn)及复合(Cd+Zn、Pb+Zn)重金属胁迫下,日本楤木体内渗透调节物质的变化,分析重金属对植物叶片内可溶性蛋白质、可溶性糖和脯氨酸含量的影响,同时探讨重金属Pb+Zn、Cd+Zn之间的相互关系,观察重金属Zn的添加是否有利于促进单一重金属胁迫(Pb、Cd)下日本楤木叶片内渗透调节物质的积累。本研究结果能为日本楤木应用于重金属污染土壤修复的研究提供一定的依据。
1 材料与方法
1.1 材料与处理
试验于2014年12月进行,将取自天津理工大学的校园地表土(0~20 cm)置于实验室内风干处理。风干后,将该土壤与购自河北省兴农生物工程开发有限公司的营养土以质量比20 ∶1的比例进行混合,过筛后取小于2 mm部分作为供试土壤。将供试土壤置于直径20 cm、高15 cm的塑料花盆中,每盆装土2.5 kg。将大小、长势一致的二年生日本楤木幼苗扦插于花盆中,并置于温度为(25±2) ℃,光—暗处理为12 h光照—12 h黑暗,湿度为85%的人工气候室中进行培养。
待幼苗恢复生长7 d后,将化学试剂CdCl2·2.5H2O(分析纯)、Pb(NO3)2(分析纯)、ZnSO4·7H2O(分析纯)以溶液的形式均匀地加入供试土壤中进行重金属胁迫处理。每个重金属共设4个浓度梯度,每个浓度梯度均设3个平行样,并以不加重金属的空白样作为对照(表1)。
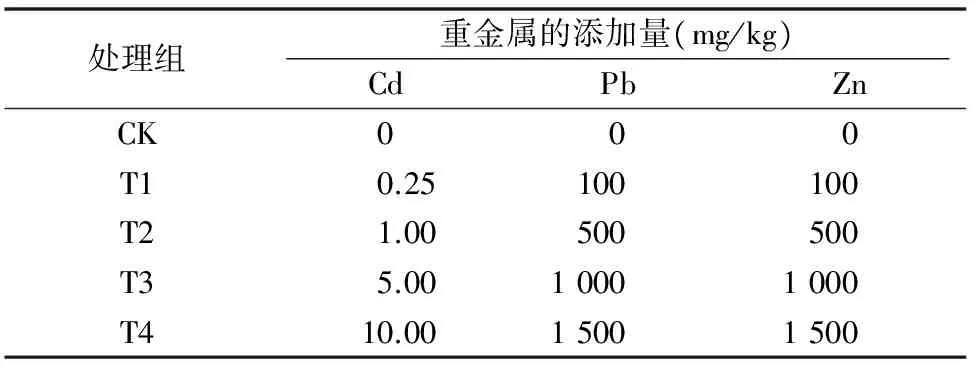
表1 复合重金属污染方案设计
1.2 指标测定及方法
2015年6月进行可溶性蛋白质含量、可溶性糖含量以及脯氨酸含量的测定,采用的方法分别为考马斯亮蓝G-250法[14]、蒽酮比色法[15]、乙醇提取法[14]。
1.3 数据分析
试验数据均采用Excel 2007软件进行整理,数据以平均值表示,并采用Origin 8.5进行制图。
2 结果与分析
渗透调节物质主要包括脯氨酸、可溶性蛋白质和可溶性糖等[16-17]。在重金属或其他胁迫下,植物体内的一些物质如脯氨酸、可溶性蛋白质和可溶性糖会积累来调节细胞内的渗透势,从而维持水的平衡[18]。另外,植物体内的渗透调节物质还可以保护参与新陈代谢等重要机体活动的酶[19]。因此,植物体内可以通过自身的渗透调节物质来提高抗胁迫能力。
2.1 可溶性蛋白质含量的变化
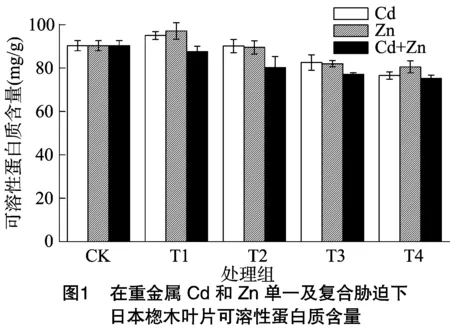
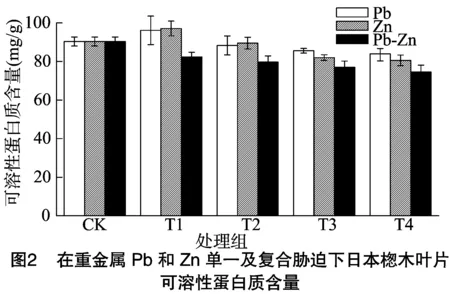
可溶性蛋白质在植物的生长过程中有着至关重要的作用[20]。大多数蛋白质都是参与植物新陈代谢的酶,因此可溶性蛋白质的含量可以表征出植物新陈代谢的强度[21]。在重金属胁迫下日本楤木叶片内可溶性蛋白质含量的变化如图1、图2所示。单一重金属胁迫下,可溶性蛋白质的含量随着重金属浓度的增加先增加后减少,其变化趋势和谌金吾研究的结果[22]一样。在土壤中重金属Cd、Pb、Zn浓度分别达到0.25、100.00、100.00 mg/kg(T1处理)时,日本楤木叶片内可溶性蛋白质的含量达到最高,分别为对照组的105%、108%、106%。随着重金属浓度的增加,可溶性蛋白质含量被抑制。当重金属Cd、Pb、Zn分别达到相应的最高浓度时,可溶性蛋白质含量分别达到最低,分别为对照组的80%、89%、93%。在重金属复合胁迫下,可溶性蛋白质含量均随重金属浓度的增加而逐渐降低,当复合重金属Cd+Zn、Pb+Zn浓度达到最高时,日本楤木叶片内可溶性蛋白质含量达到最低,分别为对照组的83.3%、82.5%。由此可以发现,复合重金属胁迫下,日本楤木内可溶性蛋白质含量随着浓度的增加呈下降趋势,但变化不明显。
2.2 可溶性糖含量的变化
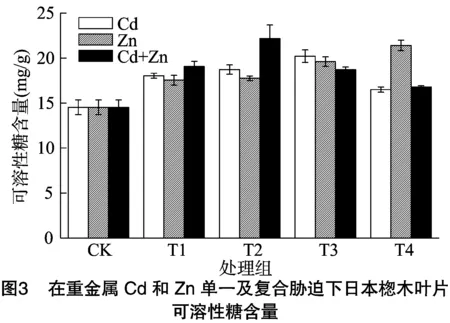
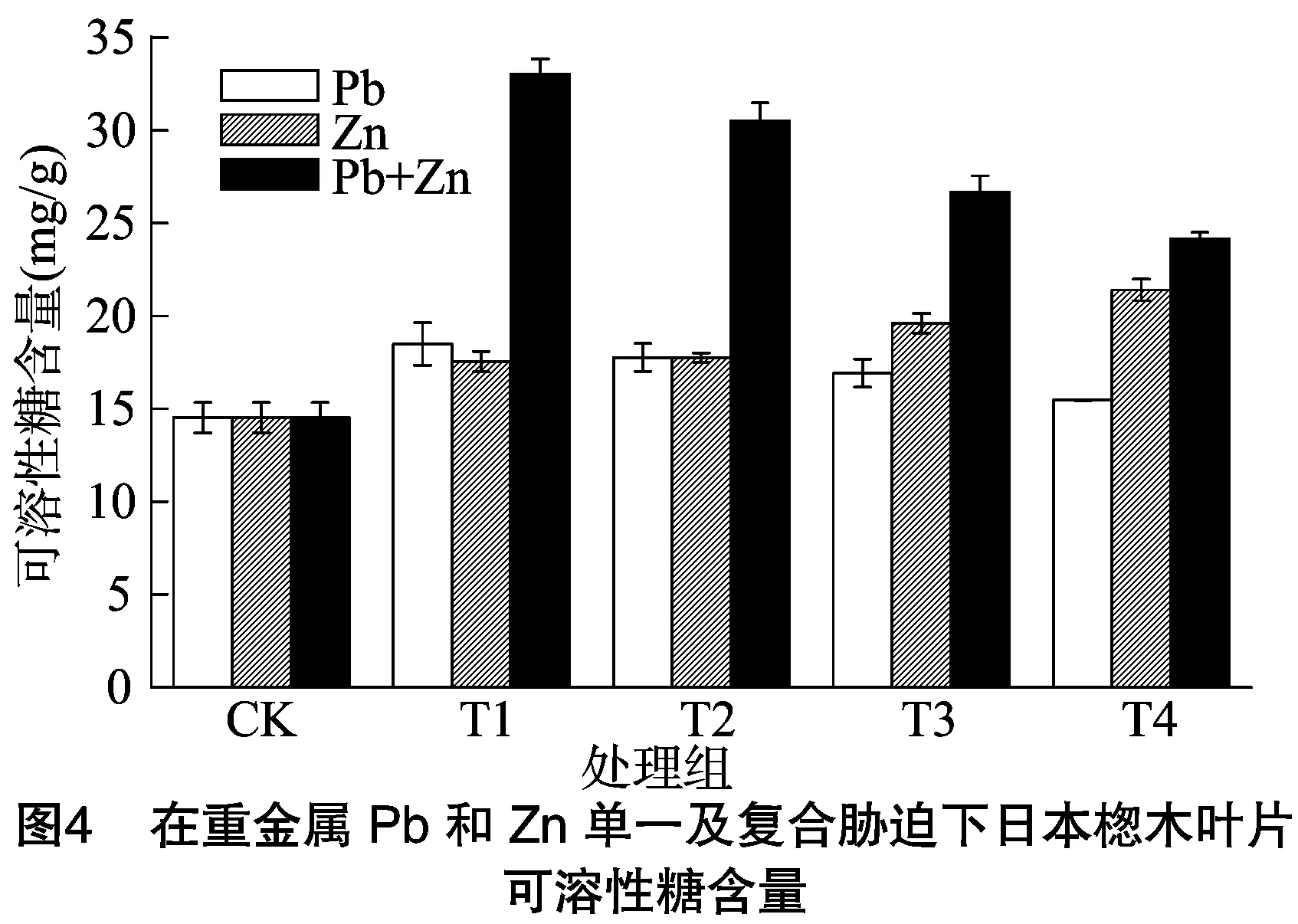
植物的光合作用通过体内的二氧化碳和水将太阳能转化为化学能,同时产生氧气和碳水化合物。碳水化合物大多数是可溶性糖,因此可溶性糖是植物生长和能量的重要来源和物质基础[23-24],同时在维持植物细胞渗透平衡中起着关键的作用。可溶性糖含量的变化可以反映植物在逆境胁迫下的适应能力。日本楤木对重金属单一及复合胁迫下可溶性糖的含量变化如图3、图4所示。在重金属Cd、Pb的胁迫下,日本楤木叶片内可溶性糖含量随着重金属浓度的增加呈先增加后减少的趋势,这种变化趋势和吴桂容等报道的重金属Cd对桐花可溶性糖含量的变化[25]和郑世英等研究的铅胁迫下玉米中可溶性糖含量的变化趋势[26]一致。同时还可以明显发现,受重金属胁迫后日本楤木叶片内可溶性糖含量高于空白对照组。当重金属Cd、Pb的浓度分别达到5(T3处理)、100(T1处理) mg/kg时,可溶性糖含量分别比对照组高39%、27%。在复合污染初期,随着重金属浓度的增加,可溶性糖含量也随之升高,当土壤中复合重金属Cd+Zn、Pb+Zn浓度达到 1 mg/kg+500 mg/kg(T2处理)、100 mg/kg+100 mg/kg(T1处理) 时,日本楤木叶片内的可溶性糖含量达到最高,分别为对照组的153%、127%。随后,可溶性糖含量随重金属浓度的增加而降低。
2.3 脯氨酸含量的变化
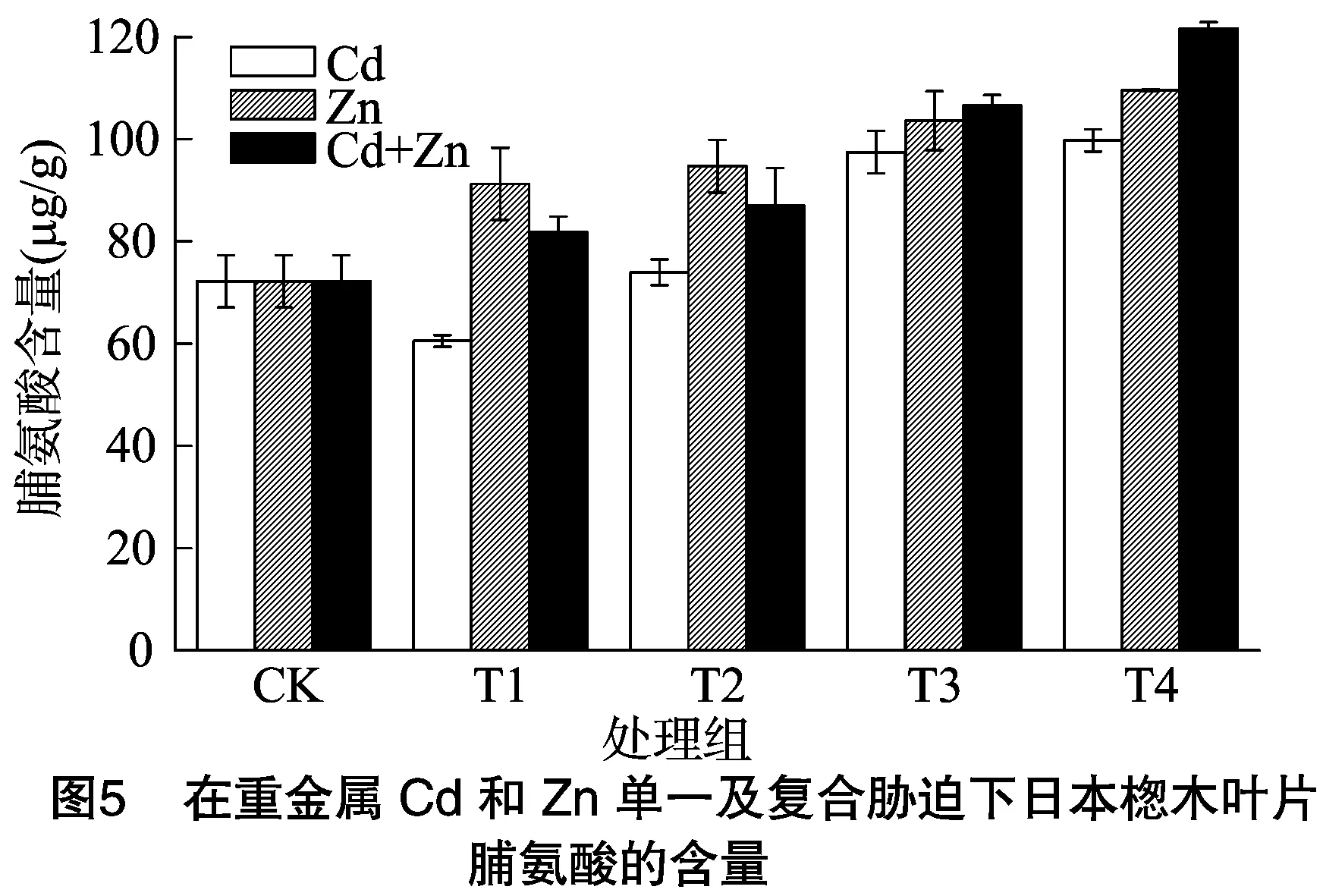
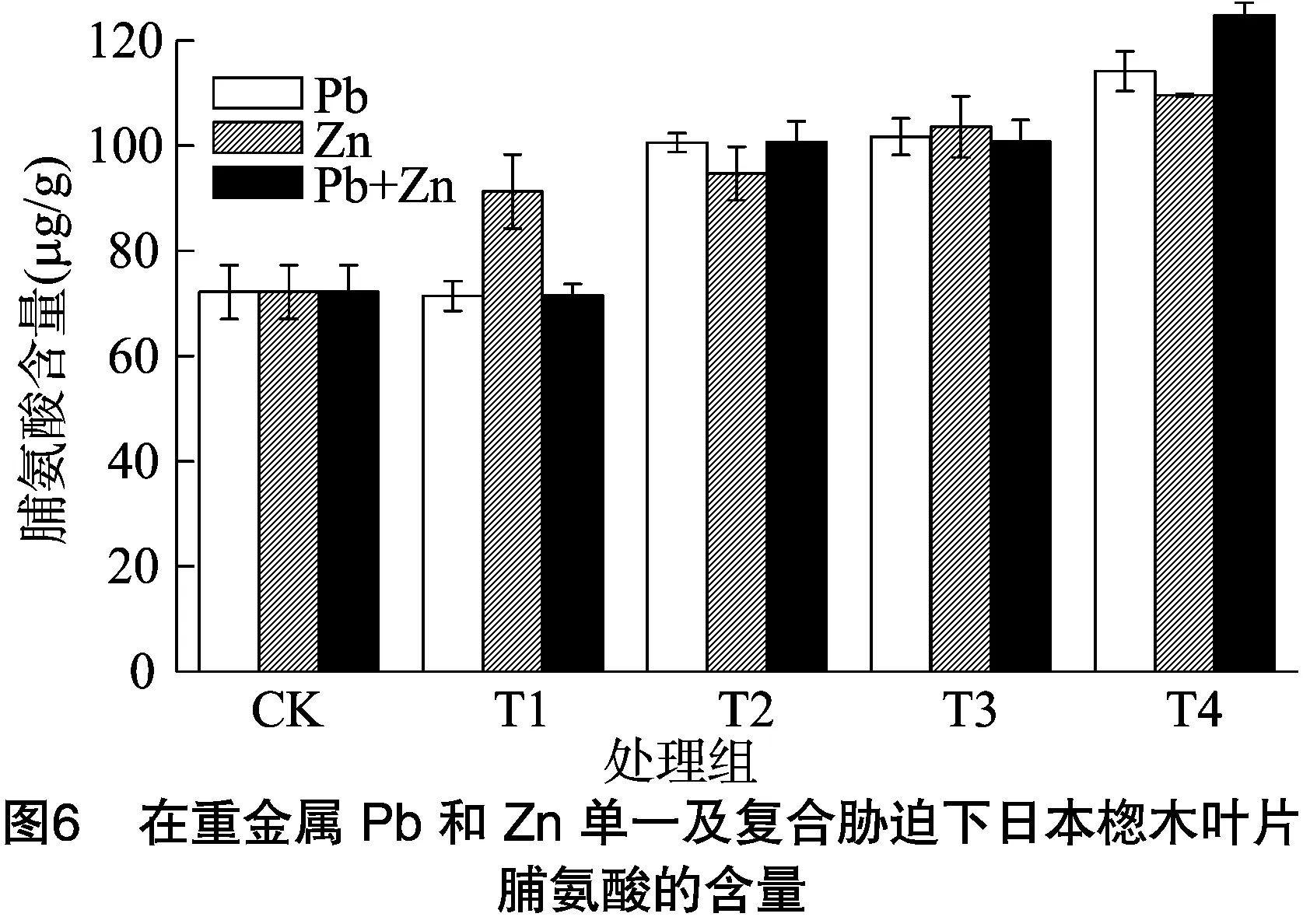
脯氨酸是调节细胞渗透压的一种重要物质,脯氨酸含量的增加在一定程度上意味着对逆境胁迫的适应性,因此脯氨酸含量常被用来衡量对逆境胁迫适应的一项重要指标。日本楤木在重金属单一及复合胁迫下,叶片内的脯氨酸含量变化如图5、图6所示。在重金属Cd的胁迫下,日本楤木叶片内脯氨酸含量在胁迫初期呈下降趋势,当土壤中Cd的浓度为0.25 mg/kg时,脯氨酸含量达到最低,为60.54 μg/g,随着重金属浓度的进一步增加,脯氨酸含量逐渐增加,当重金属浓度达到10 mg/kg时,脯氨酸含量达到最高,比对照组高38%。在重金属Pb胁迫初期,相比对照组脯氨酸含量变化不是很明显。当土壤中重金属Pb浓度达到500 mg/kg时,脯氨酸含量开始增加,当重金属Pb浓度达到最大时,脯氨酸含量也达到最高,为对照组的158%。随着重金属Zn浓度的增加,日本楤木叶片内脯氨酸含量也相应增加,当浓度达到最高时,脯氨酸含量也达到最高,为对照组的152%。在重金属Cd和Zn复合胁迫下,脯氨酸含量的变化趋势和单一重金属Zn胁迫下的变化趋势相同。当重金属Cd+Zn的浓度达到10 mg/kg+1 500 mg/kg 时,日本楤木叶片内脯氨酸含量达到最大,为121.69 μg/g。复合重金属Pb+Zn胁迫下脯氨酸含量的变化趋势和复合重金属Cd+Zn胁迫下的变化趋势一样,但是当Pb+Zn的浓度在100 mg/kg+100 mg/kg(T1处理)、500 mg/kg+500 mg/kg(T2处理)时,日本楤木叶片内脯氨酸的含量增长幅度较大。胡春霞等在水培试验研究中发现,在重金属Pb和Zn共同胁迫下,蒲公英中脯氨酸含量有明显的提高[27],本试验的变化趋势与之一样,故推测重金属的胁迫可能促进了脯氨酸的形成,从而降低了日本楤木叶片细胞的渗透势来维持细胞的渗透平衡。
3 结论与讨论
植物主要通过渗透调节物质如可溶性蛋白质、可溶性糖、脯氨酸等来调节细胞内的渗透平衡,间接保护那些参与新陈代谢的酶,从而增强植物对逆境胁迫的抵抗能力[28-30]。
可溶性蛋白质是植物进行新陈代谢和检测生理状态的一项重要指标[31]。在单一重金属胁迫下,日本楤木叶片内可溶性蛋白质含量均随着重金属浓度的增加先增加后减少,这与洪任远等的研究[32]类似,说明在胁迫初期,重金属可能促进了络合蛋白的产生,从而降低重金属对植物的毒害,这可能是植物抵抗重金属毒害的一种解毒机制。但是蛋白质含量的增加是有限的,随着重金属浓度的进一步增加,加速了蛋白质的分解,对合成系统造成了不可挽回的伤害,从而使可溶性蛋白质含量下降[33]。然而,在重金属复合胁迫下,植物体内的可溶性蛋白质含量随着重金属浓度的增加而逐渐降低,可以推测出复合重金属胁迫对蛋白质的合成产生了抑制作用。
可溶性糖的提高有助于维持细胞的新陈代谢,从而提高植物的抗逆境胁迫能力[31]。在重金属单一及复合胁迫下,日本楤木内的可溶性糖含量随着重金属浓度的增加先增加后减少,可能是因为在重金属胁迫初期,由于碳水化合物积累,促进淀粉水解,导致可溶性糖含量增加,从而维持细胞的渗透平衡。然而,随着重金属浓度的进一步增加,由于水分的缺失,使得叶绿体和类囊体的结构遭到破坏,导致气孔关闭,从而使光合速率受到抑制,光合作用产物减少,因此日本楤木叶片内可溶性糖含量降低[34]。在复合重金属Pb+Zn的污染下,日本楤木可溶性糖含量要高于相应的单一重金属胁迫下的含量,可能是因为复合重金属更有利于维持日本楤木叶片内细胞的渗透平衡,还可以推测出重金属Pb+Zn表现为协同作用,这与郭晓音研究的复合重金属胁迫下,秋茄叶片内可溶性糖含量降低,重金属元素之间表现为拮抗作用这一结果[9]相反。
脯氨酸是植物体内具有亲和性的渗透调节物质,在植物抵抗逆境胁迫中发挥着重要的作用[23-24]。除了单一重金属Cd胁迫下,日本楤木内脯氨酸含量均随着Cd浓度的增加而增加,这可能是因为蛋白质的合成速率减慢从而促进了脯氨酸的合成,导致脯氨酸含量增加,也可能是因为重金属使脯氨酸氧化酶减少而使得脯氨酸的氧化分解减慢,脯氨酸含量增加[16-17,19]。还可以推测出复合重金属胁迫下,脯氨酸含量仍然在体内积累,故重金属Pb+Zn、Cd+Zn之间表现为协同作用。在重金属Cd胁迫下,随着重金属浓度的增加,脯氨酸含量先增加后减少,可能是因为植物体内脯氨酸含量的增长是有限的,当植物体内的重金属Cd浓度过高时会对植物产生毒害作用。
综上所述,在重金属单一及复合胁迫下,日本楤木内的渗透调节物质都会得到一定的积累,并且发现重金属Zn有助于促进日本楤木叶片内脯氨酸的积累,但具体情况还需要进一步研究。本研究为日本楤木的后续使用提供了较全面系统的参考。
[1]Peuke A D,Rennenberg H.Phytoremediation[J].EMBO Rep,2005,6(6):497-501.
[2]Ren W X,Geng Y,Ma Z X,et al.Reconsidering brownfield redevelopment strategy in China’s old industrial zone:a health risk assessment of heavy metal contamination[J].Environmental Science & Pollution Research International,2015,22(4):2765-2775.
[3]Pehlivan E,Ozkan A M,Dinc S,et al.Adsorption of Cu2+and Pb2+on dolomite power[J].J Hazardous Mater,2009,167(1/2/3):1044-1049.
[4]Razek A A A E.The mobility and speciation of lead and cadmium in Bahr El Baqar region,Egypt[J].Journal of Environmental Chemical Engineering,2014,2(1):685-691.
[5]Muthukumar T,Bagyaraj D J.Use of arbuscular mycorrhizal fungi in phytoremediation of heavy metal contaminated soils[J].Proceedings of the National Academy of Sciences,India-Section B:Biological Sciences,2010,80(12):103-121.
[6]Bermudez G M A,Jasan R,Pla R,et al.Heavy metals and trace elements in atomospheric fall-out:their relationship with topsoil and wheat element composition[J].J Hazard Mater,2012,213/214:447-456.
[7]Slycken E M S V,Adriaensen K,Ruttens A,et al.The use of bio-energy crops (Zeamays) for ‘phytoattenuation’ of heavy metals on moderately contaminated soils:a field experiment[J].Chemosphere,2010,78(1):35.
[8]Houben D,Evrard L,Sonnet P.Beneficial effects of biochar application to contaminated soils on the bioavailability of Cd,Pb and Zn and the biomass production of rapeseed (BrassicanapusL.)[J].Biomass & Bioenergy,2013,57(11):196-204.
[9]郭晓音.重金属Zn、Cd复合胁迫对秋茄幼苗生长及渗透调节物质的影响[D].厦门:厦门大学,2009.
[10]杨 光,钱 丹,郭兰萍,等.重金属对膜荚黄芪种子生长及抗氧化系统的影响[J].中国中药杂志,2010,35(9):1095-1099.
[11]邹 日,沈 镝,柏新富,等.重金属对蔬菜的生理影响及其富集规律研究进展[J].中国蔬菜,2011,1(4):1-7.
[12]陈岩松,吴若菁,庄 捷,等.木本植物重金属毒害及抗性机理[J].福建林业科技,2007,34(1):50-55.
[13]李晓晶,李德生,李海茹,等.外源铜胁迫对木本蔬菜生长及品质的影响研究[J].环境污染与防治,2013,35(4):38-42.
[14]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:15-16.
[15]陈爱美,施庆珊,欧阳友生,等.稀土元素 La 和 Ce 对小球藻生长的影响[J].现代食品科技,2013(10):2401-2404.
[16]费小红,安保光,赵宝华,等.类胡萝卜素参与水稻抗氧化胁迫的研究进展[J].现代农业科学,2009,1:22-23.
[17]李 玲.植物抗非生物逆境分子机理研究[J].湖南科技学院学报,2012,33(9):173-175.
[18]王秀娟,杨会青.盐碱胁迫下西伯利亚白刺的渗透调节物质的变化[J].热带农业科学,2010,30(2):34-36.
[19]李玉全,张海艳,沈法富.作物耐盐性的分子生物学研究进展[J].山东科学,2002(2):8-15.
[20]何晓良.铅胁迫对几种草本中药生理生化特性影响的研究[D].南宁:广西大学,2013.
[21]刘慧芬,高玉葆,张 强,等.不同种群羊草幼苗对土壤干旱胁迫的生理生态响应[J].南开大学学报(自然科学版),2004,4(12):105-110.
[22]谌金吾.三叶鬼针草(BidenspilosaL.)对重金属Cd、Pb胁迫的响应与修复潜能研究[D].重庆:西南大学,2013.
[23]钱永生,王慧中.渗透调节物质在作物干旱逆境中的作用[J].杭州师范学院学报(自然科学版),2006(6):476-481.
[24]郁万文,曹福亮.高温胁迫下银杏叶片部分渗透调节物质的动态变化[J].福建林业科技,2008,35(2):126-128.
[25]吴桂容,严重玲.镉对桐花树幼苗生长及渗透调节的影响[J].生态环境,2006,15(5):1003-1008.
[26]郑世英,王丽燕,商学芳,等.铅胁迫下玉米种子萌发及叶片渗透调节物质含量的影响[J].安徽农业科学,2006,34(21):5471-5472.
[27]胡春霞,汤 洁.重金属对蒲公英种子萌发及叶片渗透调节物质含量的影响[J].北方园艺,2008(11):27-30.
[28]李 艰,周广柱.低温胁迫下3种竹柳品系的抗寒性[J].江苏农业科学,2016,44(6):307-310.
[29]宋丹华,黄俊华,王 丰,等.铃铛刺苗期对持续干旱胁迫的生理响应[J].江苏农业科学,2016,44(5):292-295,525.
[30]姜立娜,邵珠田,宋子文,等.铅处理对菜用大黄种子萌发和幼苗生长的影响[J].江苏农业科学,2016,44(4):223-225.
[31]李兆君,马国瑞,徐建民,等.植物适应重金属Cd胁迫的生理及分子生物学机理[J].土壤通报,2004,35(2):234-238.
[32]洪任远,蒲长辉.镉对小麦幼苗的生长和生理生化反应的影响[J].华北农学报,1991,6(3):70-75.
[33]李 删,程 舟.镉与锌复合污染对栝楼幼苗生理特性的影响[J].西北植物学报,2007,27(6):1191-1196.
[34]Chris B,Marc V H,Dirk L.Superoxide dismutase and stress tolerance[J].Annu Rev Plant Pysiol Plant Mol Biol,1992,34:83-116.
