烟草悬浮细胞系的构建
2018-03-05袁盛勇肖亚楠杨文超陈俊梅蒋双番史艳春
孔 琼,袁盛勇,肖亚楠,杨文超,陈俊梅,蒋双番,史艳春,杨 升
(红河学院生命科学与技术学院,云南蒙自 661100)
烟草(NicotianatabacumL.)为茄科烟草属的一年生草本植物,已成为当前生物学研究最为深入的模式植物材料,尤其在植物分子生物学、基因组学等方面应用最为广泛。植物悬浮细胞因具有均一性好、条件易控制、培养周期短、重复性好等优点,已广泛应用于细胞学、发育生物学、遗传学等研究中[1]。因此,建立稳定且活性高的烟草悬浮细胞作为试验材料,是开展后期试验的重要保证之一。植物悬浮细胞的建立受很多因素的影响,其中愈伤组织的成功获得和单细胞形成是两个重要环节,同时激素种类及浓度、接种量、蔗糖浓度、转速等也是关键影响因素[2-3]。本研究以烟草的幼嫩茎髓为试验材料,进行愈伤组织诱导和继代培养,并进行悬浮细胞培养,分析不同营养条件和培养条件对细胞悬浮系培养的影响,从而建立烟草悬浮细胞系的培养方法。
1 材料与方法
1.1 材料
以烟草BY-2品种为试验材料,烟草种子由昆明学院杨红玉教师惠赠。
1.2 方法
1.2.1 愈伤组织诱导及继代培养 将烟草幼茎切成1 cm长段,用70%乙醇消毒30 s后,再转入5%次氯酸钠中消毒 7 min,无菌水漂洗4~5次后用无菌滤纸吸干水分,切取茎髓,转入9种愈伤组织诱导培养基中,基本配方为MS+30 mg/L 蔗糖+14 mg/L琼脂,具体激素配比见表1。于 26 ℃ 暗培养3周,观察并记录愈伤组织的生长状况,统计出愈率和鲜质量。计算公式:接种量=接种后瓶质量(g/皿)-接种前瓶质量(g/皿);愈伤组织鲜质量=收获量(g/皿)-接种量(g/皿);出愈率=(诱导出愈伤组织外植体数/接种的外植体总数)×100%。
综合比较9种培养基上愈伤组织的生长速度、出愈率、鲜质量、形状、分散性、颜色等指标,筛选出诱导愈伤组织生长的最佳配方,并将其配方作为愈伤组织继代和悬浮培养的配方。
1.2.2 悬浮细胞系的建立
1.2.2.1 不同接种量对悬浮细胞生长的影响 选取白色疏松的愈伤组织1、2、3、4 g分别接种于150 mL液体培养基(“1.2.1”节中的配方)中,于26 ℃、140 r/min摇床振荡暗培养8 d后测定细胞鲜质量,3次重复。
1.2.2.2 蔗糖浓度对悬浮细胞生长的影响 将“1.2.2.1”节中最佳接种量培养10 d后的20 mL悬浮细胞转接到含有10、20、30、40、50 g/L蔗糖的130 mL新鲜液体培养基(“1.2.1”节中的配方)中,3次重复,于26 ℃、140 r/min摇床振荡暗培养8 d后测定细胞鲜质量。
1.2.2.3 转速对悬浮细胞生长的影响 选用“1.2.2.1”节和“1.2.2.2”节筛选出的最佳接种量和蔗糖浓度,制成液体培养基,分别于100、110、120、130、140、150 r/min的恒温摇床上于26 ℃振荡暗培养8 d后测定细胞鲜质量,3次重复。
1.2.3 悬浮细胞生长曲线、活性变化及pH值变化 根据“1.2.2.1”节、“1.2.2.2”节和“1.2.2.3”节筛选出的最佳结果,将悬浮细胞于26 ℃振荡培养12 d,每隔2 d取样测定细胞鲜质量、pH值和细胞活性,确定其生长周期。
1.2.4 数值测定
1.2.4.1 细胞鲜质量 根据李建安等介绍的方法[4],具体操作:取充分混匀悬浮细胞8 mL,注入预先称质量的10 mL离心管中,在3 500 r/min下离心10 min,吸去上清液,室温下敞口自然风干24 h后称质量,减去空管质量即为8 mL悬浮细胞的鲜质量。
1.2.4.2 细胞活性测定 按照孔琼等介绍的方法[5]进行。即将0.2 g细胞加入3 mL 0.6% TTC溶液(用50 mmol/L pH值 7.5 磷酸缓冲液配制,内含0.05% Tween-20),26 ℃暗培养24 h,3 500 r/min离心10 min,细胞转入大试管中后加入95%乙醇5 mL,80 ℃水浴20 min,冷却后3 500 r/min离心 10 min,取上清液于485 nm进行比色。
2 结果与分析
2.1 烟草BY-2愈伤组织诱导
为了研究不同激素组合对烟草BY-2愈伤组织诱导的影响,分别对不同诱导培养基中愈伤组织的生长情况进行观察分析。结果显示,8种激素配比的培养基均可诱导烟草茎髓长出愈伤组织,但愈伤组织产生的数量和性状之间存在明显差异(表1)。其中配方1、2和3中茎髓培养第3天时,茎髓边缘开始膨胀变大;7 d时,切口两端开始愈伤化,边缘产生肉眼可见的乳白色颗粒状愈伤组织;21 d后,出现结构疏松、生长旺盛的白色愈伤组织。但配方3中的愈伤组织获得量和颜色质地显著高于配方1、2中的诱导结果,出愈率高达 93.3%。而配方4未明显获得愈伤组织。配方5和7中获得的愈伤组织生长缓慢,伴有褐化现象。配方6、8和9中的愈伤组织生长缓慢,质地致密。因此,在诱导烟草BY-2愈伤组织过程中,激素2,4-D和6-BA配合使用比NAA、2,4-D和6-BA混合使用更能有效地促进愈伤组织产生和生长,且配方3(MS+3.0 mg/L 2,4-D+1.0 mg/L 6-BA)为诱导烟草BY-2愈伤组织生长的最佳配方。
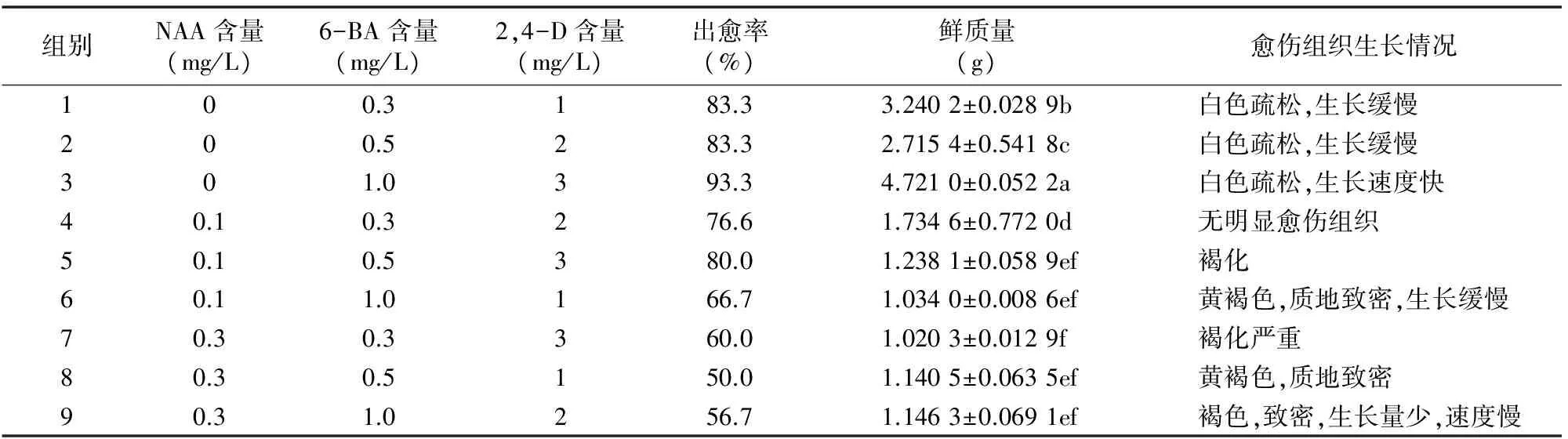
表1 不同植物激素组合对烟草BY-2愈伤组织的诱导情况
注:采用最小显著差数法(LSD)评价差异显著性,表中数值为“平均值±标准误”,不同小写字母表示在0.05水平差异显著。表2同。
2.2 悬浮细胞系构建
2.2.1 不同接种量对悬浮细胞生长的影响 初始接种量对悬浮细胞系的生长有着明显影响,细胞需要达到一定的起始密度才能进行生长,但浓度过大又需要消耗大量的养分。因此,选择适宜的接种量是悬浮细胞培养过程中一个重要的因素。不同接种量对烟草悬浮细胞生长量具有较大影响。由图1可见,在150 mL液体培养基中,当初始接种量为1、2 g时,烟草悬浮细胞生长速度较慢,显著低于3 g和4 g的初始接种量;初始接种量为3 g时,悬浮细胞生长速度快,第8天后,8 mL 细胞鲜质量高达(0.727 3±0.003 8)g。

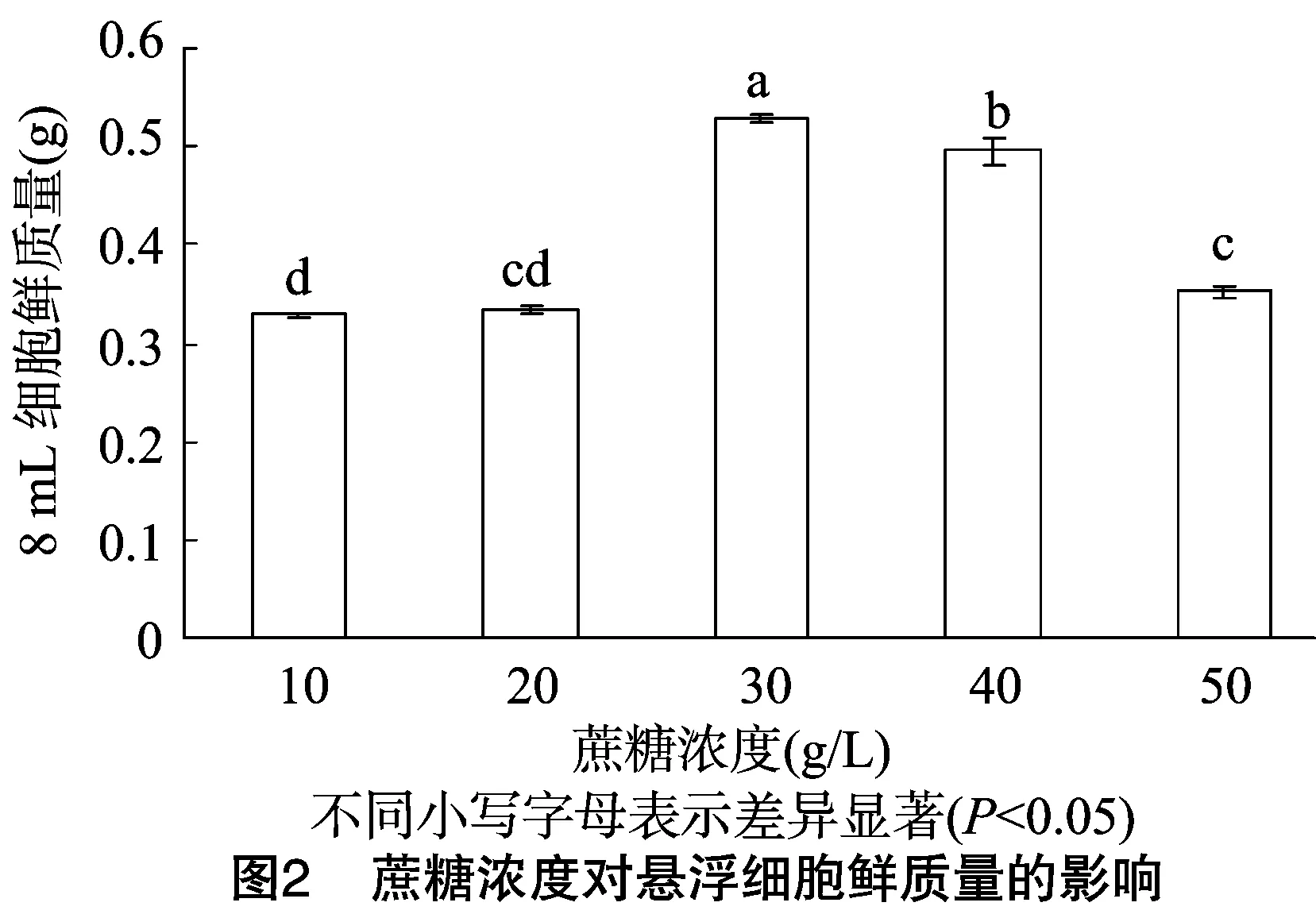
2.2.2 蔗糖浓度对悬浮细胞生长的影响 碳源是植物组织培养中的必需营养因子,同时也参与了渗透压的平衡调节,因此起着十分重要的作用。蔗糖浓度对烟草悬浮细胞鲜质量增加的影响如图2所示。当蔗糖浓度为1%、2%时,烟草细胞增殖不明显且差异不显著;而蔗糖浓度为3%、4%、5%时,细胞增殖较快,且差异显著,尤其是浓度为3%时,细胞增殖最快,显著高于其他处理。
2.2.3 转速对悬浮细胞生长的影响 不同的转速对悬浮细胞的分散性、长势和贴壁现象具有较大的影响。在最佳接种量和蔗糖浓度下,转速对悬浮细胞生长也有不同的影响,过高或过低均不利于细胞生长。当转速为l10~120 r/min时,细胞生长缓慢,细胞鲜质量增加不明显,细胞分散性差,容易在短时间内形成较大的细胞团;转速为130~140 r/min时,细胞生长较快,分散性好,且140 r/min时细胞生长最快,培养8 d后8 mL细胞鲜质量高达(0.639 5±0.009 4)g,鲜质量高于其他处理;而当转速高达150 r/min时,细胞增长量有所下降,且易出现污染问题,贴壁死细胞较多(表2)。因此适宜烟草悬浮细胞培养的转速为140 r/min,有利于细胞生长。
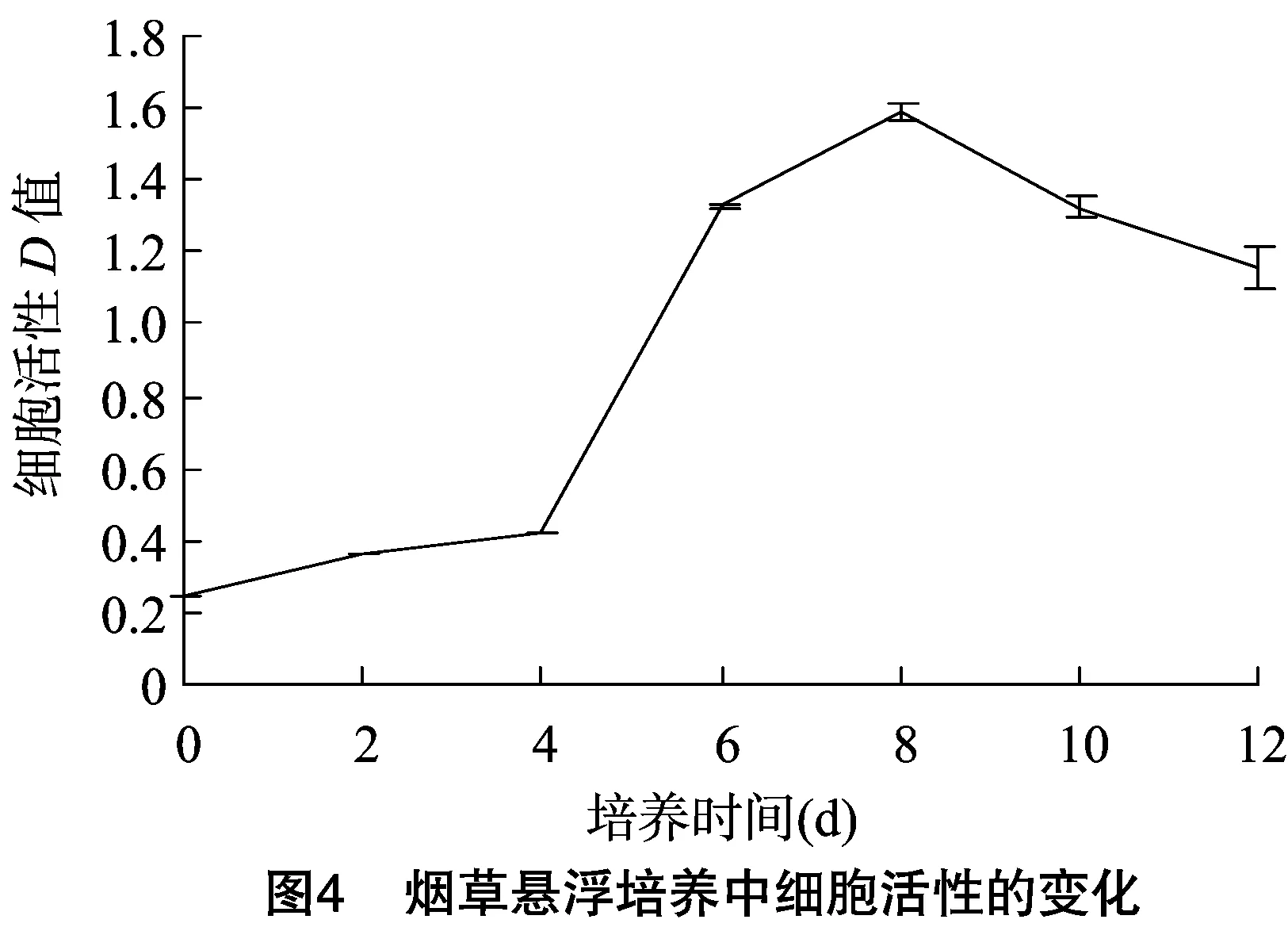
2.2.4 烟草BY-2悬浮细胞系的生长曲线、pH值及活性变化 在优化后的培养条件下,测定了烟草悬浮细胞培养过程中细胞鲜质量和pH值变化,并绘制了其生长曲线。在培养过程中,细胞生长量近“S”形规律,鲜质量变化趋势明显,且与活性变化密切相关,而培养液中pH值呈下降趋势(图3和图4)。延迟期(1~2d)和对数期(3~10d)明显,且在对数期时,细胞增殖明显,当培养到10 d时,细胞鲜质量达到最大值。根据不同培养时间下细胞活性测定结果,发现细胞活性变化与生长量变化相似,且在培养8 d时达到最高值,活性最好。因此结合细胞生长量变化,烟草悬浮细胞的继代周期为8 d。

表2 转速对悬浮细胞鲜质量的影响

3 结论与讨论
在植物悬浮细胞培养过程中,激素是愈伤组织诱导和悬浮细胞构建的关键因素之一,不同激素种类和浓度配比后,其相互作用可影响其形态建成方向[4-6]。研究发现添加一定浓度的2,4-D和6-BA对愈伤组织诱导具有很大的促进作用,且2,4-D是禾谷类植物产生愈伤组织所必需的生长物质[7-8]。本研究在烟草愈伤组织诱导过程中也发现2,4-D和6-BA配比后的重要作用,且最佳诱导配比为3.0 mg/L 2,4-D+1.0 mg/L 6-BA。因此,合适的激素种类和浓度配比是愈伤组织获取和改善状态的重要前提。
初始接种量和蔗糖的多少对悬浮细胞系建立也起着重要作用。大多数悬浮细胞的生长具有群聚效应,细胞密度过低或过高都不利于悬浮细胞系的建立,而合适的密度才能促进细胞快速生长,细胞分散性好[9]。在小麦悬浮细胞系建立过程中发现,初始接种量为0.5~1.5 g(每400 mL培养液)时,细胞增殖倍数随着接种量的增加而增加,且接种量为1.5 g时达到最大值,此时细胞系分散性好,颜色鲜艳,如接种量增加,细胞增殖倍数呈下降趋势,培养液颜色浑浊[10]。同样的现象也在草莓悬浮细胞系建立试验中发现[11]。蔗糖浓度过低,培养物不仅得不到碳源补充,还会发生营养物质外渗,而过高则会出现生理性缺水,两种情况最终都会导致细胞死亡[12]。大量试验结果表明,一般悬浮细胞的培养过程中蔗糖浓度一般为20~30 g/L。因此,烟草悬浮细胞系构建的最佳初始接种量为3 g/150 mL,蔗糖浓度为30 g/L。
前人在研究烟草悬浮细胞系构建过程中发现,不同转速对细胞长势、分散性和贴壁现象具有较大影响[13]。同样的现象也表现于本试验中,当转速较低(110~120 r/min)时,悬浮培养基中的氧含量较低,细胞生长速度较慢,机械力较小,分散性较差,易结成团;而当转速较高(150 r/min)时,可能易发生机械损伤,死细胞较多。因此合适的转速也是悬浮细胞成功构建的关键因子。
[1]吴春霞.植物细胞悬浮培养的影响因素[J].安徽农业科学,2009,37(1):36-38.
[2]周仕顺,陶志章.烟草的组织培养[J].云南农业科技,2005,24(1):28-29.
[3]李忠光,杨仕忠,周 滔.烟草悬浮培养细胞的建立及其对机械刺激的敏感性研究[J].云南师范大学学报,2005,25(6):43-45.
[4]李建安,胡芳名.拟南芥悬浮细胞生长特性及其继代培养条件[J].经济林研究,2006,4(1):26-29.
[5]孔 琼,张 燕,张华茗,等.拟南芥悬浮细胞系的建立[J].西部林业科学,2011,40(4):12-16.
[6]谢从华,柳 俊.植物细胞工程[M].北京:高等教育出版社,2004:130-131.
[7]邢登辉,吴琴生,刘大钧.禾谷类作物细胞培养[J].生物学通报,1994,29(7):1-3.
[8]王睿辉,陈耀锋,高秀武,等.激素对小麦幼胚胚性无性系高频率诱导的影响[J].西北农林科技大学学报,2001,29(1):33-36.
[9]张 瑜,杨知建,张志扬,等.不同浓度激素对野生细叶结缕草愈伤组织的诱导与分化的影响[J].生物技术通报,2007(2):143-146.
[10]陈 琰.不同抗叶锈小麦品种悬浮细胞系的建立[D].保定:河北农业大学,2005:16.
[11]周春江,李卫东,葛会波.草莓悬浮细咆系的建立及某些影响因素[J].植物生理学报,2002,38(1):22-24.
[12]邹洪波.拟南芥悬浮细胞系建立及硒对拟南芥生长的影响[D].长沙:湖南大学,2007:18-19.
[13]王 荣.疫霉菌激发子parasiticein诱导烟草细胞凋亡及发生机制研究[D].泰安:山东农业大学,2007:30-31.
