外源激素对白花蛇舌草不同外植体体外培养的影响
2018-03-05韦坤华徐建平蔡锦源李林轩缪剑华高文远
韦坤华,徐建平,蔡锦源,李林轩,缪剑华,高文远
(1.天津大学药物科学与技术学院,天津 300072;2.广西药用植物园/广西药用资源保护与遗传改良重点实验室,广西南宁 530023;3.广西科技大学鹿山学院,广西柳州 545616;4.包头医学院,内蒙古包头 014060)
白花蛇舌草(HedyoticdiffusaWilld.)为茜草科耳草属一年生草本植物。全草入药,味苦、甘,性寒。具有清热解毒、利湿之功效,用于治疗肺热喘嗽、毒蛇咬伤、咽喉肿痛等疾病[1]。白花蛇舌草广泛分布于亚热带地区,主产于我国福建、广东、江西、浙江、湖南等地,云南、贵州及四川南部亦有大量分布[2]。化学研究表明,白花蛇舌草中主要含有萜类、蒽醌类、黄酮类、挥发油类、苯丙素和香豆素类、甾醇类、含酸化合物、多糖类化合物,其中萜类为白花蛇舌草的主要成分[3-4]。现代药理研究发现,白花蛇舌草具有抗氧化、抗肿瘤、增强免疫、神经保护等多种药理作用[5-10],具有重要的开发应用价值。
近年来,由于使用量增加,白花蛇舌草资源不断枯竭,产量难以满足市场需求。且在人工栽培种植过程中发现白花蛇舌草极易混入伞房花耳草等伪品植株,造成药材品质下降。为了解决白花蛇舌草种源纯化问题,笔者在前人研究[11-12]的基础上,采用正交试验设计,优化白花蛇舌草组织培养快速繁殖体系。同时,在研究过程中,发现白花蛇舌草不同部位在离体条件下较为容易再生获得植株,因此,本研究也采用正交试验设计对白花蛇舌草不同外植体的植株再生及培养体系进行筛选、优化,建立了不同外植体的快速繁殖培养体系,为其离体快繁技术的建立提供参考依据。
1 材料与方法
1.1 试验材料
材料采自广西壮族自治区药用植物园,为野生白花蛇舌草的种子,种子播种于MS基本培养基,发芽后获得无菌苗,再选取无菌苗的不同部位进行丛生芽诱导培养,最后对丛生芽进行生根培养。
1.2 试验方法
1.2.1 种子消毒 取白花蛇舌草的成熟未开裂果实,依次用2%(体积分数)洗洁精水溶液浸泡5 min,线状自来水冲洗15~30 min,用75%的乙醇灭菌15 s,无菌水冲洗1遍,再置于添加了2~3滴吐温-20的0.1%(体积分数)氯化汞溶液中消毒9 min,无菌水冲洗3~5次,每次浸洗2 min,无菌滤纸吸干外植体表面的水分后,在无菌操作台上将果实拨开,将种子接种于MS空白培养基上培养促进种子萌发。培养条件为光照度1 500~2 000 lx,光照时间12 h/d,温度(26±2)℃。
1.2.2 试验培养基设计 试验采用正交试验进行,以MS为基本培养基,应用正交表L9(34),对6-BA、KT和IAA等3个因素的3个水平设计正交试验培养基。正交试验的激素水平见表1。
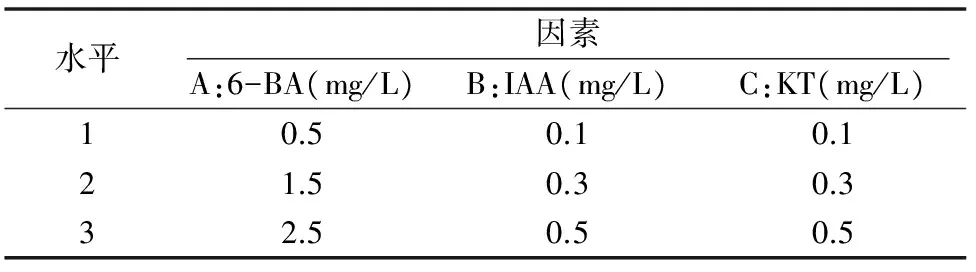
表1 正交试验因素水平
1.2.3 不同外植体的处理 将种子萌发后的嫩芽接种到添加0.5 mg/L 6-BA的MS培养基上培养,培养条件为光照度1 500~2 000 lx,光照时间12 h/d,温度(26±2)℃。获得足够数量的丛生芽后,分别选取丛生芽的3个不同部位(带芽茎段、幼嫩叶片、不带芽茎段)作为外植体进行正交试验。
带芽茎段:切下1 cm的顶芽或带1个腋芽的茎段,插入到培养基上培养,插入深度0.3~0.4 cm;幼嫩叶片:切取长约0.5 cm、宽度基本一致的幼嫩叶片,在叶片上用解剖刀轻轻划2道伤口后,平铺到培养基表面培养;不带芽茎段的处理:选取幼嫩茎段,切取长度约0.5 cm的节间部分,平铺到培养基表面培养。
1.2.4 材料培养及数据统计 每个试验处理4瓶,每瓶接种5个外植体,培养条件为光照度1 500~2 000 lx,光照时间 12 h/d,温度(26±2)℃,培养室中培养30 d后测定试管苗平均生长率和芽增殖系数。其中平均生长率=(30 d后材料质量-接种时材料质量)/接种时材料质量;平均芽增殖系数=(30 d后芽数-接种时材料数)/接种时材料数。
2 结果与分析
2.1 外源激素对白花蛇舌草带芽茎段培养的影响
前期研究发现白花蛇舌草的外植体在无菌组培条件下较容易获得丛生芽。为了明确不同激素组合对白花蛇舌草的带芽茎段增殖的影响,本研究将1 cm的顶芽或带1个腋芽的茎段,接种到正交试验培养基中,每天观察记录接种材料的变化。结果发现,培养5 d开始,接触培养基的切口部位开始膨大形成疏松愈伤组织,之后逐渐形成胚性愈伤,到11~13 d可明显观察到接触培养基的切口部位形成丛生芽团,并长出少量成型丛生芽(图1)。但不接触培养基部分的腋芽或顶芽伸长,未见分化形成丛生芽。

对带芽茎段培养的正交试验结果见表2至表4。平均生长率结果来看,白花蛇舌草带芽茎段培养30 d后,平均生长率在4.7~7.6倍之间。直观分析结果发现,3种外源激素对带芽茎段培养的平均生长率影响顺序为A(6-BA)>C(KT)>B(IAA),且3种激素均表现出低浓度促进生长,但浓度过高均抑制平均生长率的进一步增高。方差分析结果发现,3种激素对白花蛇舌草带芽茎段的平均生长率均具有显著影响,F值分别为44.33、36.33和25.58。根据平均生长率的分析结果,确定带芽茎段增殖的最佳培养基外源激素配方为A2B2C2,即MS+1.5 mg/L 6-BA+0.3 mg/L IAA+0.3 mg/L KT。
由芽的平均增殖系数结果可发现,白花蛇舌草带芽茎段培养的平均芽增殖系数均在23倍以上。直观分析结果发现,3种外源激素对叶片培养芽增殖系数影响顺序为A(6-BA)>C(KT)>B(IAA),其中6-BA浓度的提高有利于促进带芽茎段培养材料丛生芽的增殖,而适度增加IAA和KT浓度可促进丛生芽的增殖,但浓度过高具有抑制作用。方差分析结果表明,3种激素均对带芽茎段培养材料均无显著影响,P值均>0.1。但不同培养基上的芽增殖系数差异较大,最低的芽增殖系数为23.2倍,而最高的芽增殖系数为46.2倍。根据平均芽增殖系数的分析结果,确定带芽茎段增殖的最佳培养基外源激素配方为A3B2C2,即MS+2.5 mg/L 6-BA+0.3 mg/L IAA+0.3 mg/L KT。
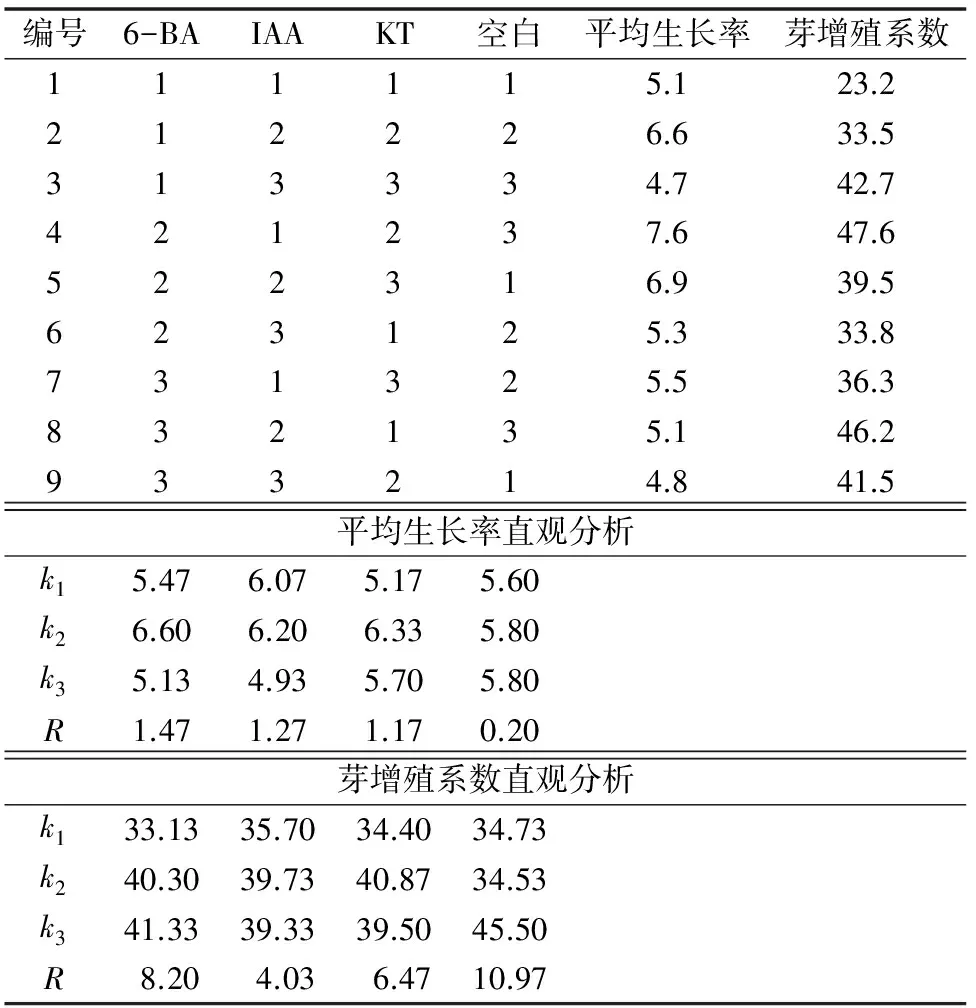
表2 白花蛇舌草茎段培养正交试验结果与直观分析
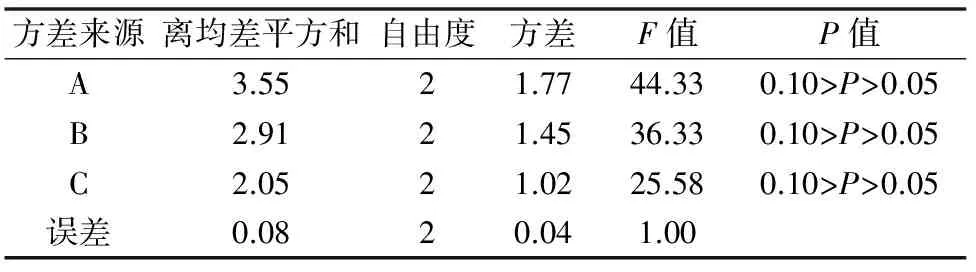
表3 白花蛇舌草带芽茎段培养平均生长率方差分析
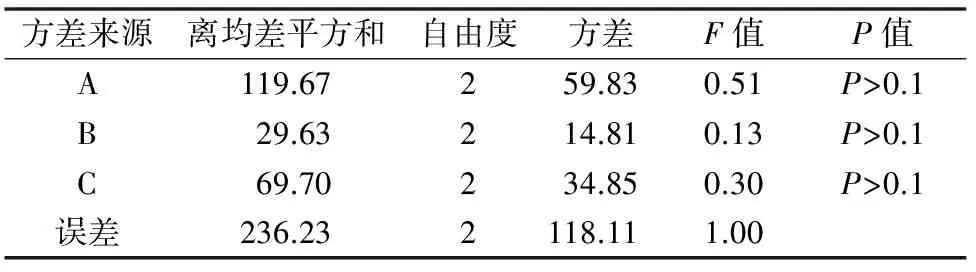
表4 白花蛇舌草带芽茎段培养芽增殖系数方差分析
根据上述分析结果,3种外源激素对带芽茎段培养材料的平均生长率具有显著影响,对芽增殖系数没有显著影响,较高浓度下,芽的增殖系数也较高。在试验过程中还发现,带芽茎段培养的材料中,接种的母芽很少分化形成丛生芽,仅为顶芽抽长或长出少量腋芽,而且培养材料容易出现叶片黄化、老化的现象。而接触培养基的切口部位长出的新的丛生芽由于生长空间限制,长势不一致,不利于实际生产利用。因此根据结果分析与材料的实际生长状况,确定嫩芽或腋芽增殖的最佳培养基外源激素配比为A2B2C2,即MS+1.5 mg/L 6-BA+0.3 mg/L IAA+0.3 mg/L KT。
2.2 外源激素对白花蛇舌草叶片培养的影响
在进行带芽茎段培养的过程中,发现接触培养基的幼嫩叶片出现膨大,并形成丛生芽的现象。为了验证这一现象,并探讨不同外源激素组合对白花蛇舌草叶片培养的影响,本研究将白花蛇舌草的无菌幼嫩叶片外植体接入不同激素不同水平的MS培养基,观察记录其生长发育情况。结果发现白花蛇舌草叶片培养的成芽率为100%,所有培养叶片均膨大形成疏松愈伤组织,再形成胚性愈伤,继而形成丛生芽簇。幼嫩叶片在培养基上培养4~6 d开始从切口部位出现不同程度的蜷曲膨胀,6 d开始在膨大部位长出翠绿色成簇的不定芽点,10 d时不定芽分化更为明显,高约0.5 cm,呈翠绿色,且向无切口部位扩大,之后逐渐形成丛生芽簇(图2)。

30 d后统计叶片外植体的平均生长率与芽增殖系数,结果见表5见表7。根据平均生长率结果,白花蛇舌草叶片外植体培养30 d后,最低的平均生长率为4.1倍,最高的平均生长率为8.1倍。平均生长率的直观分析结果发现,3种外源激素对叶片培养平均生长率的影响顺序为B(IAA)>C(KT)>A(6-BA),其中6-BA浓度增加,抑制平均生长率的提高,IAA浓度的增加可促进平均生长率的提高,而适度增加KT浓度可提高平均生长率,但浓度过高具有抑制作用。方差分析发现3种激素均对叶片的增殖具有影响,F值分别为10.11、43.00和21.44。根据平均生长率的分析结果,确定叶片增殖的最佳培养基外源激素配方为A1B3C2,即MS+0.5 mg/L 6-BA+0.5 mg/L IAA+0.3 mg/L KT。
根据芽的平均增殖系数结果,白花蛇舌草叶片外植体培养的平均芽增殖系数均在25倍以上。直观分析结果发现,3种外源激素对叶片培养芽增殖系数影响顺序为A(6-BA)>C(KT)>B(IAA),其中6-BA和IAA浓度的提高有利于叶片培养材料丛生芽的增殖,而适度增加KT浓度可促进叶片培养材料丛生芽的增殖,但浓度过高具有抑制作用。方差分析发现,3种激素均对叶片培养无显著影响,P值均>0.1。但不同培养基上的芽增殖系数差异较大,最低的芽增殖系数为25.3倍,而最高的芽增殖系数为54.5倍。根据平均芽增殖系数的分析结果,确定叶片增殖的最佳培养基外源激素配方为A3B3C2,即MS+2.5 mg/L 6-BA+0.5 mg/L IAA+0.3 mg/L KT。
上述分析结果表明,3种外源激素对叶片培养的平均生长率具有显著影响,对芽增殖系数没有显著影响,且芽的增殖系数随着激素浓度的增加而增加。但在本试验过程中发现,叶片培养材料的芽增殖系数增加到一定程度后,由于生长空间不足,容易造成丛生芽纤细、黄化等现象,培养时间稍微延长容易出现枯死,不利于种苗的工厂化生产。因此根据结果分析与材料的实际生长状况,确定叶片增殖的最佳培养基外源激素配比为A1B3C2,即MS+0.5 mg/L 6-BA+0.5 mg/L IAA+0.3 mg/L KT。在此培养条件下,平均生长率约为7.5倍,芽增殖系数约为40倍,材料生长状况良好,丛生芽粗壮,色泽翠绿。
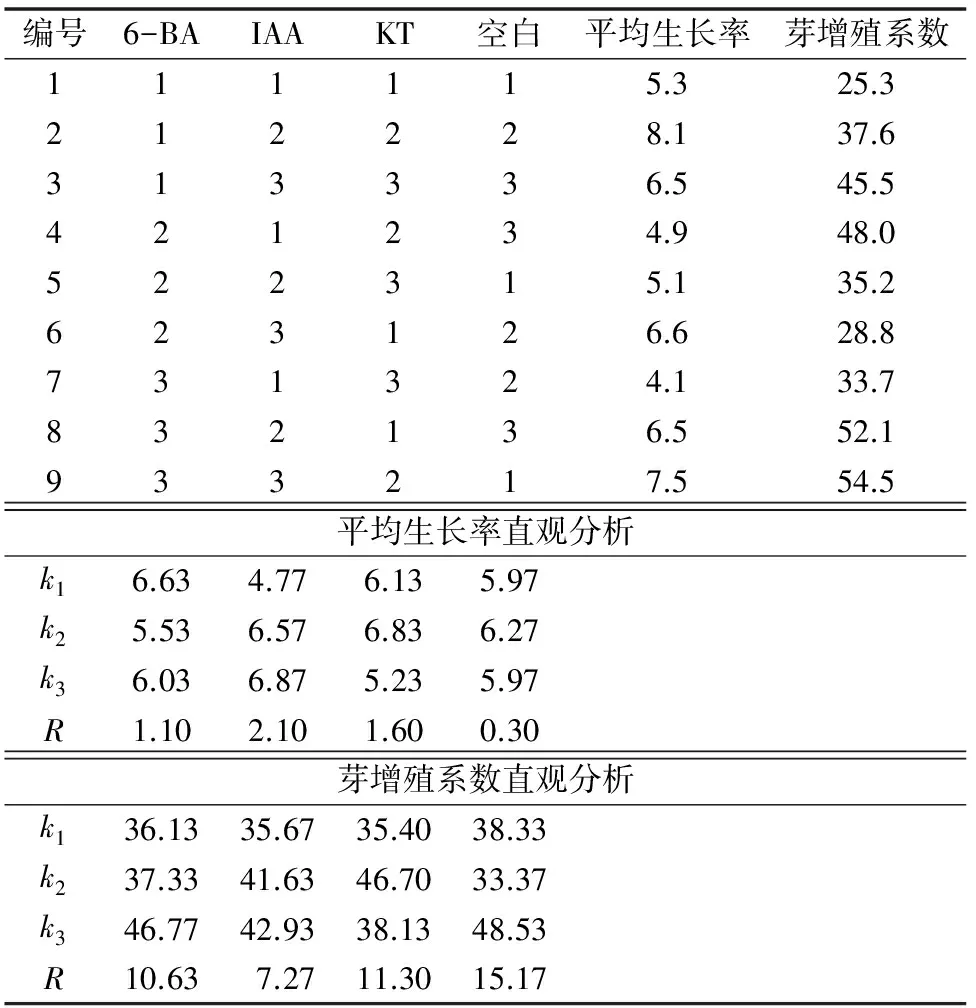
表5 白花蛇舌草叶片培养正交实验结果与直观分析
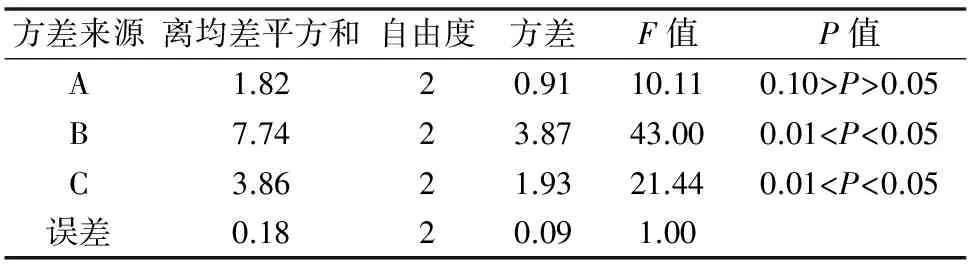
表6 白花蛇舌草叶片培养平均生长率方差分析
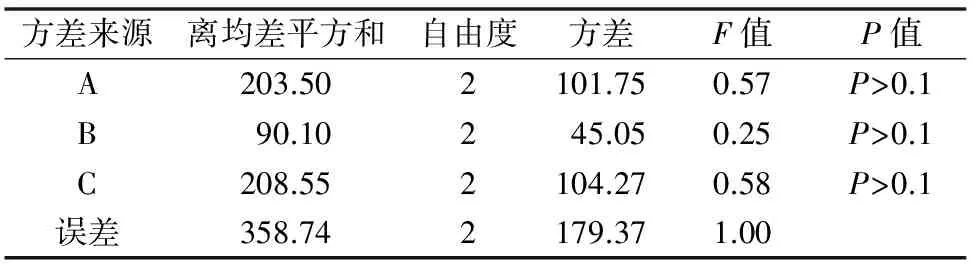
表7 白花蛇舌草叶片培养芽增殖系数方差分析
2.3 外源激素对白花蛇舌草茎段(不带腋芽)培养的影响
为了拓展外植体来源,为其他材料的组织培养,尤其是珍稀濒危物种的组织培养提供技术依据,本研究还考察了不同激素组合对白花蛇舌草节间不带芽茎段培养的影响。结果发现,白花蛇舌草不带芽的茎段培养成芽率为100%,所有培养茎段均从两端切口处膨大形成疏松愈伤组织后形成胚性愈伤,继而形成丛生芽簇。根据试验记录,茎段在培养基上培养3~4 d开始从切口部位出现不同程度的膨大,10~12 d观察到茎段两端长出大量丛生芽(图3)。
30 d后统计茎段外植体的平均生长率与芽增殖系数,结果见表8至表10。根据平均生长率结果,白花蛇舌草茎段外植体培养30 d后,最低的平均生长率为4.6倍,最高的平均生长率为9.4倍。从平均生长率的直观分析结果发现,3种外源激素对叶片培养芽增殖系数影响顺序为A(6-BA)> B(IAA)> C(KT),其中6-BA浓度的提高可显著提高茎段培养材料的平均生长率,范围值R为3.77,而IAA与KT浓度的提高对茎段培养平均生长率的影响不大,范围值R分别为0.80和0.27。方差分析发现6-BA对茎段培养的平均生长率具有显著影响,而IAA和KT无显著影响。根据平均生长率的分析结果,确定茎段增殖的最佳培养基外源激素配方为A3B2C2,即MS+2.5 mg/L 6-BA+0.3 mg/L IAA+0.3 mg/L KT。

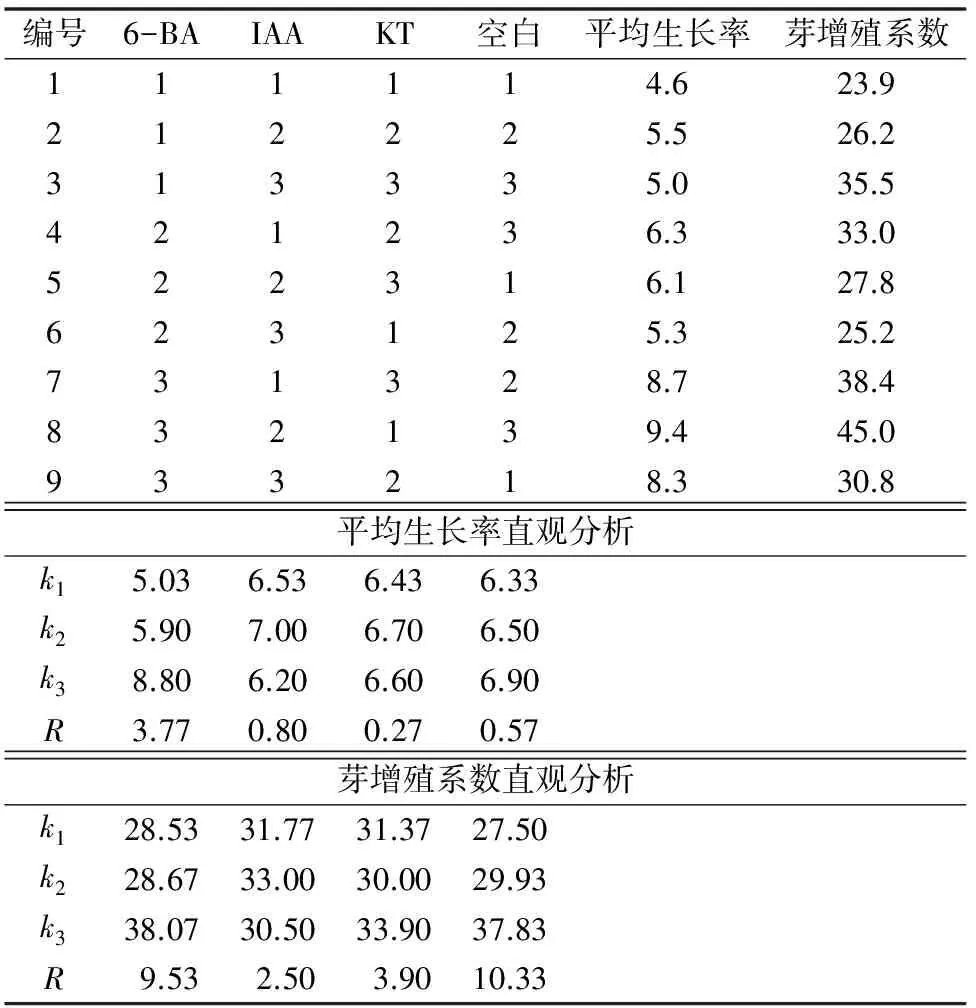
表8 白花蛇舌草不带芽茎段培养正交实验结果与直观分析
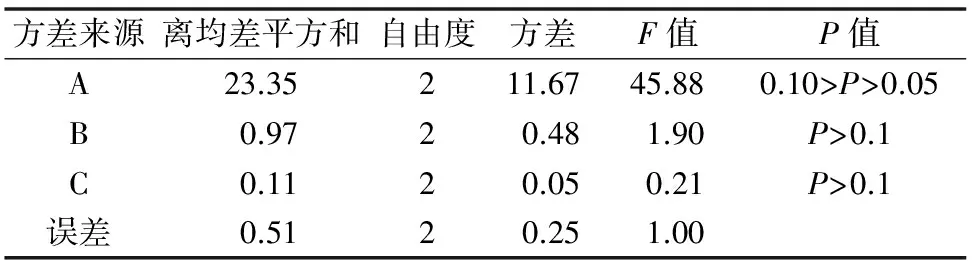
表9 白花蛇舌草不带芽茎段培养平均生长率方差分析
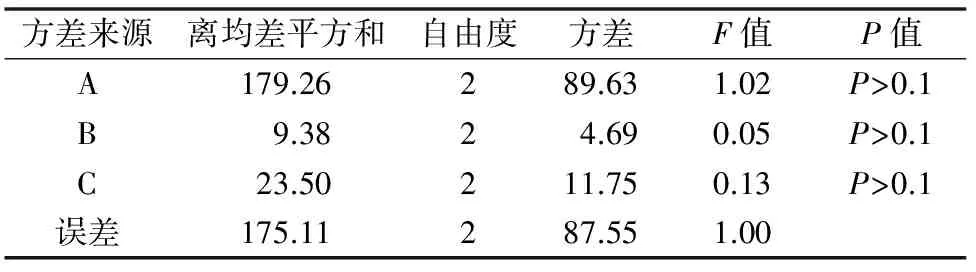
表10 白花蛇舌草不带芽茎段培养芽增殖系数方差分析
根据芽的平均增殖系数结果,发现白花蛇舌草茎段外植体培养的平均芽增殖系数均在23.9倍以上。直观分析发现,3种外源激素对叶片培养芽增殖系数影响顺序为A(6-BA)>C(KT)>B(IAA),其中6-BA浓度的提高可显著提高茎段培养材料的芽增殖系数,范围值R为9.53;适度的IAA浓度可提高茎段材料的芽增殖系数,但浓度过高具有抑制作用;KT浓度的增加对茎段培养材料的影响不具有规律性,试验中表现为较低与较高浓度均能提高培养材料的芽增殖系数。方差分析发现3种激素对叶片培养均无显著影响,P值均>0.1。但不同培养基上的芽增殖系数差异较大,最低的芽增殖系数为23.9倍,而最高的芽增殖系数为45.0倍。根据平均芽增殖系数的分析结果,确定叶片增殖的最佳培养基外源激素配方为A3B2C3,即MS+2.5 mg/L 6-BA+0.3 mg/L IAA+0.5 mg/L KT。
上述分析结果表明,6-BA对茎段培养的平均生长率具有显著影响,对芽增殖系数没有显著影响,IAA与KT对茎段培养的平均生长率和芽增殖系数均无显著影响,但较高浓度的激素组合获得较高的芽增殖系数。在试验过程中观察发现,茎段培养获得的丛生芽长势较为均一,色泽翠绿,植株健壮,是比较理想的工厂化生产材料。因此根据结果分析与材料的实际生长状况,确定茎段培养的最佳培养基外源激素配比为A3B2C2,即MS+2.5 mg/L 6-BA+0.3 mg/L IAA+0.3 mg/L KT。在此培养条件下,平均生长率约为9.0倍,芽增殖系数约为40倍,材料生长状况良好,丛生芽粗壮,色泽翠绿。
3 讨论
在体外培养条件下,白花蛇舌草的芽、幼嫩叶片与不带芽茎段均适用于丛生芽的诱导培养,均可培养获得大量丛生芽,且成芽率均达100%。但不同来源的外植体培养效果并不相同,几乎所有丛生芽均是通过接触培养基的切口部位萌动形成愈伤组织后再生形成丛生芽。嫩芽或带腋芽嫩茎培养的材料,不接触培养基部分往上延伸,但不分化形成丛生芽,顶部材料容易枯黄,而基部材料由于空间限制,丛生芽长势不均一,难以获得优质材料。以幼嫩叶片或不带芽嫩茎为外植体培养的材料,获得的丛生芽长势较为均一,颜色翠绿新鲜,成苗质量较好,但需要控制丛生芽增殖系数,以免增殖系数过高,获得的丛生芽缺少生存空间而出现黄化等现象。
不同的激素组合对白花蛇舌草外植体培养的影响不同,嫩芽或腋芽培养的最佳培养基激素配比为MS+1.5 mg/L 6-BA+0.3 mg/L IAA+0.3 mg/L KT;以幼嫩叶片为外植体培养的最佳培养基激素配比为MS+0.5 mg/L 6-BA+0.5 mg/L IAA+0.3 mg/L KT;以茎段为外植体培养的最佳培养基激素配比为MS+2.5 mg/L 6-BA+0.3 mg/L IAA+0.3 mg/L KT。但综合考虑整体试验结果,3种材料的最适 6-BA 浓度均不相同,表明对3种不同外植体培养产生的不同影响主要来源为6-BA。
数据分析发现,白花蛇舌草不同外植体培养材料的平均生长率与芽增殖系数之间并不存在线性关系,平均增长率高的试验组,芽增殖系数并不一定高,反之亦然。因此,在进行最佳培养条件确定时,需要综合材料的培养状况,选择适宜生产最优质培养材料的培养方案。
[1]国家中医药管理局中华本草编委会.中华本草:第六卷[M].上海:上海科学技术出版社,1999.
[2]范崇庆,李娆娆,金 艳,等.白花蛇舌草质量标准[J].中国实验方剂学杂志,2014,20(17):98-101.
[3]纪宝玉,范崇庆,裴莉昕,等.白花蛇舌草的化学成分及药理作用研究进展[J].中国实验方剂学杂志,2014,20(19):235-240.
[4]陈永康.白花蛇舌草的化学成分研究进展[J].中国实验方剂学杂志,2011,17(17):290-293.
[5]于 新,杜志坚,陈悦娇,等.白花蛇舌草提取物抗氧化作用的研究[J].食品与发酵工业,2002,28(3):10-13.
[6]赵浩如,李 瑞,林以宁,等.白花蛇舌草不同提取工艺对抗肿瘤活性的影响[J].中国药科大学学报,2002,33(6):510-513.
[7]王宇翎,张 艳,方 明,等.白花蛇舌草总黄酮的免疫调节作用[J].中国药理学通报,2005,21(4):444-447.
[8]孟 玮,邱世翠,刘志强,等.白花蛇舌草对小鼠淋巴细胞增殖和抗体产生的影响[J].中国中医药科技,2003,10(6):340.
[9]Kim Y,Park E J,Kim J,et al.Neuroprotective constituents from Hedyotis diffusa[J].Journal of Natural Products,2001,64(1):75-78.
[10]朱雪瑜.白花蛇舌草中的神经保护成分[J].国外医药(植物药分册),2002,17(1):28-29.
[11]李国平,杨鹭生.白花蛇舌草的组织培养和植株再生[J].植物生理学通讯,2002,38(2):150.
[12]巢建国,谈献和,张 瑜,等.白花蛇舌草组织培养研究[J].南京中医药大学学报(自然科学版),2005,21(6):369-370.
