慢性乙型肝炎患者外周血单个核细胞中STING基因表达与HBV DNA载量的关系
2018-03-05杨晓燕张平安牛志立王方平
杨晓燕,张平安,牛志立,王方平
(武汉大学人民医院,湖北 武汉 430060)
慢性乙型肝炎(chronic hepatitis B,CHB)是严重危害人类健康的重大肝脏疾病之一[1]。根据世界卫生组织统计报道,全球约有二十多亿人感染过乙型肝炎病毒(hepatitis B virus,HBV),有3.6亿人患CHB,每年有60万人因HBV相关性肝衰竭、肝硬化或肝细胞癌死亡[2]。目前,乙型肝炎的临床治疗以干扰素和核酸类及核酸类似物等药物为主,但治疗效果并不理想[3]。HBV是一种没有明显细胞毒性的嗜肝性双链DNA病毒,可导致急性和慢性肝炎[4]。通常认为,细胞免疫应答的活力和强度可以决定HBV感染是否是被清除或是持续[5]。然而,除了适应性免疫,由通过模式识别受体(pattern recognition receptors,PRRs)识别病原体相关分析模式(pathogen-associated molecular patterns,PAMP)诱导的先天免疫反应在控制病毒感染中也发挥不可或缺的作用[6]。近年研究[7-9]表明,干扰素刺激基因(stimulator of interferon genes,STING)是天然免疫信号通路中一种重要的中间蛋白,它不仅参与几乎所有胞内PRRs诱导dsDNA产生I型干扰素(interferon,IFN)的过程,其自身也可以作为PRRs识别c-di-GMP,c-di-AMP并诱导产生IFN。藉此,为探讨STING在机体抗HBV免疫应答中的作用机制,我们观察了CHB患者外周血单个核细胞SITNG的表达,以及HBV DNA复制情况,现报告如下。
1 对象与方法
1.1 研究对象 选择2016年2月—2017年2月在武汉大学人民医院感染科初入院的CHB患者88例为CHB 组,其中男性42例,女性46例;年龄18~83岁,平均(54±15)岁;CHB的诊断符合《慢性乙型肝炎防治指南(2015年更新版)》[10],所有患者在入院前6个月内未经过任何抗病毒治疗,排除其他嗜肝病毒感染,自身免疫系统疾病,其他系统严重疾病及感染性疾病。选取同期来我院进行体检的健康人群,共74例为对照组,其中男性35例,女性39例;年龄20~85岁,平均(56±15)岁。本研究经医院伦理委员会批准,所有研究对象均签署知情同意书。
1.2 主要试剂与仪器 Trizol和SYBR Premix Ex Taq II购自TaKaRa公司,反转录试剂盒Thermo Scientific购自公司。RNA浓度测定采用Thermo Scientific公司的分光光度计NanoDrop 2000。PCR分析仪由Applied Biosystem Inc公司生产,荧光定量PCR仪LighterCycler1.2 由罗氏生产。HBV DNA 病毒载量检测试剂购自凯杰生物工程有限公司,检测仪器为罗氏 LC480,实验过程严格按试剂说明书进行操作;HBV-DNA 定量最低检出限为5×102IU/mL,定量检测线性范围为1×103~1×107IU/mL。
1.3 研究方法
1.3.1 引物设计 利用美国国立生物技术信息中心(National Center of Biotechnology Information,NCBI)网站中提供的STING mRNA序列和BLAST进行引物设计,见表1。所有引物均由上海维基生物科技有限公司合成。PCR扩增产物的溶解曲线峰单一,琼脂糖凝胶电泳结果显示目的条带单一并且目的基因片段的长度与预期设计的长度一致,表明引物的特异性较好。见图1~2。
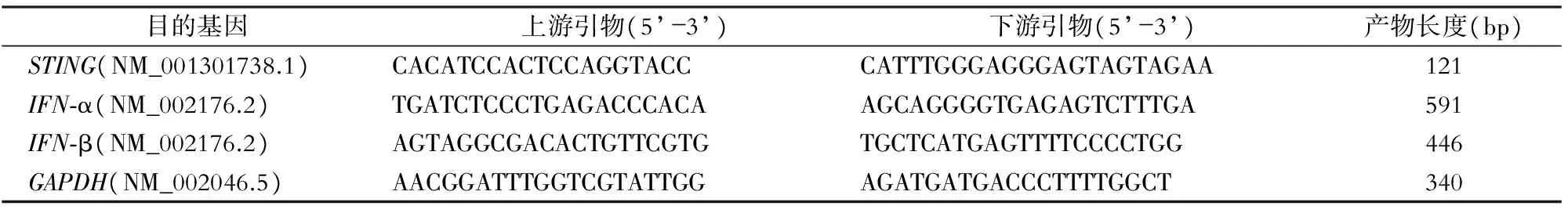
表1 STING、干扰素基因及GAPDH基因的上下游引物

图1 STING、干扰素基因及GAPDH基因引物溶解曲线

注:M为标准分子量
图2STING、干扰素基因及GAPDH基因PCR产物凝胶电泳图
Figure2Gel electrophoresis map of PCR products ofSTING, interferon genes, andGAPDHgene
1.3.2 mRNA提取和逆转录 采集所有研究对象空腹静脉血2 mL于EDTA抗凝管中,严格按照淋巴细胞分离液说明书分离外周血单个核细胞。单个核细胞总mRNA的提取采用Trizol法,所获得RNA 的纯度要求为A260 nm/A280 nm>1.8。进行逆转录时,取11 μL RNA模板并加入1 μL oligo引物混匀后瞬时离心,65℃加热5 min,冰上加入逆转录反应体系:4 μL Reaction Buffer,2 μL Mix,1 μL RI,1 μL RT。反应条件为:42℃ 60 min,72℃ 10 min,4℃保存。得到的cDNA产物置于-20℃保存备用。
1.3.3 荧光定量PCR检测 反应体系为1 μL cDNA,各l μL上下游引物,10 μL SYBR Premix Ex Taq II,0.4 μL ROX II,7.6 μL ddH2O,总体积为20 μL。扩增反应条件为5个基因(STING、IFN-α、IFN-β、GAPDH、内参基因)的反应条件均为预变性94℃ 30 s,变性94℃ 20 s,退火60℃ 20 s,延伸72℃ 35 s,PCR进行50个循环,溶解曲线条件为:95℃15 s,60℃1 min,95℃15 s。对CHC组和健康组4个目的基因mRNA的表达采用相对表达量ΔCT进行比较,ΔCt=Ct目的-Ct内参[11]。扩增效率验证:本实验对4个基因(STING、IFN-α、IFN-β、GAPDH)进行了10倍稀释,稀释5个梯度,目的基因和内参基因扩增效率相差小于5%,且在98%~102%之间,可以认为扩增效率近似相等[12]。STING、干扰素基因及GAPDH基因实时荧光定量PCR的扩增曲线见图3。
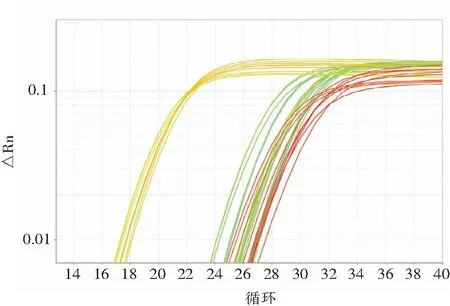
图3STING、干扰素基因及GAPDH基因荧光定量PCR扩增曲线
Figure3Real-time fluorescence quantitative PCR amplification curves ofSTING, interferon genes, andGAPDHgene

2 结果
2.1 一般资料 CHB组与对照组两组研究对象在性别构成比和年龄间的比较差异无统计学意义(t=0.027,P>0.05),而在肝功能指标天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)比较,差异有统计学意义(t值分别为52.530、49.430,均P<0.01),见表2。
表2CHB组与对照组一般资料比较
Table2Comparison of general data between CHB group and control group

组别例数性别[男,n(%)]年龄(岁,x±s)AST(mmol/L,x±s)ALT(mmol/L,x±s)CHB组8842(47.72)53.50±14.7950.01±35.1057.13±39.84对照组7435(47.30)55.61±14.8818.35±7.2822.57±4.77t/χ2-0.003-0.90151.53049.430P-0.9560.6840.0010.001
2.2 CHB组和对照组STING及干扰素基因mRNA表达量的比较 与健康对照组相比,CHB组患者STING、IFN-α、IFN-β表达量均上调,分别是健康对照组的2.95、3.14、2.01倍,差异有统计学意义。见表3。



组别例数基因相对表达量STINGIFN⁃αIFN⁃βCHB组888.97±1.959.04±3.139.14±2.74对照组7410.53±2.1510.69±2.9810.15±2.82ΔΔCt-1.56-1.651.012-ΔΔCt2.953.142.01t-4.72-3.41-2.31P<0.01<0.01<0.05
2.3 不同HBV DNA载量CHB患者STING及干扰素基因表达量的比较 根据CHB患者体内HBV DNA病毒载量的不同将其分为HBV DNA ≤104IU/mL组、104~IU/mL组、105~IU/mL组和>106IU/mL组,使用方差分析检验四组的差异,结果显示四组不同HBV DNA载量的CHB患者STING表达有差异,且差异有统计学意义(P=0.01);四组不同HBV DNA载量的CHB患者IFN-β表达有差异,且差异有统计学意义(P=0.048)。见表4。通过SNK检验对不同HBV DNA载量CHB患者STING基因表达量比较进行两两比较,结果发现,HBV DNA≤104IU/mL组患者与其他三组相比,STING基因相对表达量增高,分别是HBV DNA 104~IU/mL组、105~IU/mL组、>106IU/mL组的2.98、3.76、3.97倍,差异有统计学意义(P<0.05)。


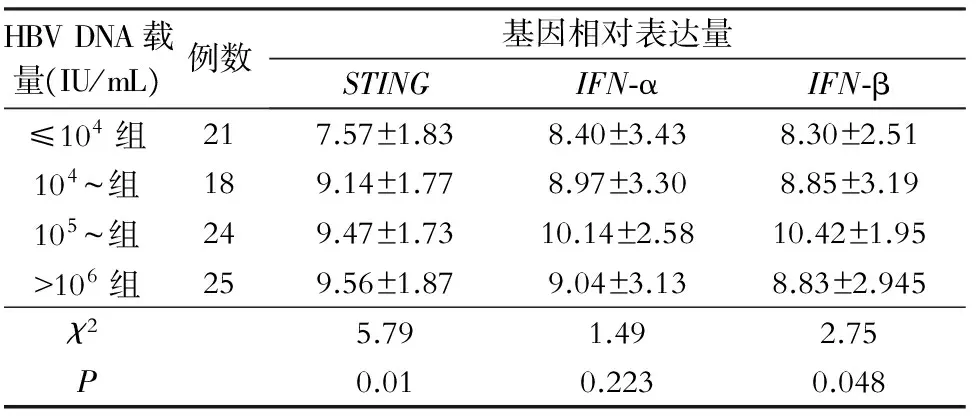
HBVDNA载量(IU/mL)例数基因相对表达量STINGIFN⁃αIFN⁃β≤104组217.57±1.838.40±3.438.30±2.51104~组189.14±1.778.97±3.308.85±3.19105~组249.47±1.7310.14±2.5810.42±1.95>106组259.56±1.879.04±3.138.83±2.945χ25.791.492.75P0.010.2230.048
2.4 CHB患者STING表达量与干扰素基因表达量以及HBV DNA载量的相关性 CHB患者STING mRNA表达量与IFN-α 和IFN-β mRNA表达量呈正相关(r值分别为0.475和0.503,P值均<0.05),与HBV DNA 载量呈弱相关性(r=0.333,P<0.05)。
3 讨论
固有免疫是人体抵御病原微生物感染的第一道防线,可通过PRRs精细识别出不同的抗原,并激活下游免疫信号通路,最终生成IFN和其他细胞因子限制病原微生物对人体的侵袭[13]。固有免疫很大程度地影响着感染的最终结局,同时也是适应性免疫的基础[14]。STING是DNA传感器环鸟苷-腺苷酸合成酶(cyclic guanosine monophosphate-adenosine monophosphate synthase,cGAS)和RNA传感器人视黄酸诱导基因(retinoic acid-inducible gene I,RIG-I)下游的细胞信号级联中的衔接蛋白,其介导的信号传导通路可以识别多种入侵病毒[15]。HBV病毒基因组全长约3.2 kb,为部分双链环状DNA,其在宿主体内可以转变为超螺旋的共价、闭合、环状DNA分子,并作为模板转录出前基因组RNA(pregenomic RNA,pgRNA)和其他mRNA。虽然肝脏是HBV复制的主要部位,但是人体外周血中也可以检测到HBV DNA。HBV通常被认为是一种“隐形”病毒,因为在HBV感染的自然过程中,固有免疫反应很弱甚至不存在,可能是由于固有免疫系统虽然可以识别到HBV,但病毒可以主动抑制或逃避早期抗病毒反应[16]。实际上,最近的研究表明,HBV的前基因组RNA和其松弛的环状DNA(relaxed circular DNA,rcDNA),可分别被RIG-I和STING识别[17]。不同的先天免疫信号通路的激活可诱导IFN应答并抑制HBV复制。另一方面,越来越多的证据表明不同的HBV蛋白和HBV病毒粒子可以通过各种机制损害先天免疫信号,如RIG-I,Toll样受体3(Toll-like receptor,TLR3)和STING刺激的信号[18]。如HBV诱导的miR146a可靶向干扰RIG-I,从而减弱IFN产生[19]。HBV X蛋白与线粒体抗病毒信号蛋白(mitochondrial antiviral signaling,MAVS)相互作用,P蛋白竞争RNA解旋酶3(DDX3)与TANK结合激酶1(TBK1)的结合,以抑制RIG-I介导的I型IFN通路信号传导[8]。
最近的研究[20]表明,cGAS-STING通路的激活可以有助于抑制的HBV复制。cGAS是细胞质dsDNA感受器,可结合细胞质中的DNA经催化后形成cGAMP。cGAMP能有效激活STING,进而激活下游Ⅰ型IFN生成及抗病毒效应。由于HBV复制期间可产生dsDNA和ssDNA,因此,STING也参与HBV复制中间体的识别和HBV清除的调节[21]。本研究发现,CHB组患者与健康对照组相比较,其STING表达量是增多的,且在HBV DNA载量低的患者体内,其STING的表达也是增多的。与Liu等[22]的体外细胞实验及小鼠动物实验中的结果一致,即过度表达的STING在体外和体内均可抑制HBV的复制,而且除了固有免疫反应外,STING也调节机体对HBV的适应性免疫反应。同时,本研究中还发现,STING的相对表达量与IFNα、IFNβ的表达呈正相关,与最近报道[23]的有关STING与干扰素基因的研究类似。
综上所述,STING在机体抗HBV免疫应答中发挥着重要作用,由于本研究纳入样本量有限,关于STING抗HBV感染的确切机制还需进一步研究确认。对于STING介导的固有免疫网络亦有待完善,从而为进一步探明病毒逃避宿主固有免疫的机制,并为HBV感染的治疗提供新的思路和靶点。
[1] Lusida MI, Juniastuti, Yano Y. Current hepatitis B virus infection situation in Indonesia and its genetic diversity[J]. World J Gastroenterol, 2016, 22(32): 7264-7274.
[2] Askari A, Hakimi H, Nasiri Ahmadabadi B, et al. Prevalence of hepatitis B co-infection among HIV positive patients: narrative review article[J]. Iran J Public Health, 2014, 6, 43(6): 705-712.
[3] Konerman MA, Lok AS. Interferon treatment for hepatitis B[J]. Clin Liver Dis, 2016, 20(4): 645-665.
[4] Villar LM, Cruz HM, Barbosa JR, et al. Update on hepatitis B and C virus diagnosis[J]. World J Virol, 2015, 4(4): 323-342.
[5] Ohno M, Otsuka M, Kishikawa T, et al. Novel therapeutic approaches for hepatitis B virus covalently closed circular DNA[J]. World J Gastroenterol, 2015, 21(23): 7084-7088.
[6] Lee JA, Kim YM, Hyun PM, et al. Honeybee (Apis mellifera) venom reinforces viral clearance during the early stage of infection with porcine reproductive and respiratory syndrome virus through the up-regulation of Th1-specific immune responses[J]. Toxins (Basel), 2015, 7(5): 1837-1853.
[7] Wu J, Sun L, Chen X, et al. Cyclic GMP-AMP is an endogenous second messenger in innate immune signaling by cytosolic DNA[J]. Science, 2013, 339(6121): 826-830.
[8] Liu Y, Li J, Chen J, et al. Hepatitis B virus polymerase disrupts K63-linked ubiquitination of STING to block innate cytosolic DNA-sensing pathways[J]. J Virol, 2015, 89(4): 2287-2300.
[9] Guo F, Han Y, Zhao X, et al. STING agonists induce an innate antiviral immune response against hepatitis B virus[J]. Antimicrob Agents Chemother, 2015, 59(2): 1273-1281.
[10] 王贵强,王福生,成军,等.慢性乙型肝炎防治指南(2015年更新版)[J].临床肝胆病杂志, 2015, 31(12) :1941-1960.
[11] Pfaffl MW.A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Res, 2001, 29(9): e45.
[12] Livak KJ, Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C (T)) method[J]. Methods, 2001, 25(4): 402-408.
[13] Wang L, Wang K, Zou ZQ. Crosstalk between innate and adaptive immunity in hepatitis B virus infection[J]. World J Hepatol, 2015, 7(30): 2980-2991.
[14] Li X, Ni R. Breaking hepatitis B virus tolerance and inducing protective immunity based on mimicking T cell-independent antigen[J]. Viral Immunol, 2016, 29(9): 502-509.
[15] Luangsay S, Gruffaz M, Isorce N, et al. Early inhibition of hepatocyte innate responses by hepatitis B virus[J]. J Hepatol, 2015, 63(6): 1314-1322.
[16] Ran Y, Shu HB, Wang YY. MITA/STING: a central and multifaceted mediator in innate immune response[J]. Cytokine Growth Factor Rev, 2014, 25(6): 631-639.
[17] Cui X, Clark DN, Liu K, et al. Viral DNA-dependent induction of innate immune response to hepatitis B virus in immortalized mouse hepatocytes[J]. J Virol, 2015, 90(1): 486-496.
[18] Sato S, Li K, Kameyama T, et al. The RNA sensor RIG-I dually functions as an innate sensor and direct antiviral factor for hepatitis B virus[J]. Immunity, 2015, 42(1): 123-132.
[19] Wei CW, Ni CF, Song T, et al. The hepatitis B virus X protein disrupts innate immunity by downregulating mitochondrial antiviral signaling protein[J]. J Immunol, 2010, 185(2): 1158-1168.
[20] Guo F, Tang L, Shu S, et al. Activation of stimulator of interferon genes in hepatocytes suppresses the replication of hepatitis B virus[J]. Antimicrob Agents Chemother, 2017, 61(10), pii: e00771-17.
[21] Gao D, Wu J, Wu YT, et al. Cyclic GMP-AMP synthase is an innate immune sensor of HIV and other retroviruses[J]. Science, 2013, 341(6148): 903-906.
[22] Liu S, Zhao K, Su X, et al. MITA/STING and its alternative splicing isoform MRP restrict hepatitis B virus replication[J]. PLoS One, 2017, 12(1): e0169701.
[23] Chen H, Pei R, Zhu W, et al. An alternative splicing isoform of MITA antagonizes MITA-mediated induction of type I IFNs[J]. J Immunol, 2014, 192(3): 1162-1170.
