绝经前高危复发乳腺癌辅助内分泌治疗的最佳方案研究
2018-03-05封伟亮陈道宝陈波乔恩奇俞星飞杨红健
封伟亮 陈道宝 陈波 乔恩奇 俞星飞 杨红健
乳腺癌是严重威胁女性健康的杀手。近年来随着综合治疗的进展,乳腺癌患者的生存期越来越长。内分泌治疗以其高效低毒在乳腺癌综合治疗中扮演着越来越重要的角色,尤其是对于激素敏感型乳腺癌即雌激素受体(ER)和(或)孕激素受体(PR)阳性者。流行病学数据显示,我国的乳腺癌发病曲线呈双峰模型,50岁及70岁均为发病高峰,中位发病年龄45~55岁[1],提示我国有一半的乳腺癌患者处于绝经前。长期以来,他莫昔芬(TAM)一直是绝经前乳腺癌内分泌治疗的标准治疗药物,早期乳腺癌临床试验协作组(EBCTCG)的研究显示其可降低47%的复发风险和26%的死亡风险[2]。戈舍瑞林是当前应用最广泛的促黄体生成激素释放激素类似物(LHRHa),可使患者达到人工绝经状态,疗效稳定,可极大降低雌二醇水平,消除肿瘤细胞赖以生存的激素环境。绝经后乳腺癌内分泌治疗时芳香化酶抑制剂(AIs)疗效优于TAM。然而,绝经前乳腺癌采用戈舍瑞林去势后是否也具有较好的疗效尚不完全确定,尤其在联合AIs时[3]。国外有研究显示卵巢功能抑制(OFS)联合AIs可明显降低乳腺癌复发风险[4-5],但也有研究未能得出相同的结论[6]。而且,既往的研究均针对早期乳腺癌人群,对高危复发的人群仅有亚组分析。因此,笔者对绝经前激素受体阳性、具有高危复发风险乳腺癌患者的最佳内分泌治疗方案进行探讨,以期为乳腺癌临床诊治提供参考,现报道如下。
1 对象和方法
1.1 对象 选择2011年6月至2013年5月本院收治的绝经前乳腺癌患者共150例。入组标准:乳腺癌诊断明确,标准辅助化疗完成;绝经前患者(以手术时间为准);有完整的病理资料包括淋巴结状况,ER/PR/Her-2状态,且 ER(+)和(或)PR(+);具有高危复发风险因素:乳腺癌腋窝淋巴结转移数目≥4枚或1~3枚并伴HER-2过表达者[免疫组化法测定CerbB-2(+++)或FISHHer-2扩增]。排除标准:既往有第二原发恶性肿瘤史;绝经状态或月经状态因为历史手术而单凭激素水平无法肯定者,复发或转移性乳腺癌;既往已使用过戈舍瑞林、TAM或阿那曲唑。入组患者按照随机数字表法分为3组,每组50例,根据治疗方案分为T组(TAM治疗)、G+T组(戈舍瑞林+TAM治疗)、G+A组(戈舍瑞林+阿那曲唑治疗)。3组一般资料比较详见表1。3组年龄、淋巴结数目、Her-2状态及曲妥珠单抗(赫赛汀)使用情况等比较差异均无统计学意义(均P>0.05)。本研究经本院伦理委员会审核通过,所有患者均签署知情同意书。
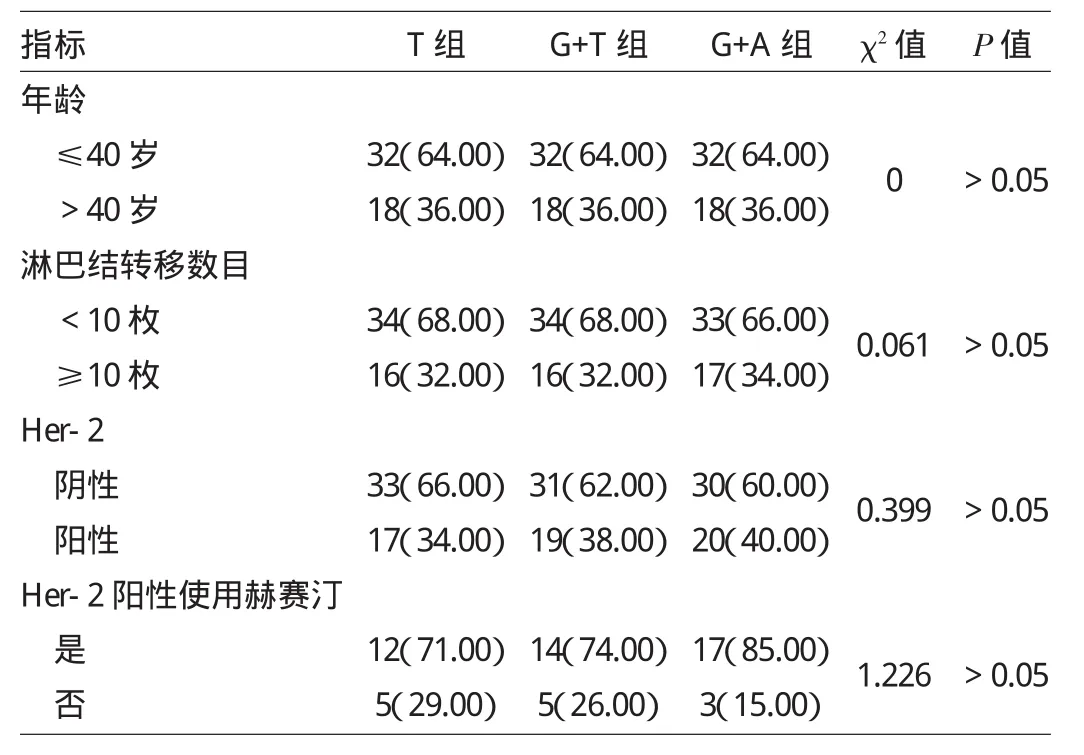
表1 3组一般资料比较[例(%)]
1.2 方法
1.2.1 治疗方法 T组:TAM(商品名:枸橼酸他莫昔芬片,扬子江药业集团有限公司,国药准字H32021472)10mg/次,2次/d,共 5年;G+T 组:戈舍瑞林(商品名:诺雷得,阿斯利康制药有限公司,国药准字J20100126)10mg/次,2次/d,共 5年,加 TAM 10mg/次,2次/d,共 5年;G+A组:戈舍瑞林10mg/次,2次/d,共5年 ,加阿那曲唑(商品名:瑞宁得,阿斯利康制药有限公司,国药准字 J20100107)1mg/次,1次/d,共 5年。
1.2.2 随访 治疗过程中每3个月常规复查1次。3组患者的无病生存(disease free survival,DFS)期从随机分组开始至首次发现乳腺癌相关复发或转移计算,无复发或转移事件发生者至随访结束时间作为截尾事件纳入统计。总生存(overall survival,OS)时间从随机分组开始至患者死亡计算,无死亡事件发生者至随访结束时间作为截尾事件纳入统计。主要研究终点为DFS率,次要研究终点为OS率和药物安全性,并分析年龄(≤40岁、>40岁)、淋巴结转移数目(<10枚、≥10枚)、Her-2状态等影响因素在不同治疗方法时对生存率的影响。
1.3 统计学处理 采用SPSS16.0统计软件,计数资料以百分率表示,组间比较采用χ2检验;生存分析采用Kaplan-Meier法,组间比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组生存状况分析 截止2016年5月,所有入组患者均完成随访,中位随访时间为49(36~57)个月。生存分析显示,G+A组3年DFS率为90.00%,显著高于T组(74.00%)(χ2=5.97,P<0.05);同时数值上也高于 G+T组(84.00%),但差异无统计学意义(χ2=1.76,P>0.05),详见图1。3组的4年OS率分别为T组89.50%,G+T组92.90%,G+A组95.70%,差异无统计学意义(χ2=1.44,P >0.05),详见图 2。
2.2 3组不良反应分析 T组患者发生肝功能不全13例(26%),潮热9例(18%),子宫内膜增厚 8例(16%)。G+T组患者发生潮热11例(22%),肝功能不全8例(16%),子宫内膜增厚3例(6%)。G+A组患者发生骨痛9例(18%),潮热7例(14%),肝功能不全5例(10%),均为轻至中度,经对症处理后均好转并可继续耐受用药。
2.3 影响3组患者3年DFS率的因素分析 见表2。
由表2可见,3组中年龄≤40岁者的3年DFS率与>40岁者相比,差异无统计学意义,但在≤40岁的患者中,G+A组的DFS率高于T组(P<0.05);3组中淋巴结转移数目<10枚者3年DFS率高于淋巴结转移数目≥10枚者,但差异无统计学意义(P>0.05),但淋巴结转移数目≥10枚者中,G+A组的DFS率高于T组(P<0.05);T组中Her-2阳性者3年DFS率低于Her-2阴性者,差异有统计学意义(P<0.05),而G+T组、G+A组中Her-2阳性患者3年DFS率低于Her-2阴性的患者,但差异均无统计学意义(均P>0.05)。在Her-2阳性者中,G+A组的3年DFS率显著高于G+T组和T组(均P<0.05)。

表2 影响3组患者3年D F S率的因素分析[例(D F S%)]

图1 3组患者3年D F S率比较

图2 3组患者4年O S率比较
3 讨论
乳腺癌目前是全球女性发病率最高的恶性肿瘤,近年来,我国的乳腺癌发病率呈不断上升趋势,每年有近20万女性确诊为乳腺癌,且近一半为绝经前乳腺癌。研究显示约60%的绝经前乳腺癌为激素受体阳性型乳腺癌[7],内分泌治疗以其高效低毒性在此类乳腺癌综合治疗中占据着重要地位。如何提高绝经前乳腺癌特别伴有高危复发危险患者的生存率是临床重要的课题。
雌激素在激素受体阳性的乳腺癌发生、发展中扮演着重要角色,进一步降低绝经前乳腺癌患者体内的雌激素水平是否可转变为生存改善?绝经前年轻女性雌激素主要来源于卵巢,卵巢去势能极大地降低雌二醇水平,消除瘤细胞赖以生存的激素环境。一系列的回顾性研究也提示,化疗后闭经的绝经前女性较未闭经者预后更好[8]。因此人为地抑制卵巢功能造成闭经可能改善绝经前患者的预后。人为闭经的方法包括手术去势、放疗去势及药物去势等。其中药物去势因其效果可靠、疗效可逆,且避免了手术创伤及相关风险,受到极大关注。戈舍瑞林是目前应用最广的LHRHa,能与垂体LHRH受体形成强而持久的结合,在垂体短暂的LH、FSH释放高峰后进入不应期,从而抑制卵巢产生雌激素,使绝经前妇女体内雌激素达到绝经后水平,达到卵巢去势的目的[9]。绝经前乳腺癌联合戈舍瑞林(去势)后的内分泌治疗是否能获得更好的治疗效果,目前尚存很大争议。
国际乳腺癌协作组(IBCSG)Ⅷ试验的结果发现化疗后加用戈舍瑞林,与单用化疗或戈舍瑞林相比,5年无复发生存率有所提高,但无统计学差异[10]。Baum等[11]的研究结果发现使用戈舍瑞林2年患者的DFS率及OS率均显著高于不用内分泌治疗的患者。TAM和依西美坦对比研究(TEXT研究)和卵巢功能抑制研究(SOFT研究)结果的公布则给人们带来更大的信心。SOFT研究结果显示,相对于单药TAM,OFS联合AIs显著降低了乳腺癌复发风险。而SOFT和TEXT联合分析显示,OFS联合AIs相对于OFS联合TAM,显著提高了5年DFS率。在本研究中,我们先根据2007年公布的St.Gallen共识进行复发危险度分级,选择具有高危复发风险的绝经前激素受体阳性的乳腺癌患者入组。入组的患者均接受了6~8个周期的常规化疗,结果显示G+A组较单用TAM组,显著提高了3年的DFS率,与SOFT研究结果相仿。而相对G+T组,G+A组的3年DFS率也较高,但差异无统计学意义,可能与病例数较少,随访时间较短有关。
然而奥地利乳腺癌与结直肠癌研究组(ABCSG)公布的研究结果却显示,OFS联合TAM组与OFS联合AIs组的DFS率无统计学差异(P=0.59)[6]。分析原因,可能源于以下几个因素:该试验中只有5%的患者接受了化疗,且纳入患者数量少于 TEXT和SOFT试验,而治疗时间只持续了3年,双磷酸盐(唑来膦酸)的应用也可能削弱了AIs的效果。
Her-2基因表达的人表皮细胞生长因子受体-2(EGFR-2)也称为 neu、C-erb-2、Her-2/neu,约在 20%~30%的乳腺癌细胞中过度表达,在辅助内分泌治疗时,表皮生长因子受体信号传导主要通过MAPK、AKT通路与ER相互作用,在乳腺癌的抗激素耐药中起重要作用并致使抗激素治疗失败,使乳腺癌细胞对以TAM为代表的内分泌治疗耐药,而对AIs敏感[12-13]。本研究发现,在Her-2阳性的患者中,G+A组的3年DFS率显著高于G+T组和T组。曲妥珠单抗(商品名:赫赛汀)作为一种单克隆抗体,可显著提高Her-2基因过表达的乳腺癌患者的生存率。但遗憾的是,因为经济原因,并非每例Her-2阳性的乳腺癌患者都能使用赫赛汀。本研究在2011年6月开始入组病例,尽管中国癌症基金会在同年9月左右开展“买6送8”的慈善赠药计划,仍有13例(23%)患者未使用赫赛汀。本研究显示,T组中未使用赫赛汀的比例略高于其他两组,尽管差异无统计学意义,但这种差异是否会影响本研究结果,因为病例数较少,笔者暂未能进一步分析,希望将来能够扩大样本量进行验证。
年龄是影响乳腺癌预后的重要因素。本研究发现,在不同的治疗组中,年龄并非是影响乳腺癌患者DFS的主要因素,但对于40岁及以下的患者,相对于T组,G+A组可显著提高患者3年DFS率。这可能是由于年龄<40岁者,化疗后卵巢功能依然旺盛,此时人为绝经,获益会更明显。2007年的一项Meta分析结果显示,40岁以下的患者接受OFS联合化疗后,其复发及死亡风险均显著下降[14]。2015年的St.gallen共识团投票结果显示,81%的专家将年龄≤35岁作为OFS的考虑因素[15]。
淋巴结转移数目一直是影响乳腺癌疾病进展的重要因素。陈建彬等[16]回顾性分析285例激素受体阳性的乳腺癌患者的临床病理资料,发现淋巴结转移是全组患者的预后不良因素。本研究通过亚组分析发现,3组中淋巴结转移数目<10枚者3年DFS率数值上均高于淋巴结转移数目≥10枚者,但差异无统计学意义。同样可能与本研究纳入患者较少,随访时间较短有关,需要进一步扩大样本量并进行长期随访进行验证。但在淋巴结转移数目≥10枚者中,G+A组的DFS率显著高于T组,显示复发风险越高,越能从OFS联合AIs治疗中获益。
殷文瑾等[17]回顾性分析了我国2214例乳腺癌患者,发现复发风险存在两个高峰期,分别位于术后第2年及术后第9.5~10年左右,本研究也发现,绝大多数的DFS事件均发生在术后2~3年,故本研究针对3年DFS率和4年OS率的中期分析结果具有一定可靠性。
本研究3组病例均未出现严重的药物不良反应,TAM最主要的不良反应为肝功能不全,但均为轻中度,予护肝治疗后可耐受,其次为潮热和子宫内膜增厚,易对患者造成一定的困扰,尤其是子宫内膜增厚易造成患者心理恐慌。江泽飞等[18]建议对绝经前患者,正常月经周期子宫内膜厚度有正常的生理变化,化疗期间闭经患者化疗后可能因即将恢复月经出现内膜增厚,测量内膜厚度无助于判断患者的月经状态。因此,对于化疗后未绝经的患者,如无其他高危因素,无需增加监测次数。而AIs的使用更多地造成了骨骼肌肉疼痛,多见于使用初期,一般予解热镇痛药对症处理可缓解,用药一段时间后可消退。
综上所述,对绝经前激素受体阳性的高危复发乳腺癌患者,OFS联合AIs的疗效优于单药TAM,该方案尤其适宜Her-2阳性、淋巴结结转移数目多及年龄≤40岁的患者,但仍需临床进一步验证。
[1]Fan L,Strasser-Weippl K,Li JJ,et al.Breast cancer in China[J].The Lancet Oncology,2014,15(7):e279-289.
[2]Buzdar A.The place of chemotherapy in the treatment of early breast cancer[J].British Journal of Cancer,1998,78(Suppl 4):16-20.
[3]Group EBCTC.Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival:an overview of the randomised trials[J].Lancet,2005,365(9472):1687-1717.
[4]PaganiO,Regan MM,Walley BA,et al.Adjuvant exemestane with ovarian suppression in premenopausal breast cancer[J].The New England Journalof Medicine,2014,371(2):107-118.
[5]Francis PA,Regan MM,Fleming GF,et al.Adjuvant ovarian suppression in premenopausal breast cancer[J].The New England Journalof Medicine,2015,372(5):436-446.
[6]Gelber RD,Aebi S.Endocrine therapy plus zoledronic acid in premenopausal breast cancer[J].The New England Journal of Medicine,2009,360(22):2367,2369-2370.
[7]McDonald Wade S,Hackney MH,Khatcheressian J,et al.Ovarian suppression in the management of premenopausal breast cancer:methods and efficacy in adjuvant and metastatic settings[J].Oncology,2008,75(3-4):192-202.
[8]Jonat W,Kaufmann M,Sauerbrei W,et al.Goserelin versus cyclophosphamide,methotrexate,and fluorouracil as adjuvant therapy in premenopausal patients with node-positive breast cancer:The Zoladex Early Breast Cancer Research Association Study[J].Journalof ClinicalOncology,2002,20(24):4628-4635.
[9]Cheer SM,Plosker GL,Simpson D,et al.Goserelin:a review of its use in the treatment of early breast cancer in premenopausal and perimenopausalwomen[J].Drugs,2005,65(18):2639-2655.
[10]Castiglione-Gertsch M,O'Neill A,Price KN,et al.Adjuvant chemotherapy followed by goserelin versus either modality alone for premenopausal lymph node-negative breast cancer:a randomized trial[J].Journal of the National Cancer Institute,2003,95(24):1833-1846.
[11]Baum M,Hackshaw A,Houghton J,et al.Adjuvant goserelin in pre-menopausalpatients with early breast cancer:Results from the ZIPP study[J].Eur J Cancer,2006,42(7):895-904.
[12]Massarweh S,Schiff R.Unraveling the mechanisms of endocrine resistance in breast cancer:new therapeutic opportunities[J].Clinicalcancer research:an officialjournalofthe American Association for Cancer Research,2007,13(7):1950-1954.
[13]RastelliF,Crispino S.Factors predictive of response to hormone therapy in breast cancer[J].Tumori,2008,94(3):370-383.
[14]Cuzick J,Ambroisine L,Davidson N,et al.Use of luteinising-hormone-releasing hormone agonists as adjuvant treatment in premenopausal patients with hormone-receptor-positive breast cancer:a meta-analysis of individual patient data from randomised adjuvant trials[J].Lancet,2007,369(9574):1711-1723.
[15]Coates AS,Winer EP,Goldhirsch A,et al.Tailoring therapies--improving the management of early breast cancer:St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015[J].Annals of oncology:official journal of the European Society for Medical Oncology/ESMO,2015,26(8):1533-1546.
[16]陈建彬,王蓓,高秀飞.激素受体阳性乳腺癌预后影响因素分析[J].浙江医学,2015,37(5):367-370.
[17]殷文瑾.乳腺癌术后复发风险时间分布规律研究[J].实用肿瘤杂志,2007,6(22):527-531.
[18]江泽飞.乳腺癌内分泌治疗十个热点问题的思考[J].中华外科杂志,2015,12(53):895-900.
