三种常见边坡植物对模拟干旱环境抗旱性能的研究
2018-03-04许翩翩王建柱三峡大学生物与制药学院湖北宜昌443002
许翩翩,王建柱(三峡大学生物与制药学院,湖北 宜昌 443002)
干旱是影响植物和农作物生长和发育的重要逆境因子[1],是导致植物体内缺水而引起的形态、生理生化特征,及一系列酶发生变化的重要因素[2]。而植物在干旱条件下生理生化指标的变化是植物学家和生态学家研究的热点和重点。缺水和土地贫瘠是边坡生态修复的限制问题,尤其是西南干热河谷地区。因此科学筛选抗旱植物是水电边坡生态修复成功的关键和前提。植物的抗旱性是其在干旱环境下生长和繁殖的必要条件,是多种因素综合作用的结果[3]。虽然目前有众多的研究成果,但是对植物抗旱生理生化特征的系统研究有所欠缺[4],对干热河谷地区边坡生态修复植物,仅停留在单一植物的抗旱性研究,同时对相同环境下不同植物抗旱性差异研究较少。
随着社会发展的需要,清洁能源的选择已成为环境保护的一条捷径,目前西部地区正在建设白鹤滩、乌东德等一系列水电工程[5];地处亚热带季风气候区,具云南高原气候及四川盆地气候特点,兼具干旱河谷的生态特征[6]。水电工程扰动区生态环境十分恶劣,对后期土壤物理结构、土壤肥力、地下水路径、地表覆盖破坏非常严重,导致植被的生态恢复难度加大[7]。而维持边坡植物多样性是保护水环境安全的重要措施,是防止水土流失的必要手段[8]。但针对干热河谷环境,水电边坡植被恢复的专门性研究工作尚未取得实质性进展[9]。因此,研究生态修复边坡植被的生态适应性,筛选出既抗旱又耐贫瘠、适于多变条件下裸露边坡环境生长的最佳植物尤为重要。本研究从水电工程扰动区的角度出发,通过模拟水电边坡不同水分特征,从种子萌发率、萌发指数特性、植物净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)、水分利用效率(WUE:Pn/Tr)、丙二醛、脯氨酸和可溶性糖参数,探究香根草(Vetiveriazizanioides)、紫花苜蓿(Medicagosativa)和高羊茅(Festucaelata)在干旱胁迫下的各项生化指标,揭示其耐旱机理和抗旱能力,以期为水电工程边坡的先锋植物筛选、植被恢复建设提供技术和理论支撑。
1 材料与方法
1.1 实验地点和时间
实验地点为湖北省宜昌市三峡大学生态学试验中心(111°18′64″ E,30°43′44″ N),种子萌发实验和植物幼苗抗旱胁迫实验于2016年3月2日开展,其中种子萌发实验历时一个月,植物幼苗抗旱胁迫实验历时3个月。
1.2 实验材料和方法
种子萌发实验:实验所需种子均采购于成都苗木基地,分别挑选大小均匀、无损伤、颗粒饱满的香根草、紫花苜蓿和高羊茅种子各750粒,用0.1%的高锰酸钾溶液消毒处理30 min,反复用蒸馏水洗净后浸种3 h;放入3层滤纸的培养皿中,每皿放入种子50粒,将培养皿分成5组,各组培养液浓度梯度分别设置为0%、5%、10%、15%、20%的聚乙二醇(PEG)溶液,每组设置3个重复,即每种植物5个梯度15组培养皿,3种植物共计45组培养皿。同时在4组培养皿中每天定时定量加入等量的PEG溶液模拟干旱胁迫,0%组中加入等量的蒸馏水;放置在光周期为14 h/10 h(昼/夜),温度25 ℃、湿度60%的人工光照培养箱中进行种子萌发实验,观察记录种子的萌发数量和萌发天数。
植物幼苗的培育:选用大小均匀、无损伤、颗粒饱满的香根草、紫花苜蓿和高羊茅种子各400粒,栽培环境选用等量工程边坡常见的灰褐土,粉碎混匀后装入盆口直径18 cm,高15 cm的塑料盆中,每盆播种10粒,每种植物播种40盆,3种植物共计120盆,播种前在土壤上表面铺一层塑料薄膜,待发芽后在种芽处撕开小口使种芽正常生长,以此减少土壤蒸发失水;放入植物实验大棚内,定期浇水,予以正常的管理。培育一周后每盆保留生长健壮高度相近的2株植株幼苗(苗长10~20 cm)进行后续实验。
模拟干旱实验:分别将香根草、紫花苜蓿和高羊茅幼苗随机分为4组,每10盆作为一组,CK组为对照组(正常水分),土壤含水量为田间相对持水量的75%~80%,其余T1、T2、T3三组为65%~70%(轻度干旱胁迫)、50%~55%(中度干旱胁迫)、35%~40%(重度干旱胁迫),同时设置一盆装土无苗塑料盆作为对照。实验采取称重法控制盆中土壤含水量,每天定时对盆栽进行称重、补水直至形成干旱胁迫水分梯度。保持设置的水分梯度15 d后,选取待测植株从顶至下第3片或第4片健康成熟叶片,测定前,先用饱和光对植物进行30 min的光诱导,测定时将叶室温度设为25 ℃,饱和光强控制在1000 μmol·m-2·s-1,CO2浓度控制在400 μmol·mol-1,采用Li-6400便携式光合分析仪分别测定相应幼苗叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)参数值;并计算植物水分利用效率(WUE:Pn/Tr);每一植物的不同处理水平随机选取3盆植株重复测定3次。
生理生化特性的测定:前期的植株培养及实验处理与光合参数测定的方法相同,生化指标的测定每一植物的不同处理水平随机选取3盆植株。选取丙二醛、脯氨酸和可溶性糖3组生理生化指标进行测定。采用硫代巴比妥酸(TBA)法测定各处理的丙二醛含量,采用茚三酮法测定各处理的脯氨酸含量,采用蒽酮法测定各处理的可溶性糖含量[10]。
1.3 数据处理与统计分析
萌发指标计算:从种子置于培养皿起开始观察,种子萌发情况,连续3 d萌发数均不足总实验种子数的1%时,认为种子萌发结束。同时计算各组种子的发芽率和发芽指数,公式如下:
萌发率=(n/N)×100%
萌发指数=∑(Gt/Dt)
式中,n为萌发种子总的个体数,N为初始选用总的种子数,Gt为第t天萌发的种子数,Dt为相应的萌发天数。为消除各物种间基础性状的差异,对参与分析的性状指标均采用其相对值,即干旱胁迫下的指标值除以对照组指标值的百分数[11]。
隶属函数值的计算:分别计算出3种种子在干旱胁迫下10项指标(萌发率、萌发指数、净光合速率、蒸腾速率、胞间CO2浓度、气孔导度、水分利用效率、丙二醛含量、脯氨酸含量、可溶性糖含量)的隶属函数值。计算公式:X=(X0-X2)/(X3-X2)。式中:X0表示某一干旱指标的测定值,X2和X3分别表示在此干旱指标下的最小值和最大值。对其进行综合评价,如果为负相关,则用反隶属函数进行转换,计算公式为:X=1-(X0-X2)/(X3-X2),最后把每种植物各项指标的隶属函数值累加平均,根据平均值大小确定其抗旱性强弱。
最后以干旱胁迫梯度为自变量,以种子的相对萌发率和相对萌发指数、光合及生化指标等为因变量进行单因素方差分析,设定显著性水平α=0.05;分析各指标对于干旱胁迫的响应机制,对不同物种的各项指标进行隶属函数分析比较其抗旱性能。所有实验数据均采用Excel 2003、SPSS 17.0进行统计和分析。
2 结果与分析
2.1 三种植物10个指标的测定结果
种子萌发率实验结果表明(表1),一定浓度的聚乙二醇(PEG)胁迫处理,可抑制种子萌发,通过PEG处理的香根草、紫花苜蓿和高羊茅种子,具有一定的延缓萌发现象,且随着PEG胁迫强度的增加各种子的萌发率显著降低。在不同PEG浓度胁迫条件下,各种子相对萌发率不同。3个物种在不同PEG浓度处理下种子萌发率均有显著降低(P<0.05),各物种相对萌发率香根草>高羊茅>紫花苜蓿。
种子萌发指数结果表明(表2),随PEG浓度的增加,各种子萌发指数逐渐下降。3个物种在5%、10%、15%和20% PEG处理下相对萌发指数较对照组均有所下降;随着干旱胁迫强度的增加,种子吸胀速度逐渐下降,种子萌发速率逐渐降低。

表1 不同PEG浓度下香根草、紫花苜蓿和高羊茅种子相对萌发率的变化Table 1 Changes of V. zizanioides, M. sativa and F. elata seed relative germination rate under different PEG concentrations

表2 不同PEG浓度下香根草、紫花苜蓿和高羊茅种子相对萌发指数的变化Table 2 Changes in the relative germination index of V. zizanioides, M. sativa and F. elata seeds under different PEG concentrations
注:*P<0.05;**P<0.01。同列不同字母表示差异显著,下同。
Note: *P<0.05;**P<0.01. Different lowercase letters within the same column mean significant difference. The same below.
3种植物叶片净光合速率的变化研究表明(图1),在不同干旱胁迫条件下,随着干旱胁迫程度的增加,3个物种的净光合速率逐渐下降。干旱胁迫越严重,3个物种叶片净光合速率降低的幅度越大,且不同水分供应条件对叶片净光合速率的影响不同。随着干旱胁迫程度的加重,3种植物的Pn均呈显著下降的趋势,与对照组相比其Pn依次下降了86.68%、81.89%、86.65%。不同土壤水分条件对3种植物的光合能力均有明显抑制作用,随着干旱胁迫的加剧,光合作用显著减弱;轻度干旱胁迫对高羊茅光合能力无明显抑制作用,中、重度土壤干旱均明显抑制其Pn;在不同土壤水分处理时,紫花苜蓿的Pn最终降低幅度最小。
3种植物叶片蒸腾速率的变化研究显示(图1), 随着土壤干旱胁迫的加剧,3个物种的叶片蒸腾速率(Tr)均出现不同程度的下降趋势。对比3种植物在同一水平的蒸腾速率,正常土壤水分水平蒸腾速率紫花苜蓿>高羊茅>香根草。香根草在各个水分处理水平间差异显著,紫花苜蓿的蒸腾速率在轻、中度干旱胁迫时差异不显著,高羊茅在轻度干旱处理较对照组差异不显著(P>0.05)。高羊茅蒸腾速率下降幅度较其他两种植物稍小,且在轻度干旱时其蒸腾速率变化不显著,表明紫花苜蓿对于轻中度干旱具有一定适应性,高羊茅对于重度干旱环境更具有优势。
3种植物叶片胞间CO2浓度(Ci)的研究显示(图1),对比3种植物在同一水平处理下,叶片胞间CO2浓度在CK组,高羊茅>紫花苜蓿>香根草,在T3组紫花苜蓿>高羊茅>香根草。3种植物的胞间CO2浓度变化随着干旱梯度的变化出现不同的差异,整体上轻度干旱较对照相比均出现下降趋势,中度和重度干旱下香根草和高羊茅继续下降,且香根草在中度和重度干旱时差异不显著(P>0.05);表明其受到气孔限制较强,紫花苜蓿的Ci浓度在中度和重度干旱时出现增加趋势,且在重度干旱时的Ci值高出对照组3.89%,且中度和重度干旱时无显著差异,表明紫花苜蓿在轻度干旱处理时,光合作用可能受到了气孔的限制,而中度和重度干旱时受非气孔限制。
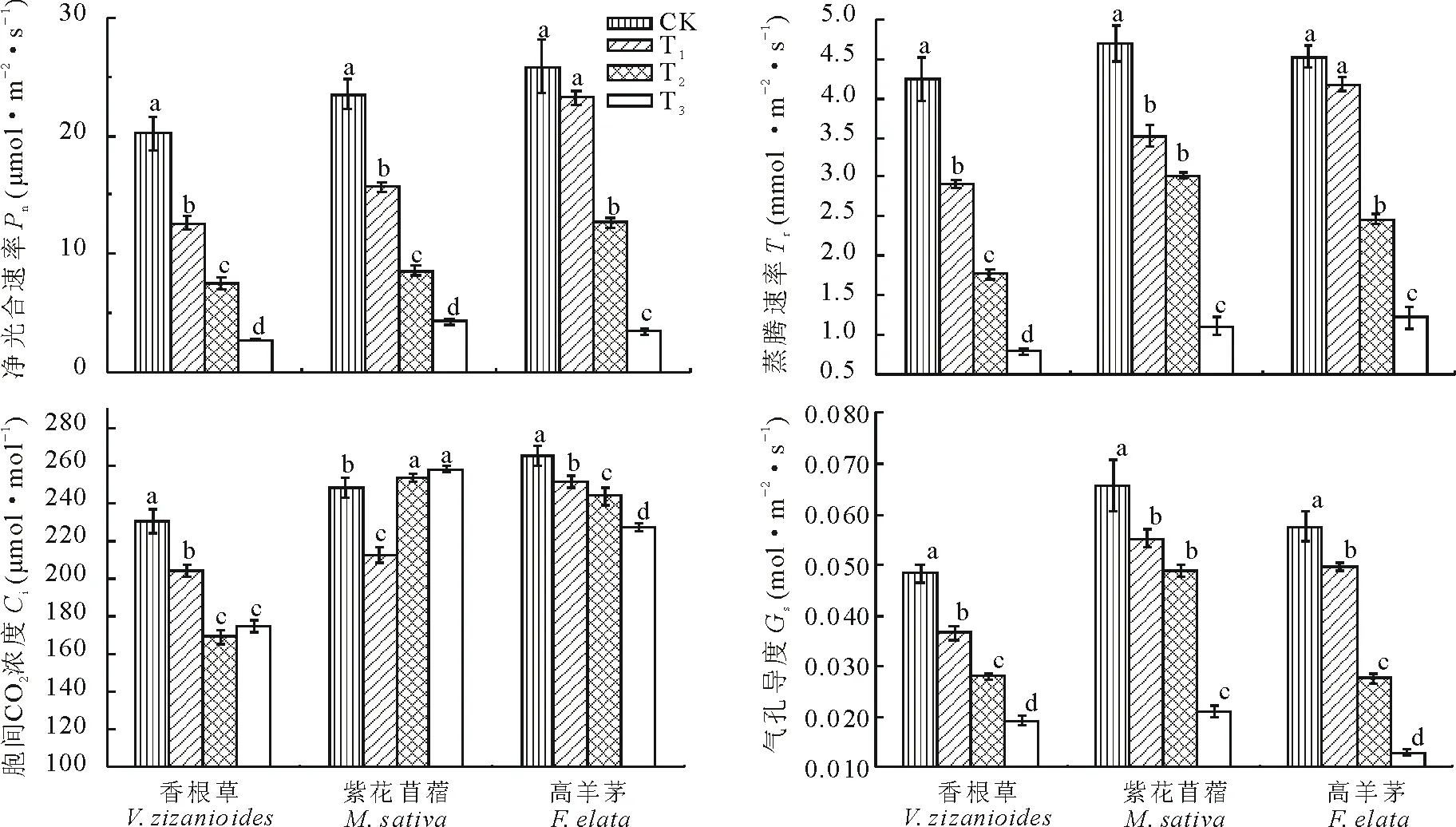
图1 不同干旱胁迫下3种植物叶片净光合速率、蒸腾速率、胞间CO2浓度、气孔导度的变化Fig.1 Changes of net photosynthetic rate (Pn), transpiration rate (Tr), intercellular CO2 concentration (Ci) and stomatal conductance (Gs) in leaves of the three plants under different drought stress不同字母表示差异显著(P<0.05),下同。 Different lowercase letters mean significant difference (P<0.05). The same below.
3种植物叶片气孔导度的变化研究表明(图1),随着土壤含水量的减少,3种植物的气孔导度呈逐渐下降趋势,土壤重度失水条件下,分别较对照组下降了60.00%,72.24%和77.46%;3种植物中香根草的气孔导度下降幅度最小。对比3种植物在同一水平的叶片气孔导度,在CK组高羊茅>紫花苜蓿>香根草,在T3组紫花苜蓿>香根草>高羊茅。香根草、紫花苜蓿和高羊茅在不同干旱胁迫条件下,叶片的气孔导度均显著降低(P<0.05),随着干旱程度的加重气孔导度下降越显著;香根草和高羊茅在不同梯度干旱胁迫条件下叶片的气孔导度差异显著(P<0.05);紫花苜蓿的气孔导度在轻度和中度干旱时较对照组显著降低但二者间差异不显著(P>0.05)。干旱条件的加剧均使不同植物的气孔活动程度明显降低,但3种植物间对此作出的反应不同,香根草降低的幅度最小。
3种植物水分利用效率的变化表明(图2),随着干旱胁迫的加剧,香根草、紫花苜蓿和高羊茅的叶片水分利用效率有不同程度的降低。对比3种植物在同一水平的水分利用效率,在CK组高羊茅>香根草>紫花苜蓿,在T3组紫花苜蓿>香根草>高羊茅。香根草、紫花苜蓿和高羊茅在各干旱处理水平下,水分利用效率均显著降低(P<0.05)。高羊茅在轻度干旱时其叶片水分利用效率较对照组无显著变化,紫花苜蓿在轻度和中度干旱时,水分利用效率的差异不显著(P>0.05)。正常供水情况下香根草、紫花苜蓿和高羊茅叶片水分利用效率相近,在同等干旱条件下紫花苜蓿的水分利用效率均优于其他两种植物,且随着干旱的加重,紫花苜蓿的水分利用效率降低幅度,均低于其他两种植物,出现这一变化的原因与紫花苜蓿受到的非气孔限制有关。
3种植物叶片丙二醛(MDA)含量变化研究表明(图2),植物在逆境胁迫条件下其细胞会产生相应的膜脂过氧化反应,最终产物即丙二醛。丙二醛含量在一定程度上反映出植物细胞膜系统受伤害的程度。植物丙二醛含量增幅越小,其抗旱性就越强,反之其抗旱性就越弱。随着土壤干旱胁迫程度的加大,香根草、紫花苜蓿和高羊茅的MDA含量均逐渐上升。香根草、紫花苜蓿和高羊茅的MDA含量随干旱胁迫的加重均出现较快增长,重度干旱胁迫下MDA含量分别是对照组的2.85,2.51和2.04倍。3种植物在干旱胁迫处理时其叶片MDA均上升且差异显著(P<0.05)。当土壤干旱胁迫加剧时,香根草细胞质膜过氧化反应程度加大,细胞膜受损程度不断加深。3种植物受干旱胁迫时,叶片MDA变化幅度香根草>紫花苜蓿>高羊茅。

图2 不同干旱胁迫下3种植物叶片水分利用效率、丙二醛、脯氨酸、可溶性糖含量的变化Fig.2 Water use efficiency, MDA, proline and soluble sugar content in the leaves of the three plants under different drought stress
3种植物叶片脯氨酸(Pro)含量变化研究表明(图2),随着土壤水分含量的降低,香根草、紫花苜蓿和高羊茅叶片脯氨酸含量呈上升趋势,各植物不同组分之间变化有一定的差异。3种植物叶片脯氨酸含量在各胁迫处理中均高于对照组,在轻度干旱胁迫时Pro含量分别是对照组的1.41,1.67和1.27倍,在中度干旱胁迫时Pro含量分别是对照组的3.22,3.02和2.85倍,在重度干旱胁迫时Pro含量分别是对照组的3.58,5.19和4.23倍。在各胁迫处理下,紫花苜蓿对脯氨酸的积累显著高于其他两种植物。香根草、紫花苜蓿和高羊茅叶片脯氨酸含量随干旱胁迫的加剧显著上升(P<0.05),但各植株内部随梯度变化具有一定差异。香根草植物体内脯氨酸的积累量随着干旱胁迫程度的逐渐加重而持续显著增加,但在中度和重度干旱胁迫时增加不显著。紫花苜蓿叶片内Pro含量在不同干旱梯度下显著上升,植物以此来调节体内渗透平衡,对干旱环境作出明显反应,高羊茅在轻度干旱时叶片脯氨酸含量较对照组无显著差异,但随着干旱加剧Pro含量增加显著。在轻度和中度干旱时香根草、紫花苜蓿和高羊茅的脯氨酸含量均会显著增加,以保障植物的渗透平衡从而使植物能获得正常供水,而当干旱条件进一步加剧达到重度干旱时,香根草叶片内脯氨酸积累减缓使得植物无法获得正常供水。
3种植物叶片可溶性糖含量变化研究显示(图2),3种植物可溶性糖含量随干旱胁迫程度加剧呈增加趋势,但增加趋势不同。3种植物叶片可溶性糖含量在各胁迫处理下,均高于对照组,仅高羊茅在轻度干旱时其含量较对照组有小幅下降,在中度干旱胁迫时可溶性糖含量分别是对照组的2.26,3.39和1.99倍,在重度干旱胁迫时可溶性糖含量分别是对照组的3.05,5.22和3.10倍。对比发现紫花苜蓿对可溶性糖含量的增加幅度要显著高于其他两种植物。香根草、紫花苜蓿和高羊茅叶片在不同土壤水分处理下,可溶性糖含量均呈显著上升趋势(P<0.05)。在轻度干旱处理下,香根草叶片可溶性糖含量与对照组差异不显著(P>0.05),而中度和重度干旱时可溶性糖含量急剧增加,与对照组差异显著(P<0.05); 紫花苜蓿叶片可溶性糖含量随干旱梯度的增加出现显著性的变化(P<0.05);高羊茅轻度干旱处理下叶片可溶性糖含量与对照组相比无差异且出现下降趋势,这可能是轻度干旱未能诱发可溶性糖作出应激反应所致。通过不同程度上可溶性糖的积累,香根草、紫花苜蓿和高羊茅都可实现体内渗透调节的平衡;但高羊茅调节能力更强,对严重干旱环境具有更强抗性。
2.2 隶属函数表征法对3种植物抗旱性分析
通过隶属函数法,对3种植物各项抗旱指标进行了综合评价表明(表3),3种植物抗旱性强弱。香根草、紫花苜蓿和高羊茅分别为0.470、0.497和0.491,3种植物均对干旱胁迫具有一定适应性,整体来看紫花苜蓿的抗旱性更强,高羊茅次之,其次为香根草。
3 讨论
3.1 三种植物种子萌发情况分析

表3 香根草、紫花苜蓿和高羊茅抗旱能力综合评价Table 3 Comprehensive evaluation of V. zizanioides, M. sativa and F. elata drought resistance
种子吸水不足是使其活力下降,种子相应发芽势和萌发指数下降重要因素。随着干旱程度增加,种子活力逐渐减弱。因此种子萌发率和萌发指数可直接反映植物生物量的多少。然而用相对萌发率评价植物种子萌发期的抗旱性,又可避免不同基因型种子在正常条件(对照)下萌发率差异对试验结果的影响,能客观鉴定干旱胁迫条件下待测种子的萌发水平,评价种子萌发期的抗旱性[12]。朱慧等[13]在研究五爪金龙(Ipomoeacairica)种子的萌发中发现,水分的缺失使得种子的吸水不足,随着干旱胁迫的延迟,不仅萌发率受到抑制,萌发指数也受到影响;随着干旱程度的加剧,现象愈加显著。
聚乙二醇(PEG)是一种具有很强亲水性的惰性高分子聚合物,在种子萌发早期阶段它能有效减缓水分进出种子的速率。有研究表明,一定浓度的PEG胁迫能刺激植物种子活性的提高,当超过植物种子对干旱胁迫的忍受限度时,种子就不能萌发。本研究表明随着PEG浓度的增加,3种植物的萌发率均出现显著下降趋势。比较3种草本可以看出低浓度的PEG胁迫对香根草的种子萌发具有引发作用,从而使得5%处理水平的萌发率明显高于对照组,这与刘杰等[14]、焦树英等[15]、荣秀连等[16]、于军等[17]的研究发现相符。
3.2 净光合速率、蒸腾速率与植物抗旱性的关系
光合作用是一切代谢活动的基础,净光合速率(Pn)直接反映了单位叶面积单位时间能量和物质的积累量,它是衡量植物生物生产量水平的最直接指标。在干旱胁迫下,气孔限制和非气孔限制是引起植物叶片光合效率降低主要原因[18]。植物受到干旱胁迫时,为了减少蒸腾,会限制叶片伸展、触发气孔关闭,同时也会减少CO2摄取量、增加叶肉细胞相对阻力,进一步抑制Pn;当受到干旱胁迫时,植物叶片光合色素的合成、光合作用过程中相关酶活性也会受到一定抑制,从而导致Pn下降。使碳同化速率降低,导致光能过剩和光合作用光抑制,甚至造成不同程度的光氧化与光破坏,最终演变成非气孔因子起主导作用[19]。王琰等[20]发现当油松(Pinustabulaeformis)受到干旱胁迫时,Pn、蒸腾速率(Tr)、气孔导度(Gs)、水分利用效率(WUE)均受到抑制。与本研究中随着干旱胁迫程度的加重3种植物的净光合速率均显著降低相符。
蒸腾速率既是水分通过叶片气孔向外界失水的过程同时又是植物被动吸水的动力,是一种复杂的生理代谢活动。它可以调节植物的水分平衡,调节自身水分损耗的能力,体现在不同环境中植物的实际耗水能力,是植物固有的生理特性。研究发现3种植物的叶片蒸腾速率随着干旱程度的加剧均出现不同程度的下降。香根草在各个干旱处理水平下,呈显著下降,紫花苜蓿在轻、中度干旱胁迫时下降不显著,高羊茅在轻度干旱处理下与对照组相比无明显变化。本研究中高羊茅变化趋势与宋玉伟等[21]、陈家宙等[22]研究相符。
3.3 胞间CO2浓度、气孔导度及水分利用率与植物抗旱性的关系
3种植物的胞间CO2浓度(Ci)随着干旱胁迫的增加差异明显,3种植物中轻度干旱导致较对照相比均表现为下降趋势,均表现为气孔限制。通过多年的进化,植物体在干旱条件下为了维持生存,叶片的气孔也发挥着举足轻重的作用。气孔导度下降是植物对干旱胁迫的最早反应[23]。香根草和紫花苜蓿在重度干旱时,Ci值反而出现显著增加,表明这两种植物在轻度干旱处理下,光合作用会受气孔一定的限制,而中度和重度干旱时受非气孔限制。Farquhar 等[24]认为:如果气孔因素限制占主导,那么植物净光合速率的下降会伴随着胞间二氧化碳浓度的下降。如果非气孔因素限制占主导,那么植物净光合速率的下降就会伴随着胞间二氧化碳浓度出现上升现象。
气孔导度是反映气孔开度的一个重要指标[25]。在水分胁迫下导致光合速率和蒸腾速率下降的主要原因是气孔关闭。干旱胁迫主要是通过气孔和非气孔因素抑制植物的光合作用[26],气孔导度的下降,导致胞间二氧化碳浓度的降低,而非气孔因素,导致胞间二氧化碳浓度的升高。因此在干旱胁迫下气孔导度的降低是导致净光合速率降低的主要原因[27]。香根草、紫花苜蓿和高羊茅叶片的气孔导度均随着干旱程度的加重气孔导度下降显著。香根草和高羊茅在不同干旱胁迫处理下差异明显,紫花苜蓿的气孔导度在轻度和中度干旱时较对照组显著降低,但二者间无显著差异。与左应梅等[28]研究表明木薯(Cassava)的气孔导度受到土壤水分的影响相符。
3.4 水分利用率及丙二醛含量与植物抗旱性的关系
水分的充足与否是影响植物水分利用效率最重要的环境因子[29]。水分过多,往往会导致植物水分利用效率下降。而在一定程度的干旱胁迫下,植物的水分利用效率会提高[30]。研究表明随着生境沿湿地、滩地、固定沙丘至流动沙丘,由湿到干的不同水分供应等级,植物的水分利用效率(WUE)呈现升高的趋势。同时,干旱胁迫下拥有较高WUE的植物具有更高生产力和生存能力[31]。叶片蒸腾作用是植物耗水的主要形式,水分利用效率是评价植物耐旱能力的重要指标之一,反映了作物生产过程中单位水分的能量转化效率,受蒸腾速率和光合速率共同影响[32]。干旱引起气孔导度下降,CO2反应受阻,导致叶片光合能力降低,作物通过提高叶片水分利用效率来适应这种逆境[33],水分胁迫对作物光合作用的严重影响,最终导致作物生物量下降[34]。随着干旱胁迫的加剧,3种植物叶片水分利用效率不同程度的降低。紫花苜蓿的水分利用效率下降幅度最低,较其他两种植物利用效率要高。
丙二醛(MDA)含量的变化是脂膜损伤程度的重要标志之一。在干旱胁迫下,植物细胞内活性氧代谢的平衡被破坏,导致产生大量的活性氧。活性氧的毒害之一是加剧膜脂过氧化作用,造成细胞系统的损伤。而在膜脂过氧化作用中,抗旱性强的植物MDA含量增加相对较慢,其含量越高表明植物抗旱能力越差。也有研究指出[35],当外界环境对植物的胁迫程度较轻时,植物体内的保护酶协同作用保持脂质过氧化程度处于较低水平,一旦超过了其耐受的极限,酶活性会受到极大抑制,导致脂质过氧化产物MDA的大量产生。3种植物在干旱胁迫处理时其叶片MDA均上升且差异显著。当干旱胁迫加剧时,香根草细胞质膜过氧化反应程度加大,细胞膜受损程度不断加深,3种植物中高羊茅的MDA变化幅度最小。Jinmin 等[36]对表土和全土壤干旱下的高羊茅进行研究,发现全土壤干旱下,植株的相对含水量和叶绿素含量以及地上生物量均明显下降,丙二醛(MDA)含量明显上升,这表明在干旱严重情况下,特别是全土壤干旱,一些抗氧化性的酶活性受到了抑制,加速了膜脂过氧化而使MDA的含量升高。
3.5 脯氨酸及可溶性糖含量与植物抗旱性的关系
脯氨酸在植物细胞中主要起渗透调节作用。叶片脯氨酸含量增加,可提高细胞的溶质含量,增强其渗透调节能力。在干旱胁迫下,植物可在细胞中通过主动积累溶质来降低渗透势,这种溶质可分为两类,一类是从环境吸收进入细胞的无机盐,如K+、Na+、Mg2+、Ca2+等;另一类是细胞中合成的小分子有机物质,如可溶性糖、游离脯氨酸等[37]。现普遍发现植物在逆境条件下就会积累过量的脯氨酸,认为脯氨酸能起缓冲保护作用,或者作为保护细胞质酶类和膜,使处于逆境条件下的植物体不易受到伤害。因而可以用脯氨酸含量增加的比例作为评价指标。赵法等[38]发现猪毛菜(Salsolaarbucula)、Guo等[39]发现小麦(Triticumaestivum)以及Ramana等[40]发现大豆(Glycinemax)受到干早胁迫时,体内Pro作为最重要的渗透调节物质含量均会迅速上升,避免了膜系统进一步受到损害。因而3种植物的脯氨酸含量随干旱胁迫的增强均表现出显著上升趋势,紫花苜蓿叶片的脯氨酸含量增加的比例最大,因此在细胞适应性代谢调节的能力上表现为最强。与孙彦等[41]研究草地早熟禾(Poaannua)与多年生黑麦草(Loliumperenne)的干旱胁迫研究中发现,游离脯氨酸含量的高低能反映出植物抗早性的强弱相符。
可溶性糖是参与调节渗透胁迫的小分子物质,渗透调节是植物适应干旱胁迫的主要生理机制。在植物对干旱胁迫的适应性调节中,是增加渗透性溶质的重要组成成分[42]。干旱胁迫下植物体能够通过自身代谢调控积累一些有机小分子物质调节渗透胁迫。可溶性糖含量的高低能够在一定程度上反映植物对逆境胁迫的耐受性。表明干旱胁迫时,植物通过生理代谢使得细胞质可溶性糖大量积累,使渗透势降低,细胞液浓度上升,防止细胞过度脱水,增强植物抗旱性。研究结果显示紫花苜蓿的脯氨酸和可溶性糖增量最显著,其次是高羊茅。这与李波等[43]、宋淑明[44]对紫花苜蓿的研究结果一致。所以干旱胁迫条件下,植物叶内可溶性糖含量的多少,是判断其自身抗逆适应性强弱的重要指标。
3.6 抗旱指标评价的选择
研究发现植物在干旱胁迫下,其耐旱的生理反应与其适应性可以通过多个指标进行评定,如运用数学的方法对与植物抗旱性相关的各个指标进行综合评价分析。从而避免单一指标都有一定的片面性。如张建国等[45]在研究我国北方主要植物耐旱性机理时,应用此种方法综合分析比较,从而得出可靠的判断。靳军英等[46]则应用此种方对牛鞭草(Hemarthriaaltissima)、高丹草和拉巴豆的耐旱性进行了准确的排序。
4 结论
1)干旱胁迫导致香根草、紫花苜蓿和高羊茅种子萌发数量减少、种子萌发活力下降,且随着干旱胁迫的加剧,受到影响程度逐渐加大。低浓度PEG胁迫对香根草种子的萌发具有引发作用,随PEG浓度的增加紫花苜蓿和高羊茅种子的相对萌发率逐渐降低。
2)干旱胁迫导致香根草、紫花苜蓿和高羊茅净光合速率、蒸腾速率、胞间CO2浓度、气孔导度和水分利用效率不同程度的下降。香根草的净光合速率、蒸腾速率和胞间CO2浓度下降最为显著,高羊茅的气孔导度和水分利用效率下降最为显著。
3)随着干旱胁迫的增加香根草、紫花苜蓿和高羊茅的丙二醛、脯氨酸和可溶性糖均显著增加。香根草叶片丙二醛含量增加最为显著,高羊茅增幅最小;紫花苜蓿叶片脯氨酸和可溶性糖含量增加最为显著,对干旱胁迫表现出更强的响应,香根草叶片脯氨酸和可溶性糖含量增幅较其他两种植物低,对干旱胁迫响应能力较差。
4)综合分析3种植物种子的萌发率、萌发指数、光合及生理生化等多个单项指标,运用隶属函数平均值法来鉴定3种边坡植物的抗旱性。紫花苜蓿的抗旱性最强,高羊茅次之,香根草较差。
References:
[1] Sun X Z, Zheng C S, Wang X F. Advances of drought tolerant mechanism in woody plant. Acta Botanica Boreali-Occidentalia Sinica, 2007, 27(3): 629-634.
孙宪芝, 郑成淑, 王秀峰. 木本植物抗旱机理研究进展. 西北植物学报, 2007, 27(3): 629-634.
[2] Yao J, Yu X Y, Qiu S,etal. Progress in research of drought resistance mechanism in plants. Acta Agriculturae Boreali-Sinica, 2007, 22(S1): 51-56.
姚觉, 于晓英, 邱收, 等. 植物抗旱机理研究进展. 华北农学报, 2007, 22(S1): 51-56.
[3] Sun C X, Shen X Y. Advances in studies on identification indexes and methods of quantitative analyses for crop drought resistance. Chinese Agricultural Science Bulletin, 2002, 18(1): 49-51.
孙彩霞, 沈秀瑛. 作物抗旱性鉴定指标及数量分析方法的研究进展. 中国农学通报, 2002, 18(1): 49-51.
[4] Zhuang L, Chen Y N, Chen M,etal. Evaluation on the drought-resistant capability of the riparian desert vegetation along the tarim river, Xinjiang. Arid Land Geography, 2005, 28(3): 367-372.
庄丽, 陈亚宁, 陈明, 等. 模糊隶属法在塔里木河荒漠植物抗旱性评价中的应用. 干旱区地理, 2005, 28(3): 367-372.
[5] Wang C H, Zeng C H, Shen D S,etal. Climatic effects of the artificial reservoir of China’s dry-hot valleys on the growth and physiological traits ofDodonaeaviscosaseedlings. Acta Ecologica Sinica, 2016, 36(17): 5343-5352.
王传华, 曾春函, 沈德嵩, 等. 云南干热河谷水库气候效应对车桑子幼苗生长发育的影响及其作用机制. 生态学报, 2016, 36(17): 5343-5352.
[6] China Hydropower Consulting Group Zhongnan survey and Design Institute. The Jinsha River Xiangjiaba hydropower station of soil and water conservation plan. 2006, 4.
中国水电顾问集团中南勘测设计研究院. 金沙江向家坝水电站水土保持方案报告书. 2006, 4.
[7] Dong Z R. Ecological stress of water conservancy projects. Water Resources and Hydropower Engineering, 2003, 34(7): 1-5.
董哲仁. 水利工程对生态系统的胁迫. 水利水电技术, 2003, 34(7): 1-5.
[8] Tan S H, Wang Y M. Research progress and thinking of bioengineering techniques for slope protection in expressway. Research of Soil and Water Conservation, 2004, 11(3): 81-84.
谭少华, 汪益敏. 高速公路边坡生态防护技术研究进展与思考. 水土保持研究, 2004, 11(3): 81-84.
[9] Li S C, Sun H L. Developing trend and situations of technique to stabilize rock slope with vegetative cover in China. Resources Science, 2004, 26(S1): 61-66.
李绍才, 孙海龙. 中国岩石边坡植被护坡技术现状及发展趋势. 资源科学, 2004, 26(S1): 61-66.
[10] Jia X P, Deng Y M, Sun X B,etal. Impacts of salt stress on the growth and physiological characteristics ofPaspalumvaginatum. Acta Prataculturae Sinica, 2015, 24(12): 204-212.
贾新平, 邓衍明, 孙晓波, 等. 盐胁迫对海滨雀稗生长和生理特性的影响. 草业学报, 2015, 24(12): 204-212.
[11] Yao W C, Xiong J Y. Studies on wheat seed germination and seedling growth under the conditions of water deficitency. Journal of Anhui Agricultural Sciences, 2000, 28(5): 607-609, 617.
姚维传, 熊际友. 水分胁迫下皖麦品种种子萌发及幼苗生长差异性研究. 安徽农业科学, 2000, 28(5): 607-609, 617.
[12] Jing R L, Chang X P. Methods for identifying drought resistance at germination stage of wheat by osmotic stress. Journal of Plant Genetic Resources, 2003, 4(4): 292-296.
景蕊莲, 昌小平. 用渗透胁迫鉴定小麦种子萌发期抗旱性的方法分析. 植物遗传资源学报, 2003, 4(4): 292-296.
[13] Zhu H, Ma R J, Wu S T,etal. Seed germination and seedling growth of invasive weedIpomoeacairicaunder drought stress. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(2): 344-349.
朱慧, 马瑞君, 吴双桃, 等. 干旱胁迫对五爪金龙种子萌发与幼苗生长的影响. 西北植物学报, 2009, 29(2): 344-349.
[14] Liu J, Liu G S, Qi D M,etal. Effect of PEG on germination and active oxygen metabolism in wildrye (Leymuschinensis) seeds. Acta Prataculturae Sinica, 2002, 11(1): 59-64.
刘杰, 刘公社, 齐冬梅, 等. 聚乙二醇处理对羊草种子萌发及活性氧代谢的影响巨. 草业学报, 2002, 11(1): 59-64.
[15] Jiao S Y, Li Y Q, Sha Y I L T,etal. Seeds germination and seedling growth about 3Pennisetumornamentalgrasses under drought stress. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(2): 308-313.
焦树英, 李永强, 沙依拉·沙尔合提, 等. 干旱胁迫对3种狼尾草种子萌发和幼苗生长的影响. 西北植物学报, 2009, 29(2): 308-313.
[16] Rong X L, Wang B, Liu K,etal. Effects of drought simulated by PEG-6000 on cool-season turfgrass seed germination. Northern Horticulture, 2010, 32(8): 80-82.
荣秀连, 王波, 刘刊, 等. PEG-6000模拟干旱胁迫对冷季型草坪种子萌发特性影响. 北方园艺, 2010, 32(8): 80-82.
[17] Yu J, Jiao P P. Inhibition of seed germination ofAmmmopiptarcthusnanus(M. Pop.) Cheng f. under simulated drought stress with Polyethylene Glyco (PEG6000). Genomics and Applied Biology, 2010, 29(2): 355-360.
于军, 焦培培. 聚乙二醇(PEG-6000)模拟干旱胁迫抑制矮沙冬青种子的萌发. 基因组学与应用生物学, 2010, 29(2): 355-360.
[18] Winter K, Schromm M J. Analysis of stomatal and nonstomatal components in theenviron mental control of CO2exchanges in leaves of welwitschia mirabilis. Plant Physiology, 1986, 82: 173-1781.
[19] Zou Q, Meng Q W, Gao H Y,etal. Photosynthesis of Crops under Abiotic Sress. Jinan: Shandong Science and Technology Press, 2004: 116-192.
邹琦, 孟庆伟, 高辉远, 等. 作物在非生物逆境下的光合作用. 济南: 山东科学技术版社, 2004: 116-192.
[20] Wang Y, Chen J W, Di X Y. Characterization of the responses of photosynthetic and chlorophyll fluorescence parameters to water stress in seedlings of six provenances of Chinese Pine (PirrustabulaefornaisCarr.). Acta Ecologica Sinica, 2011, 31(23): 7031-7038.
王琰, 陈建文, 狄晓艳. 不同油松种源光合和荧光参数对干旱胁迫的响应特征. 生态学报, 2011, 31(23): 7031-7038.
[21] Song Y W, Zhao L Y, Yang J W. Analysis of photosynthesis and physiological characteristics of Maize seedling under soil water stress. Journal of Henan University, 2009, 39(4): 387-391.
宋玉伟, 赵丽英, 杨建伟. 水分胁迫下玉米幼苗光合变化和生理特性分析. 河南大学学报, 2009, 39(4): 387-391.
[22] Chen J Z, Lv G A, He Y Q. Effects of soil water status on gas exchange of peanut and early rice leaves. Chinese Journal of Applied Ecology, 2005, 16(1): 3630-3636.
陈家宙, 吕国安, 何圆球. 土壤水分状况对花生和早稻叶片气体交换的影响. 应用生态学报, 2005, 16(1): 3630-3636.
[23] Baker N R, Foyer C H, Mullineaux P M. Causes of photooxidative stress and amelioration of defense system in plants. BocaRaton: CRC Press, 1990: 127-130.
[24] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 18(2): 1-3.
[25] Kazuo Shinozaki. Gene expression and signal transduction in water-stress response. Plant Physiology, 1997, 115: 327-334.
[26] Cornic G. Drought stress inhibits photosynthesis by decreasing stomatal aperture-not by affecting ATP synthesis. Trends Plant Science, 2000, 5: 187-188.
[27] Dai G X, Peng K Q, Deng G F,etal. Effects of drought stress simulated by polyethlene glycol on Photosynthetic characteristics in low potassium tolerant rice seedlings. Chinese Journal of Rice Science, 2008, 22(1): 99-102.
戴高兴, 彭克勤, 邓国富, 等. 聚乙二醇模拟干旱对耐低钾水稻幼苗光合特性的影响. 中国水稻科学, 2008, 22(1): 99-102.
[28] Zuo Y M, Chen Q B, Deng Q Q,etal. Effects of soilmoisture light and air humidity on stomatal conductance ofCassava(manihot esculenta Crantz). Chinese Journal of Ecology, 2011, 30(4): 689-693.
左应梅, 陈秋波, 邓权权, 等. 土壤水分、光照和空气湿度对木薯气孔导度的影响. 生态学杂志, 2011, 30(4): 689-693.
[29] Farquhar G D, Leary M H, Berry J A. On the relationship between carbon isotope discrimination and intercellular carbon dioxide concentration in leaves. Journal of Plant Physiology, 1982, 9(2): 121-137.
[30] Heitholt J J. Use efficiency and dry matter distribution in nitrogen and water stressed inter wheat. Agronomy Journal, 1989, 81(2): 464-469.
[31] Jerry L, Thomas J, Prueger H. Managing soils to achieve greater water use efficiency. Agronomy Journal, 2001, 93(2): 271-290.
[32] Wei X R, Hao M D, Zhang C X,etal. Effects of zinc and manganese fertilizers on maize photosynthetic performance under soil drought condition. Acta Agronomica Sinica, 2005, 31(8): 1101-1104.
魏孝荣, 郝明德, 张春霞, 等. 土壤干旱条件下外源锌、锰对夏玉米光合特性的影响. 作物学报, 2005, 31(8): 1101-1104.
[33] Gao Y H, Niu J Y, Xu R,etal. Effects of different film mulching on photosynthesis, transpiration rate and leaf water use efficiency of maize. Acta Prataculturae Sinica, 2012, 21(5): 178-184.
高玉红, 牛俊义, 徐锐, 等. 不同覆膜方式对玉米叶片光合、蒸腾及水分利用效率的影响. 草业学报, 2012, 21(5): 178-184.
[34] Liu Z G, Chen J P, Duan A W,etal. Effects of different soil moisture treatments on physiological characteristics of summer maize leaves. Agricultural Research in the Arid Areas, 2006, 24(1): 90-95.
刘祖贵, 陈金平, 段爱旺, 等. 不同土壤水分处理对夏玉米叶片光合等生理特性的影响. 干旱地区农业研究, 2006, 24(1): 90-95.
[35] Bu L D, Zhang R H, Han M M,etal. The physiological mechanism of compensation effect in maize leaf by re-watering after draught stress. Acta Agriculturae Boreali-occidentalis Sinica, 2009, 18(2): 88-92.
卜令铎, 张仁和, 韩苗苗, 等. 干旱复水激发玉米叶片补偿效应的生理机制. 西北农业学报, 2009, 18(2): 88-92.
[36] Jinmin F, Bingru H. Involvement of antioxidants and lipid peroxidation in the adaptation of two cool-season grasses to localized drought stress. Environmental and Experimental Botany, 2001, 45: 105-114.
[37] Zhou J Y, Liu J X, Chen S Y. Introduction on progress of turf grass drought resistance. Pratacultural Science, 2002, 19(5): 61-66.
周久亚, 刘建秀, 陈树元. 草坪草抗旱性研究概述. 草业科学, 2002, 19(5): 61-66.
[38] Zhao F, Zhao X Y, Jin W G,etal. Responses of three native shrubs to drought stress in Urumqi. Bulletin of Botanical Research, 2010, 30(6): 692-696.
赵法, 赵晓英, 靳万贵, 等. 鸟鲁木齐周边3种野生灌木对干旱胁迫的响应. 植物研究, 2010, 30(6): 692-696.
[39] Guo R, Hao W P, Gong D Z,etal. Effects of water stress on germination and growth of wheat, photosynthetic efficiency and accumulation of metabolites. Soil Processes and Current Trends, 2013, 13: 367-380.
[40] Ramana G V, Padhy S P, Chaitanya K V. Differential responses of four soybean (GlycinemaxL.) cultivars to salinity stress. Legume Research, 2012, 35(3): 185-193.
[41] Sun Y, Yang Q C, Zhang Y H. Studies on drought tolerance of eight turfgrass cultivars at seedling stage. Acta Agrestia Sinica, 2001, 9(1): 16-20.
孙彦, 杨青川, 张英华. 不同草坪草种及品种苗期抗早性比较. 草地学报, 2001, 9(1): 16-20.
[42] Zhang D P, Luo G G. Effects of water stress on grape fruit development in different stages of growing season. Acta Horticulturae Sinica, 1992, 19(4): 296-300.
张大鹏, 罗国光. 不同时期水分胁迫对葡萄果实生长发育的影响. 园艺学报, 1992, 19(4): 296-300.
[43] Li B, Jia X F, Bai Q W,etal. Effect of drought stress on prolin accumulation of alfalfa. Bulletin of Botanical Research, 2003, 23(2): 189-191.
李波, 贾秀峰, 白庆武, 等. 干旱胁迫对苜蓿脯氨酸积累的影响. 植物研究, 2003, 23(2): 189-191.
[44] Song S M. The comprehensive evaluation of drought tolerance for alfalfa in Gansu. Acta Prataculturae Sinica, 1998, 7(2): 74-80.
宋淑明. 甘肃省紫花苜蓿地方类型抗旱性的综合评判. 草业学报, 1998, 7(2): 74-80.
[45] Zhang J G, Zhao Y, Xu X W,etal. Effect of shifting sand burial on evaporation reduction and salt restraint under saline water irrigation in extremely arid region. Chinese Journal of Applied Ecology, 2014, 25(5): 1415-1421.
张建国, 赵英, 徐新文, 等. 极端干旱区咸水灌溉下流沙压埋的减蒸抑盐效应. 应用生态学报, 2014, 25(5): 1415-1421.
[46] Jin J Y, Zhang W H, Yuan L. Physiological responses of three forages to drought stress and evaluation of their drought resistance. Acta Prataculturae Sinica, 2015, 24(10): 157-165.
靳军英, 张卫华, 袁玲. 三种牧草对干旱胁迫的生理响应及抗旱性评价. 草业学报, 2015, 24(10): 157-165.
