美洲大蠊粉对腹泻小鼠结肠酶活性及其体内菌群增殖的影响
2018-03-04王巧利王俊刚张玉栋闫文静
王巧利,王俊刚*,申 红,张玉栋,闫文静
(1.石河子大学 农学院,新疆 石河子832000;2.石河子大学 动物科技学院,新疆 石河子832000)
病原微生物常会引起人类和动物发生腹泻,应用药物治疗该病是目前的主要手段。但随着抗生素的滥用,多种病原菌产生了耐药性,给腹泻治疗造成了困扰。为了解决这个问题,学者开始研究药用昆虫,致力于寻找能够替代抗生素治疗动物腹泻的天然药物。
美洲大蠊(Periplaneta americanaL.)为了防御病原微生物,进化出特殊免疫机制,体内富含多种生物活性物质,为其药用开发奠定了基础。研究显示,以美洲大蠊为原料生产的“康复新”可以治疗十二指肠溃疡及其它消化系统疾病[1];蓝江林等分离出的美洲大蠊体内活性物质能够明显抑制细菌生长[2];周琼等用美洲大蠊粉给小鼠灌胃,发现其具有提高小鼠抗腹泻的作用[3];张细元等在研究腹泻病患儿中发现腹泻引起结肠内酶活性在治疗前后有差异[4];动物肠道病原微生物群落和数量也因摄入的食物不同而发生变化[5]。
基于此,本研究以腹泻小鼠为模型,在饲料中添加美洲大蠊粉进行治疗,研究腹泻小鼠结肠内菌群和大肠杆菌的数量变化,探究饲喂美洲大蠊粉对小鼠结肠酶系的影响,为美洲大蠊粉进一步药用开发与利用提供实验依据和技术支撑。
1 材料与方法
1.1 主要实验材料 健康昆明雄性小鼠及小鼠基础饲料,均由石河子大学实验动物养殖中心提供。美洲大蠊饲养于石河子大学农学院生物防治实验室,实验用的美洲大蠊粉是将美洲大蠊低温处死,用流动水洗掉其表面杂物,在55℃烘干至恒重,粉碎备用,其颗粒直径为5μm~8μm。
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、谷胱甘肽转移酶(GSH)、乙酰胆碱酯酶(ACHE)、酸性磷酸酶(ACP)、乳酸脱氢酶(LDH)、淀粉酶(AMS)、脂肪酶(LPS)检测试剂盒均购自南京建成生物工程研究所。伊红美蓝培养基、LB固体培养基均参照文献[6]配置。
1.2 实验设计 本实验在石河子大学农学院生防实验室进行。测试期为22 d,适应期7 d,建立腹泻模型为5 d,治疗期10 d。选取体质量为20±2 g健康昆明雄性小鼠,待其适应一周后,按体质量相近随机分组,空白组10只,建模组40只。建模组小鼠经腹腔注射0.02 mL/g(3×108cfu)ATCC 43255大肠杆菌菌悬液,空白组小鼠注射等剂量无菌生理盐水。建模成功后,将建模组再次分为模型组和治疗组,治疗组分别添加美洲大蠊粉高剂量组(8 %)、中剂量组(5 %)和低剂量组(2.5 %),而空白组、模型组饲喂未添加美洲大蠊粉的同等量饲料,10只/组,5只/笼。1 d~5 d为建立腹泻模型期(没有添加美洲大蠊粉),6 d~15 d为治疗期(添加美洲大蠊粉)。小鼠投喂饲料是55 g/笼/d,给水150 mL/笼/d,连续饲喂10 d。
1.3 小鼠生理生化指标的测定 小鼠投喂饲料后1 d、3 d、5 d、7 d、9 d、11 d、13 d、15 d的下午(16∶00~18∶00)观察并记录每组每只小鼠2 h内排稀便数和排便总数,计算稀便率(%)=稀便数/排便总数×100 %。试验结束后,脱臼法迫杀小鼠,取其结肠组织和结肠内容物于无菌的EP管中,置-20℃备用。按照各试剂盒操作说明测定结肠中的SOD、POD、CAT、GSH、ACHE、ACP、LDH、AMS、LPS的吸光度值(OD);采用平板菌落计数法测定其大肠杆菌和总菌数。伊红美蓝培养基、LB固体培养基配制及大肠杆菌和总菌数的计数方法参照实验手册,采用伊红美蓝培养基、LB固体培养基分别检测结肠内容物中大肠杆菌和总菌的数量。
1.4 数据分析 试验数据采用SPSS17.0进行处理,采用One-Way ANOVA分析,采用多重比较LDS法,p<0.05为显著水平。
2 结果
2.1 美洲大蠊粉对小鼠稀便率(%)的影响 小鼠经腹腔注射大肠杆菌菌悬液建模,在建模期间(1 d~5 d),小鼠稀便率显著增加(p<0.05)。建模成功后,分别以不同剂量的美洲大蠊粉治疗腹泻小鼠,随着治疗时间的增加,与模型组相比,美洲大蠊粉各剂量组小鼠的稀便率逐渐减弱,高剂量组的疗效显著高于中、低剂量组(p<0.05);美洲大蠊粉各剂量组间小鼠稀便率显著低于模型组(p<0.05)。随着治疗时间的增加,与模型组相比,美洲大蠊粉各剂量组的稀便率逐渐降低,高剂量组的疗效显著高于中、低剂量组(图1)。表明美洲大蠊粉能减弱腹泻小鼠的稀便率,增加机体抗腹泻的能力。

图1 美洲大蠊粉对腹泻小鼠稀便率(%)的影响Fig.1 The effects of P.americana powder on defecation rate of diarrhea model mice(%)
2.2 美洲大蠊粉对腹泻小鼠结肠抗氧化能力(SOD、POD、CAT)的影响 建模成功后,分别以不同剂量的美洲大蠊粉治疗腹泻小鼠,试验结束后取其结肠组织和结肠内容物,采用试剂盒测定各组小鼠结肠SOD、POD、CAT活性。结果显示,在饲喂美洲大蠊粉10 d后,小鼠结肠中SOD、POD、CAT显著增高,且高剂量组显著高于中、低剂量组(p<0.05)。与空白组相比,模型组小鼠结肠的SOD、POD、CAT显著降低(p<0.05);其中高剂量组小鼠的SOD、POD变化不明显(p>0.05),但CAT显著提高(p<0.05),低剂量组小鼠的SOD、POD显著降低(p<0.05),但其CAT变化不明显(p>0.05)。与模型组相比,高剂量组小鼠的SOD、POD、CAT显著增加(p<0.05),低剂量组小鼠的SOD、POD和中剂量组的SOD增加不明显(p>0.05),而低剂量组小鼠的CAT显著增加(p<0.05);高剂量组小鼠的SOD、CAT增加显著高于中、低剂量组(p<0.05);中、低剂量组间小鼠的SOD、CAT无显著差异(p>0.05);高剂量组小鼠POD活性显著高于低剂量组(p<0.05);中剂量组与高剂量组和低剂量组小鼠的POD无显著差异(p>0.05)(图2)。表明美洲大蠊粉能够增加腹泻小鼠结肠保护酶(SOD、POD、CAT)在腹泻小鼠体内的抗氧化能力。

图2 美洲大蠊粉对腹泻小鼠结肠SOD、POD、CAT的影响Fig.2 Effects of P.americana powder to GSH,ACHE and ACP in colon of diarrhea mice
2.3 美洲大蠊粉对腹泻小鼠结肠解毒代谢能力(GSH、ACHE、ACP)的影响 建模成功后,分别以不同剂量的美洲大蠊粉治疗腹泻小鼠,试验结束后取其结肠组织和结肠内容,采用试剂盒测定各组小鼠结肠GSH、ACHE、ACP活性。结果显示,在饲喂美洲大蠊粉10 d后,小鼠结肠中的GSH、ACHE、ACP显著增高(p<0.05),且高剂量组显著高于低剂量组(p<0.05)。模型组与空白组相比,小鼠的GSH、ACHE、ACP显著降低(p<0.05)。与空白组相比,高、中剂量组小鼠的ACHE、ACP差异不显著(p>0.05),低剂量组小鼠的ACHE、ACP和高、中、低剂量组小鼠的GSH显著降低(p<0.05);与模型组相比,低剂量组小鼠的ACP差异不显著(p>0.05),高、中剂量组小鼠的ACP和高、中、低剂量组小鼠的GSH、ACHE显著升高(p<0.05);高剂量组小鼠的GSH、ACHE、ACP显著高于低剂量组(p<0.05);高剂量组与中剂量组小鼠的ACHE无显著差异(p>0.05);高剂量组小鼠的ACP、GSH显著高于中剂量组(p<0.05);中、低剂量组小鼠的GSH无显著差异(p>0.05)(图3)。表明美洲大蠊粉能够提高腹泻小鼠结肠解毒酶(GSH、ACHE、ACP)对外来化合物的解毒代谢能力。
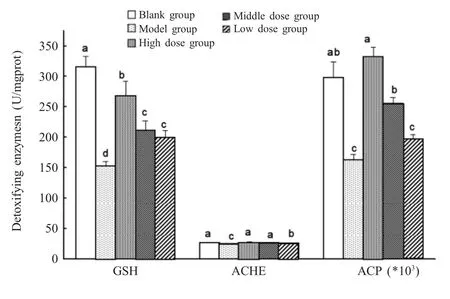
图3 美洲大蠊粉对腹泻小鼠结肠GSH、ACHE、ACP的影响Fig.3 Effects of P.americana powder to GSH,ACHE and ACPin colon of diarrhea mice
2.4 美洲大蠊粉对腹泻小鼠结肠消化能力(LDH、AMS、LPS)的影响 建模成功后,分别以不同剂量的美洲大蠊粉治疗腹泻小鼠,试验结束后取其结肠组织和结肠内容,采用试剂盒测定各组小鼠结肠LDH、AMS、LPS活性。结果显示,在饲喂美洲大蠊粉10 d后,小鼠结肠中的LDH、AMS、LPS活性显著升高(p<0.05),且高剂量组显著高于低剂量组(p<0.05)。模型组与空白组相比,小鼠的LDH、AMS、LPS活性显著降低(p<0.05);与空白组相比,高剂量组的LDH、AMS、LPS和中、低剂量组小鼠的AMS均无显著差异(p>0.05),中、低剂量组小鼠的LDH、LPS显著降低(p<0.05);与模型组相比,高、中、低剂量组小鼠的LPS和高、中剂量组小鼠的LDH、AMS活性均显著升高(p<0.05),低剂量组小鼠的LDH、AMS无显著差异(p>0.05);高剂量组小鼠的LDH、AMS、LPS显著高于低剂量组(p<0.05),且高剂量组小鼠的LDH、LPS显著高于中剂量组(p<0.05);中剂量组小鼠LPS活性显著高于低剂量组(p<0.05);中、低剂量组小鼠的LDH、AMS无显著差异(p>0.05)(图4)。表明美洲大蠊粉能够提高腹泻小鼠结肠消化酶(LDH、AMS、LPS)在腹泻小鼠体内的食物消化能力。

图4 美洲大蠊粉对腹泻小鼠结肠LDH、AMS、LPS的影响Fig.4 Effects of P.americana powder to LDH,AMS and LPS in colon of diarrhea mice
2.5 美洲大蠊粉对腹泻小鼠结肠总菌与大肠杆菌数量的影响 试验结束后,采用平板菌落计数法测定结肠中大肠杆菌数和总菌数。结果显示,在饲喂美洲大蠊粉10 d后,小鼠结肠中的大肠杆菌和总菌数显著降低,且高剂量组显著低于低剂量组(p<0.05)。空白组与模型组相比,总菌数、大肠杆菌数显著增加(p<0.05);与空白组相比,高剂量组小鼠的总菌数和大肠杆菌数差异不显著(p>0.05);中、低剂量组小鼠的总菌数和大肠杆菌数显著增加(p<0.05);与模型组相比,高、中、低剂量组小鼠的总菌数和大肠杆菌数均显著减少(p<0.05);高剂量组小鼠的大肠杆菌数和总菌数显著高于中、低剂量组(p<0.05);中、低剂量组小鼠的大肠杆菌数和总菌数差异不显著(p>0.05)(图5)。表明美洲大蠊粉能够降低腹泻小鼠结肠中大肠杆菌和其它杂菌的感染能力。

图5 美洲大蠊粉对腹泻小鼠结肠总菌与大肠杆菌数量的影响Fig.5 Effects of P.americana powder to total bacterial and E.coliin colon of diarrhea mice
3 讨论
由于生活环境的多样性,美洲大蠊能够携带多种致病病原物,如隐孢子虫、大肠肝菌、沙门氏菌等,其中隐孢子虫存在于美洲大蠊肠道内[7]。鉴于隐孢子虫、大肠肝菌、沙门氏菌可在55℃被杀死[8],本实验将美洲大蠊粉置55℃烘干,保证了美洲大蠊粉在药用期间安全有效。大肠杆菌是引起人类和动物腹泻的主要病原菌之一,常会造成肠道菌群失调,生理代谢异常[9]。为确保腹泻模型小鼠死亡率在可控范围,本实验采用腹腔注射大肠杆菌ATCC43255 0.02 mL/g(3×108cfu/mL)建立腹泻模型。
当病原物感染时,动物机体会产生大量的羟基、过氧基等自由基,与生物膜结合造成机体损伤,为了减少自由基给机体带来的伤害,SOD、CAT、GSH等酶的活性被激发[10-11]。SOD含量高则清除超氧阴离子(O2-)的能力强,CAT含量增加能够加速体内过氧化物的分解。本实验中,腹泻引起小鼠结肠组织中SOD、POD、CAT下降,饲喂美洲大蠊粉含量分别为8 %(高剂量组)、5 %(中剂量组)、2.5 %(低剂量组)的饲料后,高剂量治疗组小鼠结肠的SOD、高剂量和中剂量治疗组的POD、3种剂量治疗组的CAT均显著高于模型组,表明饲喂不同剂量的美洲大蠊粉能提高腹泻小鼠结肠抗氧化能力,以高、中剂量治疗组的效果最好。
ACP、GSH和ACHE活性的增加能够有效降低动物体内有害物质的危害。当小鼠发生腹泻,引起结肠组织中GSH、ACHE、ACP活性降低,造成有害物质增加。饲喂含不同剂量的美洲大蠊粉饲料后,各剂量治疗组小鼠的GSH、ACHE显著高于模型组,高剂量和中剂量组小鼠的ACP显著高于模型组,表明饲喂不同剂量的美洲大蠊粉能够提高腹泻小鼠清除结肠组织内有害物质,同样以高、中剂量治疗组的效果最好。
当动物发生腹泻,参与机体消化、吸收、脂肪重建和脂蛋白代谢的LPS、LDH和AMS的活性也会发生变化。小鼠腹泻会引起结肠组织中LDH、AMS、LPS活性降低,造成结肠组织消化、吸收等正常功能被破坏。饲喂含不同剂量的美洲大蠊粉饲料后,各剂量治疗组的LPS显著高于模型组,高剂量和中剂量治疗组的AMS、LDH显著高于模型组,表明美洲大蠊粉能够改善腹泻小鼠结肠机体功能,同样以高、中剂量治疗组的效果最好。
动物腹泻主要是引起了消化系统微生物紊乱,维持其动态平衡具有重要意义。腹腔注射大肠杆菌后,导致小鼠腹泻,其结肠内总菌数和大肠杆菌数大量增加,破坏了肠道内容物微生物的动态平衡。饲喂含不同剂量的美洲大蠊粉饲料后,各剂量组的大肠杆菌数、总菌数显著低于模型组,其中高剂量治疗组小鼠的大肠杆菌数量低于空白组,表明美洲大蠊粉能够有效抑制腹泻小鼠结肠内容物中总菌数和大肠杆菌数的增加,高剂量组的效果显著高于中、低剂量组。
何小姣等研究显示美洲大蠊提取液具有抗结肠炎的作用[12];Zhang等研究显示美洲大蠊提取液具有消炎及提高免疫的作用[13];美洲大蠊粉也能够抑制腹泻小鼠结肠组织中有害物质及总菌数和大肠杆菌数的增加,提高腹泻小鼠抗病的能力,表明美洲大蠊全粉及其提取物均能够达到治疗炎症及抗腹泻的作用。由于美洲大蠊粉含有多种化学成分,如蛋白质[14]、油酸[15]、微量元素、维生素[16]等,是否将其纯化或者虫粉应用有待进一步研究。当然,通过美洲大蠊粉添加于小鼠饲料中能够增强腹泻小鼠结肠酶活性和菌群平衡,可见其具有药用功效,能够在生产实践中推广应用。
