表达鹅γ干扰素重组禽痘病毒的构建及其抗病毒活性的初步研究
2018-03-04张紫璇韩明子李远超李卓昕王美淇刘晋宇
张紫璇,韩明子,高 旭,李远超,孟 媛,李卓昕,王美淇,刘晋宇
(1.延边大学农学院 动物医学系,吉林 延吉133000;2.延边州动物疫病预防控制中心,吉林 延吉133000)
干扰素(Interferon,IFN)是宿主细胞在病毒或特定的诱生剂作用下产生的一类分泌型多功能糖蛋白,有广谱抗病毒、抗肿瘤和调节免疫功能的作用[1],是重要的细胞因子之一。1995年,Lowenthal等从鸡脾淋巴细胞中得到与哺乳动物γ干扰素(IFN-γ)功能相似的IFN[2]。Digby等用RT-PCR方法从被诱导的T细胞中获 得 了IFN-γ基 因[3]。1999年,Lambrecht等分别表达了IFN-Ⅰ和IFN-Ⅱ并进行活性研究,表明E.coli和COS细胞表达的IFN与天然IFN同样具有抗病毒和免疫调节作用,且II型IFN-γ干扰素的免疫调节能力强于IFN-I[4]。
改造过的禽痘病毒(Fowlpox virus,FPV)表达外源蛋白的非必需区序列较长,并且FPV基因组序列十分庞大,又能够通过磷酸化,糖基化等修饰外源蛋白,有利于外源蛋白的表达[5]。本研究为了更好的发挥FPV作为疫苗活载体的优势,将鹅IFN-γ基因(GoIFN-γ)重组至FPV,研究GoIFN-γ能否在FPV中稳定表达,以及能否抑制鹅细小病毒(GPV)的活性,为共表达GPV VP3基因和IFN-γ基因的重组痘病毒疫苗研究和免疫学评价奠定基础,同时对进
一步阐明IFN-γ在免疫系统中的作用原理和特点具有一定意义。
1 材料与方法
1.1 种毒与载体pSY538、pSC11、pSY681质粒和S-FPV-017株FPV(2.13×106pfu/mL)由哈尔滨兽医研究所惠赠;pMD18T-IFN-γ由延边大学预防兽医学实验室构建和保存[6];GPV YBYJ株(GPV)由延边大学预防兽医学实验室保存[7]。
1.2 鸡胚与主要试剂9日龄SPF鸡胚购自北京梅里亚维通实验动物技术有限公司;ExTaq酶,X-gal和限制性内切酶均购自宝生物工程(大连)有限公司;小鼠抗鹅IFN-γ蛋白多克隆抗体由本实验室制备;山羊抗小鼠IgG-FITC购自Affinity Biosciences;DMEM培养液购自Gibco公司;Endo-free Plasmid Mini KitⅠ购自Omega公司;X-tremeGENETMHP DNA Transfection Reagent购 自SIGMA-ALDRICH公司;VirusGen Purification Kit购自康为世纪公司。
1.3 含GoIFN-γ基因转移载体的构建 根据Gen-Bank中登录的GoIFN-γ基因(JX966250)的核苷酸序列[8],使用Oligo 6.0软件设计合成1对引物(P1:5'-GAATTCATGACTTGCCAGACCTACTGCTT-3'/P2:5'-GAATTCTTATTAACATCTGCATCTCTTTGG-3'),在引物的两端加入EcoRⅠ酶切位点,以pMD18TIFNγ为模板进行GoIFN-γ基因全序列扩增,扩增片段的长度为495 bp。将扩增的目的片段回收纯化后克隆至载体pSY538中早晚期启动子LP2EP2下游的EcoRⅠ位点,构建转移载体pSY538-IFNγ;通过SmaⅠ位点将质粒pSC11中在晚期启动子P11控制下的LacZ基因报告盒插入pSY538-IFNγ质粒中,构建转移载体pSY538-IFNγ-LacZ;再用NotⅠ酶切pSY538-IFNγ-LacZ质粒,获得LP2EP2控制下的IFN-γ-LacZ基因,将其克隆至含有FPV复制非必需区的pSY681载体的NotⅠ位点,构建转移载体pSY681-IFNγ-LacZ。参照OMEGA Endo-free Plasmid Mini KitⅠ使用说明纯化质粒pSY681-IFNγ-LacZ并利用NotⅠ酶切鉴定该质粒。
1.4 重组FPV的筛选与纯化 待六孔板中鸡胚成纤维细胞(CEF)汇合度达80 %时30μL/孔加入FPV S-FPV-017,37℃孵育2 h,按照X-tremeGENETMHP DNA Transfection Reagent使用说明转染质粒pSY681-IFNγ-LacZ,6 h后换为完全培养液继续培养48 h后收获病毒,反复冻融后1 200 r/min离心,收获上清病毒,用无血清的DMEM培养液作10倍倍比稀释后分别接种于单层CEF,37℃感作2 h,弃液,加入含有1.5 %低熔点琼脂糖的DMEM固体培养基,细胞出现典型CPE后加入X-gal至终浓度为300μg/mL的DMEM营养琼脂进行染色,继续培养12 h~16 h,挑取蓝色蚀斑溶于1 mL无血清DMEM培养液中。冻融3次后进行下一轮纯化,直至筛选到稳定的重组FPV。
1.5 重组FPV的PCR鉴定 收获含重组病毒rFPV-IFNγ-LacZ的细胞反复冻融后,1 200 r/min离心后收取上清病毒,37℃5 % CO2条件下利用含3 %血清的DMEM扩大培养后,按照VirusGen Purification Kit使用说明提取rFPV-IFNγ-LacZ的核酸为模板,采用P1/P2引物进行PCR鉴定。
1.6 重组FPV的间接免疫荧光(IFA)检测 分别将重组病毒rFPV-IFNγ-LacZ和亲本病毒S-FPV-017接种六孔板内单层CEF,培养72 h至细胞出现明显CPE后用PBS清洗并用冷丙酮固定10 min后弃液,自然晾干后以鼠抗鹅IFN-γ蛋白多克隆抗体(1∶100)为一抗,山羊抗小鼠IgG-FITC(1:800)为二抗,分别进行IFA检测。
1.7 抗病毒活性检测 将rFPV-IFNγ-LacZ接种于单层CEF,在37℃5 % CO2条件下培养96 h,收获上清,利用0.22μm的微孔滤膜过滤接种于12孔板内单层CEF(2×106cell/孔),培养12 h后弃液,加入100TCID50的GPV孵育2 h后弃液,加入维持液培养至待阳性对照出现明显CPE时,采用细胞病变抑制法检测重组FPV表达的GoIFN-γ蛋白的抗病毒活。同时设立GPV阳性对照组和空白对照组,每组重复4孔。
2 结果
2.1 pSY681-IFNγ-LacZ转移载体构建 重组质粒pSY681-IFNγ-LacZ转移载体含有早晚期启动子LP2EP2控制的IFN-γ基因,晚期启动子P11控制的LacZ基因和亲本禽痘病毒同源序列(图1)。重组质粒经NotⅠ酶切鉴定,结果显示获得两条特异性条带,与预期相符(5 878 bp和3 700 bp)(图2)。将鉴定为阳性的重组质粒测序,结果显示序列正确,表明正确构建pSY681-IFNγ-LacZ转移载体。
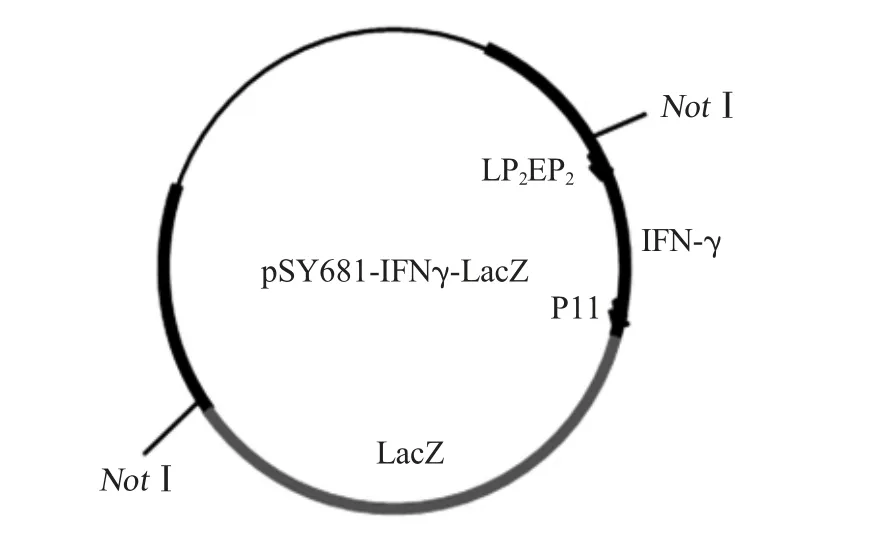
图1 转移载体pSY681-IFNγ-LacZ的结构图Fig.1 Map of transfer plasimid pSY681-IFNγ-LacZ
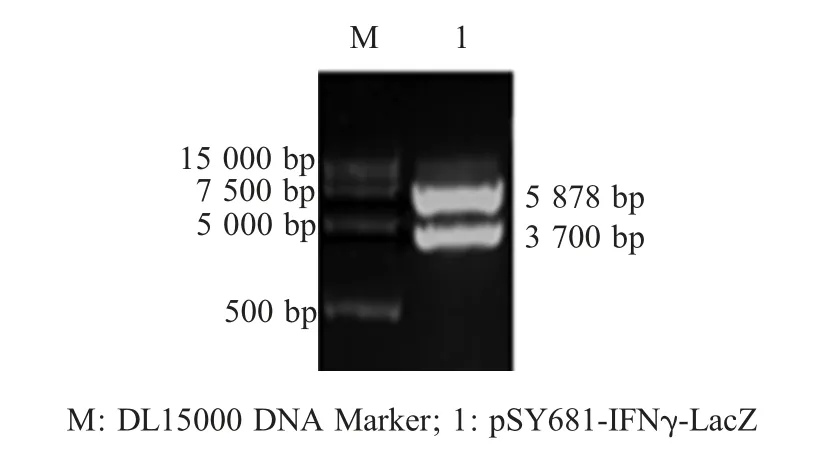
图2 重组质粒pSY681-IFNγ-LacZ的酶切鉴定Fig.2 Identification of pSY681-IFNγ-LacZ by NotⅠdigestion
2.2 重组禽痘病毒的筛选及PCR鉴定 将重组质粒pSY681-IFNγ-LacZ转染亲本病毒S-FPV-017经同源重组筛选到重组病毒rFPV-IFNγ-LacZ,因其含有LacZ报告基因,经9轮筛选后可见在含有X-gal的固体培养基中全部为蓝色蚀斑(图3),表明获得了能够稳定表达LacZ的重组病毒。提取重组病毒DNA为模板,PCR鉴定结果显示扩增获得了500 bp的GoIFN-γ基因片段(图4),表明筛选获得了含GoIFN-γ的重组FPV。
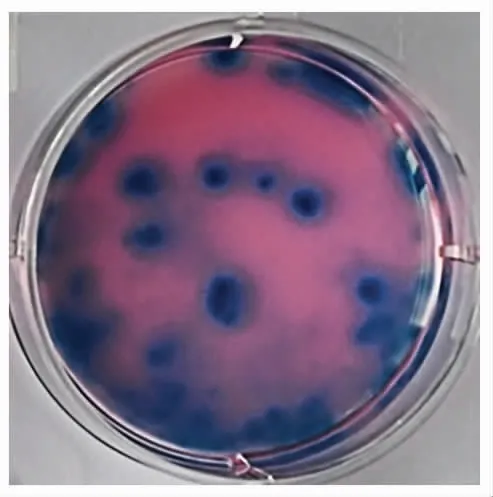
图3 重组禽痘病毒的筛选Fig.3 The selection of recombinant FPV

图4 重组FPV的PCR鉴定Fig.4 Identification of GoIFN-γgene in rFPV-IFNγ-LacZ by PCR
2.3 重组FPV表达IFN-γ蛋白的IFA检测 分别将重组病毒rFPV-IFNγ-LacZ和亲本病毒S-FPV-017接种六孔板内单层CEF,利用IFA进行检测,结果显示,rFPV-IFNγ-LacZ感染的CEF在胞内和胞浆中均出现特异性荧光反应,亲本病毒S-FPV-017感染的CEF未出现荧光反应(图5)。表明rFPV-IFNγ-LacZ表达了IFN-γ蛋白。
2.4 重组FPV抗病毒的活性检测 将rFPV-IFNγ-LacZ和鹅细小病毒于CEF中共培养,待GPV阳性对照组细胞出现明显CPE后时,而rFPV-IFNγ-LacZ试验组细胞贴壁情况良好,有少量悬浮细胞,未出现明显CPE(图6A);空白对照组细胞正常生长(图6B)。表明重组病毒rFPV-IFNγ-LacZ表达的IFN-γ在体外具有良好的抗病毒活性,能够抵抗GPV对细胞的感染。
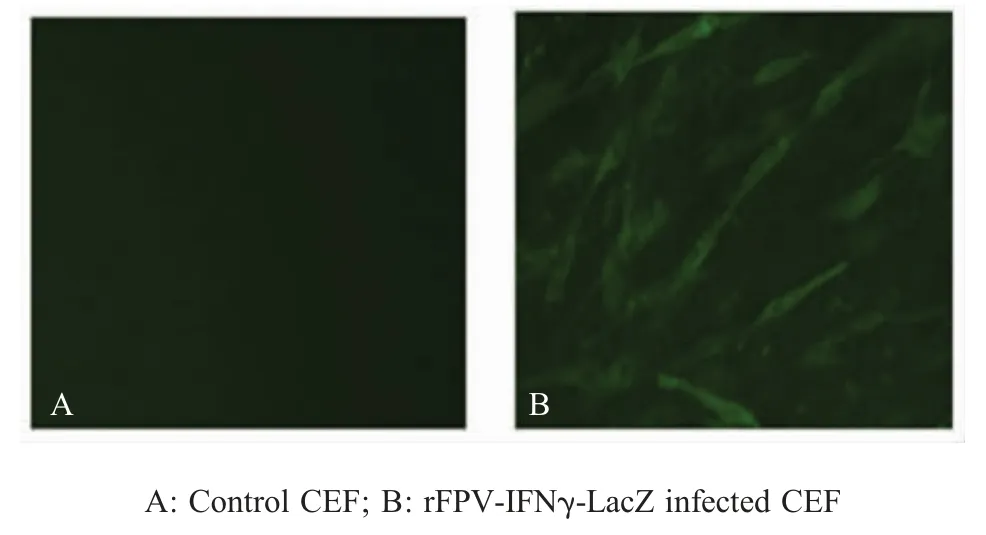
图5 rFPV-IFNγ-LacZ感染CEF的IFA鉴定结果Fig.5 Identification of the rFPV-IFNγ-LacZ by IFA
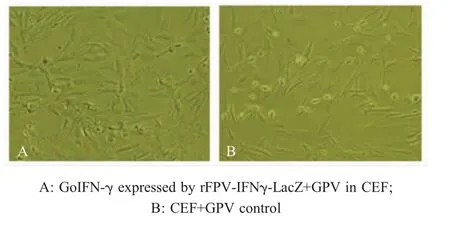
图6 重组FPV表达的GoIFN-γ在CEF中抗GPV活性的检测Fig.6 Antiviral activity of GoIFN-γexpressed from rFPV-IFNγ-LacZ against GPV in CEF
3 讨论
IFN-γ具有严格的选择性,靶向作用于非正常细胞,能够使机体迅速产生反应并长时间处于抗病毒状态,但是只有在特定的病原刺激下被抑制的IFN-γ才能表达,与此同时动物体内分泌的IFN-γ数量有限,在很大程度上制约了IFN的广泛应用。因此,建立一个高效而又稳定的表达系统至关重要。IFN原核表达真核基因时在一定程度上真核基因的信号肽会影响基因表达产物的活性[9]。所以本研究利用现代分子生物学技术对IFN-γ基因进行了体外真核表达,获得了能够稳定表达IFN-γ基因的重组病毒。
随着活载体疫苗的不断开发,痘病毒(包括FPV)作为较成熟的多效病毒载体已表达数10种不同的保护性抗原[10],在美国,表达新城疫病毒Hitchner B株HN基因和F基因,Texas株HN基因和F基因的重组FPV疫苗已经被使用[11],实践证明重组禽痘疫苗可以使免疫鸡对强毒产生良好的免疫效果。但是与常规疫苗相比其免疫的雏鸡存在体重减轻和免疫抑制[12],为了减少FPV残留的毒性,尝试在疫苗中引入细胞因子作为佐剂[13]。Schijns等将重组杆状病毒表达的猫IFN-γ作为灭活狂犬病疫苗的免疫佐剂免疫3月龄猫,与单独使用灭活狂犬疫苗相比其血清中抗体滴度显著提高[14]。Rautenschlein等融合表达火鸡纽卡斯尔病病毒和IFN-II的疫苗接种SPF火鸡胚,与单独接种纽卡斯尔病毒疫苗的火鸡胚相比,孵化率和存活率无变化的情况下同时出现轻微的增重效应,前者提前一周产生抗纽卡斯尔病毒抗体并具有良好的免疫保护能力[15]。IFN-γ作为免疫佐剂具有增重效应和免疫调节功能,能够增强机体的抗感染能力,并减少免疫原性蛋白基因重组疫苗的毒副作用。本实验用FPV表达载体表达IFN-γ基因可用于体外人工制备IFN,也为研制GoIFN-γ疫苗佐剂和共表达保护性抗原和IFN-γ的重组基因工程疫苗奠定基础。
细胞病变抑制法测定重组GoIFN-γ的抗病毒活性,结果显示重组FPV表达的IFN-γ蛋白能够有效抑制GPV介导的CEF表面抗原的表达。Mallick等[16]在杆状病毒表达系统中表达的鸡IFN-γ和刘新文等[17]应用酵母分泌表达的鸡IFN-γ均对水泡口炎病毒在CEF中的增殖具有抑制效果。这与本实验的结果是一致的,表明真核系统表达IFN-γ在体外具有抗病毒活性,但IFN-γ的其它活性功能还需要进一步探究。
IFN的活性具有相对的种属特异性,所以其不仅对同种属或相近种属的动物及其细胞有保护力,对不同种属的动物及其细胞也可能具有保护作用。如猴的IFN基因不仅对猴有保护作用,对兔和人也有一定的作用。GoIFN-γ除对鹅外,对其它种属相近的禽类或者其它的脊椎动物也可能具有保护作用。对此本研究团队将进一步深入研究。
