肠上皮Syndecan—1对艰难梭菌所致腹泻患者的肠黏膜屏障保护作用分析
2018-03-02颜娟曾志伟谢晓云
颜娟+曾志伟+谢晓云
【摘要】 目的 研究分析肠上皮Syndecan-1对027型艰难梭菌(CD)所致腹泻患者的肠黏膜屏障保护作用。方法 60例CD所致腹泻患者的血液、粪便、尿液及组织标本, 使用肝素(10 kU/L)、Syndecan-1 siRNA、Hanks平衡盐溶液(HBSS)(400 mg/L)以及V-Syndecan-1进行处理。比较处理前后Syndecan-1水平、荧光黄透过率及炎症因子分泌水平。结果 处理后, 患者Syndecan-1水平为(0.938±0.041)μg/L, 高于处理前的(0.351±0.022)μg/L, 差异具有统计学意义(P<0.05)。与处理前比较, 处理后患者荧光黄透过率降低, IL-6水平降低, IL-10水平增高, 差异具有统计学意义(P<0.05)。结论 肠上皮Syndecan-1水平越高对027型CD腹泻患者肠黏膜屏障的保护作用更明显。
【关键词】 肠上皮Syndecan-1;艰难梭菌;肠黏膜屏障损伤
DOI:10.14163/j.cnki.11-5547/r.2018.05.019
艰难梭菌属于一种革兰染色阳性产芽孢厌氧杆菌, 临床上又被称为难辨梭状芽孢杆菌, 通常在人体的肠道中寄生, 是临床上医院获得性感染性腹泻常见的疾病诱导独立危险因素, 一旦产生很容易引起传染性腹泻疾病的爆发, 提升相关疾病的复发率、死亡率[1]。Syndecan-1属于一种硫酸乙酰肝素蛋白聚糖(HSPG)分子, 在患者的上皮细胞表面进行表达, 可对患者细菌易位、肠上皮屏障破坏(主要由细菌毒素所引起)进行有效抑制[2]。在2014年, 我国大陆的南方医院首次在腹泻患者的粪便标本中, 将具有高产毒性CD菌株进行分离, 本研究便是对Syndecan-1、类似物对CD感染所引起的肠黏膜屏障损伤的作用、影响机制进行探讨。现报告如下。
1 资料与方法
1. 1 一般资料 收集2015~2017年广州市白云区人民医院住院、门诊以及部分社区60例CD所致腹泻患者的腹泻粪便(布里斯托分类 5~7 级)标本进行CD菌及毒素分析。患者中男36例, 女24例;年龄20~65岁, 平均年龄(42.56±7.54)岁。
临床症状:所有患有均出现不同程度的呕吐、腹痛、腹泻以及发热等症状。纳入标准:①所有腹泻患者均为年龄≥18岁的患者;②具有化疗、抗生素治疗史且<60 d;③住院后48 h内出现腹泻, 且患者腹泻次数≥3 次/24 h, 大便形态为不成型。排除标准:①年龄<18岁患者;②有样本采集经历;③为慢性腹泻患者;④使用过泻药的患者;⑤有肠道功能性疾病患者。
1. 2 方法 取患者的血液、粪便、尿液及组织标本, 使用肝素(10 kU/L)、Syndecan-1 siRNA、HBSS(400 mg/L)以及V-Syndecan-1进行处理。并对如下指标进行检测:①Syndecan-1表达水平检测:使用蛋白质印迹法(western blot)、荧光定量聚合酶链式反应(PCR)进行检测, 经处理后观察Syndecan-1表达水平。②上皮屏障通透性检测:荧光黄是肠屏障通透性标记物, 能够通过细胞旁转运, 将终浓度为100 μg/ml荧光黄的HBSS 100 μl加在Transwell上, 在温度为37℃的情况下进行4 h育卵, 并进行下层液体收集, 使用荧光分光光度计进行吸光度测定, 并计算荧光黄浓度。荧光黄透过率(%)=下层荧光黄浓度/加入上层荧光黄浓度(100%)。③炎症因子分泌:酶联免疫吸附实验(ELISA)法检测细胞培养上清中IL-6及IL-10水平。
1. 3 觀察指标 观察Syndecan-1水平改变前后荧光黄浓度变化及炎症因子分泌水平变化。
1. 4 统计学方法 采用SPSS18.0统计学软件对研究数据进行统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验。P<0.05表示差异具有统计学意义。
2 结果
2. 1 患者处理前后Syndecan-1水平比较 处理后, 患者Syndecan-1水平为(0.938±0.041)μg/L, 高于处理前的(0.351± 0.022)μg/L, 差异具有统计学意义(P<0.05)。见表1。
2. 2 患者处理前后荧光黄透过率及炎症因子分泌水平比较
与处理前比较, 处理后患者荧光黄透过率降低, IL-6水平降低, IL-10水平增高, 差异具有统计学意义(P<0.05)。见表2。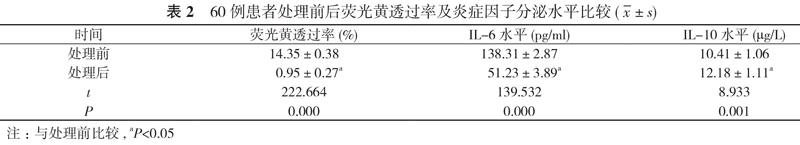
3 讨论
CD主要分成非产毒株、产毒株两种, 产毒株是以A与B两种毒素的产生而导致CD相关性疾病的发生, 而非产毒株则是在患者的肠道内利用竞争性定植在一定程度上抑制产毒株。CD高毒株亚BI/NAP1/027型菌株所引起的疾病具有细菌耐药性强、高复发率、高死亡率的特点, 是医院内部感染性疾病传播的主要病原菌, 可在短时间内引起大面积流行疾病的爆发, 并能够使患者的疾病复发率与病死率不断升高, 最终产生重大的人力、物力以及财产损失, 其造成的重要影响已经得到了世界各国的广泛关注和重视[3]。
在人体正常的生理情况下, 人体机制可利用微生物屏障、肠黏膜上皮屏障以及免疫屏障等对抗毒素。病原菌进行肠道以外的器官及组织的入侵进行阻止, 而肠黏膜上皮屏障属于一种物理结构的解剖屏障, 封闭细胞的紧密连接、肠上皮细胞的完整性是肠黏膜上皮屏障的主要依赖;Syndecan-1属于一种HSPG, 在人体通常的生理条件下, 可在其上皮细胞膜处进行表达, 并粘附分子、生长因子、胞外基质成分、细胞因子以及细菌抗原等一系列配子相结合, 同时也会对促进组织修复、调节免疫功能以及维持细胞形态等具体生理病理过程进行参与, 并对作用于肠道的致炎因素进行阻止[4]。研究发现, Syndecan-1升高后, 患者肠道通透性下降, 并且炎症因子IL-6水平下降而IL-10水平升高。肠道通透性降低, 有助于阻碍黏膜固有层炎症因子的激活, IL-6水平降低使肠道炎症得到缓解, 而IL-10水平的升高则对炎症反应起到保护作用, 提升抗炎效果。
综上所述, Syndecan-1水平变化对肠道炎症具有较大影响作用, 能够提升肠黏膜屏障的保护作用, 减少炎症发生。但是, 对该治疗的具体实施机制目前临床上并不十分明确, 且通过Syndecan-1对CD高毒株所造成的肠黏膜屏障损伤作用并未发现有相关报道的出现。
参考文献
[1] Kuehne SA, Cartman ST, Heap JT, et al. The role of toxin A and toxin B in Clostridium difficile infection. Nature, 2010, 467(7316): 711-713.
[2] Bauer MP, Notermans DW, van Benthem BH, et al. Clostridium difficile infection in Europe: a hospital-based survey. Lancet, 2011, 377(9759):63-73.
[3] Patterson AM, Delday MI, van Kuppevelt TH, et al. Expression of heparan sulfate proteoglycans in murine models of experimental colitis. Inflamm Bowel Dis, 2012, 18(6):1112-1126.
[4] Wang XF, Li AM, Li J, et al. Low molecular weight heparin relieves experimental colitis in mice by downregulating IL-1β and inhibitingsyndecan-1 shedding in the intestinal mucosa. PLoS One, 2013, 8(7):e66397.
[收稿日期:2017-10-23]endprint
