抗人表皮生长因子受体2阳性乳腺癌靶向治疗的疗效及安全性
2018-03-02衡园
衡 园
(安徽省马鞍山市人民医院 肿瘤放疗科,安徽 马鞍山,243000)
乳腺癌早期缺乏特异性症状表现,患者被确诊时往往已经丧失最佳手术治疗时机,病理学完全缓解率及生存质量均明显降低,此时化疗成为疗效最佳的治疗手段[1-2]。随着靶向治疗的日臻成熟,将其应用于乳腺癌治疗工作中无疑能够取得更为理想的疗效。本研究分析抗HER-2阳性乳腺癌靶向治疗的有效性及安全性,报告如下。
1 资料与方法
1.1 一般资料
采用等距随机抽样法将本院2014年1月—2017年7月收治的60例抗HER-2阳性乳腺癌患者分为2组各30例。对照组年龄28~65岁,平均年龄(49.28±1.52)岁; 病程时间2.5~8年,平均病程(5.20±0.24)年; TNM分期:Ⅱ期13例,Ⅲ期17例; HER-2表达强度:(2+) 20例,(3+) 10例。症状表现:无痛性乳房肿块25例,隐痛或刺痛性乳房肿块5例。观察组年龄28~65岁,平均年龄(49.30±1.50)岁; 病程2.2~8年,平均病程(5.22±0.23)年; TNM分期:Ⅱ期14例、Ⅲ期16例; HER-2表达强度:(2+) 21例,(3+) 9例; 症状表现:无痛性乳房肿块27例、隐痛或刺痛性乳房肿块3例。纳入标准:① 经病理学检查以及免疫组化染色确诊为HER-2阳性乳腺癌者; ② 无曲妥珠单抗过敏或禁忌者。排除标准:① 研究开始前已经存在心肌损伤情形者; ② 合并其他全身严重器质性疾病者。2组患者一般资料无显著差异。
1.2 方法
对照组接受EC序贯紫杉醇/多西他赛/紫杉醇脂质体治疗,方案内容如下:表阿霉素(海正辉瑞制药有限公司,国药准字H19990280)70~80 mg/m2; 环磷酰胺(江苏盛迪医药有限公司,国药准字H32020857)500~600 mg/m2; 多西他赛(江苏恒瑞医药股份有限公司,国药准字H20020543)75 mg/m2; 紫杉醇(深圳万乐药业有限公司,国药准字H20056879)135~175 mg/m2,紫杉醇脂质体(南京思科药业有限公司,国药准字H20030357)135~175 mg/m2,上述药物均静脉滴注,以21 d为1个治疗周期,持续治疗8个周期[3]。
观察组接受曲妥珠单抗+EC序贯紫杉醇/多西他赛/紫杉醇脂质体化疗治疗,EC序贯紫杉醇/多西他赛/紫杉醇脂质体化疗方案同对照组。曲妥珠单抗[Roche Pharma (Schweiz) Ltd]初始治疗量8 mg/kg,于90 min内静脉滴注完毕,维持剂量6 mg/kg,每3周1次。
1.3 观察指标
选取肿瘤标志物(癌胚抗原、糖类抗原15-3)、肌酸磷酸激酶、LVEF作为观察指标,其中肿瘤标志物采用上海酶联生物科技有限公司生产的酶联免疫吸附试剂盒测定; 肌酸磷酸激酶采用德国西门子公司生产的ADVIA Centaur CP全自动化学发光仪测定; 左室射血分数(LVEF)采用美国GE公司生产的Vivid3型超声心动图诊断仪测定[4]。
1.4 统计学方法
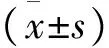
2 结 果
治疗前2组患者肿瘤标志物相比较,差异无统计学意义(P>0.05); 治疗后各指标比较,观察组均显著优于对照组(P<0.05),见表1。治疗前2组肌酸磷酸激酶、LVEF无显著差异,治疗后观察组略差于对照组(P>0.05),见表2。

表1 2组肿瘤标志物比较
与对照组比较,*P<0.05。

表2 2组肌酸磷酸激酶、LVEF比较
3 讨 论
乳腺癌发病率随着年龄的增长而呈现出明显的上升态势,而中国乳腺癌患者集中在45~55岁年龄段[5]。绝大多数乳腺癌患者并未对此引起足够的重视,使得病症得到诊断时往往已经处于中晚期,患者远期生存率及生命质量均下降[6]。随着乳腺癌筛查活动的广泛开展以及影像学技术的快速发展,乳腺癌检出率得到了有效提升,大多数乳腺癌患者能够实现早发现、早治疗的目的[7]。化疗是利用化学药物阻断癌细胞的分裂、增殖、浸润、转移,直至最终杀灭的一种全身性治疗手段[8]。化疗方案日益多样,靶向给药受到了医学界的广泛关注[9]。早期乳腺癌患者术后进行常规化疗能够最大程度上实现杀灭残存的微小转移病灶,大幅降低了肿瘤复发及转移的概率,对于提高治愈率、改善患者预后而言具有重要意义[10]。
曲妥珠单抗是将机体内免疫球蛋白G(IgG)稳定区(5%)和针对HER-2受体胞外区的鼠源单克隆抗体的抗原决定簇(5%),嵌合于一体的人源化单克隆抗体,且是目前全球范围内第一个被批准的抗HER-2靶点药物,可直接作用于HER-2基因调控的细胞表面p185糖蛋白[11]。国外临床研究[12]表明,将曲妥珠单抗用于Her-2阳性早期乳腺癌术后辅助治疗,可大幅降低其复发率和死亡率,故此已经被美国国家综合癌症网(NCCN)写入到乳腺癌临床实践指南之中。
本研究中2组患者治疗前肿瘤标志物无显著差异,在经过不同治疗方案治疗后各指标明显改善,但接受曲妥珠单抗+EC序贯紫杉醇化疗的观察组改善效果显著优于单纯EC序贯紫杉醇化疗的对照组(P<0.05)。在安全性比较上,2组患者治疗前肌酸磷酸激酶、LVEF并无显著差异,治疗后肌酸磷酸激酶均升高,而LVEF明显下降,观察组波动幅度高于对照组,但差异无统计学意义(P>0.05)。癌胚抗原、糖类抗原15-3为全球医学界公认的肿瘤标志物,通过对其数值变化进行监测有助于评估临床疗效及预测患者预后。EC序贯紫杉醇化疗能够有效阻断癌细胞生物学行为的调节,阻止血管新生以及细胞迁移,改变癌细胞周围的微环境,使得后者无法从机体中获取充足的营养物质而逐渐凋亡。曲妥珠单抗为抗HER-2的单克隆抗体药物,经由静脉给药的途径输注至患者体内后药物有效成分可附着于HER-2之上,继而实现阻止人体表皮生长因子的附着,遏制癌细胞的生长、分裂与增殖[13]。同时该药物亦能够对患者机体免疫系统形成刺激,促使免疫细胞源源不断的攻击癌细胞,直至将其最终杀灭[14]。将二者联合使用无疑能够大幅提高HER-2阳性乳腺癌患者临床治疗效果。Emilia J.Diego等[15]亦在其临床研究中指出,化疗联合抗Her-2单抗曲妥株单抗下HER-2阳性乳腺癌患者复发风险下降46%~52%,死亡风险则下降了1/3,尤其是对于高复发风险者而言,此种辅助治疗方案可带来总生存获益。需要注意的是,曲妥珠单抗对心肌组织的损伤较大,所以在治疗过程中必须密切监测乳腺癌患者心功能,以便采取有效的应对策略以提高临床治疗的安全性。
[1] 姜战胜,杨艳芳,潘战宇.帕妥珠单抗在HER-2阳性乳腺癌治疗中的临床转化[J].中国肿瘤生物治疗杂志,2016,23(04):545-549.
[2] 宋敏,赵静,陈丽艳,等.曲妥珠单抗联合多西紫杉醇在HER-2阳性晚期乳腺癌中的应用[J].现代生物医学进展,2017,17(06):1152-1155.
[3] 黄平,刘雅娟,陈占红,等.曲妥珠单抗一线治疗66例HER2阳性转移性乳腺癌的疗效和安全性分析[J].肿瘤学杂志,2017,23(06):517-522.
[4] 黄香,吴昊,李薇,等.曲妥珠单抗联合紫杉醇脂质体和卡培他滨治疗HER-2阳性复发转移性乳腺癌[J].实用肿瘤杂志,2016,31(06):550-554.
[5] 张艳秋,孙立柱,王昳凡,等.曲妥珠单抗联合内分泌维持治疗HR和HER-2阳性晚期乳腺癌的临床观察[J].临床肿瘤学杂志,2017,22(05):427-431.
[6] 周子平,陆剑豪.靶向药物联合阿霉素靶向制剂治疗Her-2阳性乳腺癌的效果及安全性研究[J].海南医学院学报,2017,23(09):1265-1268.
[7] 权利丰.曲妥珠单抗并紫杉醇新辅助化疗在HER2阳性晚期局部乳腺癌治疗中的应用研究[J].成都医学院学报,2017,12(04):484-487.
[8] 胡赛男,张莉莉.跨线曲妥珠单抗联合不同化疗方案治疗HER2阳性晚期乳腺癌的临床研究[J].肿瘤防治研究,2016,43(01):39-44.
[9] 喻志华,瞿智玲,周晟,等.HER-2阳性乳腺癌组织MDM2表达与曲妥珠单抗耐药的相关性分析[J].中华肿瘤防治杂志,2015,22(23):1813-1818.
[10] 邵婉婷,付彤,武盼盼,等.Her-2阳性乳腺癌患者曲妥珠单抗联合新辅助化疗的效果评价及其预后影响因素分析[J].吉林大学学报:医学版,2016,42(02):351-357.
[11] 周永安,刘训碧.曲妥珠单抗联合多西紫杉醇治疗Her-2阳性乳腺癌的临床研究[J].现代药物与临床,2016,31(06):863-867.
[12] Moisés Uriarte-Pinto,ngel Escolano-Pueyo,Vicente Gimeno-Ballester,et al.Trastuzumab,non-pegylated liposomal-encapsulated doxorubicin and paclitaxel in the neoadjuvant setting of HER-2 positive breast cancer[J].International Journal of Clinical Pharmacy,2016,38(2):446-453.
[13] 袁宏钧.靶向药物曲妥珠单抗联合化疗对人类表皮生长因子受体2阳性局部晚期乳腺癌患者临床疗效研究[J].中国临床药理学与治疗学,2015,20(01):86-90.
[14] 殷科,曹永晋.曲妥珠单抗新辅助化疗表皮生长因子受体2阳性乳腺癌的临床疗效及安全性评价[J].中国临床药理学杂志,2015,31(09):725-727.
[15] Emilia J.Diego,Priscilla F.McAuliffe,Atilla Soran,et al.Axillary Staging After Neoadjuvant Chemotherapy for Breast Cancer:A Pilot Study Combining Sentinel Lymph Node Biopsy with Radioactive Seed Localization of Pre-treatment Positive Axillary Lymph Nodes[J].Annals of Surgical Oncology,2016,23(5):1549-1553.
