高锰酸钾预氧化对大肠杆菌DBPsFP的去除
2018-03-02史正晨孙兴滨刘佳蒙辛会博东北林业大学林学院黑龙江哈尔滨150040
史正晨,孙兴滨,刘佳蒙,辛会博,韩 帅 (东北林业大学林学院,黑龙江 哈尔滨 150040)
细菌在自然水体中广泛存在,饮用水消毒的主要目的是灭活细菌性病原体.大肠杆菌群数作为饮用水的卫生学标准(每升饮用水中大肠杆菌群数不应超过3个),若在水中检出,可认为是被粪便污染的指标.近年来,大肠杆菌污染水源并且引起腹泻的事件依然存在[1-2],尤其是中小城镇和农村水源地由于防护不到位易受到污染.虽然采用氯化消毒这一技术可以降低受污染的水体中细菌的含量,但氯化消毒过程中会生成氯化消毒副产物(DBPs).以前,对于藻类,剑水蚤[3]等在氯化消毒过程中消毒副产物的生成规律研究较多,近几年对细菌在氯化消毒过程中生成氯化消毒副产物也引起了重视.国内外已有相关研究表明:在氯化消毒过程中,氯与细菌接触时,首先会改变细胞膜的通透性,然后细菌中的蛋白质、核酸和氨基酸等被释放,氯与进入水中的细胞壁、细胞膜和细胞质这些细菌物质发生反应生成DBPs.试验表明[4],大肠杆菌在氯化消毒过程中产生了二氯乙腈(DCAN)、三氯乙腈(TCAN) 、三氯甲烷(TCM)、三氯乙醛(CH)、1,1-二氯丙酮(1,1-DCP)、1,1,1-三氯丙酮(1,1,1-TCP)等主要的几种DBPs.
经国际流行病学会的调查研究表明,长期饮用氯化消毒的自来水,将增加人们患消化及泌尿系统癌症的风险,这使得人们对于水处理工艺,对氯化消毒副产物的控制备受关注.如果在氯化处理前端能去除较多的消毒副产物生成潜能(DBPsFP),就可以减少消毒副产物的生成量[5],因此,预氧化作为一种有效控制消毒副产物的技术应运而生.高锰酸钾作为预氧化剂具有强氧化性,可高效地去除水中的有机污染物,也可去除水中异味、控制水中藻类浓度、降低铁锰含量,并具有使用简单和管理方便等优点[6].目前许多地区已应用高锰酸钾预氧化工艺[7]处理饮用水,相关研究[8]也表明高锰酸钾预氧化是一种控制三卤甲烷等消毒副产物比较有效的方法.还有研究表明[9],高锰酸钾预氧化后没有产生对人体有害的副产物.
目前,高锰酸钾预氧化对大肠杆菌DBPsFP的去除研究较少,本文以高锰酸钾为预氧化剂处理实验室配制的大肠杆菌水样,研究在不同的高锰酸钾浓度、氯化时间、预氧化时间、pH值、反应温度条件下对大肠杆菌消毒副产物前体物的氧化去除,并分析何种条件对DBPsFP的去除效果最佳,以期为高锰酸钾预氧化工艺控制消毒副产物提供理论基础.
1 材料与方法
1.1 试验水样
试验所用大肠杆菌来自中国普通微生物菌种保藏管理中心(CGMCC),在实验室经标准方法繁殖后所得,试验中将菌种接种于牛肉膏、蛋白胨培养基的锥形瓶中,并将锥形瓶置于30℃恒温环境中震荡培养18h,使细菌生长至稳定期,此时的细菌悬液浓度约108cfu/mL.取5mL细菌悬液于离心管,置于离心机进行离心分离,转速为4000r/min,离心时间为10min,大肠杆菌沉淀后将上部营养液抽出,再加入5mL0.9%的氯化钠(NaCl)溶液,再次离心分离后将氯化钠(NaCl)溶液吸出,重复2次,得到纯细菌块,将纯细菌块悬浮于1L超纯水中,超声处理10min使细菌分布均匀,得到试验所用的纯细菌水样.此时细菌浓度为5×105cfu/ml,约为正常地表水水源中细菌数量的100倍.试验选用高细胞密度的纯细菌悬浮液进行研究有以下原因:一是为了减小操作带来的误差;二是当消毒副产物的生成浓度较高时有利于观察和比较试验结果;三是当水源受到污染时细菌大量繁殖,水中细菌浓度会大量增加.
1.2 提取消毒副产物前处理方法
前处理采用美国环保局EPA551.1[10]中所述的方法.
1.3 试验方法
氯化消毒试验于密封的玻璃瓶中进行,反应基本条件为:pH值为7,高锰酸钾投加浓度为2mg/L,预氧化时间为30min,氯投加浓度为20mg/L,反应温度为(20±2)℃,氯化消毒时间为48h,在此基础条件下,分别改变pH值(5、6、7、8、9),氯化时间(12、24、48、72、96h),高锰酸钾投加浓度(0、0.5、1、1.5、2、2.5、3mg/L),高锰酸钾预氧化时间(0、15、30、45、60、75、90min),反应温度(10℃、20℃、30℃).每组试验设置3个平行样,每组均设空白对照.
1.4 样品检测方法
样品检测气相色谱仪为美国Agilent公司的Agilent GC-7890,检测条件如下:色谱柱为HP-5石英毛细管柱,规格(30mm×0.25mm,薄膜的厚度0.25mm ID);进样口温度200℃;进样量1mL;载气采用高纯氮(≥99.999%);ECD检测温度290℃;程序开始5min温度升至35℃,然后以10℃/min升温至75℃,保持5min,再以10℃/min升温至100℃后持续2min.测样30min后得到含有各种消毒副产物峰面积和停留时间的色谱图.
1.5 数据处理方法
本试验采用单一物质标准曲线法,利用已知浓度的TCM、1,1-DCP、1,1,1-TCP、CH、DCAN和TCAN标准样品配制标准溶液进行测定.确定不同消毒副产物的停留时间和不同浓度消毒副产物的峰面积,根据标准样品浓度与其对应的峰面积绘制标准曲线,再将试验样品色谱图中对应的消毒副产物峰面积代入标准曲线计算得到消毒副产物浓度.
2 结果与分析
2.1 高锰酸钾投加量的影响
由图1可知,随着高锰酸钾浓度的增加,TCAN、DCAN、1,1,1-TCP及CH的浓度先降低,后升高;1,1-DCP浓度先升高,后降低;TCM浓度逐渐降低.
细菌中蛋白质占细胞干重的50%[11-12],细菌中有机质含有较多的N.消毒副产物TCAN、DCAN的产生主要是氯与有机氮化物相互作用的结果,高锰酸钾能够将蛋白质等大分子有机物氧化成小分子的有机物,从而使得DCAN、TCAN的浓度有所降低.当高锰酸钾浓度达到2.0mg/L时,TCAN、DCAN浓度分别达到最低值0.37和1.70μg/L,与初始浓度相比,去除率为61.8%和30.3%.消毒副产物1,1,1-TCP、CH的前体物较为不稳定,被高锰酸钾氧化分解,使得浓度有所下降,当高锰酸钾浓度达到2.0mg/L时,1,1,1-TCP浓度达到低值7.06μg/L,与初始浓度相比去除率为23.5%.高锰酸钾浓度在1.0mg/L时,CH浓度达到低值10.38μg/L,与初始浓度相比去除率为22.8%.试验表明,当高锰酸钾浓度大于2.0mg/L时,1,1-DCP浓度开始降低,而1,1,1-TCP浓度开始升高,分析可能随着高锰酸钾浓度的增加,一部分1,1-DCP的前体物被氧化分解成了1,1,1-TCP的前体物,因此,1,1-DCP和1,1,1-TCP的浓度出现了相对变化的现象.随着高锰酸钾浓度的增加,TCM浓度逐渐降低,表明细菌中TCM前体物不断地被高锰酸钾氧化,这有效的减少了消毒副产物TCM的产生.试验发现,消毒副产物前体物的去除和生成存在一个动态平衡,随着高锰酸钾浓度的增加,一部分消毒副产物前体物被氧化,从而减少了消毒副产物的生成,而当高锰酸钾浓度增加到一定程度后,消毒副产物前体物的生成量反而大于去除量,这一规律与刘晓飞等[13]的研究结果有相似之处.另外,高锰酸钾浓度过低会导致预氧化不完全,消毒副产物前体物去除效果不好,当高锰酸钾浓度较高时,又会影响出水水质.因此本试验条件下KMnO4浓度在2mg/L时对大肠杆菌消毒副产物前体物的氧化去除效果最好.
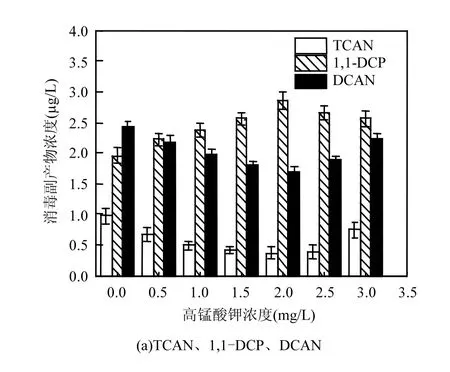
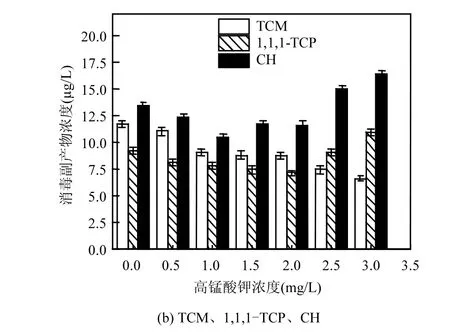
图1 高锰酸钾投加量对消毒副产物浓度的影响Fig.1 Effect of Potassium Permanganate dosages on DBPs concentration
2.2 氯化时间的影响
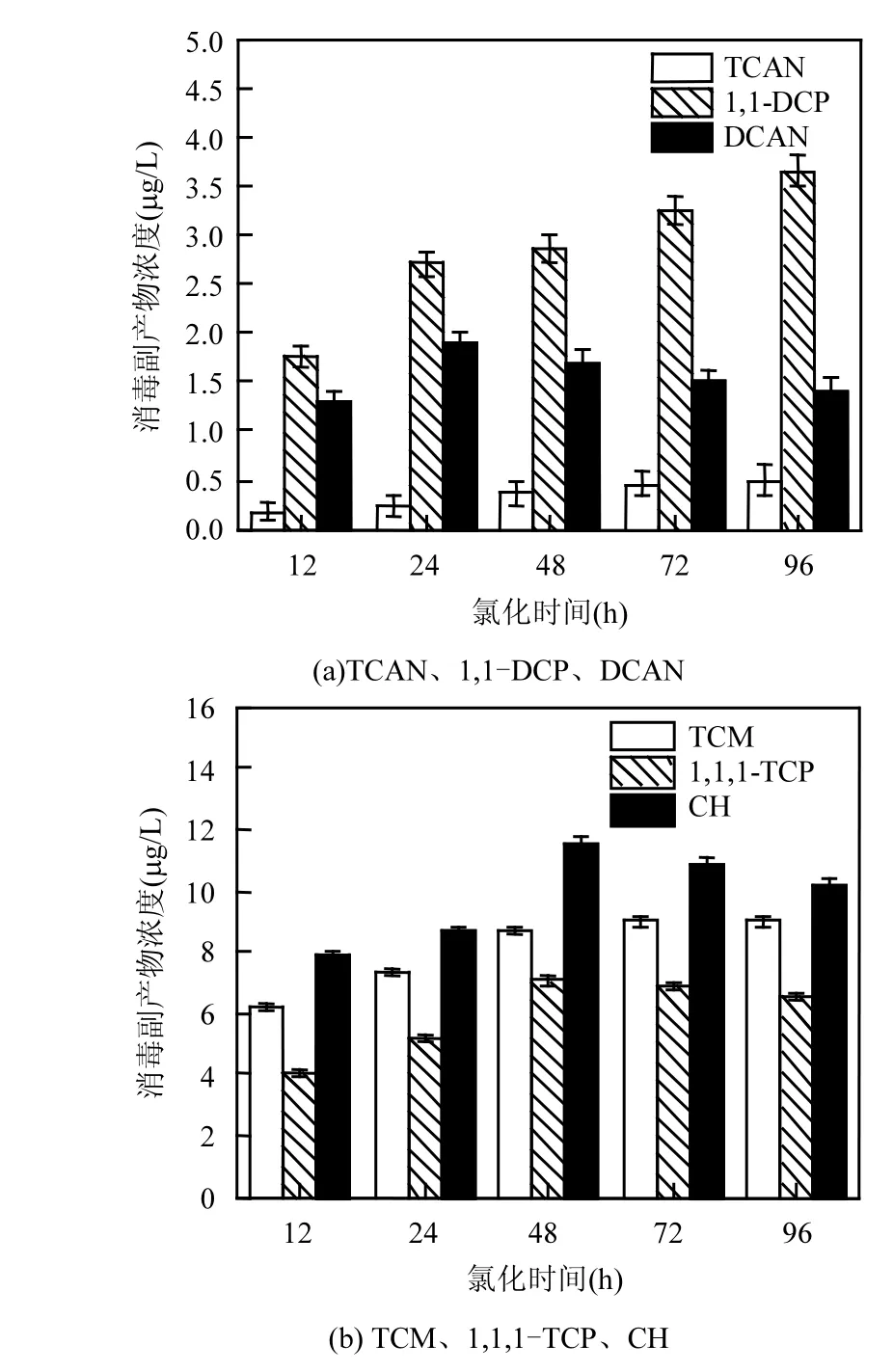
图2 氯化时间对消毒副产物浓度的影响Fig.2 Effect of chloration process time on DBPs concentration
由图2可知,随着氯化时间的增加TCAN和1,1-DCP浓度逐渐升高,而DCAN、CH和1,1,1-TCP浓度先升高后降低.TCM浓度先升高后趋于稳定.
氯化时间在12~96h之间增加时,TCAN和1,1-DCP的浓度逐渐增加,这可能是因为反应过程中这两种副产物的生成量始终大于水解减少的量,所以浓度逐渐升高.TCAN和1,1-DCP的浓度从12h时的0.18和1.76µg/L增加到96h时的0.51和3.65µg/L,分别增加了2.83和2.07倍.
而DCAN、CH、1,1,1-TCP的浓度在12~96h间先升高后降低,这是因为DCAN、CH、1,1,1-TCP为不稳定消毒副产物,在反应开始后立即生成,随着氯化时间的增加,开始水解或与余氯反应,导致浓度降低.DCAN从24h时的1.9µg/L降低到96h时的1.42µg/L,下降了25%.CH从12h时的7.88µg/L到48h时的11.55µg/L升高了46.5%,而在48~96h之间只降低了11%.表明在48h之后下降趋势减缓.
TCM浓度在12~48h之间逐渐升高,48h后开始趋于稳定,变化微小.这与TCM是稳定的消毒副产物有关.
2.3 pH值的影响
由图3可知,随着pH值的不断升高,1,1,1-TCP、TCAN浓度不断地降低;DCAN浓度先降低,再升高;TCM浓度浮动变化;而1,1-DCP、CH浓度先升高,再降低.
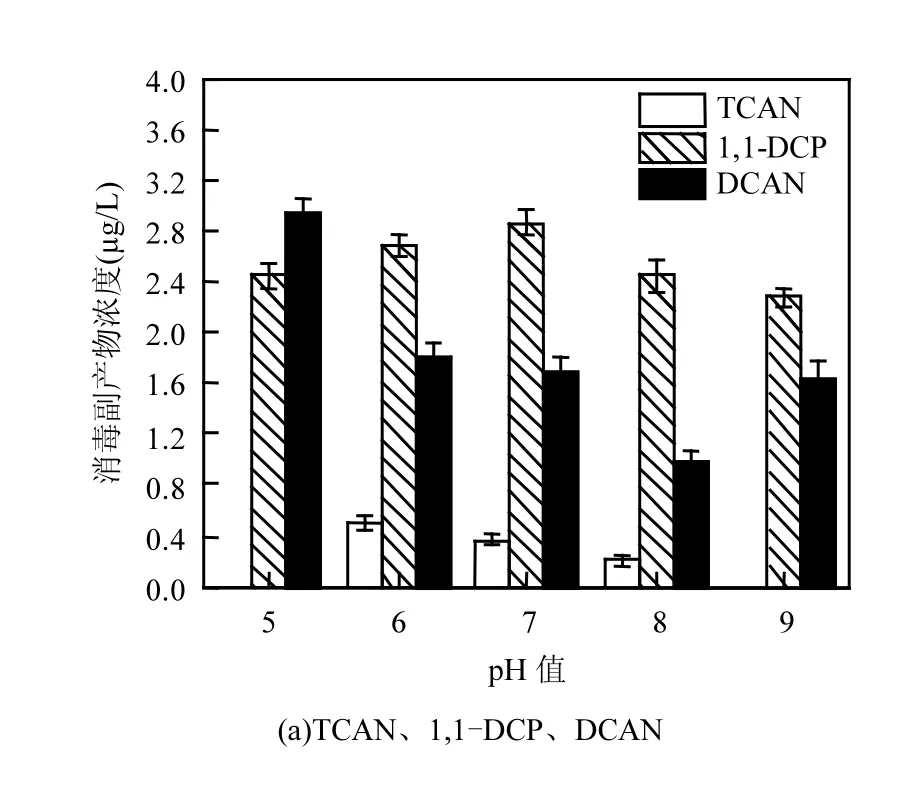
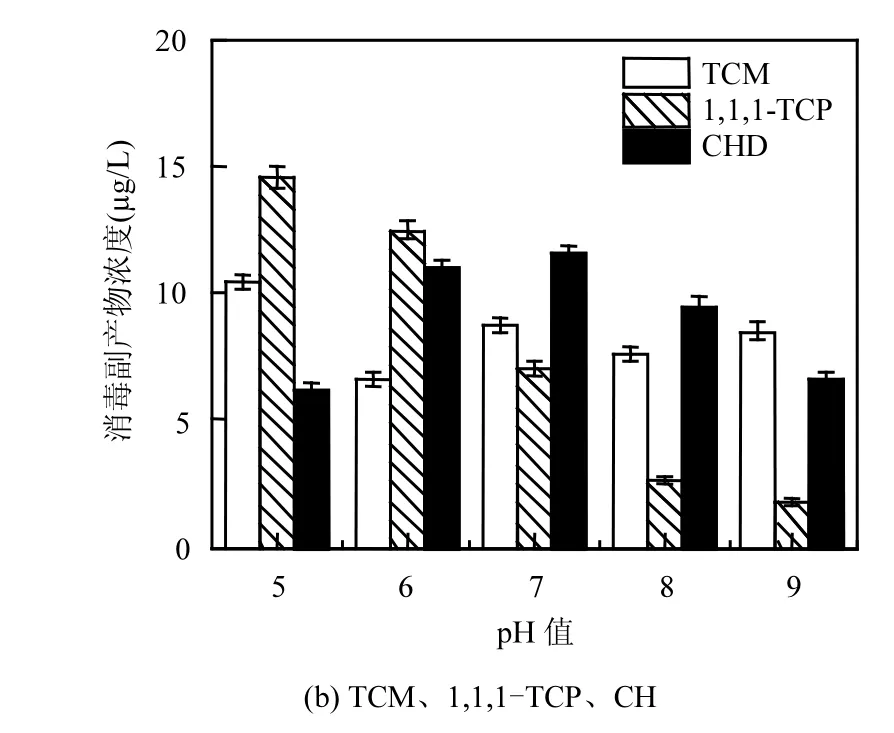
图3 pH值对消毒副产物生成浓度的影响Fig.3 Effect of pH values on DBPs formation concentration
随着pH值的不断升高,1,1,1-TCP的浓度不断减小,当pH值从5~9时,1,1,1-TCP浓度从14.61µg/L降低到1.76µg/L,去除率为87.9%,1,1,1-TCP浓度在pH值为9达到最小值,分析这是高锰酸钾氧化与酸碱度共同作用的结果,1,1,1-TCP为不稳定的消毒副产物,其水解速率随着pH值的升高而加快,当pH值为8.5时,其水解速率常数为20.90,是pH值为7时的水解速率常数的5倍[14-15],因此1,1,1-TCP的浓度随着pH值的升高而降低.pH值在5和9时,未检测到TCAN,当pH值从6~8时,TCAN浓度由0.52µg/L降低到0.22µg/L,去除率为57.6%,说明强酸和强碱性条件有利于控制TCAN的生成.DCAN的浓度随着pH值的升高先降低,再升高,在pH值为8时,达到最小值0.97µg/L,去除率为66.6%.而1,1-DCP和CH的浓度,随着pH值的升高,先升高,再降低,在pH值7时达到最大值,分别为2.87和11.55µg/L,相对而言pH值对CH浓度的影响更大,碱性条件不利于CH的生成.高锰酸钾在酸性、中性、和碱性条件下,都具有氧化性,但它的氧化性强弱取决于H+浓度的大小,在酸性条件下,其氧化性最强,易被还原成Mn2+,在碱性条件下,被还原成MnO42-.在酸性条件下,高锰酸钾的氧化性较强,对大肠杆菌氧化分解能力强,使得较多的消毒副产物前体释放出来,另外,酸性条件下,氯化消毒的HClO含量也较多.而在碱性条件下,细菌物质中难氧化部分未被充分氧化分解,消毒副产物前体物产生较少,因此碱性条件有利于对消毒副产物的控制.此结论与其他研究[16]中pH值对消毒副产物的水解速率影响较大的规律相似.
2.4 预氧化时间的影响
由图4可知,随着预氧化时间的延长,TCAN、DCAN、TCM的浓度逐渐降低;1,1-DCP 和1,1,1-TCP的浓度先升高,再降低;而CH的浓度先升高,再出现微小的波动变化.
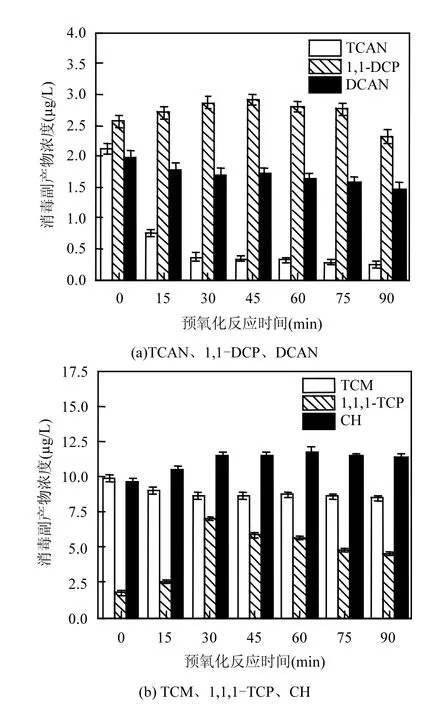
图4 预氧化反应时间对消毒副产物浓度的影响Fig.4 Effect of pre-oxidation reaction time on DBPs concentration
TCAN和DCAN浓度随着预氧化时间的延长不断降低,均在90min时达到最小值,分别为0.25和1.48µg/L,去除率分别为88%和25%,另外,TCAN浓度在0~15min期间快速下降,说明大肠杆菌中的TCAN前体物易被高锰酸钾氧化去除.1,1,1-TCP浓度在0~30min期间剧烈增加,从1.77µg/L增加到7.06µg/L,增加了3.98倍,这表明随着预氧化时间的增加,高锰酸钾对大肠杆菌氧化分解生成了大量的1,1,1-TCP前体物,随着预氧化时间的进一步延长,这部分前体物又逐渐被氧化去除,使1,1,1-TCP浓度逐渐下降.CH浓度缓慢升高再出现微小的波动变化,表明高锰酸钾对大肠杆菌中CH前体物的氧化去除与氧化时间相关性不明显,另外,虽然 CH是不稳定消毒副产物会发生水解反应,但CH在pH=7.0时的水解速率常数很低,在整个反应过程中的生成速率大于水解速率[17],这可能是导致CH的浓度微小波动的原因.TCM浓度随着预氧化时间的增加逐渐降低,在30min后趋于平缓,分析可能是 TCM前体物比较稳定,高锰酸钾只能将部分易被氧化的TCM前体物氧化去除,对另一部分难氧化的前体物去除效果不明显,预氧化时间90min时TCM浓度达到最小值,去除率为14.5%.
2.5 反应温度的影响
由图5可知,随着反应温度的升高,1,1-DCP和DCAN的浓度逐渐升高;1,1,1-TCP浓度则逐渐降低; TCAN、TCM的浓度先升高再降低,而CH浓度则先降低再升高.
温度和反应速率的关系密切,温度升高导致反应活化分子百分数增加,使得氯化反应的速率加快,因此稳定性相对较好的1,1-DCP和DCAN会随着温度的升高,其浓度也会升高,从10~30℃时,DCAN和1,1-DCP浓度分别增加了50%和28%.而随着1,1-DCP浓度的升高,1,1,1-TCP浓度反而出现了下降,与10℃时相比,1,1,1-TCP浓度降低了60%.在不同温度条件下,生成速率和分解速率的平衡可影响消毒副产物的浓度,TCAN和CH的变化趋势形成原因有两点,一是在10~20℃时,TCAN的生成速率大于分解速率,故浓度上升,在20~30℃时,TCAN的生成速率小于分解速率,故浓度下降,二是当温度由20℃升到30℃时,一部分TCAN会分解成CH,导致 TCAN浓度出现先升高再降低的现象,而CH的浓度由20℃到30℃时升高.CH浓度在20℃时最低,比10℃降低了11.2%,30℃时又比20℃升高了11.3%,这与孙兴滨等[17]在试验中的现象相似.
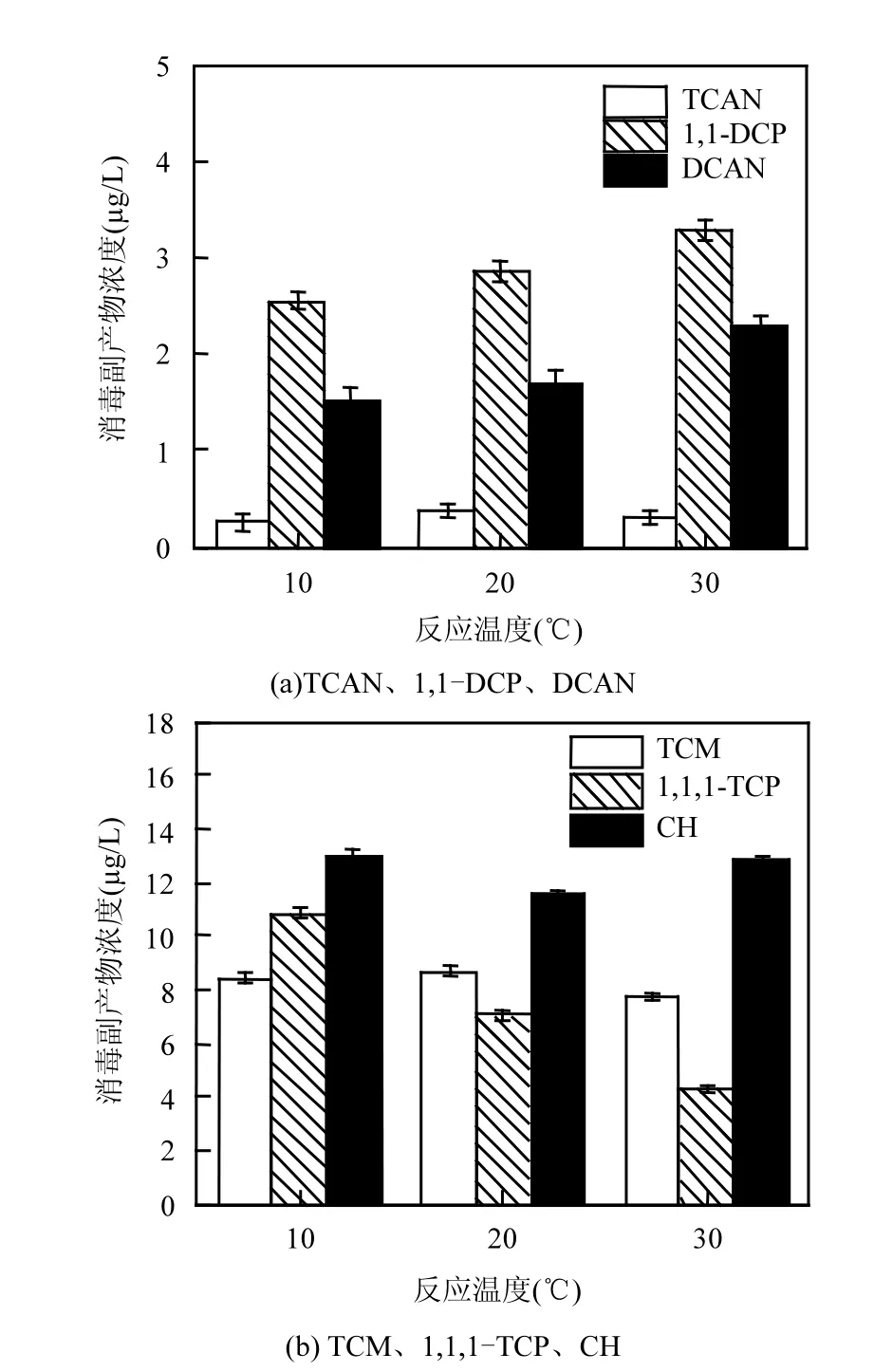
图5 反应温度对消毒副产物浓度的影响Fig.5 Effect of reaction temperature on DBPs concentration
3 结论
3.1 KMnO4浓度在2mg/L时,DCAN、TCAN、1,1,1-TCP浓度降至最低.因此,本试验条件下KMnO4浓度在2mg/L时对大肠杆菌消毒副产物前体物的氧化去除效果最好.
3.2 氯化时间不同,生成消毒副产物浓度有所不同,随着氯化时间的增加TCAN、1,1-DCP浓度逐渐升高,而DCAN、CH和1,1,1-TCP浓度先升高后降低.TCM浓度先升高后趋于稳定.总体上DCAN,CH,1,1,1-TCP和TCM在氯化时间48h后的浓度变化趋于稳定.
3.3 pH值9时1,1,1-TCP浓度降至最低,pH值8时DCAN浓度降至最低, pH值在7~9之间1,1-DCP、CH浓度降低.因此,碱性条件有利于大肠杆菌消毒副产物前体物的控制.
3.4 随着预氧化时间的延长,TCAN、DCAN、TCM的浓度逐渐降低,而1,1-DCP、CH浓度在0~30min略微升高,因此,预氧化时间控制在30min以内较为合理.
3.5 温度对几种消毒副产物有不同的影响.温度在10℃时,1,1-DCP 、DCAN、TCAN浓度最低,在20℃时TCAN、TCM浓度最高,而在30℃时1,1,1-TCP浓度最低.
[1] September S M, Els F A, Venter S N, et al. Prevalence of bacterial pathogens in biofilms of drinking water distribution systems [J].Journal of Water and Health, 2007,5(2):219-227.
[2] Zineba G, Hassan L, Mostafa M, et al. Virulence phenotype,physicochemical properties, and biofilm formation of Pseudomonas aeruginosa on polyethylene used in drinking water distribution systems [J]. Water resources, 2015,42(1):98-107.
[3] Sun X B, Sun L, Lu Y, et al.Influencing factors of disinfection byproducts formation during chloramination of Cyclops metabolite solutions. Journal of Environmental Sciences, 2014,26(3):575-580.
[4] 李林林,刘佳蒙,宋弼尧,等.饮用水中典型微生物消毒过程中消毒副产物的生成规律 [J]. 中国环境科学, 2016,36(12):3631-3638.
[5] 郑洪领,王 龙,宗逸君.我国微污染水源饮用水处理技术应用进展 [J]. 山东建筑大学学报, 2008,23(6):543-546.
[6] 张晓东,乔俊莲,吕丽萍,等.高锰酸钾预氧化对藻活性和胞内外有机物的影响 [J]. 中国环境科学, 2017,37(7):2708-2714.
[7] Zhang Y J, Wang Y, Zhou L L. Influence of excess KMnO4on the adsorption of powdered activated carbon [J]. Chemical Engineering Journal, 2013,226(12):279-285.
[8] 杨艳玲,李 星,王晓玲,等.高锰酸钾强化预氯化处理微污染原水 [J]. 中国给水排水, 2003,19(7):50-52.
[9] 李 星,杨艳玲,刘锐平,等.高锰酸钾净水的氧化副产物研究[J]. 环境科学学报, 2004,24(1):56-59.
[10] Much J W, Hautman D P. Determination of chlorination disinfection by products, chlorinated solvents, and halogenated pesticides/herbicides in drinking water by liquid-liquid extraction and gas chromatography with electron-capture detection Revision 1.0.[S]. U.S EPA Method, 551.1.1995.
[11] 肖洁雯.三种消毒剂对消毒副产物的影响研究 [D]. 广州:华南理工大学, 2012.
[12] 张 倩,杨晓波,周达诚.加氯消毒过程中纯细菌物质生成消毒副产物研究 [J]. 环境科学学报, 2010,30(2):314-320.
[13] 刘晓飞,马 军.臭氧/高锰酸盐复合预氧化控制氯化消毒副产物前质 [J]. 中国给水排水, 2006,22(9):1-4.
[14] Yang X, Shang C, Westerhoff P. Factors affecting formation of haloacetonitriles, haloketones, chloropicrin and cyanogen halides during chloramination [J]. Water Research, 2007,41(6):1193-1200.
[15] 李 坤,刘佳蒙,宋弼尧,等.高锰酸盐复合药剂预氧化对摇蚊幼虫DBPsFP的去除控制研究 [J]. 环境科学学报, 2017,37(1):249-253.
[16] 张树松.铜绿微囊藻对摇蚊幼虫生成消毒副产物影响研究 [D].哈尔滨:东北林业大学, 2015.
[17] 孙兴滨,胡 阳,袁 婷,等.高锰酸钾预氧化对剑水蚤DBPsFP的去除特征研究.中国环境科学, 2015,35(11):3296-3302.
