通窍散瘀滴鼻液与微乳刺激性及其中药效成分葛根素大鼠在体鼻循环吸收比较研究*
2018-03-02张紫薇孙如煜郑梦成杜守颖李鹏跃
贾 山,张紫薇,孙如煜,郑梦成,杨 冰,杜守颖,陆 洋,白 洁,李鹏跃
(北京中医药大学中药学院,北京 100102)
通窍散瘀方是王永炎院士的临床经验方,用于治疗急性期脑中风,疗效确切。与注射给药相比,鼻腔给药具有显著的脑靶向性[1-5],同时鼻腔给药还具有较高的生物利用度[6]。方中主要药效成分有葛根素、芍药苷和薄荷脑,分别是难溶性、水溶性、脂溶性的[7-10]。微乳具有载药量高、刺激性小的特点,前期实验室已经研究出通窍散瘀微乳的制备工艺。本课题拟比较通窍散瘀微乳与通窍散瘀滴鼻液对大鼠鼻黏膜的刺激性。采用体积校正法[11],利用大鼠在体鼻循环灌流模型考察通窍散瘀滴鼻液与通窍散瘀微乳中有效成分葛根素的鼻腔吸收变化[12-13],为通窍散瘀鼻腔给药制剂的开发奠定基础。
1 材料
TK-20B智能透皮试验仪(上海皆凯科技贸易有限公司);SartoriusBT125D电子分析天平(北京赛多利斯科学仪器有限公司);BT100-2J电子蠕动泵(保定兰格恒流泵有限公司);SPD-M20A岛津高效液相色谱仪(紫外检测器)。实验室自制通窍散瘀微乳(通过滴水法绘制伪三元相图制备通窍散瘀微乳,微乳粒径为17.86 nm,Zeta电位为-4.90 mV,含葛根素70.0 mg/mL,含芍药苷28.0 mg/mL,含薄荷脑35.0 mg/mL);实验室自制通窍散瘀滴鼻液(含葛根素70.0 mg/mL,含芍药苷28.0 mg/mL,含薄荷脑35.0 mg/mL);葛根素对照品(中国食品药品检定研究院,批号110752201514),质量分数为95.5%;1,2-丙二醇(批号:20140821,北京化工厂);去氧胆酸钠(北京索莱宝科技有限公司);聚氧乙烯-35-蓖麻油(北京凤礼精求商贸有限责任公司);肉豆蔻酸异丙酯(上海麦克林生化科技有限公司);氯化钠(北京化工厂);乙酸(色谱纯,Fisher公司);甲醇(色谱纯,美国Merck公司);纯净水(杭州娃哈哈集团);其他试剂均为分析纯。
蟾蜍(雌雄兼用,50 g左右,由北京金牧羊实验动物养殖有限责任公司提供);SD大鼠,雄性,体质量(240~260)g,北京维通利华实验动物技术有限公司提供,许可证编号SCXK(京)2016-0011。
2 方法和结果
2.1通窍散瘀滴鼻液和微乳的纤毛毒性考察
2.1.1生理盐水的配制 称取Nacl4.5g,加水500mL,配制成0.9%浓度的生理盐水溶液,备用。
2.1.2去氧胆酸钠溶液的配制 称取去氧胆酸钠0.15 g,加水 10 mL,配制成 1.5%(w/v)的去氧胆酸钠溶液,备用。
2.1.3通窍散瘀滴鼻液和微乳的纤毛毒性考察实验 将15只蟾蜍随机分为5组,即生理盐水组、通窍散瘀微乳组、阳性组(1.5%去氧胆酸钠组)、空白微乳组、通窍散瘀滴鼻液组,将蟾蜍仰卧固定,于上颚黏膜处滴加0.5 mL药物,使药液完全浸没上颚,接触30 min后,用生理盐水洗净杂物,分离蟾蜍两眼之间的黏膜,面积为3 mm×3 mm,用生理盐水洗净,黏膜面向上,平铺于载玻片上,于黏膜表面滴加少许生理盐水,盖上盖玻片,于10×40倍显微镜下观察黏膜纤毛的摆动情况,随后置于加有少量蒸馏水的层析缸中,密闭,使水蒸气呈近饱和状态,环境温度25℃。每隔30 min取出标本,阳性组每隔15 min取出,置显微镜下观察,如纤毛继续摆动则放回层析缸中,直至纤毛摆动停止,记录从给药开始至纤毛摆动停止所持续的时间(纤毛摆动时间),并计算各给药组纤毛运动时间的相对百分率,结果见表1。
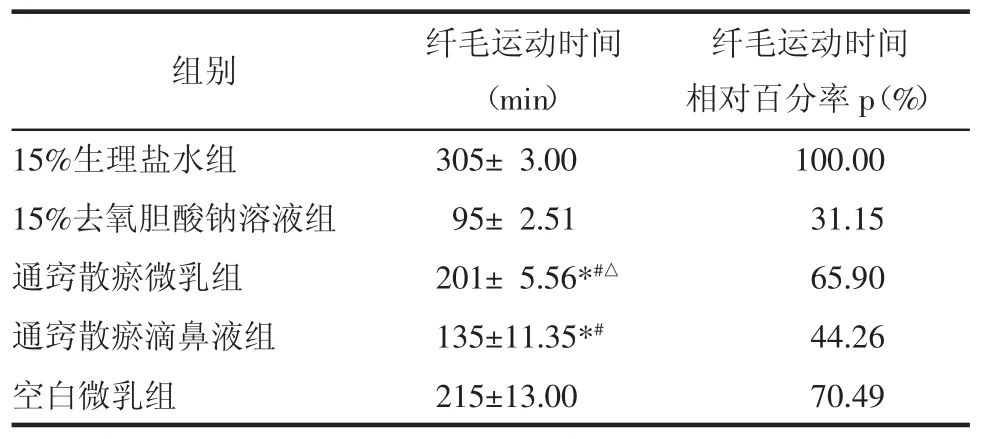
表1 纤毛运动时间表(n=3)
2.2统计方法 用SAS8.2统计软件,进行2组独立样本t检验分析。
2.3葛根素大鼠在体鼻循环吸收研究
2.3.1葛根素含量测定方法学专属性考察 结果说明,在该条件下,阴性样品对葛根素的测定没有影响。
2.3.2色谱条件 色谱柱:DIKMA Platisil ODS(250 mm×4.6 mm,5 μm);流动相:甲醇-1%乙酸水(37∶63);流速:1 mL/min;柱温:30 ℃;检测波长:250 nm。
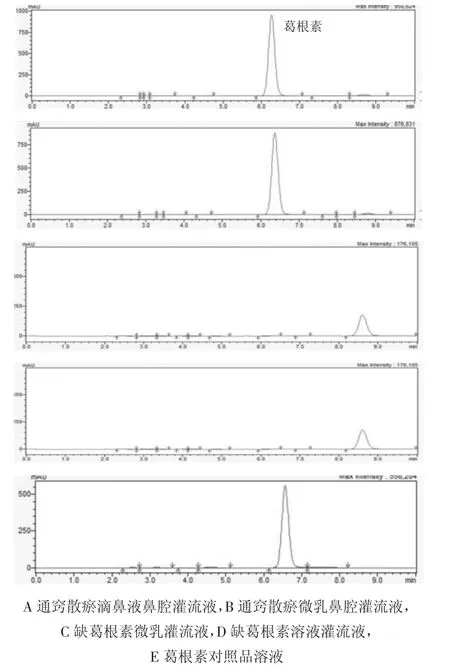
图1 葛根素对照品及样品图
2.3.3线性关系考察 精密称取葛根素对照品4.01 mg,置25 mL容量瓶中,加甲醇溶解并配制成每1mL含180.4 μg的溶液,即得对照品储备液。精密移取上述对照品储备液 0.1、0.2、0.5、1、2、5 mL,至10 mL量瓶中,用甲醇稀释至刻度,摇匀,配制成质 量浓度 分 别 为 180.4、90.02、36.08、18.04、9.02、3.608、1.804 μg/mL的系列对照品溶液。在选定的色谱条件下,测定葛根素的峰面积,以峰面积(A)对质量浓度(C)进行回归,标准曲线方程为A=83 830.055 3C+33 500.498 3,r=0.999 9,葛根素在(1.804~180.4)μg/mL,与峰面积线性关系良好。
2.3.4精密度考察 精密吸取4号对照品溶液,重复进样6次,峰面积的相对标准偏差(RSD)为0.22%,表明仪器的精密度良好。
2.3.5稳定性考察 以生理盐水为循环液,将蠕动泵进液口接一根聚乙烯管,插入盛有50 mL生理盐水的烧杯中,蠕动泵出液口连接进入大鼠鼻腔的聚乙烯管,开启蠕动泵使生理盐水通过鼻腔,速度2.5 mL/min,循环2 h后,得大鼠鼻腔分泌液。以鼻腔分泌液将通窍散瘀微乳和通窍散瘀滴鼻液分别稀释100倍,并置于37℃水浴中,孵育振荡,分别于0、2、4、6 h取样,测定葛根素的含量。结果显示,在前6 h里,通窍散瘀滴鼻液中葛根素的RSD值为1.09%,在通窍散瘀微乳中葛根素的RSD值为2.45%,表明葛根素在大鼠鼻腔分泌液中6 h内稳定。
2.3.6蠕动泵管路对药物物理吸附的考察 考察循环装置对药物物理吸附作用,将用生理盐水稀释50倍的通窍散瘀微乳和滴鼻液分别放置在10 mL置于量筒中,37℃恒温水浴,蠕动泵硅胶管插入药液中,于体外空循环,在 0、15、30、60、90、120、300、360 min取样,测定葛根素的质量,微乳RSD值为1.63%,滴鼻液RSD值为1.36%。说明6 h内,葛根素在循环管路中基本不吸附。
2.3.7大鼠鼻腔循环灌流实验 动物模型的准备:体质量(240~260)g,SD 雄性大鼠,饲养 2 d,待其充分适应环境后,正常饮水,实验前禁食12 h。大鼠腹腔注射10%水合氯醛麻醉(4.8 mL/kg),仰卧固定于鼠板上,于颈部切口暴露气管和食管。取聚乙烯管2支,一支向大鼠下端插入气管,另一支的一端向大鼠上端插入食管,直至鼻腔后端。用胶黏剂将鼻腔与口腔的鼻颚通道封闭,蠕动泵另一端插入装有药液的5 mL量筒底部,启动蠕动泵使药液循环。循环液体积流量设为2.5 mL/min。首先以生理盐水10 mL循环10 min,测定循环前后的生理盐水体积,体积变化为0.05 mL,说明整个环路密封性良好,无漏液情况。排尽生理盐水后,药液循环1min,使药液充满管路。取药液5 mL置量筒中,以一小玻璃漏斗与大鼠鼻部紧密贴合,漏斗下接量筒,保证药液经大鼠鼻腔流出后直接经漏斗进入量筒中。开启蠕动泵使药液经过蠕动泵灌流,待大鼠鼻中药液滴出时开始计时,设为 0 min,分别在灌流后的 0、15、30、45、60、90、120 min,读取量筒中剩余药液体积Vn后取样0.25 mL,补加循环药液0.25 mL,以高效液相色谱法(HPLC)测定各时间剩余药物浓度Cn。其中循环死体积为VD=5-V0,剩余药量Qn的计算方法(体积校正法)为:

式中Qn为第n个时间点的剩余药量(μg),(Vn+VD)为第n个时间点循环液的实际体积(mL),Cn为第n个取样点测得的药物质量浓度(mg/L),Cx为补加的循环药液 (母液)的质量浓度(mg/L),0.25代表取样0.25 mL。通过不同时间的剩余药量Qn,计算各时间点剩余药量百分率X,取对数后与相应时间t进行回归,回归直线的斜率即为吸收速度常数K,K的大小可反映药物的鼻腔吸收情况。X=Q/Q0,lnX=-Kt,文献报道鼻循环灌流过程中鼻腔对水分的分泌和重吸收可忽略不计,但根据实验中的实际情况,大鼠在2 h左右一般会吸收1 mL左右的吸收液,溶液体积的变化对药物吸收量的计算影响极大,经过多次预实验确定以体积法计算各时间点的Qn。将已知浓度的通窍散瘀滴鼻液和已知浓度的通窍散瘀微乳用生理盐水稀释50倍后,按上述方法进行大鼠鼻腔循环灌流实验。
3 结果
3.1通窍散瘀滴鼻液和微乳的纤毛毒性考察 通窍散瘀微乳组、通窍散瘀滴鼻液组与生理盐水组相比,差异有统计学意义(P<0.05),通窍散瘀微乳组、通窍散瘀滴鼻液组与去氧胆酸钠溶液组相比,差异有统计学意义(P<0.05=,说明通窍散瘀方做成制剂后有一定毒性与刺激性,但刺激性比去氧胆酸钠溶液组小。通窍散瘀微乳组与空白微乳组相比,差异没有统计学意义(P>0.05)。另外通窍散瘀微乳组与通窍散瘀滴鼻液组相比差异有统计学意义(P<0.05),通窍散瘀微乳组刺激性小于通窍散瘀滴鼻液组。结果见表1。
3.2葛根素大鼠在体鼻循环吸收研究 通窍散瘀滴鼻液组与通窍散瘀微乳组比较,差异有统计学意义(P<0.05),通窍散瘀滴鼻液的吸收速率大于通窍散瘀微乳。结果见表2、3,图2。
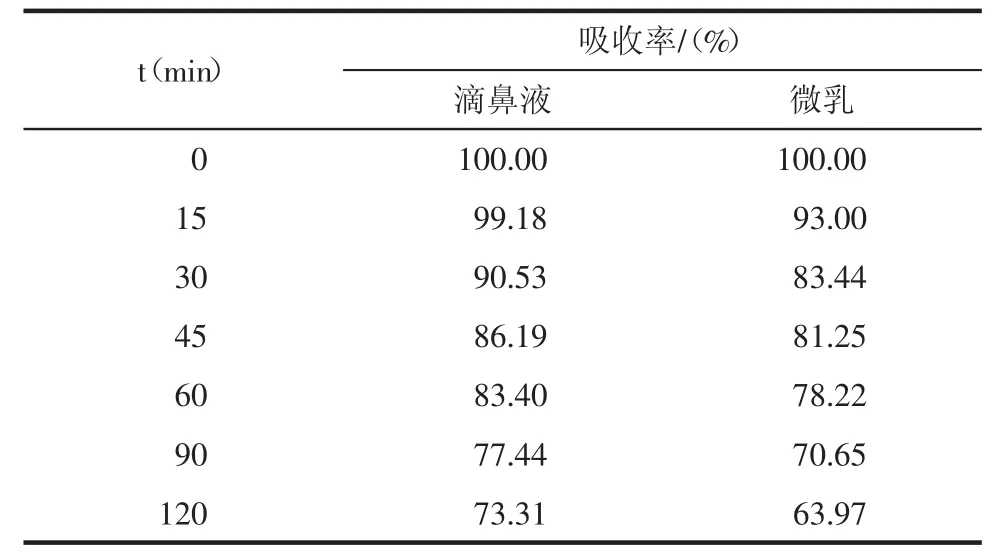
表2 葛根素大鼠在体鼻循环吸收率比较研究(n=5)
表3 葛根素大鼠在体鼻循环吸收速率常数比较(±s,n=5)×10-3/min
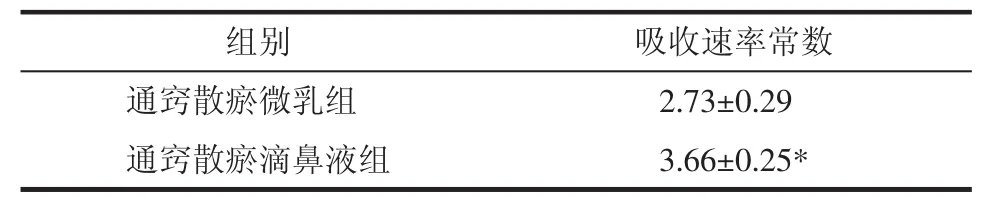
表3 葛根素大鼠在体鼻循环吸收速率常数比较(±s,n=5)×10-3/min
注:与通窍散微乳比较,*P<0.05。
组别 吸收速率常数通窍散瘀微乳组 2.73±0.29通窍散瘀滴鼻液组 3.66±0.25*

图2 葛根素在体鼻循环吸收(-lnx)-t图
4 讨论
鼻用制剂需要满足载药量高和刺激性小两大要求。而刺激性可能来自药物有效成分和微乳基质。所以在设计刺激性实验的时候,设计空白微乳组[14]。通过研究发现,空白微乳组和载药微乳组都有刺激性,并且没有统计学差异,故猜测是药物基质产生了刺激性。通窍散瘀方里的主要药效成分葛根素、芍药苷、薄荷脑,分别是难溶性、水溶性和脂溶性。常用的滴鼻液难以达到较高的载药量。本实验制备的微乳载药量高,满足临床上患者对于药物的需求。
通窍散瘀微乳是将薄荷、白芍、葛根分离提取得到的有效成分,薄荷脑、芍药苷、葛根素,以聚氧乙烯-35-蓖麻油作为乳化剂,1,2-丙二醇作为助乳化剂,IPM作为油相,通过磁力搅拌的方法制得的,制得微乳粒径为17.86 nm,Zeta电位为-4.90 mV,含葛根素70.0 mg/mL,含芍药苷28.0 mg/mL,含薄荷脑35.0 mg/mL。通窍散瘀滴鼻液与微乳载药量相同,其中薄荷脑中加入与微乳中相同量的IPM,以溶解薄荷脑。滴鼻液中含有与微乳中相同浓度的薄荷脑、芍药苷、葛根素。
本研究结果表明,通窍散瘀微乳比通窍散瘀滴鼻液的刺激性小,可能是因为方中刺激性药物薄荷脑被O/W型微乳包裹在油相里,存在在微乳的内核中。没有直接和蟾蜍的上颚皮肤接触,从而减小了刺激性。文献里也有报导挥发性药物会刺激黏膜,并且促进黏膜的吸收的相关研究[15]。
本实验采用体积校正法,通过大鼠在体鼻循环灌流方法研究通窍散瘀微乳和通窍散瘀滴鼻液的吸收速率。使用体积校正法是发现在实际的实验过程中,大鼠在2 h的实验过程中会吸收1~1.5 mL的液体。所以采用体积校正法会更准确。在鼻腔灌流的实验中,通窍散瘀滴鼻液吸收速率比通窍散瘀微乳吸收快,可能是因为通窍散瘀滴鼻液在一定程度上损伤了鼻黏膜,加快了葛根素的吸收。也有可能是因为薄荷脑对葛根素和芍药苷的吸收起到了促进作用[16-19]。
虽然葛根素在微乳中的吸收速率比滴鼻液中小,但是通窍散瘀微乳的刺激性比滴鼻液中小很多,而且载药量大。因此此部分的研究对通窍散瘀鼻用制剂的开发有一定的意义。另外还需进一步对方中其他有效成分(芍药苷及薄荷脑)进行鼻腔吸收研究。有文献报导,循环管路可能会吸附非极性的成分[20],如果薄荷脑对管路有吸附也可以考虑改进循环装置进行进一步研究。
[1] 陈晓兰,陆 洋,杜守颖,等.通窍散瘀方经不同途径给药血药和脑药动力学的比较研究[J].中华中医药杂志,2014,29(8):2668-2672.
[2] 王慧敏,魏国光,高明月,等.酒石酸卡巴拉汀鼻腔吸收及脑靶向性评价[J].药学学报,2016,64(10):1616-1621.
[3] 许日鑫.神清喷鼻微乳的工艺、质量评价及大鼠脑靶向研究[D].广州:广州中医药大学,2013.
[4] 赖宝林.芎冰微乳鼻腔给药的脑靶向性及脑局部PK-PD结合模型研究[D].广州:广州中医药大学,2011.
[5] 史亚军.黄芩有效部位鼻用脑靶向制剂研究[D].成都:成都中医药大学,2012.
[6] 陈晓兰,杜守颖,陆 洋,等.不同给药途径通窍散瘀方中葛根素在大鼠体内药动学研究[J].中国中药杂志,2011,57(17):2347-2349.
[7] 梅志刚,王明智,刘晓洁,等.葛根素对大鼠脑缺血再灌注损伤 α7nAChR、NF-кBp65及 STAT3mRNA 表达的影响[J].中华中医药杂志,2013,28(1):113-117.
[8] 李冬梅,徐 丽,张淑珍,等.芍药苷对沙土鼠脑缺血再灌注损伤的保护作用[J].医学研究生学报,2014,27(11):1139-1142.
[9] 徐晓虹,陈 瑜,郑筱祥.葛根素对脑缺血诱导神经细胞凋亡的保护作用[J].中国药学杂志,2006,54(21):1628-1631.
[10]李范珠.冰片-薄荷脑低共熔物对纳米粒鼻腔给药载药入脑的影响[A].中华中医药学会中药制剂分会.中华中医药学会第九届制剂学术研讨会论文汇编[C].广州:中华中医药学会中药制剂分会,2008.
[11]陆 洋,郝 博,温 然,等.醒脑静滴鼻液与醒脑静微乳中栀子苷大鼠在体鼻循环吸收比较研究[J].中国中药杂志,2013,59(10):1510-1512.
[12]Shinde RL,Bharkad GP,Devarajan PV.Intranasal microemulsion for targeted nose to brain delivery in neurocysticercosis:Role of docosahexaenoic acid[J].European Jour-nal of Pharmaceutics and Biopharmaceutics,2015,96:363-379.
[13]Yao Z,Lu Y,Du S,et al.Study on pharmacokinetics of jasminoidin in rabbits administered xingnaojing naristillae by nasal medication[J].China Journal of Chinese Materia Medica,2010,35(14):1871-1873.
[14]刘 梅,党学良,王庆伟,等.复方血竭微乳对豚鼠皮肤刺激性实验观察[J].中国医药导报,2011,32(31):15-16.
[15]Lu Y,Chen XL,Du SY,et al.The in situ and in vivo study on enhancing effect of borneol in nasal absorption of geniposide in rats[J].Arch Pharm Res,2010,33(5):691-696.
[16]吴玉梅,陈晓兰,魏文珍,等.透皮促进剂对雪上一枝蒿甲素经皮渗透的影响[J].贵阳中医学院学报,2015,37(5):23-26.
[17]李鹏跃,陆 洋,杜守颖,等.薄荷脑对葛根素体外黏膜的促渗作用研究[J].中国药房,2012,23(47):4425-4427.
[18]陈新梅,朱家壁,孙卫东,等.冰片对人参皂苷Rg1鼻腔吸收的促进作用及鼻腔纤毛毒性研究[J].中国药学杂志,2006,54(4):261-264.
[19]张 林.通窍散瘀方中有效成分鼻黏膜吸收及鼻—脑间接通路转运机制的研究[D].北京:北京中医药大学,2016.
[20]温 然,陆 洋,杨 冰,等.醒脑静不同制剂给大鼠鼻单向灌流后龙脑和麝香酮吸收比较研究[J].中草药,2013,44(20):2894-2897.
