葛根素参与的可注射钙离子敏感凝胶构建和性质研究*
2018-03-02岳占龙崔元璐
岳占龙,崔元璐
(天津中医药大学中医药研究院,天津 300193)
骨关节炎(OA)是一种以关节软骨退行性病变和继发性骨质增生为特征的慢性关节疾病。65岁以上的老年人,其骨关节炎的患病率高达33.9%[1]。骨关节炎自我修复能力差,传统治疗仅能够在一定程度上缓解症状、延缓病情发展,缺少有效的治疗措施。关节腔内直接给药和干细胞注入修复,是骨关节炎治疗的新策略。海藻酸钠(SA)是生物相容性良好的天然多糖,能与Ca2+络合形成经典的蛋盒结构凝胶[2-4]。实验发现葛根素(Pu)可参与海藻酸钙凝胶构建,增加海藻酸钙凝胶的强度,同时Pu具有诱导间充质干细胞向软骨细胞分化的活性[5]。研究发现骨关节炎患者关节液中钙离子浓度较高[6-7],利用这一特点,构建SA、Pu参与的可注射型离子敏感凝胶,对骨关节炎患者关节液中较高浓度的Ca2+产生响应,在关节腔中由液体状态迅速形成凝胶,作为药物控释或者负载干细胞的载体,通过干细胞的多向分化潜能,修复重建软骨组织来治疗骨关节炎。
1 试剂与仪器
海藻酸钠,生工生物工程(上海)股份有限公司,中国;葛根素(纯度>99%),上海永恒生物科技有限公司,中国;粉防己碱(Tet,纯度>98%),上海永恒生物科技有限公司,中国;无水氯化钙(CaCl2纯度≥96%),天津市风船化学试剂科技有限公司,中国;色谱纯甲醇,天津康科德有限公司,中国;色谱纯乙腈,天津康科德有限公司,中国;苯甲酸,天津市光复精细化工研究所,中国;粉防己碱标准品,中国食品药品检定研究院;葛根素标准品,中国食品药品检定研究院。
DV-III程序式黏度计,Brookfield公司,美国;智能温控式恒温金属浴,杭州博日公司,中国;AR1000流变仪,TA公司,美国;Quanta 200环境扫描电子显微镜,FEI公司,美国;SPH-111B大容量恒温培养摇床,上海世平实验设备有限公司,中国;2695型高效液相色谱仪,Waters公司,美国;Kromasil 100-5 C18色谱柱(4.6 mm×250 mm),Eka Chemicals AB 公司,瑞典。
2 实验方法
2.1葛根素-海藻酸钙凝胶的制备 称取一定量的SA,加入适量超纯水,45℃电磁搅拌4~6 h至完全溶解,4℃条件下放置24 h,成稳定的溶胶,备用。在SA溶液中加入一定质量的Pu粉末,50℃条件下溶解或者分散均匀,得到两者的混合液。纯水配制CaCl2溶液,在西林瓶中快速拌条件下将等体积的SA与CaCl2溶液混合均匀,常温放置2 h使凝胶充分溶胀,得到一系列处方凝胶。采用翻转小瓶法初步判断处方中SA、CaCl2与Pu三者浓度对凝胶强度影响的大小与三者所需的浓度范围,以凝胶强度可以承受自重翻转为佳。
2.2葛根素-海藻酸钙凝胶黏度测定 按照3.1中方法制备以下处方:(1)0.5%SA、(2)1.0%SA、(3)1.5%SA、(4)1.0%SA+0.2%Pu、(5)1.0%SA+0.5%Pu、(6)1.0%SA+1.0%Pu、(7)0.5%SA+6 mmol/L CaCl2、(8)0.5%SA+6 mmol/L CaCl2+0.15%Pu、(9)0.5%SA+6 mmol/L CaCl2+0.25%Pu、(10)0.5%SA+6 mmol/L CaCl2+0.5%Pu,温度为37℃条件下,采用DV-III黏度计64号探头,液面下深度2.5 cm对进行粘性测定。
2.3凝胶最佳处方筛选 按照3.1中制备方法,依据凝胶制备所需三者的浓度范围,采用单一变量法调整SA、CaCl2和Pu的浓度制备凝胶,CaCl2设置4、6、8 mmol/L 3个浓度梯度,SA 设置 0.55%、0.60%、0.65%、0.70%4个浓度梯度,Pu设置0.03%、0.1%、0.2%3个浓度梯度。通过流变仪测定凝胶流变流参数,从流变学结果中筛选最佳处方,流变仪参数:振动过程,角频率 0.1~100 rad/s,20 mm 锥形盘,温度37℃。
2.4扫描电镜分析 按照3.1中制备方法,按照以下处方制备凝胶:1)1.0%SA+0.2%Pu;2)0.5%SA+4 mmol/L CaCl2+0.2%Pu;3)0.5%SA+4 mmol/L CaCl2;4)0.5%SA+8 mmol/L CaCl2,溶胀均匀后,在-80℃冰箱中预冻,然后在冻干机中冻干,用手术刀片将冻干样品切片,喷金后扫描电镜下观察凝胶的微观结构。
2.5凝胶溶胀、降解实验
2.5.1凝胶的溶胀实验 按照3.1中制备方法,制备两种处方凝胶:0.6%SA+6 mmol/L CaCl2、0.6%SA+6 mmol/L CaCl2+0.2%Pu,每组平行4个样本,在15 mL离心管中称量质量约2 g,于真空干燥箱中65℃真空干燥超过24 h,得到干燥凝胶,称量干燥凝胶的质量,加含有0.01%苯甲酸的无菌PBS溶液至15 mL,保存于37℃环境,于设定时间点弃去PBS溶液,滤纸吸取凝胶表面水分,称量凝胶湿质量,根据溶胀率计算公式得到溶胀率:
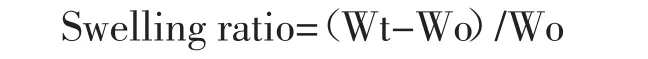
Wo为凝胶干重,Wt为凝胶溶胀后质量。
2.5.2凝胶的体外降解实验 按照3.5.1方法制备凝胶,每组平行4个,在15 mL离心管中称量质量约2 g,于真空干燥箱中65℃真空干燥24 h以上,得到干燥凝胶,称量干燥凝胶的质量,加PBS溶液后,置于37℃恒温摇床中,于固定时间点取样,滤纸吸取凝胶表面水分,真空干燥并称质量,得到降解后凝胶的干质量,通过对比凝胶降解后损失质量与降解前干重得到降解率。
2.6葛根素海藻酸钙凝胶的体外药物释放 配制1.2%SA溶液和12 mmol/L CaCl2溶液,按照3.1中方法,用1.2%SA溶液溶解Pu,12 mmol/L CaCl2溶液溶解粉防己碱(Tet)。使用以上溶液制备两种凝胶,处方为:0.6%SA+6 mmol/L CaCl2+0.2%Pu+0.05%Tet、0.6%SA+6 mmol/L CaCl2+0.05%Tet。释放过程在恒温摇床中完成[8],释放介质为含有0.01%苯甲酸PBS溶液,通过0.22 μm孔径滤膜除菌,称量质量为2 g凝胶密封于截留量为7 000 Da的半透膜中,释放条件为:PBS溶液100 mL,温度为37℃,转速为55 r/min,采样时间点为:0.5、1、3、7、12、24、48、72 h,取样2 mL,同时补充PBS溶液。采用HPLC方法探索流动相比例,对Pu、Tet标准品溶液进样,检测波长分别为250 nm、278 nm,绘制积分面积-浓度标准曲线,同样方法测定样品中Pu、Tet浓度,计算药物的累积释放速率。
3 实验结果
3.1葛根素-海藻酸钙凝胶的制备 当CaCl2浓度达到3.0 mmol/L时即发生弱的胶凝现象,随着钙离子浓度增加胶凝强度增加,凝胶强度越弱则流动性越明显,凝胶强度过大则会出现局部胶凝,凝胶体积缩小并有水析出,通过翻转小瓶法初步判断处方中SA、CaCl2和Pu对凝胶强度影响由大到小依次为CaCl2>SA>Pu,胶凝化良好时3种材料的浓度范围依次为 CaCl2:5~7 mmol/L、SA:0.5%~1.0%、Pu 浓度<0.3%。
3.2葛根素-海藻酸钙凝胶黏度测定结果 由表1数据可知,对于SA溶液,随着SA浓度增加,黏度不断增加,每增加0.5%浓度,黏度增加3~8倍,形成凝胶后黏度快速增加,Pu微溶于水并具有水化特性,当Pu过饱和时,能够使SA溶液和凝胶黏度明显增加,未饱和时(≤0.25%)对SA溶液和凝胶黏度无明显影响,处方中3种原料对凝胶黏度影响大小顺序为 CaCl2>SA>Pu。
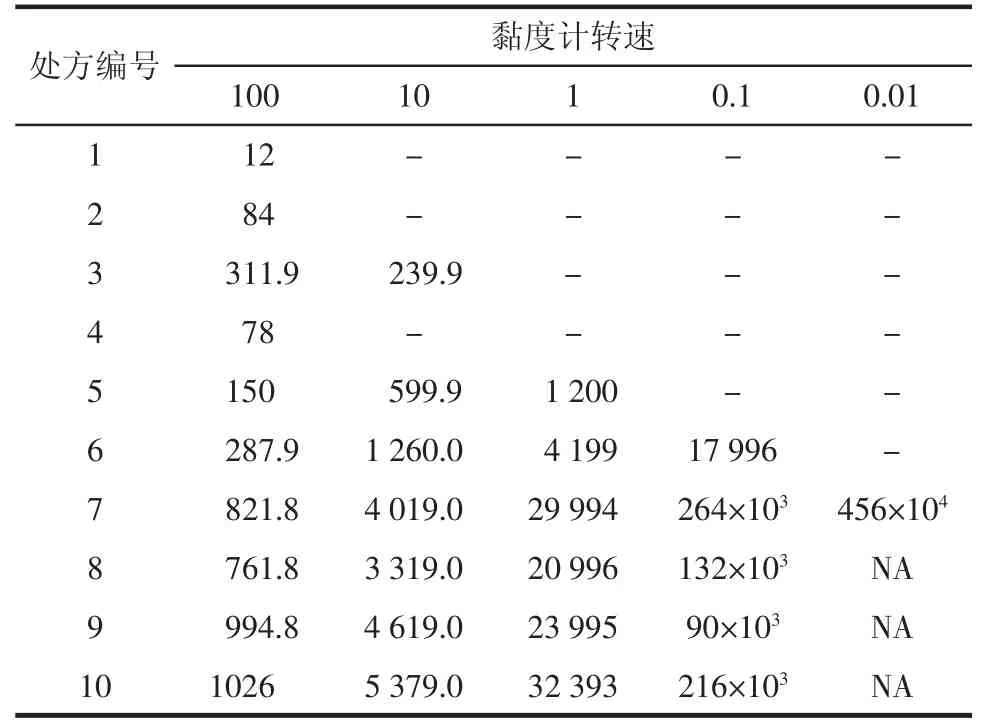
表1 葛根素-海藻酸钙凝胶黏度测定结果cP
3.3凝胶最佳处方筛选 通过流变学方法表征凝胶流变学参数时,当黏性模量G”>弹性模量G’时,溶液处于黏性液体状态,当G’>G”时表现为凝胶状态[9],凝胶的强度大小由G’决定。筛选最佳凝胶处方参考李凯[10]等研究结果,用于间充质干细胞培养的透明质酸凝胶最佳强度为G’略大于100 Pa。当CaCl2浓度≤6 mmol/L 时,G’与 G”大小相近,凝胶强度偏弱,达到8 mmol/L时,凝胶强度过大;SA浓度在0.55%~0.65%之间对凝胶强度影响不大,达到0.7%流变学参数变得不规律;Pu浓度≤0.1%时,对凝胶强度影响不明显,葛根素浓度达到0.2%时对凝胶强度有明显的促进作用,也证明了葛根素可能参与海藻酸钙凝胶构建。在确保所得凝胶均一透明和可注射性前提下,筛选最佳凝胶处方为0.6%SA+6 mmol/L CaCl2+0.2%Pu。
3.4凝胶的显微结构 根据图4凝胶扫描电镜结果可知,SA与Pu的混合物不具有明显的网孔支架结构,而是呈现不规则的层状碎片结构,含有0.2%Pu处方的凝胶中有Pu析出,存在与凝胶网孔壁上。处方中CaCl2浓度达到4 mmol/L即形成三维网孔支架结构,网孔单元直径约为100 μm,分布规律,大小均一;当CaCl2浓度达到8 mmol/L时,凝胶网孔单元直径减小至60 μm左右,孔隙率有所下降,由于凝胶强度较大,冻干凝胶平面切片时形成较多碎片。相比传统2D培养,3D培养更贴近体生理条件,使细胞更好的表达出生理功能[11],扫描电镜结果说明,Pu-海藻酸钙凝胶结构具有较大孔隙率,符合细胞3D培养的要求,能够为细胞提供充足的生长空间,保证细胞的营养物质和气体交换。
3.5凝胶体外溶胀、降解性质
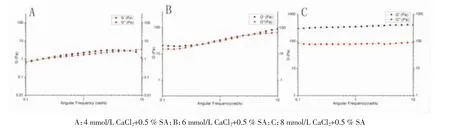
图1 不同浓度CaCl2条件下凝胶流变学参数

图2 不同浓度SA条件下凝胶流变学参数
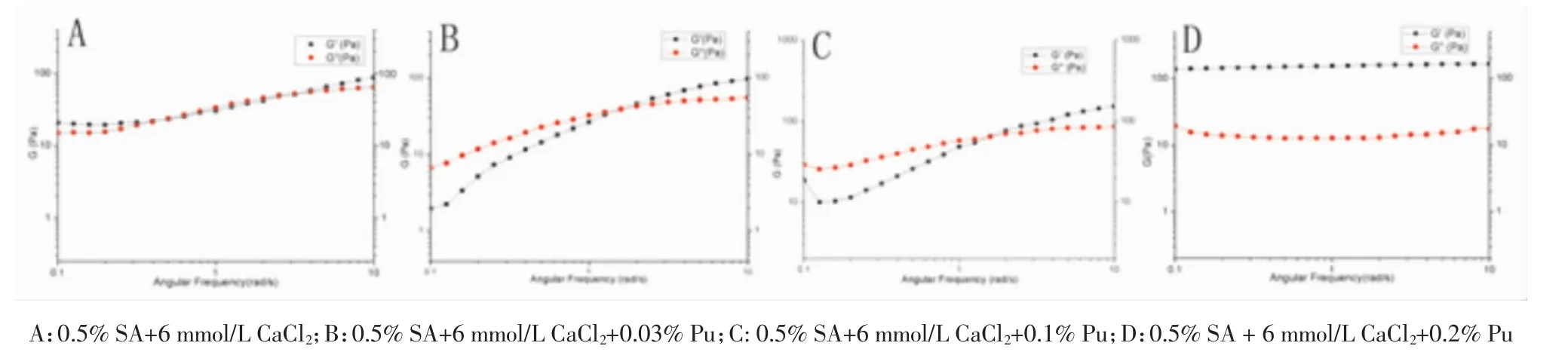
图3 不同浓度Pu条件下凝胶流变学参数

图4 凝胶的扫描电镜图
3.5.1凝胶体外溶胀结果 由图5凝胶溶胀结果可知,无论是海藻酸钙凝胶还是Pu-海藻酸钙凝胶,在12 h溶胀平衡,海藻酸钙凝胶溶胀率为75倍,Pu-海藻酸钙凝胶的溶胀率为45倍。对于海藻酸钙凝胶,强度弱则溶胀率大,Pu具有增加海藻酸钙凝胶强度的作用,导致凝胶的溶胀率下降。凝胶溶胀率反映了凝胶的保水性和孔隙率,对于细胞的支架材料来说,要为细胞提供稳定载体和营养物质交换条件,凝胶强度太大不利于营养物质交换,强度小则降解速度快。
3.5.2凝胶体外降解结果 在体外降解实验中,Pu-海藻酸钙凝胶均匀、透明,溶胀体积较小,而海藻酸钙凝胶有白色片状絮凝现象,溶胀体积较大。说明Pu-海藻酸钙凝胶强度较大,凝胶状态更稳定。海藻酸钙凝胶在12 d开始出现明显降解,到第24天降解83.78%,Pu-海藻酸钙凝在第24天开始降解,降解率仅为18.86%。对于负载细胞和药物的关节原位注射凝胶,要求凝胶强度和降解周期与治疗周期相符,体内关节腔环境比较复杂,一方面是生理环境,透明质酸能够阻碍SA与Ca2+形成凝胶[12],二是关节腔存在的机械力,对凝胶的降解也有促进作用。Pu-海藻酸钙凝胶相比海藻酸钙凝胶在溶胀、降解性质方面都具有明显优势,Pu-海藻酸钙凝胶更符合骨关节炎的治疗要求。
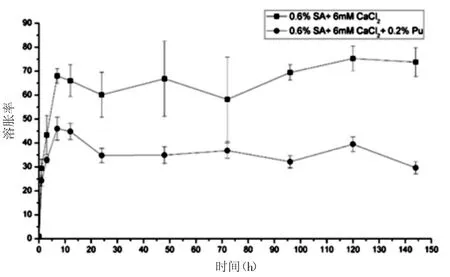
图5 凝胶的平均溶胀率曲线图
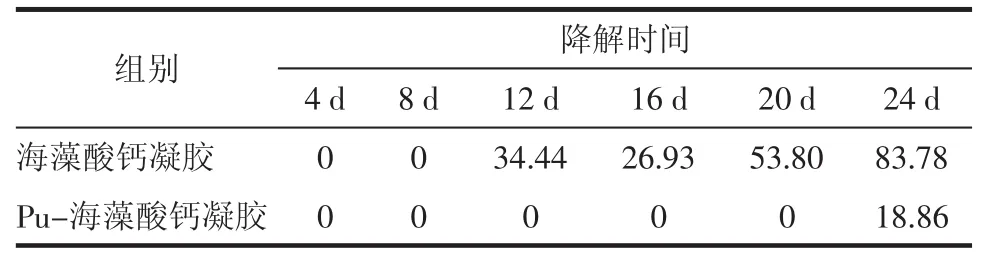
表3 凝胶的体外平均降解率%
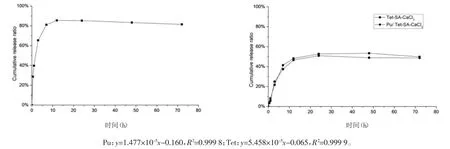
图6 药物释放曲线(左:Pu,右:Tet)
3.6葛根素海藻酸钙凝胶的体外药物释放 样品通过HPLC进样测定浓度,经过条件筛选,Pu流动相比例为0.1%磷酸水溶液:甲醇=1∶1,Tet流动相比例为0.1%磷酸水溶液:甲醇∶0.1%三乙胺乙腈溶液=0.1∶0.55∶0.35。采用标准品溶液得到浓度-积分面积标准曲线分别为 Pu:y=1.477×10-5-0.160,R2=0.99 9 8;Tet:y=5.458×10-5-0.065,R2=0.9999。
从药物释放结果看,Tet在24 h基本达到释放平衡点,仅仅释放药物总量的53%,中性Tet在弱碱性水溶液中会以微晶体或亚微晶体析出,释放完成后凝胶中可见析出的Tet药物,所以Tet释放药物总量的53%。Pu的存在对Tet释放基本无影响,对于海藻酸钙凝胶,改变胶凝强度对于Mw≤20 000 Da药物释放基本无影响[13]。凝胶中Pu释放速率较快,于12 h基本达到释放平衡点,累积释放率达到药物总量的85.5%,首先葛根素有少量的降解[14],由释放曲线12 h到72 h结果可知,Pu在释放条件下有少量降解。其次因为Pu的吸光度极易受pH值的影响,随着pH值变大,Pu黄酮母核羟基容易电离,λmax发生明显红移[15],红移后在原λmax吸光度减小,此时测得Pu含量偏小。
4 讨论
海藻酸钙凝胶一般通过SA与不溶性钙盐缓慢释放Ca2+交联所得,SA与Ca2+能够迅速发生物理交联而胶凝化[16-17],直接滴加法也只适用于制备凝胶粒子,粒子表面交联强度大于内部[18],实验证明当Ca2+浓度小于7 mmol/L时,采用物理搅拌可以得到均一凝胶。以SA为主要材料构建Pu-海藻酸钙凝胶具有以下优势,SA生物相容性良好;SA均为酸性多糖,关节滑液主要成分为透明质酸[19-20],两者性质相似[21];骨关节炎患者滑液中透明质酸有明显降低趋势[20],采用SA材料能够改善此病理条件;有文献报道SA能够促进间充质干细胞向成骨细胞分化[22];人体缺少SA相关降解酶,经关节注射后,SA在体内降解缓慢,比较适用骨关节炎这类慢性疾病。Pu-海藻酸钙凝胶具有较高孔隙率,为细胞生长提供充足的空间,与海藻酸钙凝胶相比,弹性模量G’较大、溶胀率下降、体外降解时间长,一致说明Pu对海藻酸钙凝胶强度有促进作用,凝胶性质有所改善。负载粉防己碱凝胶表现出良好的药物缓释行为,24 h内释放药物总量的53%,未释放药物会随着凝胶的缓慢降解逐渐释放。综上所述,Pu-海藻酸钙凝胶有望成为骨关节炎治疗的良好载体。
[1] NeogiT.The epidemiology and impactofpain in osteoarthritis[J].Osteoarthritis Cartilage,2013,21(9):1145-1153.
[2] Donati I,Holtan S,Mørch YA,et al.New hypothesis on the role of alternating sequences in Calcium-alginate gels[J].Biomacromolecules,2005,6(2):1031-1040.
[3]Siew CK,Williams PA,Young NWG.New insights into the mechanism of gelation of alginate and pectin:charge annihilationandreversalmechanism[J].Biomacromolecules,2005,6(2):963-969.
[4] Borgogna M,Skjåk-Bræk G,Paoletti S,et al.On the initial binding of alginate by Calciumions.The tilted egg-box hypothesis[J].The Journal of Physical Chemistry B,2013,117(24):7277-7282.
[5] 蔡 花,吴乐乐,孙晓春,等.葛根素对脐带间质干细胞增殖与成骨分化的作用[J].药学学报,2011,46:738-741.
[6] Yavorskyy A,Hernandez-Santana A,Shortt B,et al.Determination of Ca-in synovial fluid samples as an aid to diagnosing osteoarthritis[J].Bioanalysis,2010,2:189-195.
[7] Wan LQ,Jiang J,Arnold DE,et al.Ca-concentration effects on the mechanical and biochemical properties of chondrocyte-alginate constructs[J].Cell Mol Bioeng,2008,1:93-102.
[8] 周姝春.可注射的温敏性水凝胶用于盐酸阿霉素缓释载体的研究[D].上海:复旦大学,2011.
[9] Agulhon P,Robitzer M,Habas JP,et al.Influence of both cation and alginate nature on the rheological behavior of transition metal alginate gels[J].Carbohydrate polymers,2014,112(1):525-531.
[10]李 凯.不同浓度透明质酸水凝胶性能表征及其对骨髓间充质干细胞三维培养生长行为的影响[D].北京:北京协和医学院,2013.
[11]Glicklis R,Shapiro L,Agbaria R,et al.Hepatocyte behavior within three-dimensional porous alginate scaffolds[J].Biotechnology and Bioengineering,2000,67(3):344-353.
[12]梁 晔.海藻多糖生物交联剂的制备、性质及其生物学性能研究[D].青岛:中国海洋大学,2008.
[13]Puguan JMC,Yu X,Kim H.Diffusion characteristics of differentmolecularweightsolutesinCa-alginategelbeads[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2015(469):158-165.
[14]国海东,蒋 艳,上官新晨,等.葛根素的稳定性研究[J].食品科技,2014(11):229-232.
[15]邢志华,何丽娟,孙志伟,等.溶液pH值对葛根素结构稳定性影响[J].哈尔滨商业大学学报(自然科学版),2015,31(6):650-652.
[16]Chung TW,Yang J,Akaike T,et al.Preparation of alginate/galactosylated chitosan scaffold for hepatocyte attachment[J].Biomaterials,2002,23(14):2827-2834.
[17]Hollister SJ.Porous scaffold design for tissue engineering[J].Nature Materials,2005,4(7):518-524.
[18]高春梅,柳明珠,吕少瑜,等.海藻酸钠水凝胶的制备及其在药物释放中的应用[J].化学进展,2013,25(6):1012-1022.
[19]Bouloux GF.Temporomandibular joint pain and synovial fluid analysis:a review of the literature[J].Journal of Oral and Maxillofacial Surgery,2009,67(11):2497-2504.
[20]丁 伟,康治臣,谢天奇,等.透明质酸对骨性关节炎作用的研究进展[J].中国实验诊断学,2014,18(3):512-514.
[21]王 嫣,陈小菊,王 兰,等.海藻酸钠凝胶对骨髓间充质干细胞生物学效应的初步研究[J].重庆医科大学学报,2006,31(4):478-481.
[22]赵 昱,段王平,卢剑功,等.海藻酸钠凝胶球复合软骨细胞体内外降解对比分析[J].中国矫形外科杂志,2016,24(12):1101-1106.
