木质纤维“一锅法”制备生物乙醇的研究进展
2018-03-01常福祥孙建中王钱钱
魏 薇, 常福祥, 孙建中, 王钱钱,2,3*
(1. 江苏大学 环境与安全工程学院;生物质能源研究所, 江苏 镇江 212013; 2. 中国林业科学研究院 林产化学工业 研究所;江苏省 生物质能源与材料重点实验室, 江苏 南京 210042; 3.中国科学院 广州能源研究所; 广东省新能源和可再生能源研究开发与应用重点实验室, 广东 广州 510640)
乙醇是一种可以通过糖发酵获得的可再生能源。在美国,乙醇已经被广泛用作特殊的石油替代品。第一代燃料乙醇是淀粉乙醇,多采用粮食作物为原料,造成了食品价格增长与耕地的占用,将能源危机转变成了食品危机[1]。另外,有学者指出生产淀粉乙醇所需的热能主要由化石燃料提供,这使得温室气体排放并未得到改观甚至还有所增长[2]。上述缺陷让国际社会将更多目光投向第二代燃料乙醇,即纤维素乙醇。纤维素乙醇以非粮木质纤维为原料,整合先进的生物精炼与废气处理工艺,实现液体燃料生产的同时降低温室气体排放[3-4]。木质纤维是地球上最丰富的可再生资源,主要来自于木材和农业废弃物,既可以用于制备生物乙醇、生物氢气等生物能源[5-7],同时也可以用于制备各种化工原料及生物基材料[8-10],将其转化为燃料乙醇,避免食品危机的产生[11]。此外,木质纤维具有产量高、分布广、绿色、环保、可再生等特点[12],使得它在制备生物乙醇和化工原料方面具有广阔的应用空间[13]。然而,由于木质纤维复杂的结构和多样性,使其转化效率受到一定限制[14]。木质纤维制备生物乙醇一般需要经过预处理、酶解糖化和发酵3个过程。预处理的目的是破坏纤维细胞的致密结构,提高底物后续酶解转化率。酶解糖化过程是将纤维素水解为低聚糖和单糖,同时降低水解产物的黏性,使水解产物更易搅拌[15]。木质纤维底物的酶解糖化是一个复杂的多相催化反应,不仅受到底物和纤维素酶自身性质的影响,同时还与纤维素酶在底物上的吸附、渗透等传质过程密切相关[16]。木质纤维原料经预处理和酶解糖化之后,通过酵母菌发酵得到生物乙醇。传统的分步酶解糖化发酵(SHF)是指预处理后的原料先经酶解糖化生成葡萄糖,然后在另一反应器中进行发酵转化为乙醇。SHF主要优点是糖化和发酵都能在各自最优的条件下进行[17],缺点是糖化产物葡萄糖和纤维二糖的积累会抑制纤维素酶的活力,导致产率降低,而发酵生产乙醇的过程中,高浓度的乙醇会抑制酵母的活性,降低乙醇产率。为了弥补SHF工艺的不足,有研究者开发出了木质纤维“一锅法”制备生物乙醇的新方法。“一锅法”包括预处理与酶解糖化“一锅法”,酶解糖化与发酵“一锅法”,酶制备、酶解糖化与发酵“一锅法”以及预处理、酶解糖化与发酵“一锅法”等。笔者对以上4种“一锅法”制备生物乙醇的方法进行了介绍,并分析了各自的国内外研究进展,旨在为木质纤维“一锅法”制备生物乙醇的工业化应用提供参考。
1 预处理与酶解糖化“一锅法”
图1为传统工艺和预处理与酶解糖化“一锅法”制备生物乙醇的对比。从图1(a)中可以看出,传统工艺制备生物乙醇,预处理、酶解糖化和发酵都是独立的操作单元。这种工艺预处理后需要大量的水洗去木质纤维表面的化学残留物,存在水资源浪费和废弃物难以处理的问题。为了解决这一问题,有研究者提出了预处理与酶解糖化“一锅法”,工艺流程如图1中(b)所示。从图1(b)中可以看出,“一锅法”制备生物乙醇过程中,预处理与酶解糖化在同一反应器中进行,酶解后直接提取出糖,获得木质素并回收化学溶剂,不仅节省费用,同时可以提高发酵条件的稳定性。
Shi等[13]采用预处理与酶解糖化“一锅法”,使用离子液体[C2mim][OAc]对柳枝稷进行预处理,研究了不同预处理温度和时间对预处理效果的影响。预处理后的底物,无需水洗直接稀释至离子液体体积分数为10 %和20 %,每克底物中加入5.75 mg的耐高温纤维素酶JTherm酶,在50和70 ℃下分别进行酶解。研究发现,预处理温度对预处理效果影响较小,160 ℃预处理3 h可以实现最优的预处理效果。在离子液体体积分数为10 %,70 ℃酶解72 h后,葡聚糖转化率为81.2 %,木聚糖转化率为87.4 %,通过湿法萃取可将90 %的木聚糖和葡聚糖分离。采用预处理与酶解糖化“一锅法”制备生物乙醇与“分步法”相比,可以节省70 %~90 %的水。Auxenfans等[14]将棉花中的纤维素在[Emim]+[MeO(H)PO2]-离子液体中进行预处理,加入里氏木霉(Trichodermareesei)纤维素酶,使得纤维素的最终质量分数为2 %,纤维素酶用量为1 g/L,研究不同的离子液体用量对酶水解的影响。研究发现,在离子液体为10 %,40 ℃酶解90 h时,葡聚糖的转化率为(68±6)%。Liszka等[18]研究了一种基于二羧酸的新型离子液体,使用胆碱氢氧化物作为阳离子、水中的游离酸作为阴离子,在室温中反应15 min,用活性炭去除杂质,该过程预处理效率高并且对商业酶混合物和微生物发酵宿主生物体影响小。研究表明,使用离子液体预处理柳枝稷,液固比为20∶1(mL∶g),120 ℃条件下预处理3 h,预处理后直接酶解,在每克底物中加入20 mg纤维素酶CTec2和HTec2的混合酶(用量为9∶1),50 ℃条件下酶解72 h,可发酵糖的转化率为90 %。Wahlström等[19]使用深度共熔溶剂(DES)和[EMIM]AcO预处理桉木,80 ℃预处理24 h。预处理后,在45 ℃水浴锅中,使用缓冲液将DES和[EMIM]AcO稀释至30 %或80 %;加入T.reesei酶进行酶解,每克底物中加入15 mg酶,45 ℃酶解48 h。研究发现,DES存在下的水解产率显着高于[EMIM]AcO溶液。
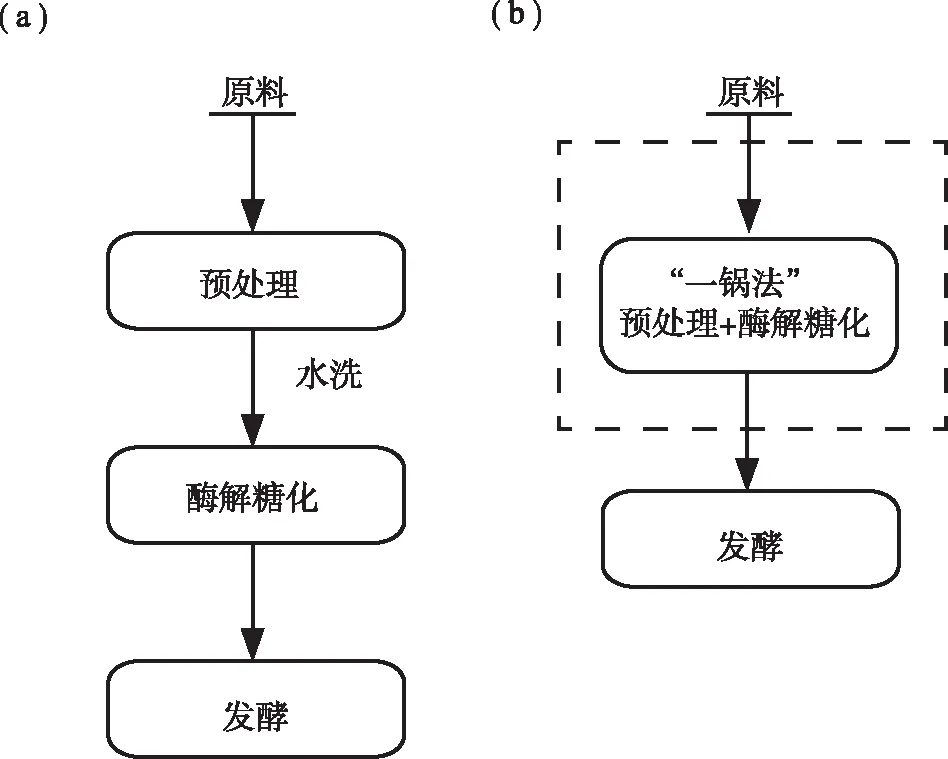
图 1 传统工艺制备生物乙醇(a)与“一锅法”制备生物乙醇(b)对比Fig. 1 Comparison of traditional process(a) and “one-pot” method(b) for ethanol production
2 酶解糖化与发酵“一锅法”
2.1同步糖化发酵
同步糖化发酵(SSF)工艺是经预处理的木质纤维原料的水解与发酵过程在同一容器中连续同时进行的发酵方法,该方法主要改善了分步水解发酵中糖对纤维素酶的抑制作用以及乙醇对酵母的抑制作用,这是因为第一步糖化反应产生的葡萄糖会立即被利用发酵成乙醇,使整个反应连续起来[20]。该方法不但能够提高水解效率、提高产量,还能够减少纤维素酶的用量、缩短反应时间[21]。然而同步糖化发酵工艺的缺点是水解最适温度和发酵最适温度不一致,因为纤维素酶活性最佳的温度是45~55 ℃,而一般酵母发酵的最佳温度是25~37 ℃,同时发酵过程中产生的乙醇也会抑制微生物的活性,需要选取耐酒精性较好的微生物。
Karimi等[22]运用SSF工艺,以稻草为原料制备生物乙醇,研究发现:在发酵2~3 d后乙醇产量达到最大值,乙醇的总回收率为SSF乙醇最大产率的40 %~74 %。使用米根霉(Rhizopusoryzae)进行乙醇发酵,可以获得的最大乙醇产率为74 %。Lee等[23]使用质量分数为0.06 %的硫磺酸在170 ℃条件下预处理海带15 min,去除海带中的非葡聚糖成分。使用酿酒酵母(Saccharomycescerevisiae)DK410362,在纤维素酶15 FPU/g以及β-葡萄糖苷酶70 IU/g条件下,采用SSF工艺进行发酵,研究发现:经过预处理后葡聚糖的酶解转化率为83.96 %,发酵后获得的生物乙醇质量浓度为6.65 g/L,相当于葡聚糖质量浓度为13.01 g/L。水解产物中甘露醇和藻酸盐低聚糖可以应用于其他发酵。Pessani等[24]研究了SSF工艺中酶添加量和温度对经过热液预处理的柳枝稷发酵产乙醇效果的影响,选择耐高温酿酒酵母(Kluyveromycesmarxianus)IMB3,底物质量分数为8 %。结果表明:纤维素酶Accellerase 1500酶的活性为82.2 FPU/g,添加量为0.7 mL/g,温度为45 ℃时可以获得最高的乙醇产量,发酵168 h后乙醇的产率为86 %。吉骊等[25]研究了糠醛渣经不同强度绿液-过氧化氢预处理脱木质素后,与木薯渣混合进行同步糖化发酵产乙醇。同步糖化发酵条件为无患子皂素表面活性剂添加量0.5 g/L,纤维素酶用量12 FPU/g,纤维二糖酶用量15 IU/g,预处理后的糠醛渣与木薯渣(质量比为2∶1)混合作为底物,底物质量浓度200 g/L时,发酵120 h最终乙醇质量浓度可达56.6 g/L,乙醇得率为86.3 %。
2.2同步糖化共发酵
同步糖化共发酵(SSCF)是由同步糖化发酵衍生出来的工艺,将对戊糖和己糖都有发酵能力的菌群复合进行发酵,以提高乙醇的生产效率[26]。因为通常情况下木糖对纤维素酶水解纤维素有一定的抑制作用,而采用这种在发酵己糖的同时发酵戊糖的方式一方面可以减少木糖的抑制作用、增加酶的活性,另一方面也提高了单糖的利用率、提高乙醇的产率。同时,这种方法由于酶水解、葡萄糖发酵、木糖发酵过程同时进行,也进一步节约了成本。
Suriyachai等[27]将酿酒酵母(Saccharomycescerevisiae)和树干毕赤酵母(Scheffersomycesstipitis)联合培养,通过SSCF法发酵稻秆生产乙醇。研究发现,底物质量分数为5%,S.cerevisiae和S.stipiti细胞比率为0.31,搅拌速率为116 r/min,发酵温度33.1 ℃,可以达到最优的发酵效果。此时乙醇的质量浓度为15.2 g/L,乙醇产量为理论值的99 %。Jin等[28]运用SSCF工艺发酵经氨纤维爆破(AFEXTM)预处理过的玉米秸秆,研究发现,利用S.cerevisiae424A(LNH-ST)发酵过程中,木聚糖的消耗与S.cerevisiae424A(LNH-ST)的活性极其相关,预处理后葡聚糖的浓度影响细胞活性,进而影响木聚糖的发酵,未被水解的底物对细胞的生长没有抑制作用,SSCF体系中最佳发酵温度为45 ℃。Olofsson等[29]通过控制SSCF过程中加入纤维素酶的量来提高木聚糖转化率,从而提高其转化为生物乙醇的效率。该方法在处理木聚糖含量丰富的原料时可以大大提高生物乙醇的产量。陈坤等[30]在纤维素酶20 FPU/g、发酵温度38 ℃、接种量15 %、管囊酵母和酿酒酵母的接种比例2∶1 条件下,选择不同的固液比(1∶5、1∶10、1∶15 和1∶20),研究了稻草秸秆同时糖化法产乙醇的情况。结果表明:固液比1∶15时,获得了较高的乙醇产率,为18.3 %。
2.3非等温同步糖化发酵
非等温同步糖化发酵(NSSF)工艺包含一个水解塔和一个发酵罐,水解和发酵分别在水解塔和发酵罐中进行,不含酵母细胞的流体在两者之间循环。NSSF作为同步糖化发酵的一种改良方法,在一定程度上解决了纤维素酶和发酵菌体最适温度不同的问题,使水解阶段和发酵阶段各自保持在最适宜的温度,在保持酶和酵母活性的同时提高水解效率和乙醇产率。Wu等[31]将酶解和发酵在2个不同的反应器中同时进行,研究表明,NSSF工艺的水解与发酵条件更加稳定,酶解效果明显提高,酶的需求量减少30 %~40 %。Chen等[32]在蒸汽爆破的最佳预处理条件下预处理玉米秸秆5 min,预处理后样品的酶解糖化和发酵分别在约50和37 ℃下进行,酶解糖化的葡萄糖被酵母消耗,并通过与吸附活性炭偶联的CO2气提分离得到乙醇,底物质量分数达到25 %时,在发酵中获得的乙醇产率为18.96 %~30.29 %。Alamanou等[33]利用厨余垃圾在质量分数20 %条件下,121 ℃微波消化15 min,加入7 FPU/g的纤维素酶和Novozyme 188混合酶(体积比5∶1),50 ℃酶解6 h,利用S.cerevisiae在30 ℃发酵36 h,最终底物质量分数为40 %时,乙醇产量为42.66 g/L。Oh等[34]使用数学模型和计算机模拟软件包估算每个温度下的动力学参数,并绘制出可获得最大乙醇产量的温度曲线。将纯化的纤维素,在pH值4.8的柠檬酸钠缓冲液中搅拌12 h,用里氏木霉(Trichodermareesei)纤维素酶Celluclast 1.5 L和β-葡萄糖苷酶(Novozyme 188)进行酶解,加酶量为30 FPU/g。研究发现,酶解最佳温度分布为35 ℃开始,有利于里氏木霉细胞的繁殖,10 h后,操作温度迅速升至39 ℃,然后缓慢降至36 ℃。在具有上述温度分布的NSSF系统中,获得的最大乙醇产量为14.87 g/L。
3 酶制备、酶解糖化与发酵“一锅法”
联合生物(CBP)工艺也被称作直接微生物转化(DMC),即在一个反应容器中、用一种微生物或者一个微生物群完成木质纤维原料的酶制备、酶水解以及戊糖和己糖的发酵全过程。该工艺的优点是流程简单、操作方便,适合应用于大规模的生产;缺点是筛选在各个反应步骤都有高效转化率的菌株或菌株群比较困难,导致目前大部分生产过程中底物的转化率和乙醇的产率都比较低,特别是在高底物浓度的条件下。Li等[35]采用CBP工艺,使用木薯浆制备生物乙醇,热纤梭菌(Clostridiumthermocellum)和嗜热厌氧菌(Thermoanaerobacteriumaotearoense)联用可产生13.65±0.45 g/L的葡萄糖,高温发酵84 h后,可产生8.83±0.31 g/L的乙醇,乙醇转化率为(64.95±2.71)%。杨梅等[36]在联合生物加工技术发酵菊芋生料生产乙醇工艺中,利用马克斯克鲁维酵母(Kluyveromycesmarxianus),在最佳工艺条件下,分别在发酵12和24 h时补料,菊芋干粉终质量浓度可达到300 g/L,发酵时间48 h,乙醇质量浓度达到91.6 g/L,乙醇对糖的得率为0.464,为理论值的90.6 %。Gao等[37]通过联合生物工艺应用氧化还原电位提高菊粉的乙醇产量。研究发现,当氧化还原电位控制在-130 mV时,达到最高的乙醇质量浓度和生产率,分别为97.7 g/L和2.04 g/(L·h),残余糖质量浓度为3 g/L。Yang等[38]为了提高酿酒酵母的纤维素酶表达效率,通过原生质体法将含有单酶系统的三纤维素酶基因(sestc)的真核表达载体整合到酿酒酵母基因组中。使用聚合酶链式反应(PCR)筛选和逆转录PCR(RT-PCR),选择了能够有效表达异质纤维素酶的几种重组酿酒酵母菌株。重组酿酒酵母转化体的纤维素酶、内切-β-D-葡聚糖酶、外切-β-D-葡聚糖酶和木聚糖酶的总活性分别为1.1、378、1.44和164 U/mL,比野生型菌株高27.5、63、24和19倍。以麦麸为碳源,重组酿酒酵母菌株产生的乙醇质量浓度为8.1 g/L,比野生型菌株产生的质量浓度(0.14 g/L)高57.86倍。
4 预处理、酶解糖化与发酵“一锅法”
现在大多数的木质纤维原料预处理后需要经过固液分离、水洗、中和和解毒等过程,使得实验成本增加,因此,建立一种低成本、高效的生物乙醇制备工艺,需要尽可能省去预处理后的一些环节。预处理、酶解糖化和发酵“一锅法”可以满足以上要求。如图2所示,预处理、酶解糖化和发酵“一锅法”是指预处理、酶解糖化与发酵过程在同一反应器中进行,省去了预处理后固液分离和水洗等过程。为了避免预处理后抑制剂的产生,预处理过程中不能使用大量的酸和催化剂。预处理、酶解糖化和发酵“一锅法”从经济的角度看具有明显的优势。然而,此工艺面临很多挑战,比如:1)由于水的限制,质量传递限制存在于预处理、酶解糖化与发酵过程的始终;2)高的底物浓度会产生抑制剂,从而影响后续过程[39],葡糖糖和纤维二糖等终产物的浓度会降低整体酶活性[40];3)高的葡萄糖和木糖等碳源浓度会降低微生物活性[41]。Jung等[42]以稻草为原料采用预处理、酶解糖化与发酵“一锅法”制备生物乙醇。稻草原料在催化剂混合液中,经过3 min温度上升至190 ℃,在190 ℃条件下预处理2 min。预处理后的稻秆采用SSF工艺进行发酵,底物质量分数为6 %,加入纤维素酶的量为15 FPU/g,酿酒酵母接种量为5 %,发酵60 h后,乙醇的产率为理论值的70.7 %。结果表明,预处理、酶解糖化与发酵“一锅法”是制备生物乙醇的一种经济有效的方法。Xu等[43]使用离子液体[Ch][OAc]预处理玉米秸秆,液固比为10∶3,140 ℃预处理3 h。预处理后,加入纤维素酶Cellic®CTec2和HTec2,每克葡聚糖加入20 mg酶,50 ℃酶解24 h。研究发现,使用预处理、酶解糖化与发酵“一锅法”工艺,离子液体的使用量降低了90 %,加水量和废水减少了85 %,乙醇产量为41.1 g/L,相当于总葡萄糖的74.8 %。
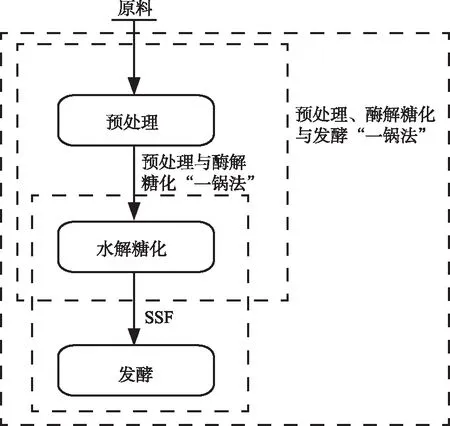
图 2 预处理、酶解糖化与发酵“一锅法”流程图Fig. 2 “One-pot” flow chart of pretreatment, enzymatic saccharification and fermentation
5 结语与展望
在全球性能源危机环境下,利用木质纤维制备生物乙醇,不仅能够缓解能源危机,而且解决了丢弃木质纤维造成的环境污染和资源浪费等问题。传统的“分步法”制备生物乙醇面临着产量低、产生大量废水以及废弃物难以处理等问题,因此,“一锅法”制备生物乙醇日益受到人们的关注。然而,发展经济有效的“一锅法”制备生物乙醇的方法仍然面临很多挑战,如水解最适温度和发酵最适温度不一致、发酵过程产生的乙醇会抑制纤维素酶的活性以及酵母菌的生长繁殖和废弃物难以回收利用等。开发新型的“一锅法”制备生物乙醇以提高乙醇产量、减少水资源浪费、避免产生二次污染,对木质纤维资源化利用有着十分重要的意义。
[1]FAIRLEY P. Introduction:Next generation biofuels[J]. Nature,2011,474(7352):S2-S5.
[2]FARRELL A E,PLEVIN R J,TURNER B T,et al. Ethanol can contribute to energy and environmental goals[J]. Science,2006,311(5760):506-508.
[3]TILMAN D,HILL J,LEHMAN C. Carbon-negative biofuels from low-input high-diversity grassland biomass[J]. Science,2006,314(5805):1598-1600.
[4]FARGIONE J,HILL J,TILMAN D,et al. Land clearing and the biofuel carbon debt[J]. Science,2008,319(5867):1235-1238.
[5]WYMAN C E. What is (and is not) vital to advancing cellulosic ethanol[J]. Trends in Biotechnology,2007,25(4):153-157.
[6]CHISTI Y. Biodiesel from microalgae[J]. Biotechnology Advances,2007,25(3):294-306.
[7]LEVIN D. Biohydrogen production:Prospects and limitations to practical application[J]. International Journal of Hydrogen Energy,2004,29(2):173-185.
[8]RAGAUSKAS A J,BECKHAM G T,BIDDY M J,et al. Lignin valorization:Improving lignin processing in the biorefinery[J]. Science,2014,344(6185):708-720.
[9]RAGAUSKAS A J W C K,DAVISON B H,BRITOVSEK G,et al. The path forward for biofuels and biomaterials[J]. Science,2006,311(5760):484-489.
[10]CHHEDA J N,HUBER G W,DUMESIC J A. Liquid-phase catalytic processing of biomass-derived oxygenated hydrocarbons to fuels and chemicals[J]. Angewandte Chemie,2007,46(38):7164-7183.
[11]GRAHAM-ROWE D. Agriculture:Beyond food versus fuel[J]. Nature,2011,474(7352):S6-S8.
[12]TILMAN D,HILL J,LEHMAN C. Carbon-negative biofuels from low-input high-diversity grassland biomass[J]. Science,2006,314(5805):1598-1600.
[13]SHI J,GLADDEN J M,SATHITSUKSANOH N,et al. One-pot ionic liquid pretreatment and saccharification of switchgrass[J]. Green Chemistry,2013,15(9):2579-2589.
[14]AUXENFANS T,BUCHOUX S,DJELLAB K,et al. Mild pretreatment and enzymatic saccharification of cellulose with recycled ionic liquids towards one-batch process[J]. Carbohydrate Polymers,2012,90(2):805-813.
[15]HSU C L,CHANG K S,LAI M Z,et al. Pretreatment and hydrolysis of cellulosic agricultural wastes with a cellulase-producingStreptomycesfor bioethanol production[J]. Biomass and Bioenergy,2011,35(5):1878-1884.
[16]VIAMAJALA S,DONOHOE B,DECKER S,et al. Heat and Mass Transport in Processing of Lignocellulosic Biomass for Fuels and Chemicals[M]∥SINGH O V,HARVEY S P. Sustainable Biotechnology. [s.l.]:Springer Netherlands,2010:1-18.
[17]TAHERZADEH M J,KARIMI K. Enzymatic-based hydrolysis processes for ethanol from lignocellulosic materials:A review[J]. BioResources,2007,2(4):707-738.
[18]LISZKA M J,KANG A,KONDA N V S N M,et al. Switchable ionic liquids based on di-carboxylic acids for one-pot conversion of biomass to an advanced biofuel[J]. Green Chemistry,2016,18(14):4012-4021.
[19]WAHLSTRÖM R,HILTUNEN J,PITALUGA D S,et al. Comparison of three deep eutectic solvents and 1-ethyl-3-methylimidazolium acetate in the pretreatment of lignocellulose:Effect on enzyme stability,lignocellulose digestibility and one-pot hydrolysis[J]. RSC Advances,2016,6(72):68100-68110.
[20]KADAR Z,SZENGYEL Z,RECZEY K. Simultaneous saccharification and fermentation(SSF) of industrial wastes for the production of ethanol[J]. Industrial Crops and Products,2004,20(1):103-110.
[21]袁希钢,刘振,王金鹏,等. 木薯干原料同步糖化发酵生产乙醇[J]. 过程工程学报,2005,5(3):353-356.
[22]KARIMI K,EMTIAZI G,TAHERZADEH M J. Ethanol production from dilute-acid pretreated rice straw by simultaneous saccharification and fermentation withMucorindicus,Rhizopusoryzae, andSaccharomycescerevisiae[J]. Enzyme and Microbial Technology,2006,40(1):138-144.
[23]LEE J Y,LI P,LEE J,et al. Ethanol production fromSaccharinajaponicausing an optimized extremely low acid pretreatment followed by simultaneous saccharification and fermentation[J]. Bioresource Technology,2013,127:119-125.
[24]PESSANI N K,ATIYEH H K,WILKINS M R,et al. Simultaneous saccharification and fermentation ofKanlowswitchgrassby thermotolerantKluyveromycesmarxianusIMB3:The effect of enzyme loading,temperature and higher solid loadings[J]. Bioresource Technology,2011,102(22):10618-10624.
[25]吉骊,赵鹏翔,游艳芝,等. 糠醛渣/木薯渣混合底物同步糖化发酵转化乙醇研究[J]. 林产化学与工业,2016,36(2):121-128.
[26]OLSSON L,GERDAL B. Fermentation of lignocellulosic hydrolysates for ethanol production[J]. Enzyme and Microbial Technology,1996,18(5):312-331.
[27]SURIYACHAI N,WEERASAIA K,LAOSIRIPOJANA N,et al. Optimized simultaneous saccharification and co-fermentation of rice straw for ethanol production bySaccharomycescerevisiaeandScheffersomycesstipitisco-culture using design of experiments[J]. Bioresource Technology,2013,142:171-178.
[28]JIN M,GUNAWAN C,BALAN V,et al. Simultaneous saccharification and co-fermentation(SSCF) of AFEXTMpretreated corn stover for ethanol production using commercial enzymes andSaccharomycescerevisiae424A(LNH-ST)[J]. Bioresource Technology,2012,110:587-594.
[29]OLOFSSON K,WIMAN M,LID N G. Controlled feeding of cellulases improves conversion of xylose in simultaneous saccharification and co-fermentation for bioethanol production[J]. Journal of Biotechnology,2010,145(2):168-175.
[30]陈坤,徐龙君,杨睿,等. 稻草秸秆同时糖化法产乙醇的动力学研究[J]. 林产化学与工业,2014,34(1):13-18.
[31]WU Z,LEE Y Y. Nonisothermal simultaneous saccharification and fermentation for direct conversion of lignocellulosic biomass to ethanol[J]. Applied Biochemistry and Biotechnology,1998,70(72):479-493.
[32]CHEN H,LI G. An industrial level system with nonisothermal simultaneous solid state saccharification,fermentation and separation for ethanol production[J]. Biochemical Engineering Journal,2013,74:121-126.
[33]ALAMANOU D G,MALAMIS D,MAMMA D,et al. Bioethanol from dried household food waste applying non-isothermal simultaneous saccharification and fermentation at high substrate concentration[J]. Waste and Biomass Valorization,2015,6(3):353-361.
[34]OH K K K S W,JEONG Y S. Bioconversion of cellulose into ethanol by nonisothermal simultaneous saccharification and fermentation[J]. Applied Biochemistry and Biotechnology,2000,89(1):15-30.
[35]LI P,ZHU M J. A consolidated bio-processing of ethanol from cassava pulp accompanied by hydrogen production[J]. Bioresource Technology,2011,102(22):10471-10479.
[36]杨梅,袁文杰,凤丽华. 菊芋生料联合生物加工发酵生产燃料乙醇[J]. 安徽农业科学,2012,40(9):5438-5441.
[37]GAO J Q,YUAN W J,LI Y M,et al. Application of redox potential control to improve ethanol productivity from inulin by consolidated bioprocessing[J]. Process Biochemistry,2016,51(10):1544-1551.
[38]YANG P Z,ZHANG H F,JIANG S T. Construction of recombinant sestcSaccharomycescerevisiaefor consolidated bioprocessing,cellulase characterization,and ethanol production by in situ fermentation[J]. Biotech,2016,6(2):1-11.
[39]LU Y F,WANG Y H,XU G Q,et al. Influence of high solid concentration on enzymatic hydrolysis and fermentation of steam-exploded corn stover biomass[J]. Applied Biochemistry and Biotechnology,2010,160(2):360-369.
[40]XIAO Z,ZHANG X,GREGG D J,et al. Effects of sugar inhibition on cellulases andβ-glucosidase during enzymatic hydrolysis of softwood substrates[C]∥Proceedings of the Twenty-Fifth Symposium on Biotechnology for Fuels and Chemicals. Breckenridge,May 4-7,2003.
[41]KOPPRAM R,TOM S-PEJ E,XIROS C,et al. Lignocellulosic ethanol production at high-gravity:Challenges and perspectives[J]. Trends in Biotechnology,2014,32(1):46-53.
[42]JUNG Y H,PARK H M,KIM I J,et al. One-pot pretreatment,saccharification and ethanol fermentation of lignocellulose based on acid-base mixture pretreatment[J]. RSC Advance,2014,4(98):55318-55327.
[43]XU F,SUN J,KONDA N V S N M,et al. Transforming biomass conversion with ionic liquids:Process intensification and the development of a high-gravity,one-pot process for the production of cellulosic ethanol[J]. Energy & Environmental Science,2016,9(3):1042-1049.
