莫西沙星/纳米纤维素缓释膜的制备及其释药性能研究
2018-03-01唐爱民闫长媛李德贵
唐爱民, 闫长媛, 李德贵
(华南理工大学 制浆造纸工程国家重点实验室, 广东 广州 510640)
高分子药物缓释膜是在可使用条件下使药物缓慢释放以延长药物作用时间的膜材料,这类膜材料通常由缓释载体材料和药物组成。其中常见的药物缓释载体包括天然高分子缓释载体(藻酸盐、明胶和纳米纤维素(NFC)等[1])和合成高分子缓释载体(聚碳酸酯聚合物和聚酯类等[2])。常见的药物有莫西沙星、硫酸庆大霉素和伊曲康唑等。合成高分子缓释载体的成膜方式一般采用熔融成膜法,而药物在加热成膜时极易被氧化。天然高分子缓释载体与药物的结合方式主要为包覆和共混。Li等[3]将壳聚糖-藻酸盐复合膜作为不同药片的包衣,在模拟肠胃环境下发现复合膜有效地抑制了药片的侵蚀,使得药片在水合物基质中进行缓慢释放。Kolakovic等[4]采用真空抽滤将NFC与伊曲康唑等药物共混,结果表明NFC膜的载药量为40 %~50 %,药物的包封率达90 %以上,药物缓释周期可达3个月以上。药物缓释膜的成膜方式和多孔结构是研究缓释膜中急需解决的问题。而来源于植物生物质的NFC具有良好的成膜性、力学性能、高亲水性及成膜后的多孔结构,是一种直径在100 nm以下、长度在几百纳米到几个微米的天然材料[5]。NFC以其良好的生物相容、可生物降解、环境友好及低毒等特性,在创伤修复、组织工程支架、软骨移植以及药物缓释等多个领域[6-8]得到了广泛应用。目前,纳米粒子载药体系已成为药物控制释放和靶向释放研究的主要方向[9-10],因此NFC作为药物缓释载体的研究受到广泛关注。Kolakovic等[11-12]利用喷雾干燥法将对乙酰氨基酚和吲哚美辛药物包裹在NFC微球中,发现药物主要包裹在NFC的无定形区,由于NFC的网状结构限制了药物的大量释放而取得良好的缓释效果。Valo等[13]将由微晶纤维素、细菌纤维素、木瓜种子制备得到的NFC及2,2,6,6-四甲基哌啶-1-氧化物自由基(TEMPO)氧化制得的NFC与二丙酸倍氯米松药物共混,将混合液采用冷冻干燥的方式制得气凝胶,得出不同方法制得的NFC药物缓释气凝胶中药物缓释曲线是不同的。莫西沙星是一种氟喹诺酮类非离子型药物,抗菌谱广且效果明显[14],将其与缓释载体复合,可延长莫西沙星的作用时间,提高药物疗效,实现缓释的目的。然而目前未见将莫西沙星与NFC通过物理共混制备莫西沙星/NFC缓释膜的研究报道。本研究将抗菌药物莫西沙星与NFC共混,采用真空抽滤成膜的方法制备具有缓释和抗菌特性的莫西沙星/NFC缓释膜,考察了NFC的羧基含量、制备NFC时的均质次数对莫西沙星/NFC缓释膜的力学性能、溶胀性能以及莫西沙星累积释放率的影响;同时探讨了莫西沙星/NFC缓释膜在不同pH值的磷酸盐缓冲液(PBS)中莫西沙星的累积释放率及其对标准金黄色葡萄球菌的抑菌效果,以期为莫西沙星/NFC缓释膜在药物缓释系统、创伤修复系统中的应用提供理论基础。
1 材料与方法
1.1原料、试剂及仪器
漂白硫酸盐桉木浆(蝴蝶牌):α-纤维素86.8 %,打浆度15°SR,水分64.65 %; 2,2,6,6-四甲基哌啶-1-氧化物自由基(TEMPO),Alfa Aesar公司;盐酸莫西沙星,分析纯,Adamas 试剂厂;NaClO(10 %)、NaBr、无水乙醇、磷酸氢二钠,均为分析纯。pH值为3.0、5.0和7.4的磷酸盐缓冲液(PBS),采用Perrin[15]方法制得,并将溶解液定容到1 000 mL,备用。
Nano DeBEE型高压微射流均质机,美国BEE公司;Vector 33型傅里叶变换红外光谱(FT-IR)仪,德国Bruker公司;Instron 5565型拉伸压缩材料试验机; MultiMode 8型原子力显微镜(AFM),德国Bruker公司;S3150型紫外分光光度计,美国Agilent公司。
1.2样品的制备
1.2.1NFC的制备 以漂白硫酸盐桉木浆为原料,按文献[16]对浆料进行碱性氧化预处理。先加入0.1 mmol/g TEMPO,再加入1 mmol/g NaBr和不同用量的NaClO,然后经过D4喷嘴进行均质处理,得到不同的NFC样品(见表1,其中T代表TEMPO碱性氧化浆,D4代表均质机的D4喷嘴)。
1.2.2莫西沙星/NFC缓释膜的制备 将6组NFC悬浮液(质量分数1 %)与莫西沙星以质量比25∶1(绝干质量)进行混合,搅拌12 h,将混合液倒入砂芯漏斗中进行真空过滤,待样品表面的水分几乎被抽干并贴附在滤膜上时,将样品(含滤膜)倒置于培养皿中,室温条件下放置24 h后,用酒精将莫西沙星/NFC缓释膜取下,并放入干燥器中保存。制备好的莫西沙星/NFC缓释膜的直径为40 mm,面积为50.24 cm2,药物负载率为21 %。
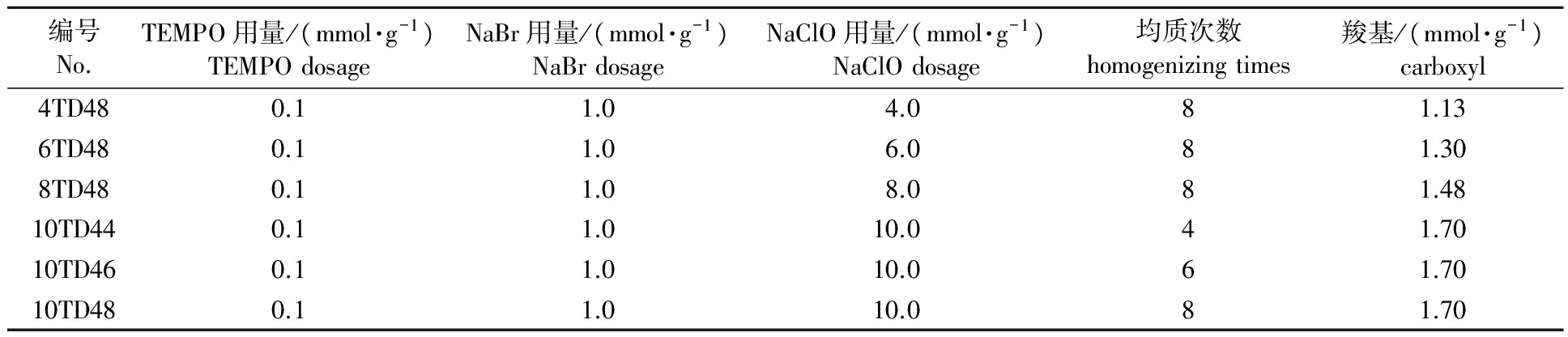
表 1 NFC样品的制备条件及编号Table 1 Preparation conditions and serial number of NFC samples
1.3测试与表征
1.3.1缓释膜的表征 采用溴化钾压片法、在500~4000 cm-1范围内对样品进行红外分析,分辨率4 cm-1,扫描速率为32次/min。NFC膜和莫西沙星/NFC缓释膜的形貌结构采用AFM进行观察。将NFC膜和莫西沙星/NFC缓释膜裁剪为30 mm×3 mm的长条,使用拉伸压缩材料试验机对样品的弹性模量进行测试,移动速度为1 mm/min。
1.3.2缓释膜的平衡溶胀率 利用称重法[17]测定莫西沙星/NFC缓释膜在PBS中的平衡溶胀率(RES):将干燥的莫西沙星/NFC缓释膜放入pH值3、5和7.4的PBS中浸泡3天,使其达到溶胀平衡点,用滤纸将膜表面的水分擦干后称质量。莫西沙星/NFC缓释膜的平衡溶胀率为RES=(Wt-Wd)/Wd,其中Wd为干燥的莫西沙星/NFC缓释膜质量,Wt为达到溶胀平衡点的莫西沙星/NFC缓释膜质量。
1.3.3缓释膜的累积释放率 将莫西沙星/NFC缓释膜置于装有15 mL PBS的锥形瓶中,然后置于37±0.1 ℃,50 r/min的恒温水浴振荡器中振荡。定时取出2 mL溶液,立即补加2 mL PBS,整个取样时间持续24 h,同时进行3组平行试验。利用紫外分光光度计测定样品在289 nm处的吸光度值[18],累积释放率为 (2∑Ci-1+15Ci)/m×100 %,其中Ci为第i次取样时莫西沙星的释放浓度,m为总的载药量。
1.3.4缓释膜的抗菌性能 采用琼脂平皿扩散国家标准法分析莫西沙星/NFC缓释膜对标准菌株金黄色葡萄球菌的抗菌性能,将NFC膜和莫西沙星/NFC缓释膜置于涂有菌液的培养基上,倒置于37 ℃恒温培养箱中培养24 h。抑菌圈直径为:D=(B-R)/2,其中B为抑菌圈外边缘总直径,R为样品的直径。
2 结果与讨论
2.1莫西沙星/NFC缓释膜的基本理化性质

图 1 NFC、莫西沙星和缓释膜的FT-IR谱图Fig. 1 FT-IR spectra of NFC,moxifloxacin and sustained-release film
2.1.2AFM观察 NFC膜(10TD48)和相应的莫西沙星/NFC缓释膜的AFM表征结果见图2。图2(a)和(b)分别为NFC膜的形貌图和3D立体图,图2(c)和(d)分别为莫西沙星/NFC缓释膜的形貌图和3D立体图。从图2(a)和(b)可以看到NFC膜在5 μm范围内表面相对平滑,有部分褶皱或凸起,整体粗糙度为2.28 nm;而在图2(c)和(d)中,莫西沙星/NFC缓释膜内部的纤维与药物粒子之间交错分布,较大的莫西沙星颗粒导致缓释膜表面高低起伏,表面高度最大达到158.8 nm,整体粗糙度为35.10 nm。由此可见,莫西沙星/NFC缓释膜表面比NFC膜更加粗糙,莫西沙星粒子被网络结构密集的纤维封存在莫西沙星/NFC缓释膜内部。

图 2 NFC和莫西沙星/NFC缓释膜的AFM图Fig. 2 AFM images of NFC and moxifloxacin/NFC sustained-release film
2.1.3力学性能分析 均质次数8次时NFC羧基含量和羧基为1.70 mmol/g时制备NFC时的均质次数对NFC膜和莫西沙星/NFC缓释膜的弹性模量的影响如图3所示。
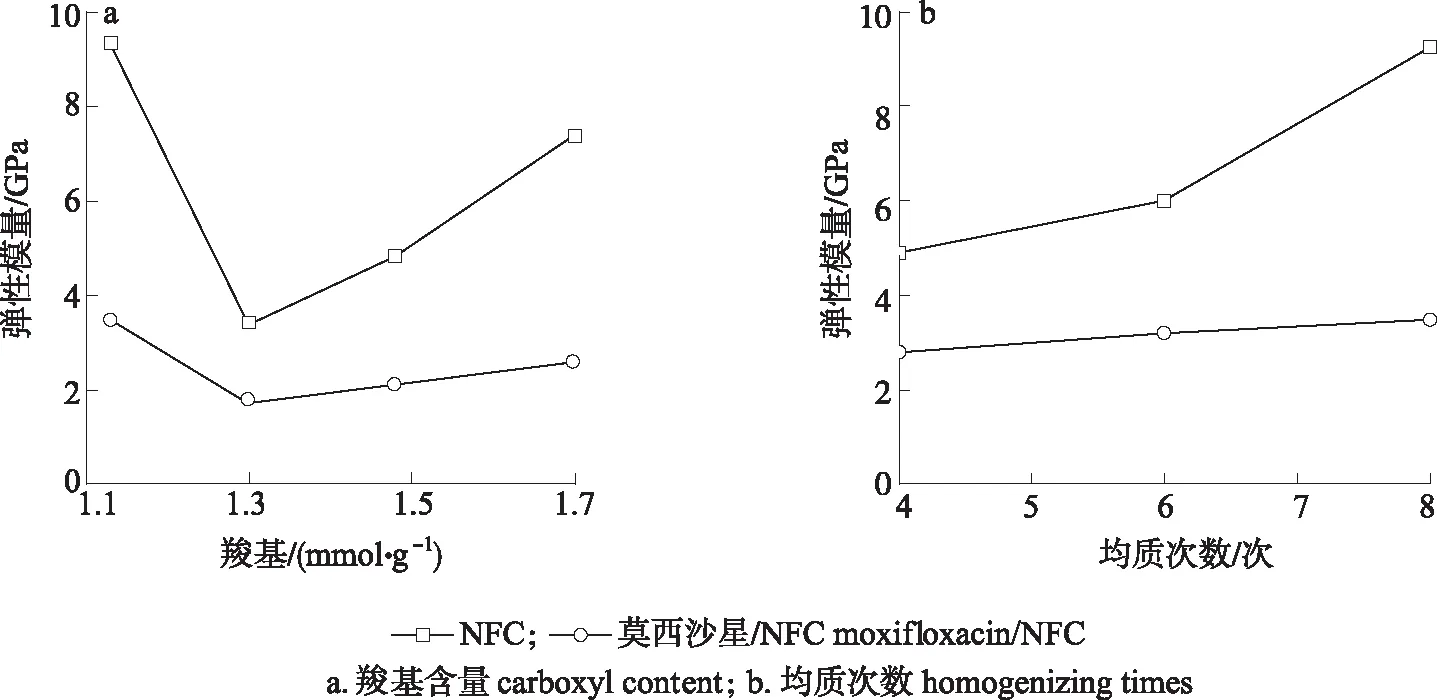
图 3 羧基含量和均质次数对膜样品弹性模量的影响Fig. 3 The influence of carboxyl content and homogenizing times on the elastic modulus of films
图3(a)显示,当制备NFC时的均质次数为8次(4TD48、6TD48、8TD48和10TD48)时,NFC膜和莫西沙星/NFC缓释膜的弹性模量随着NFC羧基含量的增加,呈现先减少后增加的趋势。当羧基由1.13 mmol/g增加到1.30 mmol/g时,NFC膜的弹性模量由9.34 GPa下降到最小值3.41 GPa,莫西沙星/NFC缓释膜的弹性模量由3.48 GPa下降到最小值1.77 GPa。而羧基由1.30 mmol/g增加到1.70 mmol/g时,NFC膜和莫西沙星/NFC缓释膜的弹性模量均有所增加。因此,要使NFC膜和莫西沙星/NFC缓释膜的弹性模量均达到最大,适宜的羧基为1.13 mmol/g,同时也说明莫西沙星的加入会降低材料的弹性模量。由图3(b)可知,当NFC的羧基为1.70 mmol/g时,莫西沙星/NFC缓释膜的弹性模量随着NFC制备时均质次数的增加而增加。均质次数由4次增加至8次时,NFC膜的弹性模量由4.92 GPa增加到9.34 GPa,莫西沙星/NFC缓释膜的弹性模量由2.82 GPa增加到3.48 GPa。同样,莫西沙星/NFC缓释膜的弹性模量比NFC膜低,这是由于莫西沙星药物粒子的存在,阻碍了纤维与纤维之间氢键的连接,使得莫西沙星/NFC缓释膜强度降低[4],但制备的莫西沙星/NFC缓释膜仍具有较高的弹性模量。
2.2莫西沙星/NFC缓释膜的溶胀动力学曲线测试
不同条件制备的NFC膜和相应的莫西沙星/NFC缓释膜的溶胀动力学曲线如图4所示。
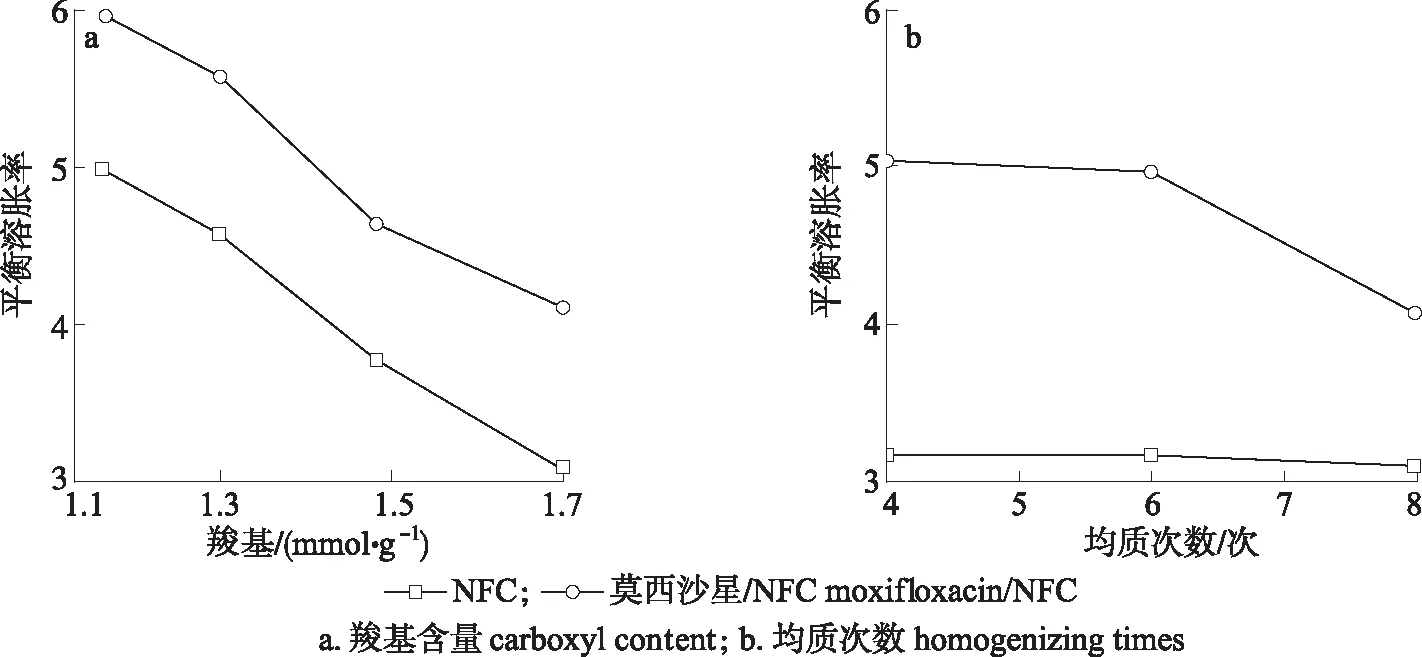
图 4 羧基含量和均质次数对膜样品的平衡溶胀率的影响Fig. 4 The influence of carboxyl content and homogenizing times on the equlilbrium swelling ratio of films
由图4(a)可知,当NFC制备时的均质次数为8次时,莫西沙星/NFC缓释膜的平衡溶胀率随着NFC羧基含量的增加而下降。羧基由1.13 mmol/g增加到1.70 mmol/g时,NFC膜的平衡溶胀率由5.01下降至3.10,莫西沙星/NFC缓释膜的平衡溶胀率由6.03下降至4.11。莫西沙星/NFC缓释膜的平衡溶胀率高于NFC膜,说明莫西沙星的加入削弱了NFC紧密的三维网络结构,吸水空间变大,从而增加了材料的平衡溶胀率。由图4(b)可知,当NFC的羧基为1.70 mmol/g,莫西沙星/NFC缓释膜的平衡溶胀率随着NFC制备时均质次数的增加而下降。NFC均质次数由4次增加至时8次时,NFC膜的平衡溶胀率由3.20减少至3.10,变化不大,而莫西沙星/NFC缓释膜的平衡溶胀率由5.06减少至4.11。与NFC 膜相比,莫西沙星/NFC缓释膜的平衡溶胀率有较大程度的提高,其原因可能是以物理方式吸附在NFC表面的莫西沙星,削弱了纤维素分子之间的氢键交互作用结合位点,纤维间空隙增大,使得水分子在网络间的自由移动增加,从而导致莫西沙星/NFC缓释膜的平衡溶胀率高于NFC膜[20]。
2.3莫西沙星/NFC缓释膜的释药性能研究
2.3.1释放率 NFC羧基含量、制备NFC时的均质次数和pH值对莫西沙星/NFC缓释膜的累积释放率的影响如图5所示。莫西沙星/NFC缓释膜的体外释放过程均分为突释相和缓释相[21]。突释是指接近聚合物表面或接近水层的药物突然扩散释放,而缓释为聚合物控制型的药物缓慢释放,其药物释放的机制包括:聚合物多孔释放、聚合物基质释放、渗透释放和溶胀释放[22]。在图5(a)中,当NFC制备时的均质次数为8次时,随着NFC羧基含量的增加,药物的累积释放率相应减小,缓释膜的体外释药均在8 h达到平衡。其中当NFC羧基由1.13 mmol/g增加到1.70 mmol/g时,累积释放率由19.96 %减小到11.94 %。如图5(b)所示,当NFC羧基为1.70 mmol/g,NFC制备过程均质次数为4次和6次时,缓释膜的体外释药均在24 h达到平衡,累积释放率分别为15.16 %和14.25 %。当NFC制备过程均质次数为8次时,缓释膜的体外释药在8 h达到平衡,其累积释放率为11.94 %。所以当NFC羧基含量和NFC制备时的均质次数增加时,莫西沙星/NFC缓释膜的平衡溶胀率下降,导致莫西沙星的累积释放率减小。图5(c)显示了PBS的pH值对莫西沙星/NFC缓释膜的累积释放率的影响。当NFC羧基为1.70 mmol/g、制备时的均质次数为8次时,在pH值7.4的PBS中,缓释膜的体外释药在8 h达到平衡,其累积释放率为11.94 %;在酸性环境即pH值为3时,缓释膜的体外释药在14 h达到平衡,其累积释放率增加至20.91 %,与pH值为7.4和pH值为5时的莫西沙星/NFC缓释膜的释放率相比,分别增加了8.97和4.33个百分点。
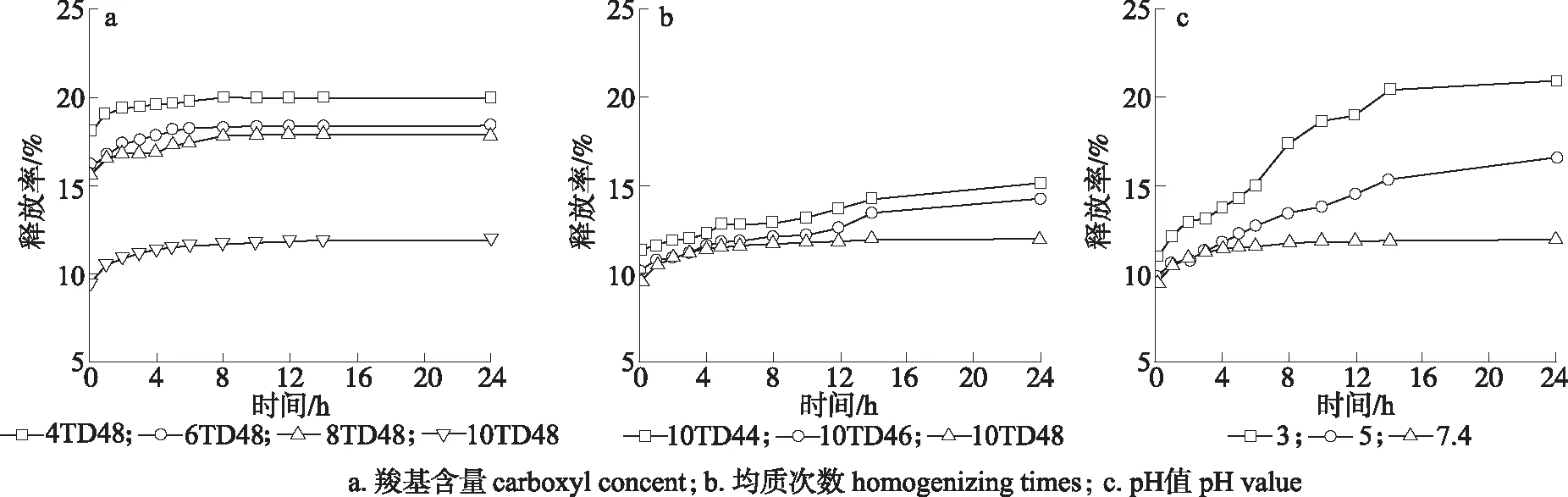
图 5 NFC制备条件和pH值对莫西沙星/NFC缓释膜药物释放的影响Fig. 5 The influence of processing conditions of NFC and pH value on the drug release of moxifloxacin/NFC sustained-release film
2.3.2动力学方程 采用零级动力学方程(Q=Q0+k0t)、一级动力学方程(ln(1-Q)=-k1t)、Higuchi方程(Q=kHt1/2)以及Peppas方程(Q=ktn)对上述缓释膜的释放曲线进行拟合,其中R2越大,表示与缓释膜的药物释放曲线拟合度越高[23],具体拟合结果见表2、表3和表4(Q为累积释放率,t为释放时间)。由表2可知,NFC羧基含量的变化对缓释膜的药物释放机制影响基本符合Peppas方程,且n都小于0.5[24],表明其主要是由于缓释膜内外的药物浓度差进行扩散释放。
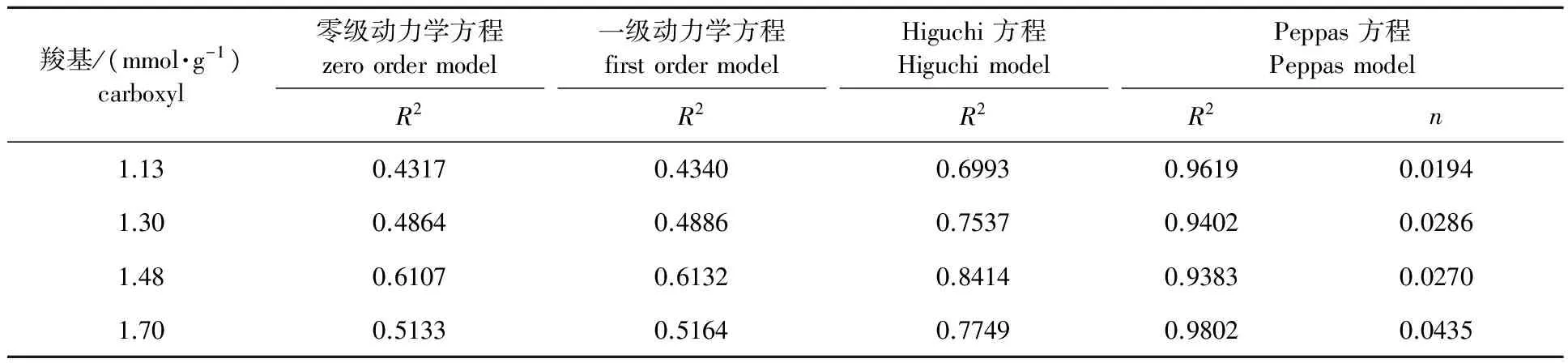
表 2 NFC羧基含量对莫西沙星/NFC缓释膜体外释放曲线拟合结果的影响
从表3看出,NFC制备时的均质次数为4次和6次的缓释膜的药物释放机制符合Higuchi方程[25],由于缓释膜的多孔结构导致药物的释放,同时伴随着周围水溶液的渗透,进而导致缓释膜的溶胀以促进药物释放。均质次数为8次的缓释膜的药物释放机制符合Peppas方程[25],缓释膜的突释最快,其药物释放的主要动力是缓释膜内外的药物浓度差,这主要是因为随着均质次数的增加,NFC的尺寸变小,NFC膜结构更加紧密,孔隙率减小[26],药物的释放由渗透释放和溶胀释放为主转为浓度差驱动为主,因此形成了2种不同的药物释放模式。
从表4中释放曲线的拟合数据可以发现,在pH值3和pH值5的PBS中,缓释膜的药物释放曲线符合Higuchi方程,在pH值为7.4的PBS中,缓释膜的药物释放曲线符合Peppas方程[25],表明莫西沙星/NFC缓释膜更易受到酸的影响,酸促进了缓释膜的多孔结构及溶胀体系的形成,进而导致药物释放。
通过对NFC羧基含量、制备NFC时的均质次数和pH值对莫西沙星/NFC缓释膜的药物释放动力学影响的分析以及红外分析,表明非离子型药物莫西沙星与NFC主要通过物理吸附方式结合,其药物释放机理主要包括扩散释放、渗透释放和溶胀释放[22]:其一是符合Peppas方程释放机制,即缓释膜内外的药物浓度差导致的扩散释放;其二是符合Higuchi方程释放机制,药物通过纤维膜内部的微孔向外释放,同时伴随着水溶液的渗透,进而从膜内部向外通过溶胀方式释放。由于莫西沙星的非离子型药物特性,制备的莫西沙星/NFC缓释膜的药物缓释性能还有待进一步提高。
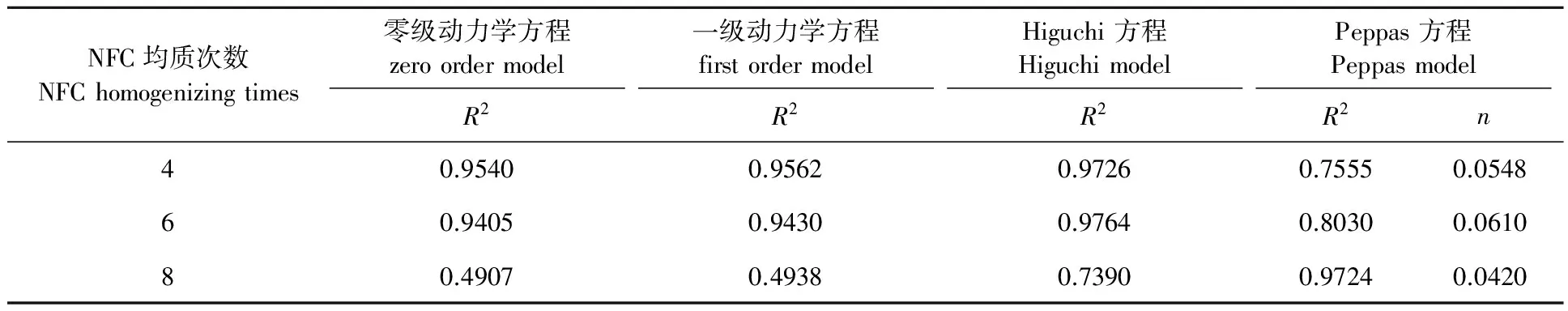
表 3 NFC制备时的均质次数对莫西沙星/NFC缓释膜体外释放曲线拟合结果的影响

表 4 pH值对莫西沙星/NFC缓释膜体外释放曲线拟合结果的影响
2.4莫西沙星/NFC缓释膜的抗菌作用分析
通过抑菌圈的直径(D)来判断莫西沙星/NFC缓释膜对标准金黄色葡萄球菌的抗菌作用[27],结果如图6所示。
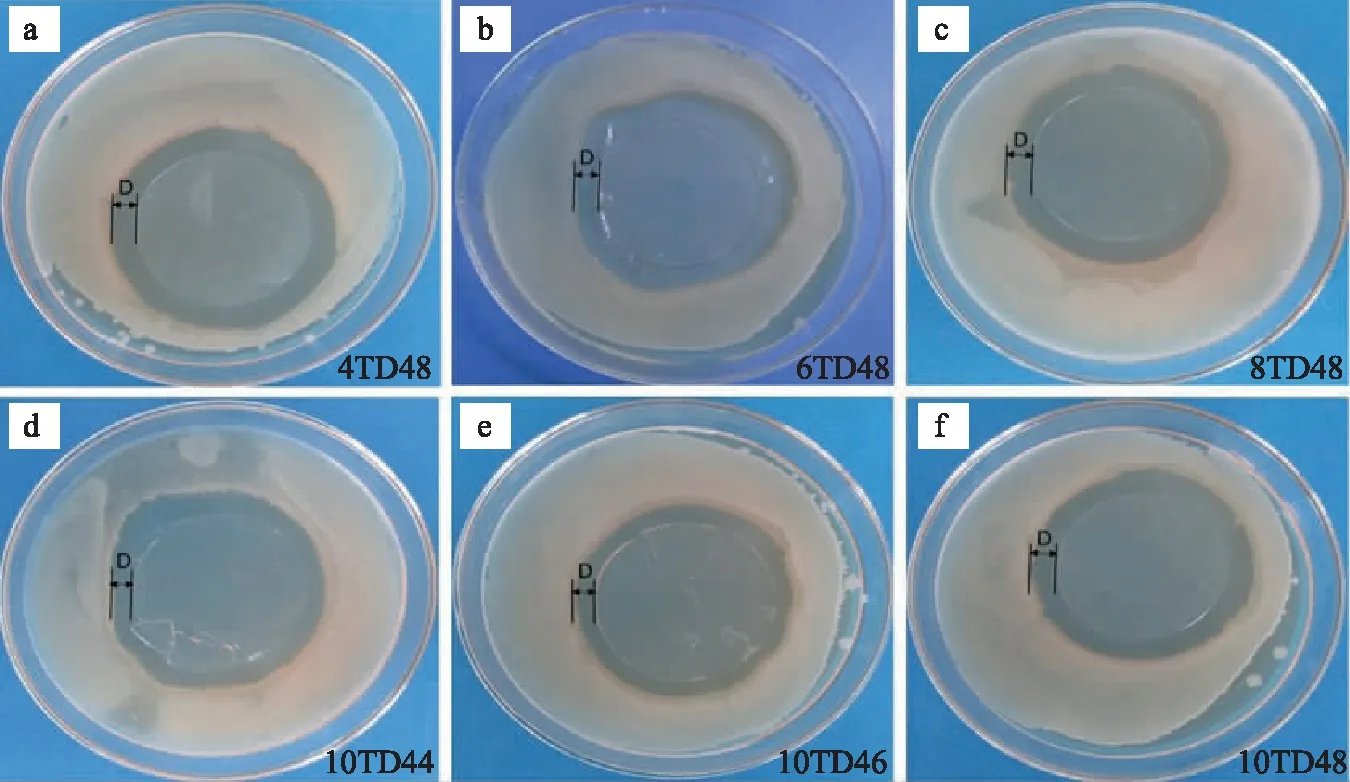
图 6 莫西沙星/NFC缓释膜的抗菌性能Fig. 6 The antibacterial properties of moxifloxacin/NFC sustained-release film
由图6可知,在相同均质次数(8次)条件下,NFC羧基分别为1.13、1.3和1.48 mmol/g时,莫西沙星/NFC缓释膜4TD48、6TD48和8TD48的D分别是5.09、5.34和5.82 mm,变化不大,说明NFC羧基含量的变化对莫西沙星/NFC缓释膜的抑菌效果影响不显著,其主要原因是莫西沙星与NFC通过物理吸附的方式结合,羧基含量的变化对缓释膜的药物释放机制影响不大;而当NFC的羧基保持1.70 mmol/g不变时,改变均质次数为4、6和8,莫西沙星/NFC缓释膜10TD44、10TD46和10TD48的D分别是4.38、5.27和6.33 mm,可见莫西沙星/NFC缓释膜的抑菌效果随NFC制备时的均质次数增加而增加。其原因是当NFC制备时的均质次数增加时,得到的NFC尺寸变小,NFC膜的结构更致密,膜的孔隙率减少,药物的释放由渗透释放和溶胀释放为主转为浓度差驱动为主。均质次数为8次的10TD48缓释膜抑菌效果最好,这可能与其药物释放为浓度差驱动为主,突释速度最快有关。制备的莫西沙星/NFC缓释膜对标准金黄色葡萄球菌的抑菌圈直径为4.38~6.33 mm,表明其具有较好的抗菌作用。 由于莫西沙星是非离子型药物,其在NFC上负载主要通过物理吸附作用,制备的莫西沙星/NFC缓释膜的药物缓释性能还有待提高。后续工作将进一步对阳离子药物的缓释性能开展研究,从而为NFC在药物缓释、创伤修复系统的应用提供更好的参考和理论依据。
3 结 论
3.1将NFC与广谱抗菌剂莫西沙星通过物理共混制备莫西沙星/NFC缓释膜,其FT-IR谱图中未见新的特征吸收峰出现,表明NFC与莫西沙星以物理吸附方式结合;当NFC含羧基为1.13 mmol/g,NFC制备时的均质次数为8次时,缓释膜的弹性模量可达到3.48 GPa,平衡溶胀率为6.03。
3.2改变羧基含量对缓释膜的药物释放行为影响不大,其缓释膜的药物释放曲线均符合Peppas方程。均质次数增加时,缓释膜的药物释放曲线由符合Higuchi方程转为符合Peppas方程。pH值为3时,莫西沙星的累积释放量达到最大值为20.91 %,缓释膜的药物释放行为更易受到酸的影响。
3.3抑菌实验显示莫西沙星/NFC缓释膜对金黄色葡萄球菌有明显的抗菌作用,缓释膜周围的抑菌圈直径在4.38~6.33 mm之间,均质次数为8次的10TD48缓释膜抑菌效果最好。
[1]ALEMDAR N. Fabrication of a novel bone ash-reinforced gelatin/alginate/hyaluronic acid composite film for controlled drug delivery[J]. Carbohydrate Polymers,2016,151:1019-1026.
[2]侯静文. 聚酯基高分子的合成、表征及用作药物载体的研究[D]. 上海:上海交通大学博士学位论文,2011.
[3]LI L,WANG L L,SHAO Y,et al. Drug release characteristics from chitosan-alginate matrix tablets based on the theory of self-assembled film[J]. International Journal of Pharmaceutics,2013,450(1/2):197-207.
[4]KOLAKOVIC R,PELTONEN L,LAUKKANEN A,et al. Nanofibrillar cellulose films for controlled drug delivery[J]. European Journal of Pharmaceutics and Biopharmaceutics,2012,82(2):308-315.
[5]NECHYPORCHUK O,BELGACEM M N,BRAS J. Production of cellulose nanofibrils:A review of recent advances[J]. Industrial Crops and Products,2016,93:2-25.
[6]JORFI M,FOSTER E J. Recent advances in nanocellulose for biomedical applications[J/OL]. Journal of Applied Polymer Science,2015,132:1-19[2016-12-10]. https:∥doi.org/10.1002/app.41719.
[7]GUISE C,FANGUEIRO R. Biomedical applications of nanocellulose[J]. Springer Netherlands,2016,12:155-169.
[8]KOLAKOVIC R,PELTONEN L,LAUKKANEN A,et al. Evaluation of drug interactions with nanofibrillar cellulose[J]. European Journal of Pharmaceutics and Biopharmaceutics,2013,85(3):1238-1244.
[9]MOTTAGHITALAB F,FAROKHI M,SHOKRGOZAR M A,et al. Silk fibroin nanoparticle as a novel drug delivery system[J]. Journal of Controlled Release,2015,206:161-176.
[10]VIJ N,MIN T,BODAS M,et al. Neutrophil targeted nano-drug delivery system for chronic obstructive lung diseases[J]. Nanomedicine:Nanotechnology,Biology and Medicine,2016,12(8):2415-2472.
[11]KOLAKOVIC R,PELTONEN L,LAAKSONEN T,et al. Spray-dried cellulose nanofibers as novel tablet excipient[J]. American Association of Pharmaceutical Scientists,2011,12(4):1366-1373.
[12]KOLAKOVIC R,LAAKSONEN T,PELTONEN L,et al. Spray-dried nanofibrillar cellulose microparticles for sustained drug release[J]. International Journal of Pharmaceutics,2012,430(1/2):47-55.
[13]VALO H,AROLA S,LAAKSONEN P,et al. Drug release from nanoparticles embedded in four different nanofibrillar cellulose aerogels[J]. European Journal of Pharmaceutical Sciences,2013,50(1):69-77.
[14]CHINTA D P,KATAKAM P,MURTHY V S N,et al. Formulation and in-vitro evaluation of moxifloxacin loaded crosslinked chitosan films for the treatment of periodontitis[J]. Journal of Pharmacy Research,2013,7(6):483-490.
[15]LINDFORS T,IVASKA A. pH sensitivity of polyaniline and its substituted derivatives[J]. Journal of Electroanalytical Chemistry,2002,531(1):43-52.
[16]赵姗. 纳米纤维素的光固化及其组织工程支架的可控制备研究[D]. 广州:华南理工大学硕士学位论文,2015.
[17]FAN L,CHENG C,QIAO Y B,et al. GNPs-CS/KGM as hemostatic first aid wound dressing with antibiotic effect:Invitroandinvivostudy[J/OL]. PloS One,2013,8(7):1-11[2016-12-10]. http:∥journals.plos.org/plosone/article/file?id=10.1371/journal. pone.0066890&type=printable.
[18]MOTWANI S K,CHOPRA S,AHMAD F J,et al. Validated spectrophotometric methods for the estimation of moxifloxacin in bulk and pharmaceutical formulations[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2007,68(2):250-256.
[19]GADAD A P,CHANDRA P S,DANDAGI P M,et al. Moxifloxacin loaded polymeric nanoparticles for sustained ocular drug delivery[J]. International Journal of Pharmaceutical Sciences and Nanotechnology,2012,5(2):1727-1734.
[20]罗璋,周新华,陈思晓,等. SA/FK 智能复合微球的交互作用及溶胀性能[J]. 精细化工,2014,31(3):312-316.
[21]胡运玖,左奕,邬均,等. 聚己内酯载药微球的制备及释药性能研究[J]. 材料导报,2015,29(2):29-32.
[22]KAMALY N,YAMEEN B,WU J,et al. Degradable controlled-release polymers and polymeric nanoparticles:Mechanisms of controlling drug release[J]. Chemical Reviews,2016,116(4):2602-2663.
[23]DASH S,MURTHY P N,NATH L,et al. Kinetic modeling on drug release from controlled drug delivery systems[J]. Acta Poloniae Pharmaceutica:Drug Research,2010,67(3):217-223.
[24]FREDENBERG S,WAHLGREN M,RESLOW M,et al. The mechanisms of drug release in poly (lactic-co-glycolic acid)-based drug delivery systems:A review[J]. International Journal of Pharmaceutics,2011,415(1/2):34-52.
[25]SINGHVI G,SINGH M. Review:In-vitrodrug release characterization models[J]. International Journal of Pharmaceutical Studies and Research,2011,2(1):77-84.
[26]史海真. 基于纳米纤维素的光电复合器件材料的可控制备与表征[D]. 广州:华南理工大学硕士学位论文,2014.
[27]WEI B,YANG G,HONG F. Preparation and evaluation of a kind of bacterial cellulose dry films with antibacterial properties[J]. Carbohydrate Polymers,2011,84(1):533-538.
