乌鳢短肽螯合铁的制备及其结构特性研究
2018-03-01汪婧瑜张业辉张友胜刘学铭张炫陈智毅程镜蓉王旭苹
汪婧瑜,张业辉,张友胜,刘学铭,张炫,陈智毅,程镜蓉,王旭苹
(1.广东省农业科学院蚕业与农产品加工研究所,农业部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)(2.广东宝桑园健康食品有限公司,广东广州 510610)
铁元素在人体内是许多关键酶功能特性所必需的元素,在生理代谢、氧转运、蛋白质和DNA合成、免疫功能、细胞分裂和细胞间信号转导等方面也发挥着重要作用[1,2]。目前,铁缺乏已经成为全球性的问题,在贫血和神经退行性疾病等方面已包含广泛的临床反应[1]。如何维持机体铁元素的平衡已成为亟需解决的问题。有研究表明,可以从膳食中补充铁元素,但是日常膳食中的植酸、草酸和磷酸等物质会抑制铁的吸收[3]。而无机铁元素补充剂的生物利用率低,因而,肽-铁螯合物作为新型的有机铁元素补充剂受到人们的广泛关注。研究表明,肽-铁螯合物使得铁元素利用小分子肽在小肠中易吸收的模式提高其生物利用度,促进铁元素的吸收。郑炯等[4]以Wistar品系初断乳大鼠为缺铁贫血模型,通过比较血红蛋白多肽螯合铁、葡萄糖酸亚铁和氯化亚铁对改善大鼠缺铁性贫血的效果,发现螯合铁使大鼠的体重、血红蛋白、红细胞计数、血清铁水平等显著升高,说明螯合铁具有补铁的功效;陈乐群等[5]通过断乳Wistar雌鼠缺铁贫血模型研究证实亚铁血红素肽螯合物具有很好的补铁功能,能促进铁离子的吸收。
乌鳢(Channa argus)是一种营养价值非常高的底栖淡水鱼类,其鱼肉中含有多种氨基酸及人体必需的微量元素钙、磷、铁和维生素,具有去瘀生新、滋补调养等功效[6]。因肉质鲜美,营养丰富,乌鳢主要以鲜食为主,其应用研究还很少。因而将高蛋白低脂肪的乌鳢进行高值化加工利用显得尤为重要。目前,以乌鳢为原料制备乌鳢螯合铁还未见报道。本研究通过分析螯合工艺对铁离子螯合率的影响、螯合铁的结构特征,旨在为乌鳢的高值化利用提供一些理论依据。
1 材料与方法
1.1 原料
1.1.1 原料
乌鳢购自广州天河区世纪联华超市,挑选大小均一,鲜活的鱼为实验材料。
1.1.2 试剂
胰蛋白酶(牛胰,250 U/mg),购自广州齐云生物技术有限公司;盐酸、氢氧化钠、无水乙醇、氯化亚铁、邻菲罗啉、盐酸羟胺、维生素C、十二水合硫酸铁铵、醋酸铵,均为分析纯,购自国药集团化学试剂有限公司。
1.1.3 仪器
数显电子分析天平,德国Sartorius公司;精密数显pH计,德国Sartorius公司;高速冷冻离心机,美国Thermo Fisher公司;真空冷冻干燥机,美国Laconic公司;FT-IR红外光谱仪,美国Nicolet公司;S7130氨基酸全自动分析仪,德国Siam公司;Leo-1530vp场发射电子扫描显微镜,德国LEO公司;UV-1800紫外可见分光光度计,日本岛津公司;JEM2100透射显微镜,日本电子株式会社。
1.2 方法
1.2.1 乌鳢短肽螯合铁的制备
参照林慧敏等[7]的方法。
乌鳢鱼肉→4倍体积的冰水→匀浆→调pH至8→浸提60 min→离心→上清液→调pH至5→离心→沉淀→调pH至7→鱼肉蛋白→调pH至6.5→胰蛋白酶酶解→离心→中间清夜→加入抗氧化剂Vc→按比例加入氯化亚铁→调pH→振荡反应→醇沉离心→沉淀→鼓风干燥→乌鳢短肽螯合铁
1.2.2 螯合率的测定
采用邻菲罗啉[8]法进行测定。
标准曲线的绘制:分别吸取铁标准溶液(10 μg/mL),0、2.0、4.0、6.0、8.0、10.0 mL,分别置于50 mL容量瓶中,依次加入1 mol/L的HC1溶液1 mL,10%的盐酸羟胺1 mL,0.12%邻菲罗啉1 mL,然后加入醋酸钠溶液5 mL,用水稀释至刻度,摇匀。以不加铁的试剂空白溶液作参比液,在510 nm波长处测定吸光度。以铁离子溶度x(μg/mL)为横坐标,吸光度y为纵坐标绘制标准曲线。得到的标准曲线回归方程为y=0.04x+0.0023,相关系数R2=0.9997。
样品测定:取适量的样品置于100 mL烧杯中,加入2 mL浓盐酸,待样品完全溶解后,用蒸馏水定容至100 mL容量瓶中。准确吸取5 mL样品液于50 mL容量瓶中,按照标准曲线的操作步骤测定吸光度。
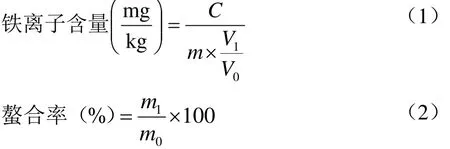
式中:C,标准曲线上查的样品试液相应的铁含量,μg;m,样品的质量,g;V1,测定时所取样品试液的体积,mL;V0,样品处理后的定容体积,mL;m1,螯合物中铁的量,mg;m0,加入反应体系中铁的量,mg。
1.2.3 单因素优化工艺研究
以螯合率为指标,以加酶量、pH值、短肽与氯化亚铁质量比、反应时间、反应温度为考察因素,设定基本条件为加酶量35000 U/g、pH 6.0、质量比3:1、时间30 min、温度25 ℃,改变其中一个条件,固定其他条件(其中氯化亚铁含量为0.1 g),考察各因素对螯合率的影响。
1.2.4 响应面优化工艺研究
在单因素试验的基础上,选取pH值、质量比、加酶量为试验因素,以螯合率为评价指标,根据Box-Benhnken方法进行响应面试验(参见表1)。
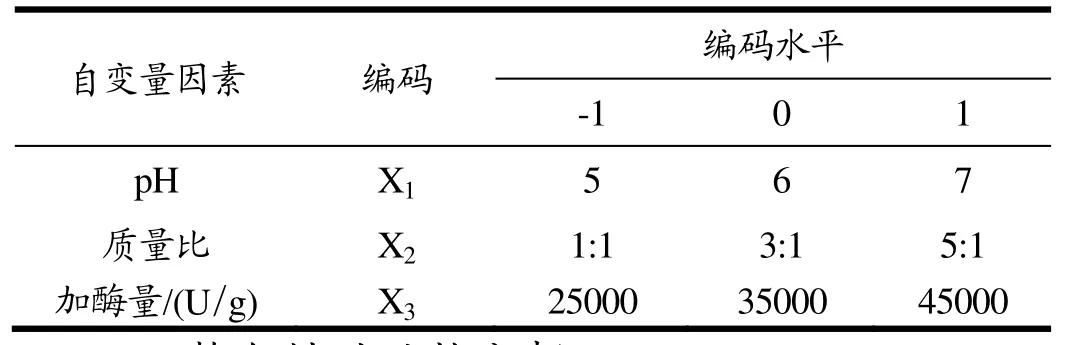
表1 因素水平表Table 1 Factors and levels of orthogonal test
1.2.5 螯合铁的结构分析
氨基酸组成分析:采用GB/T 5009.124-2003法;
紫外光谱扫描分析:将短肽和螯合铁分别配制成1 mg/mL水溶液,室温下测定其紫外吸收光谱,扫描范围为190~400 nm;
红外光谱扫描分析:将短肽和螯合铁分别与溴化钾充分研磨压片,室温下扫描其红外光谱,扫描范围为400~4000 cm-1;
扫描电镜分析:将短肽和螯合铁粉末均匀涂在样盘双面胶上,喷金镀膜处理后,利用Leo-1530vp场发射型电子扫描显微镜进行研究;
透射电镜分析[9]:取一定量短肽和螯合铁样品,制成1 mg/mL的溶液,吸取1 μL样品滴加在载有碳膜的铜网上,常温下自然晾干,于JEM2100透射显微镜下,观察其形态。
1.3 统计方法
每次试验设3个平行,结果取平均值。数据采用SPSS、Design-Expert软件进行统计分析,并采用Duncan法进行多重比较。采用Origin软件进行画图。
2 结果与讨论
2.1 不同单因素对乌鳢短肽螯合率的影响
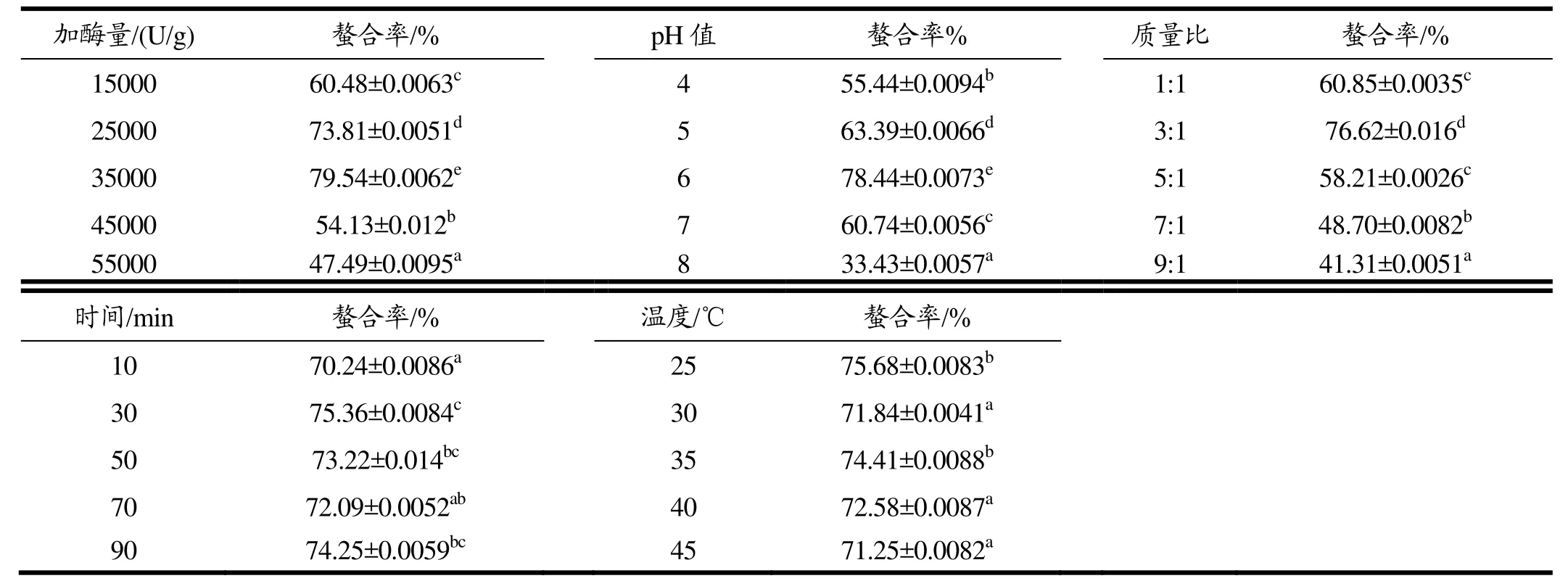
表2 各单因素对螯合率影响的显著性分析Table 2 The significant analysis of the effect of single factor on the chelating rate
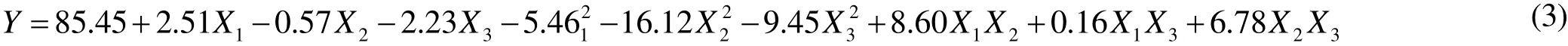
由表2可知,乌鳢短肽螯合铁的螯合率随着加酶量的增加,呈现先增加后下降的趋势,在35000 U/g时达到最大值79.54%,且与其他组存在显著差异。随着pH值的升高,螯合率逐渐增加,当pH为6.0时,螯合率达到最大值78.44%,与其它组存在极显著差异。质量比对螯合率的影响较大,随着质量比的增加,螯合率先增加后降低,在质量比为3:1时,螯合率达到最高,且与其它组存在显著差异。反应时间和反应温度对螯合率的影响不大。25 ℃是最佳螯合温度,此时螯合率达到最高值75.68%;反应时间为30 min,螯合率达到最高值75.36%。
2.2 响应面优化分析
试验具体设计组合、试验值和软件预测值见表3,得到螯合率Y对自变量pH(X1)、质量比(X2)、加酶量(X3)的二次多元回归方程,见公式3。
由表4知,总决定系数R2=0.9965,R2adj=0.9920,表明自变量与响应值之间线性关系显著。回归方程达到极显著水平(p<0.01),表明不同条件下螯合率的差异显著性。失拟项不显著(p>0.05),表明该方程对实验数据拟合较好。各项系数的显著性分析表明,因素1X1、X3的对螯合率的影响极显著(p<0.01),二次项X12、X22、X32都极显著,交互项中X1X2、X2X3极显著。三个因素中pH和加酶量对螯合率有极显著影响,且pH值>加酶量。考虑到实际操作的可行性,将得到的最佳螯合条件pH 6.25、质量比3.1:1、加酶量33933.14 U/g校正为pH 6.0、质量比3:1、加酶量35000 U/g,在此条件下,螯合率的理论值达到86.24%。经实验验证,最优条件下的螯合率为84.46%,与理论值的相对误差不大,说明该模型进行预测可行。
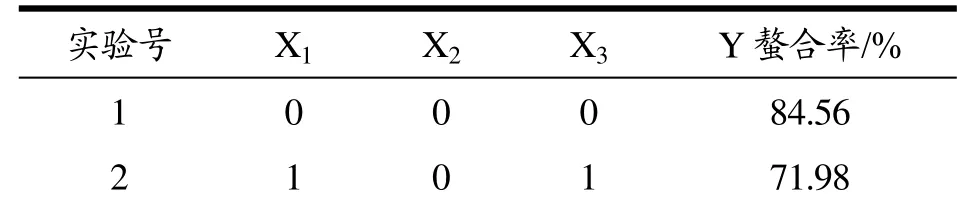
表3 响应面实验方案及实验结果表Table 3 The response surface experiment schemes and experiment results
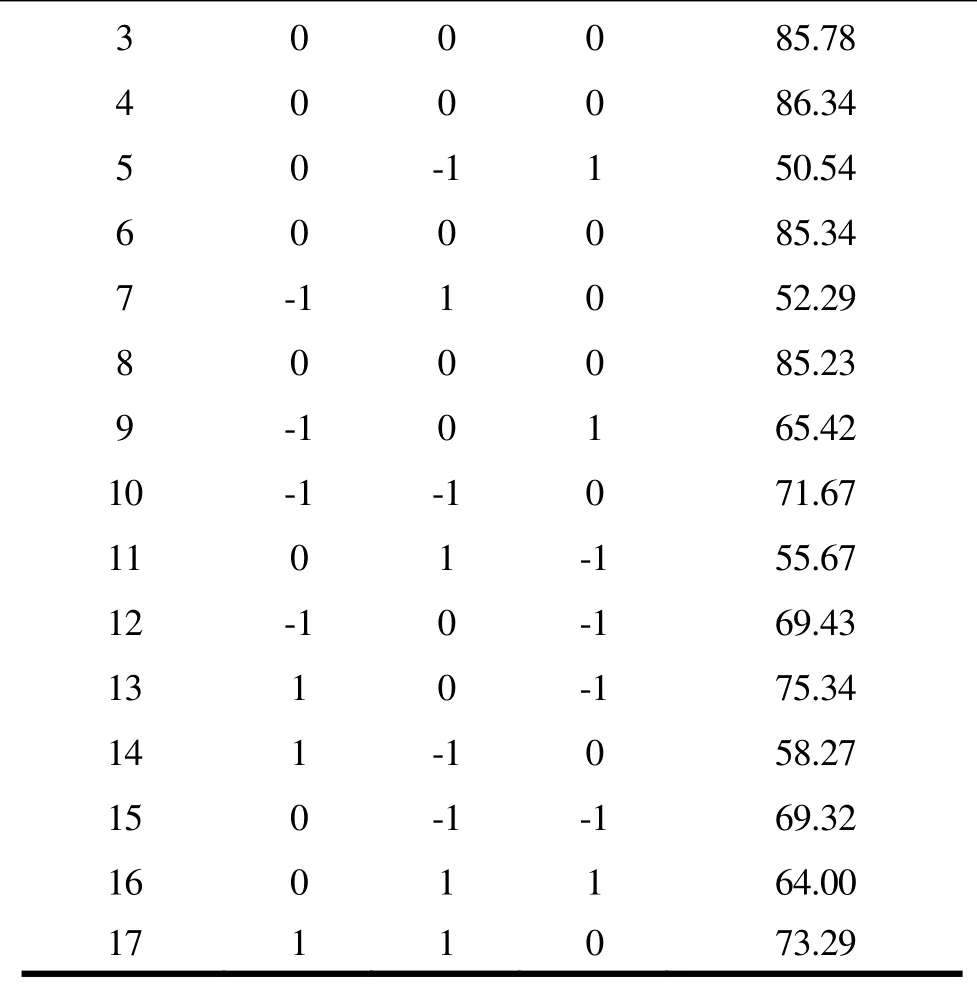
3 0 0 0 85.78 4 0 0 0 86.34 5 0 -1 1 50.54 6 0 0 0 85.34 7 -1 1 0 52.29 8 0 0 0 85.23 9 -1 0 1 65.42 10 -1 -1 0 71.67 11 0 1 -1 55.67 12 -1 0 -1 69.43 13 1 0 -1 75.34 14 1 -1 0 58.27 15 0 -1 -1 69.32 16 0 1 1 64.00 17 1 1 0 73.29

表4 回归方程的方差分析Table 4 The variance analysis of regression equation
2.3 螯合铁的氨基酸组成成分分析
乌鳢短肽与螯合铁的氨基酸组成分如表5所示。从表5可以看出,乌鳢短肽与螯合铁中Glu、Asp含量较高,但是与短肽相比螯合铁中Asp和Glu的含量增加。
这说明酸性的Asp和Glu与亚铁离子有较强的结合能力,可能是因为这两种氨基酸侧链基团上的羧基与亚铁离子发生更多的螯合[10]。高菲等[11]也证实海洋鱼骨胶原肽与钙离子螯合后,其Asp和Glu含量增加,说明Asp和Glu螯合钙离子的能力强。

表5 短肽和螯合铁的氨基酸组成Table 5 Amino acid compositionof short peptide and chelating iron
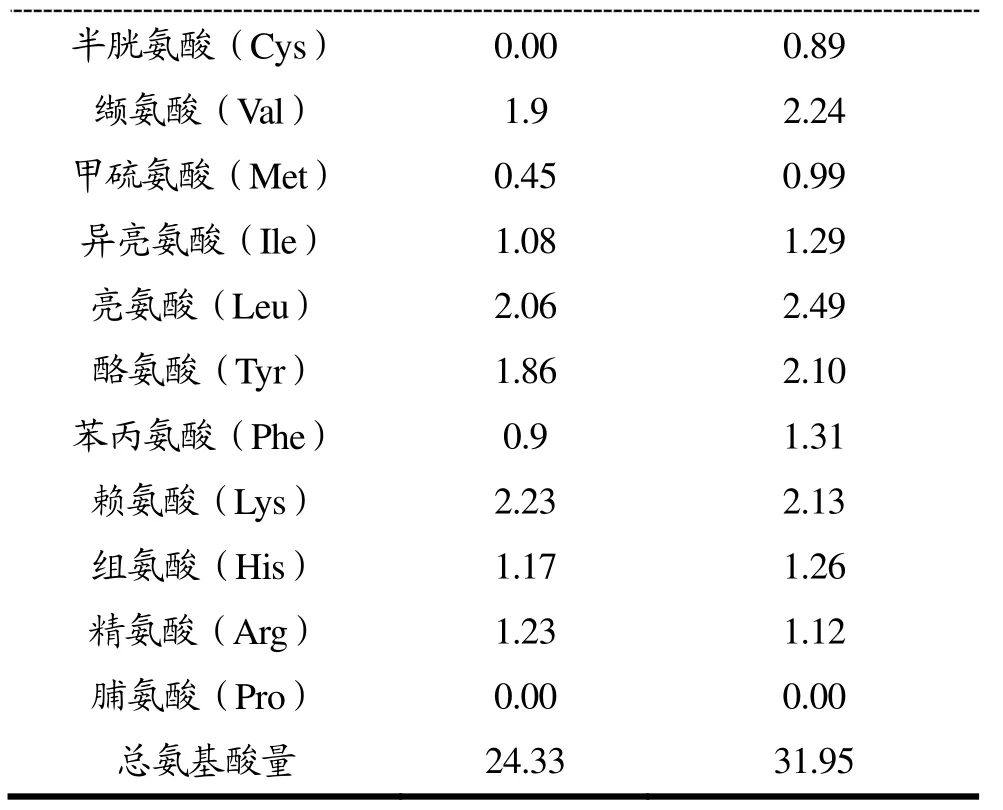
注:由于酸水解导致Trp被破坏,所以未能检测到Trp。
2.4 螯合铁的光谱分析
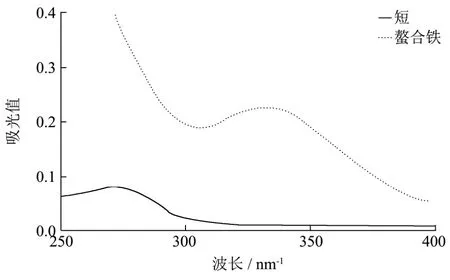
图1 紫外光谱图Fig.1 UV-VIS spectra
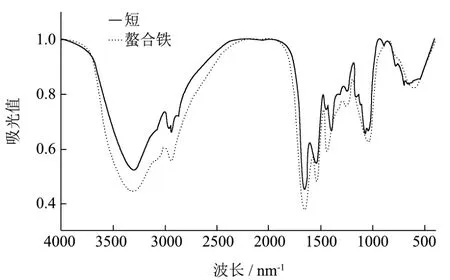
图2 红外光谱图Fig.2 FT-IR spectrum
图1显示,短肽的特征吸收峰在273.8 nm,螯合铁的最大吸收峰在332.2 nm,说明与亚铁离子螯合后的短肽,其最大吸收峰发生红移,且吸收强度增加。表明短肽与亚铁离子作用后形成了新的物质,其产生电子跃迁的能量与短肽的不同,因而其吸收光的波长不同[12],这初步证实了短肽与亚铁离子之间发生了螯合反应。
图2中发现,短肽由于氨基的伸缩振动、变角振动和羧基的伸缩振动产生的吸收峰在与亚铁离子螯合后,发生明显的位移,其吸收强度也发生改变[13]。短肽在3290.45 cm-1处具有吸收峰,表明有-NH2存在;在1649.10 cm-1处具有吸收峰,说明有C=O的存在,而-COO-的吸收峰在1542.05 cm-1处;由NH3+变角振动引起的吸收峰在1078.18 cm-1处;由N-H的面外变形振动产生的吸收峰在542.94 cm-1处。短肽与亚铁离子螯合后,氨基的吸收峰移动至3299.13 cm-1处,强度也发生改变;而C=O的吸收峰、-COO-的吸收峰分别移动至1651.97 cm-1、1534.32 cm-1;另外,NH3+变角振动引起的吸收峰以及由N-H的面外变形振动产生的吸收峰,螯合后分别移动至1039.60 cm-1、至595.98 cm-1处。这说明,与亚铁离子发生配位的基团可能是-NH2、C=O、-COO-、NH3+和N-H。
2.5 螯合铁的微观结构

图3 短肽和螯合铁扫描电镜图Fig.3 SEM images of short peptide and chelating iron

图4 短肽和螯合铁透射电镜图Fig.4 TEM images of short peptide and chelating iron
2 k和30 k倍数下的短肽电镜图(图3)发现,短肽表面光滑,有均匀分布的裂纹,可能是短肽在电镜真空环境下失水干燥留下的痕迹[14]。而2 k倍数下的螯合铁电镜图中发现,螯合铁表面不平整,有孔状结构,30 k倍数下的螯合铁电镜图中发现螯合铁颗粒是交织的团状结构,可能是短肽与亚铁离子反应后,吸附了一定的铁晶体[15]。
短肽与螯合铁的透射电镜图(图4)发现,短肽呈圆球状,聚集在一起,分散比较均匀;而螯合铁也呈圆球状,聚集更加密集,但边界分布不清,较模糊,分散不均匀。这说明,短肽与亚铁离子螯合后,短肽与亚铁离子结合更加紧密,聚集度更高。
3 结论
3.1 目前,关于螯合物的研究有很多,螯合工艺条件很成熟,蔡冰娜等[16]通过响应面法优化鳕鱼皮胶原蛋白肽与氯化亚铁的螯合工艺,得到螯合率为37.31%的鳕鱼皮胶原蛋白肽螯合铁;林慧敏等[17]采用二次正交旋转组合设计优化了复合酶解带鱼下脚料蛋白制备亚铁螯合多肽的工艺,得到螯合率为82.31%的带鱼下脚料蛋白肽螯合铁。但是以乌鳢为原料制备乌鳢短肽螯合物的研究鲜有报道。本研究选用乌鳢鱼肉为原料,通过响应面实验优化工艺条件,得到乌鳢短肽螯合铁的最优方案:以35000 U/g的加酶量加入胰蛋白酶得到短肽,再以质量比为3:1加入短肽和氯化压铁,于pH 6.0的条件下,40 ℃水浴螯合30 min,在此条件下制备乌鳢短肽螯合铁螯合率为84.46%。
3.2 通过对短肽和螯合物结构的分析比较,不仅证实了短肽与金属离子发生螯合反应,还解决了螯合物的化学键问题,并分析了螯合物的反应基团[18]。本研究中通过对螯合前后氨基酸组分分析,发现螯合铁中Asp和Glu含量较短肽增加,说明Asp和Glu的侧链基团上的羧基是短肽与亚铁离子的结合位点。螯合前后的光谱分析发现,短肽的特征吸收峰的强度和位置都发生偏移,说明短肽的-NH2、C=O、-COO-、NH3+和N-H等基团与亚铁离子发生配位反应。扫描电子显微镜和透射电子显微镜则揭示了短肽与螯合物的微观结构,表明短肽与亚铁离子之间还存在吸附作用,并且结合紧密。
3.3 本研究初步探究了乌鳢短肽与亚铁离子的螯合工艺,并分析了螯合物的结构特征。但是,关于短肽铁螯合物的生物活性、构效关系等还需要进一步的探究。另外,短肽铁螯合物作为新型的亚铁离子补充剂,其吸收特性、安全性和稳定性等也需要进一步深入探究。
[1] Abbaspour N, Hurrell R, Kelishadi R. Review on iron and its importance for human health [J]. Journal of Research in Medical Sciences: the Official Journal of Isfahan University of Medical Sciences, 2014, 19(2): 164-174
[2] Toxqui L, Vaquero M P. Chronic iron deficiency as an emerging risk factor for osteoporosis: a hypothesis [J].Nutrients, 2015, 7(4): 2324-2344
[3] Hurrell R, Egli I. Iron bioavailability and dietary reference values [J]. The American Journal of Clinical Nutrition, 2010,91(5): 1461S-1467S
[4] 郑炯,汪学荣,阚建全.血红蛋白多肽螯合铁的抗贫血功能研究[J].食品工业科技,2009,30(10):312-313
ZHENG Jiong, WANG Xue-rong, KAN Jian-quan. Study on anti-anemia function of haemoglobin polypeptide chelated iron [J]. Science and Technology of Food Industry, 2009,30(10): 312-313
[5] 陈乐群.食品级亚铁血红素肽的研制及其功能特性研究[D].长春:吉林大学,2012
CHEN Le-qun. Research on enzymatic preparation and functional characteristics of heme-iron enriched polypeptide[D]. Changchun: Jilin University, 2012
[6] 周龙珍.乌鳢胰蛋白酶的分离纯化,性质分析及分子克隆[D].厦门:集美大学,2012
ZHOU Long-zhen. Purification, characterization and cDNA cloning of trypsin from the pancreas of snakehead (Channa argus) [D]. Xiamen: Jimei University, 2012
[7] 林慧敏,邓尚贵,庞杰,等.超滤法制备高抗菌抗氧化活性带鱼蛋白亚铁螯合肽(Fe-HPH)的工艺研究[J].中国食品学报,2012,12(6):16-21
LIN Hui-min, DENG Shang-gui, PANG Jie, et al. Preparing ferrous chelating of Hairtail protein hydrolysate (Fe-HPH)with high antibacterial and antioxidant activity by ultrafiltration [J]. Journal of Chinese Institute of Food Science and Technology, 2012, 12(6): 16-21
[8] 廉宜君,汪河滨,肖芙蓉,等.响应面法优化棉籽粕复合氨基酸螯合铁制备工艺[J].食品工业科技,2013,34(22):200-203
LIAN Yi-jun, WANG He-bin, XIAO Fu-rong, et al.Optimization of compound amino acid in cottonseed meal chelated iron (Ⅱ) preparation via response surface methodology [J]. Science and Technology of Food Industry,2013, 34(22): 200-203
[9] 林谢凤.鱼类副产物胶原肽螯合锌的制备及其性质研究[D].厦门:集美大学,2015
LIN Xie-feng. Preparation and properties of collagen peptide chelated zinc from fish bioprocessing by-products [D].Xiamen: Jimei University, 2015
[10] 刘文颖,鲁军,宋莎莎,等.乌鸡低聚肽亚铁螯合物的分离纯化与结构鉴定[J].现代食品科技,2017,33(8):1-8
LIU Wen-ying, LU Jun, SONG Sha-sha, et al. Isolation and identification of black-bone silky fowl-sourced iron(II)-chelating oligopeptides [J]. Modern Food Science and Technology, 2017, 33(8): 1-8
[11] 高菲,王维有,鲁军,等.海洋鱼骨胶原肽钙螯合物的制备及红外光谱表征[J].中国海洋大学学报(自然科学版),2015,45(1):47-54
GAO Fei, WANG Wei-you, LU Jun, et al. Preparation and infrared spectrum identification for Marine Fish Ossein peptide chelated calcium [J]. Periodical of Ocean University of China, 2015, 45(1): 47-54
[12] 陆剑锋,孟昌伟,李进,等.斑点叉尾鱼骨胶原多肽螯合钙的制备及其特征[J].水产学报,2012,36(2):314-320
LU Jian-feng, MENG Chang-wei, LI Jin, et al. Preparation and characterization of collagen polypeptide chelated calcium from fish bone powder of channel catfish (Ictalurus punctatus) [J]. Journal of Fisheries of China, 2012, 36(2):314-320
[13] 霍健聪,邓尚贵,童国忠.鱼蛋白酶水解物亚铁螯合修饰物抑菌特性及机理研究[J].中国食品学报,2010,10(5):83-90
HUO Jian-cong, DENG Shang-gui, TONG Guo-zhong.Studies on antibacterial activity and mechanism of Fe2+chelate modifier of hydrolysate by proteinase from Trichiurus Haumela offal [J]. Journal of Chinese Institute of Food Science and Technology, 2010, 10(5): 83-90
[14] 付文雯.牛骨胶原多肽螯合钙的制备及其结构表征[D].武汉:华中农业大学,2010
FU Wen-wen. Preparation and structure characterization of cattle bone collagen peptide chelating calcium [D]. Wuhan:Huazhong Agricultural University, 2010
[15] 许先猛,董文宾,孙皎皎.猪皮胶原多肽螯合钙的制备及其结构表征[J].食品工业科技,2015,36(20):309-313
XU Xian-meng, DONG Wen-bin, SUN Jiao-jiao. Preparation and characterization of pigskin polypeptide chelating calcium[J]. Science and Technology of Food Industry, 2015, 36(20):309-313
[16] 蔡冰娜,陈忻,潘剑宇,等.响应面法优化鳕鱼皮胶原蛋白肽螯合铁工艺[J].食品科学,2012,33(2):48-52
CAI Bing-na, CHEN Xin, PAN Jian-yu, et al. Optimization of preparation process for Cod skin collagen peptide-Iron (Ⅱ)chelate via response Surface Methodology [J]. Food Science,2012, 33(2): 48-52
[17] 林慧敏,邓尚贵,庞杰,等.复合酶解带鱼蛋白制备亚铁螯合多肽的工艺优化[J].中国食品学报,2011,11(8):87-94
LIN Hui-min, DENG Shang-gui, PANG Jie, et al.Optimization of composite enzymatic hydrolysis technology for preparation of ferrous chelating polypeptide from Hairtail protein [J]. Journal of Chinese Institute of Food Science and Technology, 2011, 11(8): 87-94
[18] 汪婧瑜,张业辉,刘学铭,等.动物性短肽螯合物研究进展[J].食品科技,2015,40(10):236-240
WANG Jing-yu, ZHANG Ye-hui, LIU Xue-ming, et al.Advances progress in animal peptide chelates [J]. Food Science and Technology, 2015, 40(10): 236-240
