Serratia sp. SYBC H发酵浮萍生产蛋白酶的研究
2018-03-01李桂英廖祥儒蔡宇杰
李桂英,廖祥儒,蔡宇杰
(1.钦州学院食品工程学院,广西北部湾特色海产品资源开发与高值化利用高校重点实验室,广西钦州 535011)(2.江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
浮萍是一种水生植物,生长繁殖快,2~7 d可以繁殖一代,在温热带地区可以常年生长。浮萍含有丰富的粗蛋白质,纤维素及灰分[1]。对于浮萍的开发利用,许多研究工作者作过一些报道,如利用浮萍生产燃料乙醇[2];提取紫萍中的中药成分[3,4];利用浮萍快速生长繁殖的特点,除去污水中丰富的氮、磷成分,从而达到净化除污的目的[5,6];利用生物分离技术提取浮萍中的多糖[7];利用浮萍研究植物衰老机理,以及开发植物反应器和除草剂等[8~12]。
利用微生物生产代谢产物,培养基的成分及其用量对微生物的生长、代谢产物的积累,甚至对大规模工业发酵生产都有很大的影响,因而,培养基成分的选择和优化显得尤为重要。工业上,耐有机溶剂蛋白酶的生产菌株常常来自于假单胞菌属,芽孢杆菌属以及某些霉菌[13~16],鲜有沙雷氏菌发酵生产蛋白酶的报道。另外,生产蛋白酶的氮源常常是酵母提取物、牛肉膏和鱼蛋白等昂贵氮源[17,18],后来逐渐扩展到利用农副产品的下脚料如豆粕,豆皮来发酵生产[19,20],尚未见来自于浮萍的生产报道。据估计,常规的发酵培养基成本占整个生产成本的30%左右[21]。
从无锡太湖腐败的蓝藻中分离筛选出一株蛋白酶生产菌株,根据其形态学特征,生理生化特性,16S rRNA基因序列分析,以及脂肪酸含量测定,认为该菌株为粘质沙雷氏菌(Serratia marcescens),命名为Serratia sp. SYBC H。拟采用单因素实验和正交试验研究Serratia sp. SYBC H摇瓶发酵浮萍生产稀有的蛋白酶的培养基优化工作。先采用单因素实验对Serratia sp.SYBC H生产蛋白酶的发酵时间,碳源、碳氮比、无机盐和产酶添加剂等因素进行筛选,接着采用正交实验研究影响Serratia sp. SYBC H生产蛋白酶的发酵培养基的组成及其用量范围。通过培养基优化,提高Serratia sp. SYBC H生产蛋白酶的产率。利用Serratia sp. SYBC H发酵浮萍生产蛋白酶,既提升浮萍资源的利用,又降低蛋白酶的生产成本,增强市场竞争力,获得经济效益与环境净化的双赢。
1 材料与方法
1.1 试验材料
1.1.1 浮萍与菌株
浮萍取自于无锡太湖,晒干,筛选,除异物,粉碎,过200目筛。
菌株Serratia sp. SYBC H分离于无锡太湖的蓝藻中,保藏于4 ℃的LB斜面培养基及-20 ℃的甘油中。
1.1.2 培养基
种子培养基(g/L):酵母提取物5,胰蛋白胨10,氯化钠5,pH 7~7.2。
斜面培养基:在种子培养基的组成上再加上2%的琼脂。
基本发酵培养基(g/L):可溶性淀粉10,浮萍20,pH 7~7.2。
1.2 测定方法
采用Bhosale的方法[22],略加改动。抽取发酵液5 mL,8000 r/min离心10 min,取离心上清液0.1 mL作为粗酶,加入0.5 mL预热后的1%(m/V)偶联酪蛋白溶液,混匀,于37 ℃的水浴中反应10 min,加入1.9 mL的10%三氯乙酸终止酶促反应。接着,将反应混合液离心分离(6000 r/min,10 min),小心吸取离心上清液,加入2 mL 10% (m/V) NaOH溶液进行显色反应。在波长440 nm下测定吸光值,平行测定三次。空白对照以失活的蛋白酶进行相同方法处理。一个酶活单位(U)定义为在此条件下每分钟释放1 µg酪氨酸所需要的蛋白酶量。
1.3 试验方法
1.3.1 种子液与蛋白酶制备的培养方法
将活化后的斜面菌种划1~2环接入灭菌的种子培养基,于30 ℃,200 r/min条件下摇瓶培养10 h。接着,将生长旺盛的种子液按5%的接种比例转入基本发酵培养基,于30 ℃,200 r/min条件下继续培养。
1.3.2 蛋白酶生产时间曲线
以5%的接种比,将生长旺盛的菌种转入已灭菌的基本发酵培养基,于30 ℃,200 r/min条件下摇瓶培养,每隔3 h取样,离心分离(8000 r/min,10 min),取离心上清液作为粗酶,测其蛋白酶活力。平行重复三次试验。
1.3.3 各种碳源对蛋白酶生产的影响
取葡萄糖、蔗糖、麦芽粉、玉米粉、马铃薯粉和小麦粉等各以10 g/L的浓度取代基本发酵培养基里的可溶性淀粉,其它成分及浓度保持不变,于30 ℃,200 r/min条件下摇瓶培养18 h。取发酵液,离心分离(8000 r/min,10 min),取离心上清液,测其蛋白酶活力。平行重复三次试验。
1.3.4 小麦粉与浮萍的比例对产酶的影响
以小麦粉取代基本发酵培养基里的可溶性淀粉,以不同的小麦粉与浮萍比例,于30 ℃,200 r/min条件下培养18 h。提取发酵液,离心分离(8000 r/min,10 min),取离心上清液,测其蛋白酶活力。平行重复三次试验。
1.3.5 各种无机盐对产酶的影响
分别向基本发酵培养基加入不同的无机盐,其它组分及其浓度保持不变,于30 ℃,200 r/min条件下摇瓶培养18 h。取发酵液,离心分离(8000 r/min,10 min),取离心上清液,测其蛋白酶活力。以不加任何无机盐的试验作为空白对照,设空白对照的酶活为相对酶活100%。平行重复三次试验。
1.3.6 各种产酶添加剂对产酶的影响
分别向基本发酵培养基加入不同的添加剂,其它成分及浓度保持不变,于30 ℃,200 r/min条件下摇瓶培养18 h。取发酵液,离心分离(8000 r/min,10 min),取离心上清液,测其蛋白酶活力。以不加任何添加剂的试验作为空白对照,设空白对照的酶活为相对酶活100%。平行重复三次试验。
1.3.7 正交试验
在单因素实验的基础上,设计六因素三水平正交试验,研究各因素各水平对蛋白酶生产的影响,设酶活值作为实验结果,以极差R值作为评判依据。每一组实验设计三个平行样,于30 ℃,200 r/min条件下培养18 h。发酵结束后,提取发酵液,离心分离(8000 r/min,10 min),取离心上清液,测其蛋白酶活力,平行重复测定三次。筛选的因素及其水平如表1。
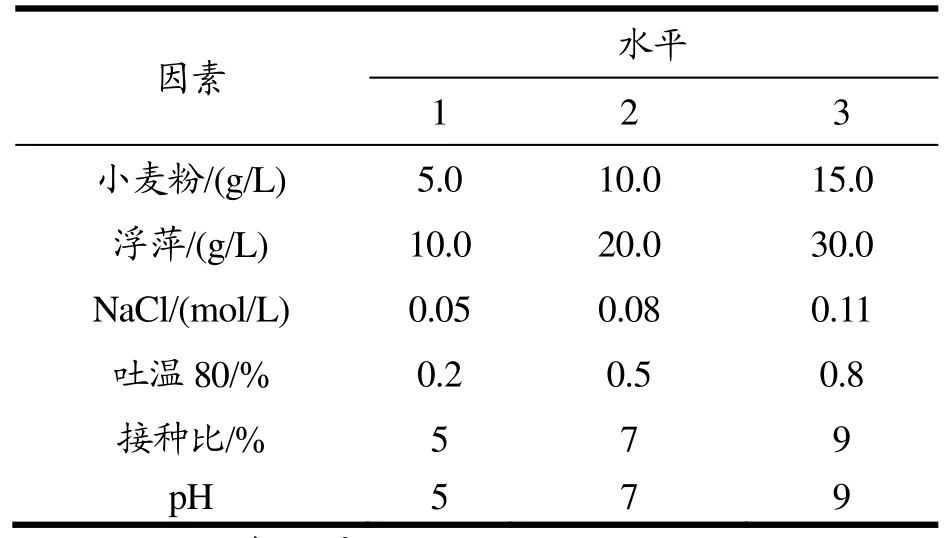
表1 六因素三水平正交试验表Table 1 6 factors -3 levels of orthogonal experiment design
1.3.8 蛋白酶纯度鉴定
经分离纯化后的蛋白酶,采用SDS-PAGE检测,按照试剂盒说明书进行配胶和操作。以发酵上清液作为对照。
1.3.9 数据统计分析
采用DPS v7.05软件进行正交试验设计和R值分析,用origin 8.0作图。
2 结果与分析
2.1 发酵时间对产酶的影响

图1 发酵时间与蛋白酶生产的关系Fig.1 The relationship between fermentation time and protease production
按5%的接种比,将生长旺盛的菌种接入基本发酵培养基,30 ℃,200 r/min条件下培养,每间隔3 h取样,按照蛋白酶的检测方法(1.2),测定样品中的蛋白酶活力。平行重复三次试验。结果如图1发酵培养基接入菌种后,随着发酵时间的增加,蛋白酶的产值也逐渐增加,发酵18 h时,蛋白酶的产值达到最大值;随后,随着发酵时间的延长,蛋白酶的产值逐渐下降。这种现象经常发生在微生物发酵产酶过程中。根据实验结果,发酵18 h左右,适宜终止蛋白酶生产。利用Serratia sp. SYBC H发酵浮萍生产蛋白酶,发酵周期短,这是Serratia sp. SYBC H有别于其它蛋白酶生产菌株的特征之一。如常见的蛋白酶生产菌株枯草芽孢杆菌,其蛋白酶的发酵生产时间一般都在40 h左右[23],有的高达72 h[24],Psedomonas sp.菌株生产蛋白酶的时间一般在48 h以上[25],有的菌株生产蛋白酶需要120 h[26]。利用Serratia sp. SYBC H发酵浮萍,周期短,不仅可加速对浮萍的高值化处理,还可以高产蛋白酶,获得双重收获。
2.2 各种碳源对蛋白酶生产的影响
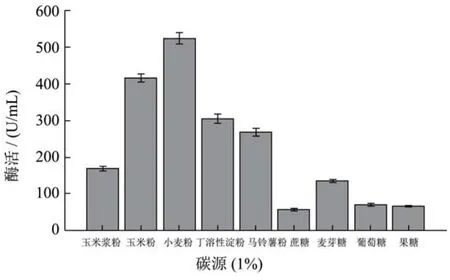
图2 碳源对Serratia sp. SYBC H蛋白酶生产的影响Fig.2 Effect of carbon source on Serratia sp. SYBC H protease production
微生物生长与产酶都需要碳源。不同的菌种,以及生产不同的酶,需要不同的碳源。通过对碳源的优化,结果(图2)发现:Serratia sp. SYBC H发酵浮萍生产蛋白酶的最佳碳源是小麦粉,其次是玉米粉。简单易利用的碳源如果糖﹑葡萄糖、蔗糖,其蛋白酶的产率却较低。发生这种现象的原因是由于简单易利用的碳源如葡萄糖对蛋白酶的生产易形成分解代谢物阻遏作用[27],降低蛋白酶的生产。因此,为了提高蛋白酶的生产,应该避免使用大量可迅速利用的碳源如葡萄糖等。
2.3 小麦粉与浮萍比例对产酶的影响
发酵培养基的C/N比对产酶有重要影响。因此,我们采用试验结果中的最佳碳源-小麦粉取代基本发酵培养基里的可溶性淀粉,研究不同的小麦粉/浮萍之比对蛋白酶生产的影响,结果如图3。浮萍:小麦粉为2:1时,蛋白酶的生产达到最大值(1378.30 U/mL),表明Serratia sp. SYBC H生产蛋白酶,可以通过控制培养基里的小麦粉/浮萍之比来控制C/N之比,从而提高蛋白酶的产率。在以前的文献报道中,有科研工作者也发现以小麦粉作碳源可以提高蛋白酶的发酵生产[28]。

图3 浮萍与小麦粉之比对Serratia sp. SYBC H蛋白酶生产的影响Fig.3 Effect of duckweed /wheat flour ratio on Serratia sp.SYBC H protease production
2.4 各种无机盐对产酶的影响
对于微生物的生长与代谢,需要各种无机盐参与复杂的生化反应。通过向基本发酵培养基添加不同的无机盐,蛋白酶的生产见表2。NaCl显著刺激蛋白酶的生产,CaCl2不影响蛋白酶的生产,重金属盐除了MnCl2不抑制蛋白酶生产外,其它的无机盐,如FeCl2、ZnCl2和CoCl2均不同程度地抑制Serratia sp. SYBC生产蛋白酶。类似以NaCl作无机盐提高蛋白酶的发酵生产还有Serratia rubidaea菌株[29]。

表2 无机盐对Serratia sp. SYBC H蛋白酶生产的影响Table 2 Effects of inorganic salts on Serratia sp. SYBC H protease production
2.5 各种添加剂对Serratia sp. SYBC H生产蛋白酶的影响
利用微生物发酵生产酶制剂,经常需要添加各种添加剂刺激酶的生产。分别向基本发酵培养基加入不同的添加剂,以不加任何添加剂的试验作为空白对照,试验结果如表3。吐温80显著促进蛋白酶生产,曲拉通X-100,聚乙烯醇对蛋白酶生产的促进作用不明显;一些油脂(酯)类如橄榄油、大豆油、杂油脂和油酸等明显抑制Serratia sp. SYBC H生产蛋白酶,其产酶值基本为空白对照的50%左右。
吐温80是微生物产酶常用的非离子表面活性剂。它可以增强微生物细胞膜的通透性,促进微生物对营养基质的吸收以及胞外酶的分泌释放;它还可以增大发酵液的气液比表面积,增大溶解氧的传质系数,有利于好氧菌对溶解氧的吸收利用[30,31];另外,它还可以保护酶的活性。

表3 各种添加剂对Serratia sp. SYBC H 蛋白酶生产的影响Table 3 Effects of additives on Serratia sp. SYBC H protease production
2.6 正交试验
正交试验的产酶结果如表4。根据极差R值分析,对影响蛋白酶生产的因素进行排序。结果发现,小麦粉为第一主要因素,其次是浮萍,小麦粉和浮萍分别作为产酶的碳源和氮源,它们是影响蛋白酶生产的主要因素。排在第三位的是吐温80,吐温80影响蛋白酶的分泌释放,增强细胞膜对营养物及溶解氧的吸收。正交实验的最高产酶值为1459.94 U/mL(第9组)。根据极差R值分析,pH和接种量不是影响Serratia sp.SYBC H生产蛋白酶的主要因素。
同一株菌,Serratia sp. SYBC H发酵蓝藻生产蛋白酶的最高产酶值为941 U/mL[32];发酵浮萍生产蛋白酶的产酶值为1459.94 U/mL,是发酵蓝藻产酶值的1.55倍。
表明浮萍作为有机氮源,比蓝藻更适合Serratia sp.SYBC H生产蛋白酶。同一株菌发酵,造成蛋白酶产值这么悬殊的原因可能是蓝藻浆里含有抗营养因子和抑菌剂[32],阻碍Serratia sp. SYBC H的生长,要除去蓝藻浆里的抑菌剂和抗营养因子,需要复杂的操作,进一步增加生产成本的投入。另一方面,用蓝藻发酵生产蛋白酶,所配用的是简单碳源蔗糖,对蛋白酶的生产易形成分解代谢物阻遏作用,从而降低蛋白酶的生产[27]。而浮萍,易于打捞,风晒,筛选,粉碎。风干的浮萍未曾有抑菌剂的报道,所配用的碳源是复杂碳源小麦粉,在极大程度上降低了分解代谢物阻遏作用,这些优势是蓝藻浆发酵生产蛋白酶所不可比拟的。

表4 正交试验设计及其试验蛋白酶活值Table 4 Orthogonal experiment design and protease activity
2.7 蛋白酶纯度鉴定

图4 SDS-PAG分析 Serratia sp. SYBC H蛋白酶Fig.4 SDS-PAGE images of Serratia sp. SYBC H protease
由图4可知,由浮萍发酵生产的Serratia sp. SYBC H蛋白酶经盐析,透析,离子交换层析,凝胶层析等一系列分离纯化操作,得到电泳纯的蛋白酶,其分子量在58 ku左右。经分离纯化后的沙雷氏菌蛋白酶,脱除了可能残留于蛋白酶中的沙雷氏菌细胞,解除了可能存在的安全隐患。另外,整个发酵过程是安全的,无Serratia sp. SYBC H逃逸;发酵结束后,提取粗酶后的发酵渣及发酵液体经过灭菌后才排放,故利用Serratia sp. SYBC H发酵生产蛋白酶是安全可行的。
3 结论
以酶活为考察指标,采用单因素试验和正交试验研究了影响Serratia sp. SYBC H发酵浮萍生产蛋白酶的培养基组成及其用量范围。Serratia sp. SYBC H发酵浮萍生产蛋白酶的培养基组成及其最佳水平分别为小麦粉15 g/L,浮萍30 g/L,吐温80 0.8% (V/V),NaCl 0.05 mol/L;在试验范围内,最高产酶值可达1459.94 U/mL,发酵周期为18 h。
[1] 许万祥,周岩,胡宗泽.不同加工储藏方法对浮萍营养成分的影响[J].当代畜牧,1998,3:35-36
XU Wan-xiang, ZHOU Yan, HU Zong-Ze. Effects of different processing and storage methods on nutritional components of duckweed [J]. Contemporary Animal Husbandry, 1998, 3: 35-36
[2] 薛慧玲,董志红,方杨,等.水生能源植物浮萍生产燃料乙醇[J].可再生能源,2013,31(7):55-59
XUE Hui-ling, DONG Zhi-hong, FANG Yang, et al.Producing fuel ethanol from energy hygrophyte duckweed [J].Renewable Energy Resources, 2013, 31(7): 55-59
[3] 罗铁成,侯恩太,路锋,等.浮萍药用研究概况[J].安徽农业科学,2010,38(16):8423-8424
LUO Tie-cheng, HOU En-tai, LU Feng, et al. General medicinal research on duckweed [J]. Journal of Anhui Agriculture Sciences, 2010, 38(16): 8423-8424
[4] 凌云,万峰.中药浮萍的微量元素分析[J].微量元素与健康研究,1999,2:43-44
LIN Yun, WANG Feng. Analysis of trace elements in Chinese medicinal duckweed [J]. Trace Elements and Health Studies, 1999, 2: 43-44
[5] 辛静,张震,钱晓晴,等.浮萍去除污水处理厂出水中氮磷的比较研究[J].环境科学与技术,2011,34(11):100-103
XIN Jing, ZHANG Zhen, QIAN Xiao-qing, et al. Effects of duckweed on nitrogen and phosphorus removal in reclaimed waste water [J]. Environmental Science & Technology, 2011,34(11): 100-103
[6] 李阳,成家杨,钟钰,等.浮萍多样性对富营养化水体净化效果的影响[J].南方农业学报,2017,48(2):259-265
LI Yang, CHENG Jia-yang, ZHONG Yu, et al. Effects of duckweed diversity on purifying eutrophic water [J]. Journal of Southern Agriculture, 2017, 48(2): 259-265
[7] 蒋征,王红,吴启南.PB试验结合BBD响应面法优化浮萍多糖的提取工艺研究[J].中药材,2015,38(6):1283-1286
JIANG Zheng, WANG Hong, WU Qi-nan. Optimization of polysaccharide extraction from spirodela polyrrhiza by plackett-burman design combined with box-behnken response surface methodology [J]. Journal of Chinese Medicinal Materials, 2015, 38(6): 1283-1286
[8] XU H, HU X H, ZOU X M, et al. Synthesis and herbicidal activities of novel 3-N-Substituted Amino-6-Methyl-4-(3-Trifluoromethylphenyl) pyridazine derivatives [J]. Journal of Agricultural & Food Chemistry, 2008, 56(15): 6567-6572
[9] Rival S, Wisniewski J P, Langlais A, et al. Spirodela(Duckweed) as an alternative production system for pharmaceuticals: a case study, aprotinin [J]. Transgenic Research, 2008, 17(4): 503
[10] Edelman M, Vunsh R, Hong L J, et al. Transgenic Spirodela:a Unique, Low-Risk, Plant Biotechnology System. http://abstracts. aspb. org/ pb2003 / public/p56/0834. Html
[11] ZHU Y R, TAO H L, LV X Y, et al. High Level of Endogenous L-serine Initiates Senescence in Spirodela Polyrrhiza [J]. Plant Science, 2004, 166(5): 1159-1166
[12] 朱晔荣,马荣,刘清岱,等.浮萍相关研究的几方面重要进展[J].生物学通报,2010,45(4):4-6 ZHU Ye-rong, MA Rong, LIU Qing-dai, et al. Study on some important advances related duckweed [J]. Bulletin of Biology,2010, 45(4): 4-6
[13] Gupta A, Roy I, Khare S K, et al. Purification and characterization of solvent stable protease from Pseudomonas Aeruginosa PseA [J]. Journal Chromatography A, 2005, 1069:155-161
[14] Yildirim V, Baltaci Mo, Ozgencli L, et al. Purification and biochemical characterization of a novel thermostable serine alkaline protease from aeribacillus pallidus c10: a potential additive for detergents [J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2017, 32(1): 468-477
[15] Zhang R, Song Z, Wu Q, et al. a Novel Surfactant- NaCl -and Protease-Tolerant β-Mannanase from Bacillus sp. HJ14 [J].Folia Microbiolologica, 2016, 61(3): 233-242
[16] Alves M P, Salgado R L, Eller M R, et al. Characterization of aHheat -Resistant Extracellular Protease from Pseudomonas Fluorescens 07A ShowsThat Low Temperature Treatments Are More Effective in Deactivating Its Proteolytic Activity[J]. Journal of Dairy Science, 2016, 99(10): 7842-7851
[17] Dey G, Mitra A, Banerjee R, et al. Enhanced production of amylase by optimization of nutritional constituents using response surface methodology [J]. Biochemical Engineering Journal, 2001, 7: 227-231
[18] Chauhan B, Gupta R. Application of statistical experimental design for optimization of alkaline protease production from Bacillus sp. RGR-14 [J]. Process Biochemistry, 2004, 39(12):2115-2122
[19] Prakasham Rs, Rao C, Sarma Pn. Green gram husk-an inexpensive substrate for alkaline protease production by Bacillus sp. in solid-state fermentation [J]. Bioresource Technology, 2006, 97(13): 1449
[20] Novelli P K, Barros M M, Fleuri L F. Novel inexpensive fungi proteases: production by solid state fermentation and characterization [J]. Food Chemistry, 2015, 198: 119
[21] Kirk O, Borchert T V, Fuglsang C C. Industrial enzyme application [J]. Current Opinion Biotechnology, 2002, 13:345-351
[22] Bhosale S H, Rao M B, Deshpande V V, et al.Thermostability of high activity alkaline protease from conidiobolus coronatus (NCI86.8.20) [J]. Enzyme and Microbial Technology, 1995, 17(2): 136-139
[23] 许昕,曾辉,曾德勇,等.响应面优化解淀粉芽孢杆菌产中型蛋白酶发酵条件[J].中国酿造,2017,36(4):78-82
XU Xin, ZENG Hui, ZENG De-yong, et al. Optimization of fermentation conditions of neutral protease-producing Bacillus amyloliquefaciens by response surface methodology[J]. China Brewing, 2017, 36(4): 78-82
[24] 李冰峰.蛋白酶生产菌的产酶条件的研究[J].化学工业与工程技术,2011,32(1):15-19
LI Bing-feng. Rournal of conditions of protease production from bacterium [J]. Journal of Chemical Industry &Engineering, 2011, 32(1): 15-19
[25] 康传红,田亚新,李秀凉,等.Psedomonas.sp.W7产低温蛋白酶培养基及培养条件的优化[J].食品科学,2015, 36(19):163-169
KANG Chuan-hong, TIAN Ya-xin, LI Xiu-liang, et al.Optimization of medium components and culture conditions for cold-adapted protease produced by Pseudomonas sp. W7[J]. Food Science, 2015, 36(19): 163-169
[26] 李杏华,黄梓浩,张弛,等.黑曲霉液体发酵制备蛋白酶的条件优化[J].广东工业大学学报,2017,34(2):23-27
LI Xing-hua, HUANG Zi-hao, ZHANG Chi, et al. an Optimization design for protease produced by Aspergillus niger liquid state fermentation [J]. Journal of Guangdong University of Technology, 2017, 34(2): 23-27
[27] 郭勇.微生物水解酶类生物合成的模式[J].中国酿造,1985,4(5):1-5
GUO Yong. Biosynthesis patterns of microbial hydrolases [J].China Brewing, 1985, 4(5): 1-5
[28] Mehta V J, Thumar J T, Singh S P. Production of alkaline protease from an alkaliphilic actinomycete [J]. Bioresource Technology, 2006, 9: 1650-1654
[29] Doddapaneni K K, Tatineni R, Vellanki R N, et al.Purification and characterization of two novel extra cellular protease from Serratia rubidaea [J]. Process Biochemistry,2007, 42: 1229-1236
[30] Ellouz Y, Bayoudh S, Kammoun N, et al. Production of protease by Bacillus Substilis grown on sardinelle heads and viscera flour [J]. Bio-Resource Technology, 2001, 80(1):49-51
[31] Johnvesly B, Naik G R. Studies on production of thermostable alkaline protease from thermophilic and alkaliphilic Bacillus sp. JB-99 in a chemically defined medium [J]. Process Biochemistry, 2001, 37(2): 139-144
[32] 李桂英,蔡宇杰,廖祥儒.沙雷氏菌发酵蓝藻生产蛋白酶[J].环境工程学报,2012,6(3):1043-1046
LI Gui-ying, CAI Yu-jie, LIAO Xiang-ru. Protease production by Serratia sp. SYBC H with duckweed [J].Journal of Environmental Engineering, 2012, 6(3):1043-1046
