黑豆种皮中原花青素的提取和纯化研究
2018-03-01朱学伸赵文林淑鑫王仁雷
朱学伸,赵文,林淑鑫,王仁雷
(江苏第二师范学院生命科学与化学化工学院,江苏省生物功能分子重点建设实验室,江苏南京 210013)
黑豆(Phaseolus vulgaris)是豆科植物大豆的成熟的黑色种子。黑豆的种皮是黑色的,子叶有黄色或者绿色的,分为黄仁黑豆、青仁黑豆和恒春黑豆3个品种。种植面积较广,原产于我国黑龙江、吉林、辽宁和安徽,现在山东、河南、河北和江苏均有种植。黑豆的营养价值很丰富,具有高蛋白、低脂肪的特点,并含有维生素和多种微量元素。中医学认为,黑豆是一种经济、有助于抗衰老、具有医食同疗的特殊功能食品,尤其是其黑紫色的豆皮富含具有抗氧化作用的原花青素[1]。
原花青素(procyanidins,PC)是自然界中广泛存在于植物体中的一类多酚类化合物,是从植物中分离到的一种无色的物质,一般将在无机酸存在时、在加热条件下可以产生红色花青素的一类多酚化合物统称为原花青素[2]。原花青素由儿茶素、表儿茶素单体和不同数量的儿茶素或表儿茶素聚合体组成,聚合体又分为低聚体和高聚体[3]。现代医学认为,人体的许多疾病都和体内存在的自由基有关,大量研究表明,原花青素是目前研究发现的容易获得、最强效的自由基清除剂。原花青素低聚体具有高效的抗氧化活性,其清除自由基能力是VE的50倍、Vc的20倍[4]。还具有保护心血管系统、降血糖、抗肿瘤、延缓皮肤衰老、抑菌和抗疲劳等作用,并作为保健食品被大量生产,被广泛应用于药品、食品、保健食品和化妆品等领域[5],是极具经济价值与市场开发价值的天然产物。
原花青素大多存在于植物的树皮、果皮及种皮中,目前市场上原花青素主要来源于松树皮、葡萄皮、葡萄籽和荔枝皮等,但从黑豆种皮中提取、纯化原花青素并进行系统化分析的报道较少。本文旨在研究黑豆种皮中原花青素的提取、纯化方法。
1 材料与方法
1.1 材料与试剂
黑豆(产自福建省三明市);无水乙醇、甲醇、盐酸(ω%:36.0~38.0)和氢氧化钠等试剂(南京化学试剂股份有限公司);柠檬酸(西陇化工股份有限公司);柠檬酸三钠(国药集团化学试剂有限公司);Tris(Biosharp公司);儿茶素标准品(Sigma-aldrich公司);香草醛(生物工程股份有限公司);AB-8大孔树脂(西安瀚宇树脂科技有限公司)。
1.2 仪器与设备
高功率数控超声波清洗器(超声仪器有限公司);破壁料理机(九阳股份有限公司);BSA224S电子天平(赛多利斯科学仪器有限公司);SHZ-Ⅲ循环水式真空泵(科尔仪器设备有限公司);安泰生物安全柜(苏净集团有限公司);分光光度计(Thermo公司);数显恒温水浴锅(荣华仪器制造有限公司);冷冻干燥机(Telstar公司);真空浓缩仪(Eppendorf公司)。
1.3 方法
1.3.1 原花青素浓度的测量方法
采用香草醛-盐酸法测量黑豆种皮原花青素粗提物的浓度。以甲醇为溶剂,配置浓度为2%的香草醛甲醇溶液,现配现用。测量时,取1 mL提取液于试管中(若提取液浓度过高,将其稀释10倍后再取),加入5 mL的2%香草醛甲醇溶液,再加入1 mL的浓盐酸,震荡摇匀后,于500 nm波长下测量吸光值。
以儿茶素为标准品,配置浓度分别为0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL的儿茶素标准溶液,使用香草醛-盐酸法于500 nm下测量吸光值。以儿茶素浓度(mg/mL)为x轴,吸光度值A为y轴,绘制标准曲线并得到直线方程如下:
y=0.98x +0.0193,R2= 0.9931
1.3.2 原花青素提取单因素试验
1.3.2.1 乙醇浓度对原花青素提取效果的影响
剥取一定量的黑豆种皮,使用料理机磨碎成粉末,称取1 g黑豆种皮粉末置于锥形瓶中,分别加入55%、60%、65%、70%和75%的5个不同浓度的乙醇溶液,料液比为1:20(m/V),使用封口膜封闭锥形瓶。然后将样品放入超声波清洗仪中,使用100%功率,在60 ℃下提取30 min。将提取液进行抽滤除去固体颗粒,分别取1 mL提取液按照香草醛-盐酸法测定原花青素含量。
1.3.2.2 提取时间对原花青素提取效果的影响
剥取一定量的黑豆种皮,使用料理机磨碎成粉末,称取1 g黑豆种皮粉末置于锥形瓶中,加入60%的乙醇溶液,料液比为1:20(m/V),使用封口膜封闭锥形瓶。然后将样品放入超声波清洗仪中,使用100%功率,在60 ℃下进行提取,设定5个不同的提取时间分别为20 min、30 min、40 min、50 min和60 min。将提取液进行抽滤除去固体颗粒,分别取1 mL提取液按照香草醛-盐酸法测定原花青素含量。
1.3.2.3 料液比对原花青素提取效果的影响
剥取一定量的黑豆种皮,使用料理机磨碎成粉末,称取1 g黑豆种皮粉末置于锥形瓶中,加入60%的乙醇溶液,设定5个不同的料液比分别为1:10、1:20、1:30、1:40、1:50(m/V),使用封口膜封闭锥形瓶。然后将样品放入超声波清洗仪中,使用100%功率,在60 ℃下提取,提取时间为30 min。将提取液进行抽滤除去固体颗粒,分别取1 mL提取液按照香草醛-盐酸法测定原花青素含量。
1.3.2.4 提取温度对原花青素提取效果的影响
剥取一定量的黑豆种皮,使用料理机磨碎成粉末,称取1 g黑豆种皮粉末置于锥形瓶中,加入60%的乙醇溶液,料液比为1:20(m/V),使用封口膜封闭锥形瓶。然后将样品放入超声波清洗仪中,使用100%功率,设置5个不同的温度分别为40 ℃、50 ℃、60 ℃和70 ℃进行提取,提取时间30 min。将提取液进行抽滤除去固体颗粒。分别取1 mL提取液按照香草醛-盐酸法测定原花青素含量。
1.3.2.5 原花青素提取正交试验方法
为了更加准确的确定黑豆种皮原花青素的提取条件,根据正交实验原理,在前述的乙醇浓度、提取时间、提取温度、料液比、提取次数4个单因素实验的基础之上,分别选取较优的3个水平进行试验,重复两次并取平均值,最后进行结果分析。原花青素提取率的计算:
提取率(%)=(粗提液中原花青素质量/黑豆种皮质量)×100%
1.3.3 原花青素粗提物的纯化研究
按照1.3.3优化的最优方法得到的黑豆种皮原花青素粗提液经真空浓缩[6]、冷冻、干燥成粉末备用。采用大孔树脂层析柱进行纯化处理。大孔树脂多为工业型原料,含有碱等防腐剂,因此使用前须预处理除去杂质。取适量大孔树脂于无水乙醇中静置24 h,令树脂充分水合后用蒸馏水洗至无醇;其次用5%的盐酸溶液浸泡树脂12 h,用蒸馏水洗至中性;再置于5%氢氧化钠溶液中浸没12 h后用蒸馏水冲洗;最后置于蒸馏水中备用[7];采用大孔树脂湿法装柱待用[8],研究动态的吸附与解析条件。
1.3.3.1 确定最佳上样液流速
配制上样液浓度为0.6 mg/mL,测出吸光值A0。将20 mL AB-8大孔树脂湿法装柱,分别以0.4、0.6、0.8、1.0 mL/min的流速上样,流出液每到10 mL收集一次,测吸光值A1。当A1值趋于稳定时,停止上样,绘制泄露曲线,确定最佳上样液流速。
1.3.3.2 确定吸附液的最适浓度
量取20 mL AB-8大孔树脂,湿法装柱。上样液质量浓度分别为0.2、0.4、0.6、0.8、1.0 mg/mL,分别测上样液的吸光度值A0[9],以最佳上样液流速上样20 mL,待上样液全部通过层析柱后,测出流出液的吸光值A1,计算吸附率并绘制曲线,确定吸附液的最适浓度。
1.3.3.3 选择最佳洗脱流速
量取20 mL AB-8大孔树脂,以上述最佳浓度的溶液上样使其吸附饱和,先用适量的去离子水洗脱有机酸、糖类等杂质(可进行速度调试),然后用静态吸附试验选择出最优浓度的乙醇溶液洗脱,分别以0.5、1、1.5 mL/min的流速洗脱,每收集10 mL流出液时,测吸光值A2,绘制相应曲线,选择最佳洗脱流速。
1.3.4 原花青素纯化产物的红外色谱定性分析
称量纯化后的黑豆皮原花青素固体粉末约2 mg,与溴化钾充分研磨,进行干燥处理。经压片处理5 min后,得到原花青素-溴化钾圆片,在红外分光光度计中进行红外光谱扫描,得到红外光谱图[10]。
1.4 数据分析
数据处理及作图采用SPSS和Microsoft Excel分析软件。
2 结果与讨论
2.1 原花青素提取效果单因素实验分析
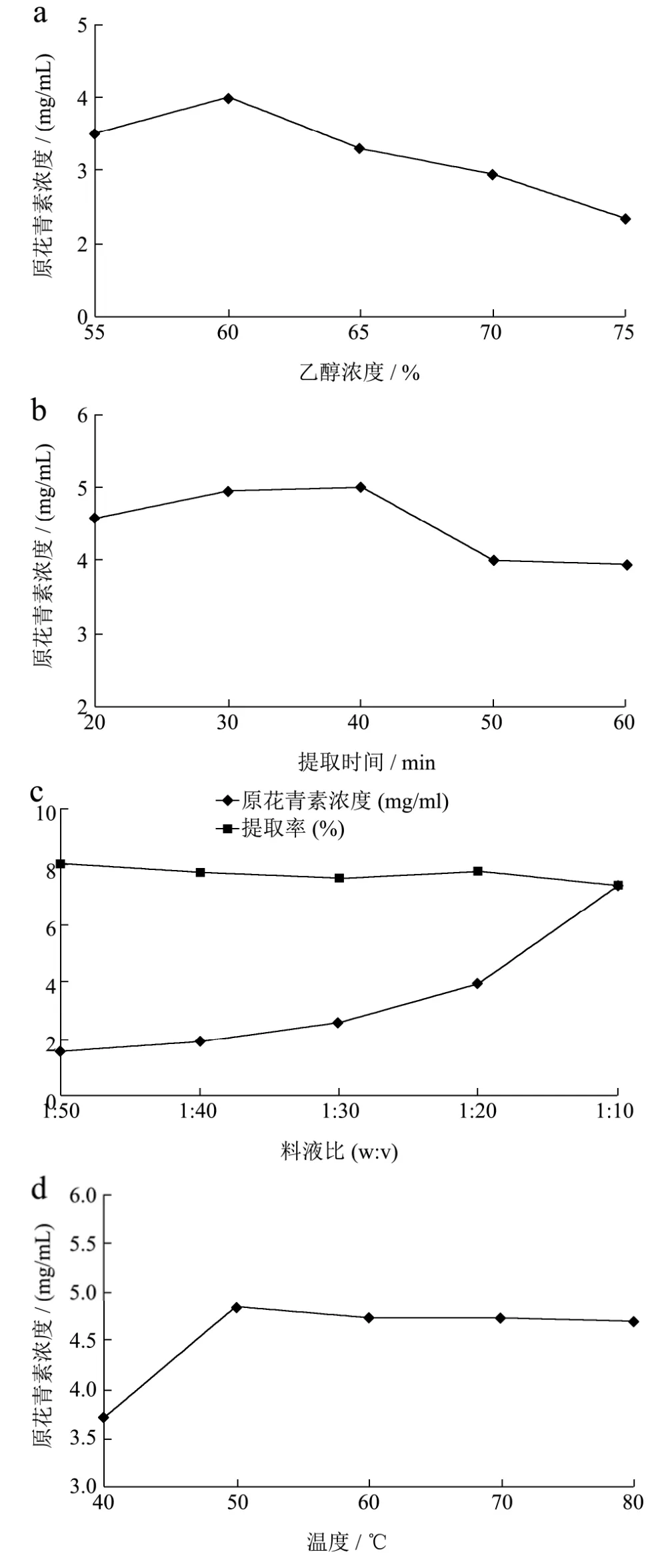
图1 乙醇浓度(a)、提取时间(b)、料液比(c)、和提取温度(d)对原花青素提取效果影响的结果Fig.1 Effects of ethanol concentration (a), extraction time (b),solid-liquid ratio (c) and extraction temperature (d) on the extraction of procyanidins
根据图1(a)结果所示,乙醇的浓度在低于60%时,随着乙醇浓度的增加,黑豆种皮中原花青素的提取效果呈上升趋势;当乙醇的浓度高于60%时,随着乙醇浓度的增加,提取效果反而呈下降趋势,乙醇浓度过高反而不利于提取。因此,采用55%、60%、65%作为正交试验中乙醇浓度三个水平。
提取时间对原花青素提取效果影响的结果如图1(b)所示。提取时间在40 min之前,黑豆种皮中原花青素的提取效果随着提取时间的延长而呈上升趋势;提取时间在40 min之后,提取效果随着提取时间的延长而呈下降趋势,提取时间过长可能会导致原花青素的稳定性下降,反而降低了提取率。
因此,采用30 min、40 min和50 min作为正交试验的提取时间三个水平。
根据图1(c)结果所示,黑豆种皮中原花青素的提取浓度随着料液比的增大而升高,但是料液比过高会造成材料的浪费。再根据提取率来看,料液比在低于1:30时,提取率随着料液比的增高而降低,料液比在1:30~1:10之间,提取率有峰值,料液比为1:20 (m/V)的时候提取率水平较高,但仍低于料液比为1:50的提取率。但是1:50的溶液量过多,考虑到后期的浓缩以及溶液的节省问题,因此,采用1:30、1:20、1:10 (m/V)作为正交试验的中料液比的三个水平。
提取温度对原花青素提取效果影响的结果如图1(d)所示。提取温度在50 ℃之前,黑豆种皮中原花青素的提取效果随着提取温度的升高而呈上升趋势;提取温度在50 ℃之后,提取效果随着提取温度的升高而呈下降趋势,提取时间过高可能会导致原花青素的稳定性下降,反而降低了提取率。因此,采用40 ℃、50 ℃和60 ℃作为正交试验中提取温度三个水平。
2.2 原花青素提取效果正交实验分析
在正交单因素实验的基础之上,对影响黑豆种皮原花青素粗提物提取效果的4个主要因素:乙醇浓度(A)、提取时间(B)、料液比(C)和提取温度(D)进行分析,分别选取3个水平,采用L9(34)正交实验进行最佳提取条件实验分析,具体设计参照表1。
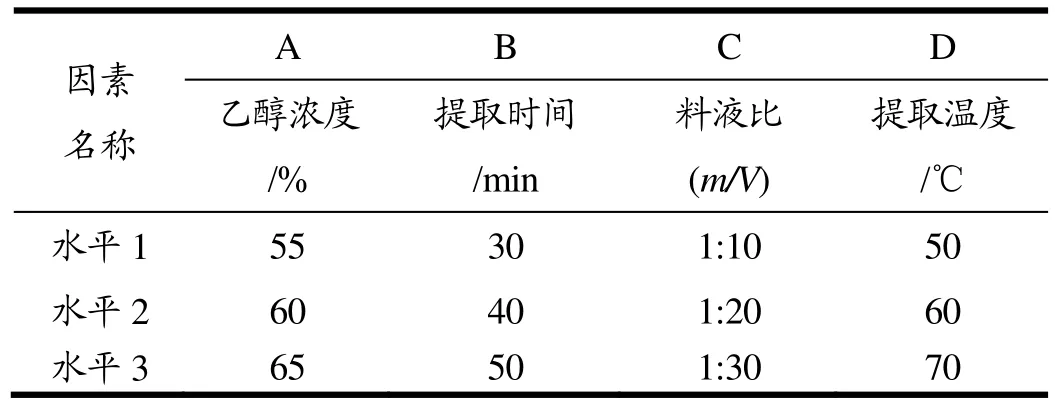
表1 正交试验设计Table 1 The design of orthogonal experiment
由表2的正交试验结果可知,料液比和乙醇浓度对黑豆种皮的原花青素提取效果影响较大,相比较之下,提取温度和提取时间影响较小。
四个因素对黑豆种皮中原花青素的提取效果的显著性依次是:料液比(m/V)>乙醇浓度(%)>提取温度(℃)>提取时间(min)。根据均值的结果得出,黑豆种皮原花青素的最优提取条件是A2B3C1D2。但根据料液比的单因素试验,当料液比为1:10(m/V)时,提取率较低,浪费原材料,并且乙醇易挥发,会导致溶液过少,不利于工业化生产,所以最终选用的料液比为1:20(m/V)。因此确定的最优提取条件为A2B3C2D2,即乙醇浓度为60%、提取时间为50 min、料液比为1:20(m/V)、提取温度为60 ℃。
童锡迪等[11]、张海晖等[12]、孙智达等[13]和姜霞等[14]分别研究了莲子壳、板栗壳中、沙枣果肉和葡萄籽中原花青素的最佳提取工艺,研究结果显示乙醇浓度介于50%~72%之间,提取温度在介于40 ℃和76 ℃之间,料液比为1:7(m/V)至1:15(m/V)不等,由于均未使用超声波辅助提取,所以提取时间都较长。
QIN等人使用超声波辅助提取法研究了红景天中原花青素的最优提取条件,其最佳提取条件如下:料液比为1:40 (m/V)、乙醇浓度为60%,提取温度为50 ℃,提取时间为30 min[15],同本文的最终结果较为接近。因为所使用的提取材料都不同,所以最佳提取条件会有所偏差,但均在一定的较小的范围内波动。
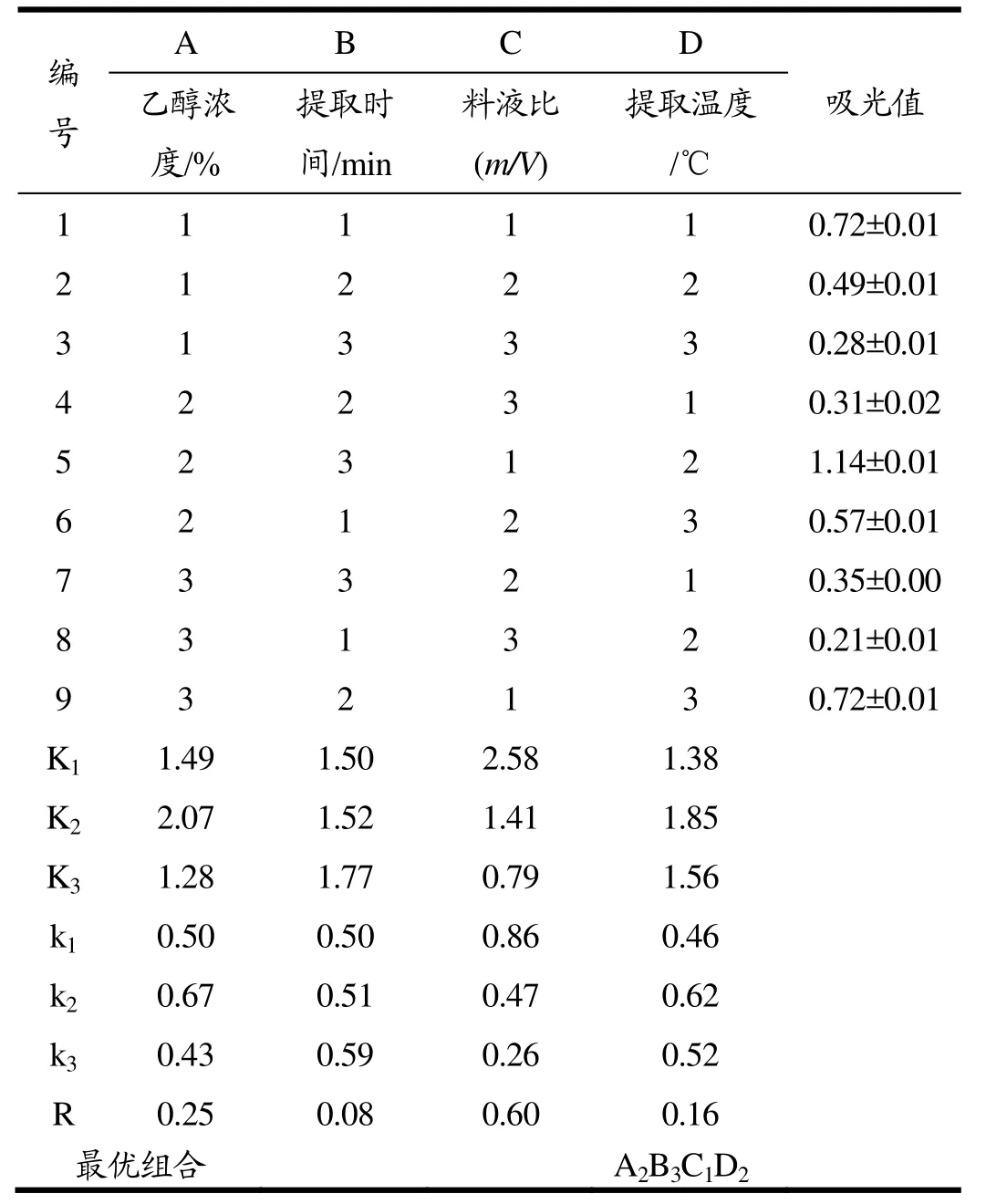
表2 正交试验设计分析结果Table 2 The analysis results of orthogonal experiment
2.3 黑豆种皮原花青素动态吸附和解析研究
2.3.1 上样液流速对动态吸附的影响

图2 上样液流速对动态吸附的影响Fig.2 Effects of different sampling velocities on the dynamic adsorption
由图2上样液流速对动态吸附的影响曲线可知,不同流速的上样液导致吸附效率不同。本试验每当流出液体积到10 mL时测量吸光值,图中虽然展示流出液体积相同情况下,流速较慢,吸光值越较快达到饱和。但是上样液0.4 mL/min的流速需25 min才流出10 mL,而流速为1 mL/min的上样液只需要10 min。图中也显示最后各流速吸光值饱和值相似且1.0 mL/min的流速饱和值略大,因此综合考虑时间因素决定选用1.0 mL/min的上样液流速以提高效率。
2.3.2 上样液浓度对动态吸附的影响
图3 上样液浓度对动态吸附的影响Fig.3 Effects of different sampling concentrations on the dynamic adsorption
由图3可知,一定范围内,吸附率随着上样液浓度增大而增大,到了0.6 mg/mL后呈下降趋势,可能由于上样液浓度过大,超出树脂吸附限量。因此,选用上样液浓度为0.6 mg/mL。
2.3.3 洗脱液流速对解析速度的影响
由图4可知,不同的洗脱液流速进行洗脱,洗脱的峰值较为集中,说明洗脱流速对洗脱剂量影响不大,综合考虑实验所耗时间,选择速度稍快的1.5 mL/min作为最佳解析流速。
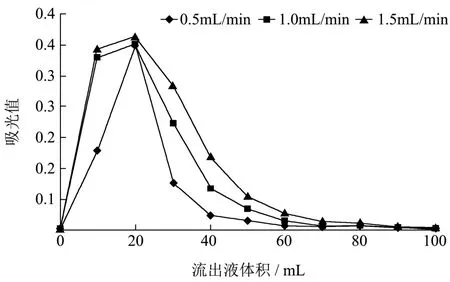
图4 洗脱液流速对解析速度的影响Fig.4 Effects of different eluent velocities on the elution efficiency
本实验选取AB-8型大孔树脂,张继曼等纯化黑豆花色苷时通过动态和静态试验最终也选取AB-8型大孔树脂[16],王少波等也通过比较发现AB-8型大孔树脂吸附与解析率最高[17]。原因可能在于黑豆中原花青素物质属于弱极性化合物,AB-8型树脂能较易吸附带有一定的极性和亲水性的物质。
本实验最佳纯化条件为:吸附平衡时间4 h,解析平衡时间3 h,上样液浓度为0.6 mg/mL,流速1.0 mL/min,洗脱液乙醇浓度60%,洗脱液流速1.5 mL/min。
宋岩等[18]2013年对黑豆花色苷提取纯化研究中,大孔树脂吸附平衡与解析时间分别为40 min和70 min,比本实验时间短,原因可能为其静态吸附使用了200 mL花色苷粗提样,吸附迅速达到饱和,本试验仅用30 mL粗提液,所以时间较长。于立梅等以马尾松树皮的原花青素为对象进行纯化研究中,通过LSA-10树脂的上样液与解析液流速与本实验相同,而上样浓度为12.5 mg/mL[19],部分原因可能是大孔树脂型号不同导致吸附量不同。
2.3.4 原花青素提取物的红外光谱分析
红外光谱图数据显示,黑豆皮原花青素的粗提物、纯化物和标准品的透过率(T%)逐步降低,说明纯化工艺奏效,纯化物含有的吸光杂质成分比粗提物少,因此透过率T值较低。由于提供的标准品为儿茶素,而原花青素除了含有儿茶素外,还有表儿茶素及其他多聚体,因此标准品的峰值较少。纯化物出现与标准品相同情况的几次尖峰、双峰或肩峰,而粗提物却无相似的特征峰出现。红外光谱图显示,在1500~1600 cm-1间,出现苯环振动的吸收峰,在3400 cm-1处峰为原花青素的羟基振动。因此,红外图谱显示本实验的纯化工艺确实奏效,纯化物含有纯度更好的原花青素。
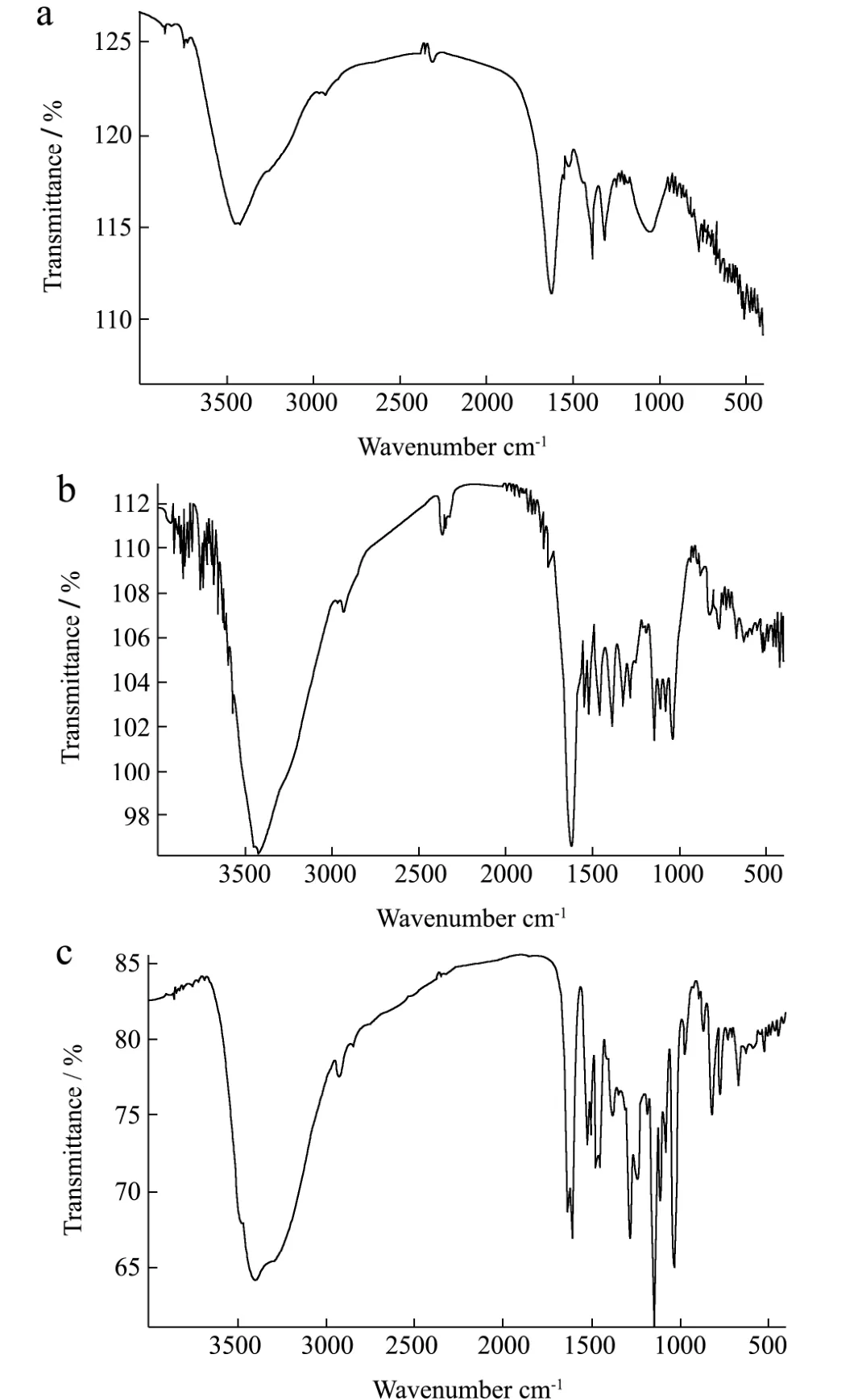
图5 黑豆皮原花青素粗提物(a)、黑豆皮原花青素纯化物(b)和儿茶素标准品(c)红外光谱图Fig.5 Infrared spectra of crude extract of procyanidins from black bean seed coats (a), purified substance of procyanidins from black bean seed coats (b), and catechins standard (c)
3 总结
使用超声波辅助提取法粗提黑豆皮中原花青素的最佳条件为:乙醇浓度为60%、提取时间为50 min、料液比为1:20(m/V)、提取温度为60 ℃为最优提取条件。
确立了以AB-8型大孔树脂吸附法纯化粗提物最优条件是0.6 mg/mL的原花青素粗提液为上样液质量浓度,流速为1.0 mL/min,吸附平衡时间为4 h,60%的乙醇溶液作为洗脱液,洗脱流速1.5 mL/min,解析时间为3 h。以上研究结果可为黑豆种皮中原花青素的工业化提取和纯化生产提供一定的实践指导。
[1] 徐亚维,赵杨,魏馨,等.黑豆皮原花青素提取工艺的优化[J].贵州农业科学,2011,39(12):229-231
XU Ya-wei, ZHAO Yang, WEI Xin, et al. Optimization on extraction process of procyanidins from black soybean seed coat [J]. Guizhou Agricultural Science, 2011, 39(12):229-231
[2] 杨晓辉,葛云叶,汪岭.“黑美人”马铃薯中原花青素的提取工艺优化及稳定性分析[J].安徽农业科学,2011, 39(29):18256-18257,18314
YANG Xiao-hui, GE Yun-ye, WANG Ling. Study on the optimization of extraction technique and stability of proanthocyanidins from ‘heimeiren’potatoes [J]. Anhui Agricultural Sciences, 2011, 39(29): 18256-18257, 18314
[3] 薛菲,阴新负,彭效明,等.葡萄籽原花青素溶剂浸提工艺研究[J].农业科学研究,2015,4:30-36
XUE Fei, YIN Xin-fu, PENG Xiao-ming, et al. Study on solvent extraction process of grape seed procyanidins [J].Agricultural Science Research, 2015, 4: 30-36
[4] 周中凯,徐晶晶,刘玉茜,等.铁蛋白-原花青素的相互作用及原花青素稳定性[J].食品科学,2016,38(13):34-40
ZHOU Zhong-kai, XU Jing-jing, LIU Yu-qian, et al.Research on the interaction of apoferritin -proanthocyanidins and the stability of proanthocyanidins (PCs) [J]. Food Science, 2016, 38(13): 34-40
[5] 周玮婧.荔枝皮原花青素的提取、纯化以及抗氧化活性研究[D].武汉:华中农业大学,2010
ZHOU Wei-jing. Study on extraction, purification and antioxidant activity of procyanidins from litchi peel [D].Wuhan: Huazhong Agricultural University, 2010
[6] 宋岩,于国萍,吴昊,等.超声波酶法复合提取黑豆皮中花色苷工艺优化[J].食品工业,2013,1:17-20
SONG Yan, YU Guo-ping, WU Hao, et al. Optimization of extraction process of anthocyanin from black soybean seed coat by ultrasonic enzyme method [J]. Food Industry, 2013, 1:17-20
[7] 刘晓丽,吴克刚,柴向华,等.大孔树脂纯化紫色甘薯皮原花青素的研究[C].中国农业工程学会农产品加工及贮藏工程分会学术年会暨华南地区农产品加工产学研研讨会,2010
LIU Xiao-li, WU Ke-gang, CHAI Xiang-hua, et al.Purification of procyanidins from sweet potato skin by macroporous adsorbent aesins [C]. Chinese agricultural engineering society agricultural products processing and storage engineering branch academic year and southern china agricultural products processing industry research seminar,2010
[8] 李元元,李炳奇,刘红,等.DM-2型大孔树脂分离纯化沙枣多糖的工艺研究[J].黑龙江畜牧兽医,2012,1:110-113
LI Yuan-yuan, LI Bing-qi, LIU Hong, et al. Technical study on the separation and purification of Elaeagnus angustifolia polysaccharide by using the DM-2 macroporous resins [J].Heilongjiang Animal Science and Veterinary Medicine, 2012,1: 110-113
[9] 李辉.葡萄籽中有效成分的提取、分离及工艺优化[D].西安:西北大学,2012
LI Hui. Extraction, separation and optimization of the effective components in grape seed [D]. Xi’an: Northwestern University, 2012
[10] 马玉美.刺葡萄籽中原花青素的提取、分离纯化研究[D].长沙:湖南农业大学,2007
MA Yu-mei. Study on extraction and purification of procyanidins from vitis davidii seeds [D]. Changsha: Hunan Agricultural University, 2007
[11] 童锡迪,彭红.正交试验法优化莲子壳中原花青素的提取工艺[J].食品研究与开发,2016,1:60-63
TONG Xi-di, PENG Hong. Study on the extraction technology of proanthocyanidins from lotus seed shell by orthogonal test [J]. Food Research and Development, 2016, 1:60-63
[12] 张海晖,李金凤,段玉清,等.板栗壳原花青素提取及其稳定性研究[J].食品科学,2011,32(8):5-9
ZHANG Hai-hui, LI Jin-feng, DUAN Yu-qing, et al.Extraction and stability of procyanidins from chestnut shells[J]. Food Science, 2011, 32(8): 5-9
[13] 孙智达,石翠芳,杨尔宁,等.沙枣果肉原花青素的提取、纯化及清除·OH能力初探[J].食品工业科技,2006,9:88-90,93
SUN Zhi-da, SHI Cui-fang, YANG Er-ning, et al.Preliminary study on extraction of procyanidins from elaeagnus angustifolia, purification and scavenging ability of OH [J]. Science and Technology of Food Industry, 2006, 9:88-90, 93
[14] 姜霞.葡萄籽中分离提取原花青素的研究[J].科技创新与应用,2016,1:34-35
JIANG Xia. Study on the isolation and extraction of procyanidins from grape seeds [J]. Technology Innovation and Application, 2016, 1: 34-35
[15] QIN Fei, ZHANG Ye. Ultrasonic assisted extraction of procyanidins from rhodiola rosea [J]. Medicinal Plant, 2012,8: 72-75
[16] 张继曼.黑豆红花色苷的优化提取及其降血糖作用的研究[D].合肥:安徽农业大学,2010
ZHANG Ji-man. Study on optimum extraction of safflower anthocyanin from black bean and hypoglycemic effect [D].Hefei: Anhui Agriculture University, 2010
[17] 王少波.黑豆皮中花色苷的提取及纯化研究[D].西安:西安理工大学,2008
WANG Shao-bo. Extraction and Purification of Anthocyanins from Black Bean Seed Coats [D]. Xi’an: Xi’an University of Technology, 2008
[18] 宋岩.黑豆花色苷提取、纯化及体内外抗氧化研究[D].哈尔滨:东北农业大学, 2013
SONG Yan. Study on extraction and purification of anthocyanins from black bean and antioxidant activities in vitro and in vivo [D]. Harbin: Northeast Agricultural University, 2013
[19] 于立梅,曾晓房,陈海光,等.大孔树脂对马尾松树皮原花青素的吸附分离特性[J].食品研究与开发,2010,31(9):15-19
YU Li-mei, ZENG Xiao-fang, CHEN Hai-guang, et al.Performance of adsozrption and separation of the macroreticular resin for procyanidins from pinus massoniana’s bark [J]. Food Research and Development,2010, 31(9): 15-19
