双酶法制备具有促皮肤成纤维细胞活性的马鹿茸胶原蛋白肽
2018-03-01杨丛珊张立钢赵玉红
杨丛珊,张立钢,赵玉红
(1.东北林业大学林学院,黑龙江哈尔滨 150040)(2.东北农业大学食品学院,黑龙江哈尔滨 150030)
胶原蛋白作为生物体中的结构蛋白,与细胞再生、分化、运动、免疫、关节润滑、血压抑制、伤口愈合、衰老及疾病等有极其密切的关系。胶原蛋白肽是胶原蛋白的水解产物,其特有的三螺旋结构发生改变,经过不同的蛋白酶等降解处理后得到易被人体消化吸收的多肽混合物。相对于胶原蛋白,胶原蛋白肽相对分子量较小,从几千到几万之间分布的很广,并且呈线性结构,具有很高的消化吸收性[1]。鹿茸中粗蛋白含量占干重的50%以上,胶原蛋白是鹿茸中含量最高的蛋白质,鹿茸中胶原类型包括Ⅰ型、Ⅱ型、Ⅺ型和Ⅹ型胶原蛋白[2]。提取鹿茸中多肽研究其生物学活性及药理作用近年来备受研究者们的关注[3],Lei等[4]研究表明从鹿茸中提取的多肽可以作为功能食品或者保健食品中抗炎的一种有效成分。杨吉平等[5]采用胃蛋白酶和胰蛋白酶双酶法制备鹿茸胶原多肽,证明酶解得到的鹿茸胶原多肽相对分子质量越小越易被人体消化吸收。Zhao等[6]研究鹿茸多肽sVP32可以激活心肌成纤维细胞并促进胶原合成。徐明等[7]选择胰蛋白酶和复合蛋白酶对鹿茸蛋白水解获得多肽。Zhang等[8]研究表明天然鹿茸多肽和合成鹿茸多肽都能促进软骨和成骨细胞增殖并且可以有效改善骨质疏松的症状。翁梁等[9]采用[3H]TDR深入细胞DNA法研究表明天然鹿茸多肽是总鹿茸多肽中促进表皮细胞分裂和加速皮肤创伤愈合的主要活性多肽,合成鹿茸多肽对表皮细胞和成纤维细胞增殖有促进作用。
目前有关胶原蛋白肽对细胞增殖和创伤愈合方面的研究主要集中在以猪、牛等哺乳动物和水产品为原料[10,11],如Yasutaka等[12]研究鱼鳞胶原蛋白水解物对小鼠成纤维细胞增殖性的影响,证明含有Pro-Hyp的肽对小鼠成纤维细胞增殖有很大影响进而促进皮肤创伤愈合。而有关对鹿茸胶原蛋白进行酶解制备具有促进皮肤成纤维细胞增殖效果的胶原蛋白肽的研究尚未见报道。本研究以马鹿茸为原料,采用Alcalase和胰蛋白酶进行双酶水解胶原蛋白,研究具有促进皮肤成纤维细胞增殖效果的鹿茸胶原蛋白肽的适宜制备条件,为鹿茸胶原蛋白肽在创伤修复领域的应用提供理论基础。
1 材料与方法
1.1 材料与试剂
马鹿茸为三叉茸,来自黑龙江省大庄园集团。
胰蛋白酶(250000 U/g),Gibco公司;Alcalase 2.4 L(240000 U/g),丹麦诺维信(中国)公司;正常人皮肤成纤维细胞(NHDF),赛齐(上海)生物工程有限公司;α-MEM培养基,美国Hyclone公司;胰酶消化液、青霉素-链霉素溶液、二甲基亚砜(DMSO),Sigma公司;十二烷基磺酸钠(SDS)、丙烯酰胺、N-N’甲叉双丙烯酰胺、Tris、三羟甲基氨基甘氨酸(Tricine)、巯基乙醇、TEMED、过硫酸铵(APS)、尿素、甘油、溴酚蓝、盐酸、HPLC级乙腈、三氟乙酸、考马斯亮蓝R-250氢氧化钠、浓硫酸和浓盐酸等均为国产分析纯;超低分子量蛋白质Marker,北京索莱宝科技有限公司。
1.2 仪器与设备
Hitachi-8900型氨基酸全自动分析仪;pH计EL20,梅特勒-托利多仪器(上海)有限公司;DK-8D型电热恒温水浴槽,上海一恒科学仪器有限公司;ELx800NB型酶标仪,美国BioTek公司;DYY-6D型电脑三恒电泳仪,北京六一仪器厂。
1.3 方法
1.3.1 鹿茸胶原蛋白的粗提取
将鲜马鹿茸去皮,烘干制成鹿茸粉末,将处理好的鹿茸粉按料液比1:6(g/mL)加入蒸馏水,置于100 ℃沸水中,水煎煮5次,每次2 h,合并上清液,过滤浓缩,弃掉残渣,冻干上清液,研磨成粉,备用。
1.3.1.1 马鹿茸胶原蛋白的吸收波长检测
对粗提取的马鹿茸胶原蛋白进行波长扫描,选择波长范围:190~900 nm。
1.3.1.2 马鹿茸胶原蛋白氨基酸含量的测定
采用氨基酸分析仪进行分析,由农业部谷物及制品质量监督检测中心(哈尔滨)测定。
1.3.2 鹿茸胶原蛋白肽的制备
1.3.2.1 胶原蛋白肽单因素实验
取胶原蛋白冻干粉置于烧杯中,按底物浓度加入适量水,调节至适合pH值,Alcalase在酶底比1~5%,pH 7.0~9.0,温度45~65 ℃条件下酶解3 h;胰蛋白酶在酶底比1~5%,pH 7.0~9.0,温度37~48 ℃条件下酶解3 h,分别研究pH值、酶底比和反应温度的影响;根据两种酶的单因素实验,改变两种酶的反应顺序,分别测定不同顺序的两种蛋白酶酶解产物的水解度和蛋白质回收率和NHDF细胞增殖率。酶解步骤为在一定条件下向马鹿茸胶原蛋白溶液中加入第一种蛋白酶进行酶解后,沸水浴灭酶,调节温度、pH值后,再加入第二种蛋白酶继续酶解,分别测定三项指标进而确定酶解顺序。
1.3.2.2 正常人皮肤成纤维细胞(NHDF)培养
NHDF于α-MEM培养基(含10%胎牛血清)在5%CO2,湿度95%,恒温37 ℃的二氧化碳培养箱中培养。取96孔板,培养的NHDF细胞经0.25%胰酶消化后,按2.5×104/mL的密度接种于96孔细胞培养板中,每孔100 μL。待细胞附着后,各组中分别加入0.2 mg/mL的单因素试验中胶原蛋白降解物5 μL,以加入相同体积PBS缓冲液作为空白对照组。
1.3.2.3 水解度(DH)的测定
采用pH-stat法[13]计算水解度。

式中,h:单位质量蛋白质中被水解的肽键的量(mmol/g);htot:单位质量蛋白质中肽键的总量(mmol/g);Ma:所水解蛋白质中氨基酸的平均分子量;Pi:组成蛋白质的某种氨基酸的百分含量;Mi:组成蛋白质的某种氨基酸的分子量。蛋白质的氨基酸组成是通过氨基酸分析仪测定,从而计算出Ma,进一步求出htot。
1.3.2.4 多肽得率的测定
对特定底物而言,三氯乙酸可以定性地反应蛋白质的分解情况,溶解指数越高,表明较短肽链的含量也越高。因此,多肽得率采用三氯乙酸可溶性氮法(TCA-SNI)进行检测,其计算公式为:

式中:TCA-NSI表示三氯乙酸可溶性氮得率/%;N1表示在10%TCA中可溶性氮量;N0表示原料中总氮量。
采用MTT细胞计数法测定。培养的NHDF细胞经0.25%胰酶消化后,按2.5×104/mL的密度接种于96孔细胞培养板中,每孔100 μL,每个组分6个复孔。培养24 h后,添加各组胶原蛋白降解物继续培养48 h,每孔分别加入10 μL MTT溶液,37 ℃孵育4 h,加入150 μL DMSO,振荡10 min,酶标仪测量490 nm波长下的吸光值A490。

式中:A1为实验组吸光值;A0为空白对照组吸光值;A2为对照组吸光值。
1.3.3 马鹿茸胶原蛋白肽(ACP)分子量的测定
采用SDS-PAGE凝胶电泳的方法进行测定,使用浓度为10%的分离胶和浓度为5%的浓缩胶,浓缩胶电压为70 mV,分离胶电压为140 mV。染色4 h后用脱色液(甲醇:冰醋酸:水=4.5:4.5:1)脱色,直至背景清晰。
1.4 数据处理
采用Origin 9.2制图,采用SPSS 20.0对数据进行方差分析、显著性检验,显著性水平设置p<0.05。
2 结果与讨论
2.1 马鹿茸胶原蛋白氨基酸组成
已知胶原蛋白所特有的吸收峰在230 nm左右,与一般蛋白在280 nm处有最大紫外吸收峰的情况不同,这是因为蛋白质分子中含有共轭双键的酪氨酸和色氨酸,因此在280 nm处有特征性吸收峰,但是胶原蛋白基本没有色氨酸,酪氨酸的含量也很少[14]。将粗提取的马鹿茸胶原蛋白进行紫外波长扫描,结果如图1,在228 nm处有最大吸收峰,结合表1氨基酸含量分析甘氨酸和脯氨酸含量均较高,因此符合胶原蛋白特性。从表1可知,所提取的马鹿茸胶原蛋白蛋白含量为68.21%。根据公式计算总肽键数为htot=11.30 mmol/g,用于下一步计算水解度。
为了验证算法对实际电路产生的波形的适用性,搭建半导体激光发射和单元雪崩光电二极管(Avalanche Photo Diode,APD)激光接收板级测试平台,采集实测不同饱和度的波形在上位机进行运算.激光发射电路产生脉冲宽度为10 ns的1 064 nm激光经准直照射到目标物,线性APD接收回波信号产生脉冲电流,经过跨阻放大器和模拟放大电路产生脉冲电压信号,通过控制激光发射功率和目标反射物的距离获得不同饱和度的波形,由波形采集平台对饱和度50%~1 000%的实测波形进行采集,在上位机运算.
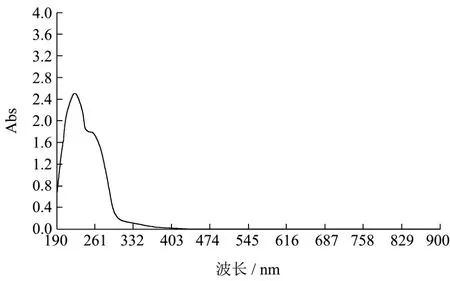
图1 马鹿茸胶原蛋白紫外吸收光谱Fig.1 UV absorption spectrum of the collagen from antler of red deer
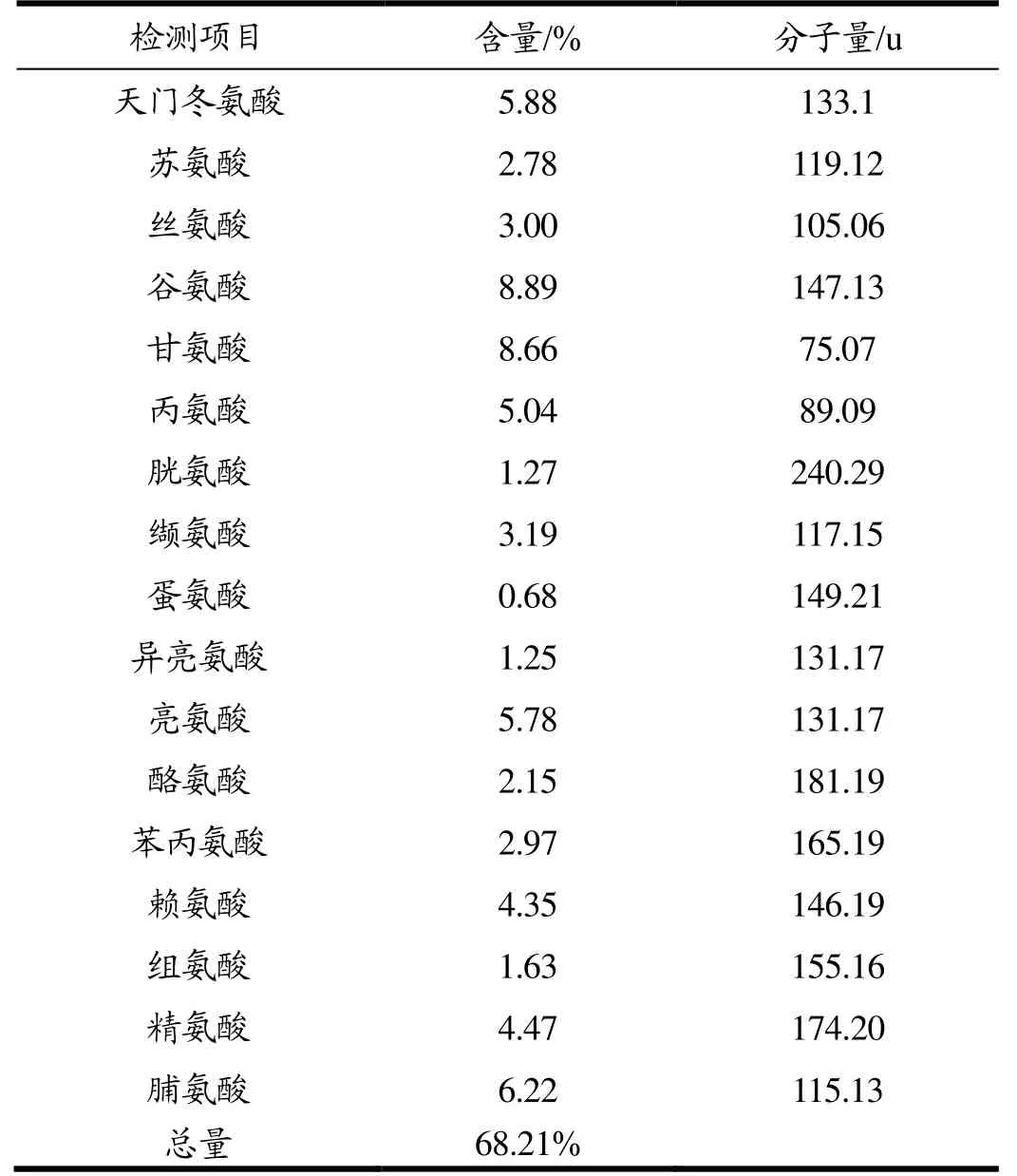
表1 马鹿茸胶原蛋白氨基酸含量Table 1 Amino acid composition of the collagen from antler of red deer
2.2 单因素酶解条件的确定
2.2.1 酶底比对酶解效果的影响
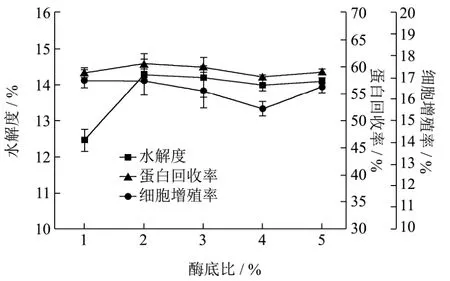
图2 Alcalase对酶解反应的影响Fig.2 Effects of the enyme-to- collagen ratios on the enzymatic hydrolysis by alcalase

图3 胰蛋白酶对酶解反应的影响Fig.3 Effects of of the enyme-to- collagen ratios on the enzymatic hydrolysis by trypsin
Alcalase在底物浓度1%,酶底比1~5%,pH 8.0,温度60 ℃,时间3 h条件下酶解,胰蛋白酶在底物浓度1%,酶底比1~5%,pH 8.0,温度45 ℃,时间3 h条件下酶解,分别考察酶底比对水解度、多肽得率和对正常人皮肤成纤维细胞(NHDF)增殖率的影响。
由图2可知,随着Alcalase蛋白酶酶底比的增加,水解度明显增加,在酶底比达2%之后趋于稳定;多肽得率和细胞增殖率在酶底比2%之后略有下降;可能是当酶的浓度低于底物浓度时,酶用量增大加快反应速度,碱性蛋白酶酶底比在2%时水解度为14.28%,多肽得率为60.5%,细胞增殖率为16.88%。由图3可知,随着胰蛋白酶酶底比的增加,水解度、多肽得率和细胞增殖率呈现逐渐上升后趋于稳定的趋势,胰蛋白酶酶底比为5%时效果最好,水解度为8.58%,多肽得率为60.52%,细胞增殖率为13.44%。本研究实验结果与许丹[15]在制备鱿鱼皮胶原蛋白肽时综合考虑碱性蛋白酶和胰蛋白酶的酶解效果和用量相似,可能是当添加酶的浓度相对于底物浓度较高时,反应速率开始由底物决定,所以继续增加酶的用量水解度增加缓慢。
2.2.2 pH对酶解效果的影响
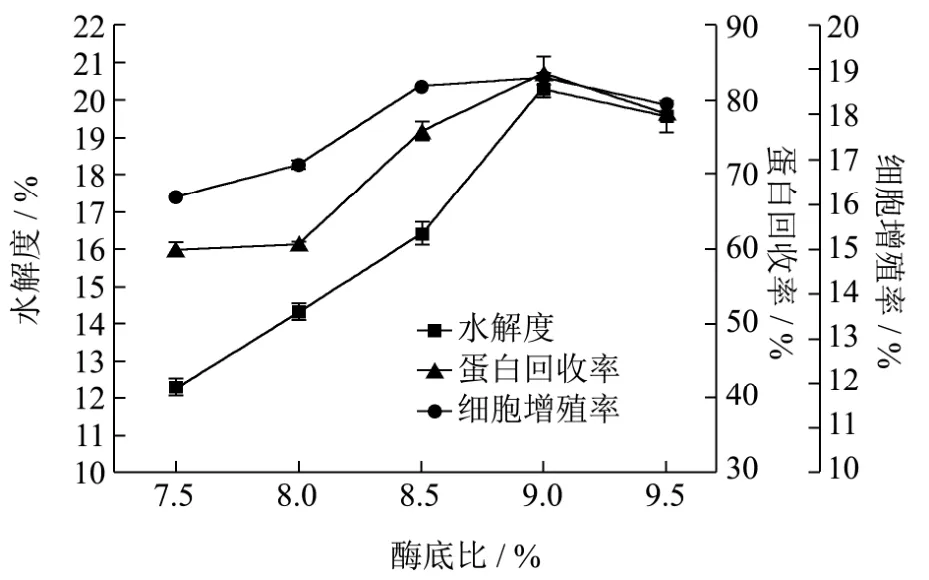
图4 Alcalase对酶解反应的影响Fig.4 Effects of the pH on the enzymatic hydrolysis by alcalase
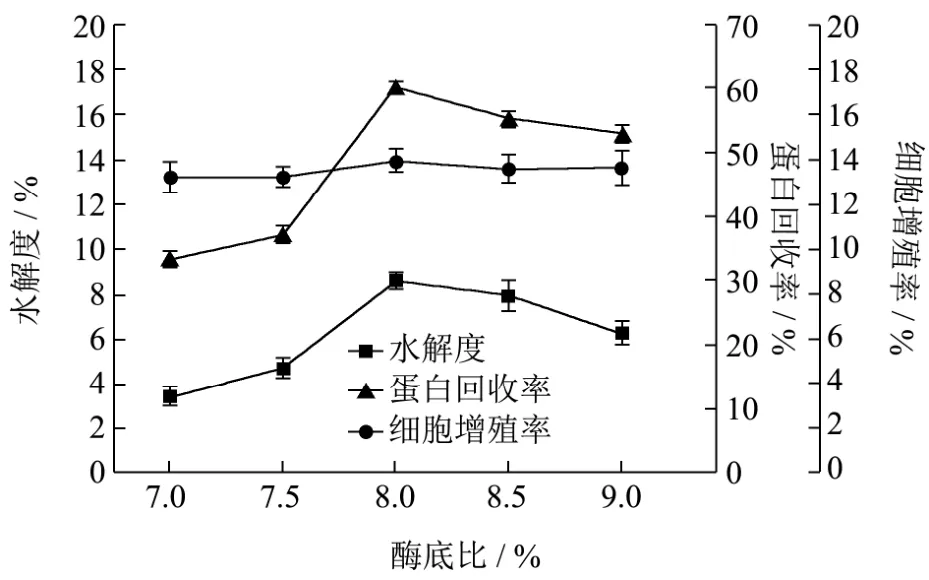
图5 胰蛋白酶对酶解反应的影响Fig.5 Effects of the pH on the enzymatic hydrolysis by trypsin
Alcalase在底物浓度1%,酶底比2%,pH 7.5~9.5,温度60 ℃,时间3 h条件下酶解,胰蛋白酶在底物浓度1%,酶底比5%,pH 7.0~9.0,温度45 ℃,时间3 h条件下酶解,分别考察pH对水解度、多肽得率和对正常人皮肤成纤维细胞(NHDF)增殖率的影响。
由图4可知,在Alcalase蛋白酶酶解过程中,随着pH增加,水解度、多肽得率和细胞增殖率均呈现先增加后下降的趋势,这是由于溶液pH不同会影响蛋白酶的活力,在pH 9时达到最大值,水解度为20.31%,多肽得率为83.42%,细胞增殖率为18.83%,这与陈季旺[16]等采用碱性蛋白酶水解鱼蛋白制备鱼肽的结果相似,在pH 8.0~9.0范围内,随着pH值的增加,水解度明显增加,当pH 9.5时,水解度开始下降;王长周[17]选用碱性蛋白酶制备林蛙皮胶原蛋白肽,其确定最佳酶解条件pH 9.0时水解度最好,蛙皮转化率可达80%以上;由图5可知,在胰蛋白酶酶解过程中,随着pH的增加,水解度、多肽得率和细胞增殖率均呈现先增加后下降的趋势,这是由于胰蛋白酶是一种中性偏碱性的酶,因此在偏碱性的条件下酶解效果最好。在pH 8.0时达到最大值,水解度为8.58%,多肽得率为60.2%,细胞增殖率为13.93%,这与刘程惠[18]等采用胰蛋白酶水解制备海参肽的结果相似,其肽得率在pH为8.0时达到最大值,其酶解效果最好,pH继续升高,肽得率反而下降。
2.2.3 温度对酶解效果的影响

图6 Alcalase对酶解反应的影响Fig.6 Effects of the temperature on the enzymatic hydrolysis by alcalase

图7 胰蛋白酶对酶解反应的影响Fig.7 Effects of the temperature on the enzymatic hydrolysis by trypsin
Alcalase在底物浓度1%,酶底比2%,pH 9.0,温度45~65 ℃,时间3 h条件下酶解,胰蛋白酶在底物浓度1%,酶底比5%,pH 8.0,温度37~48 ℃,时间3 h条件下酶解,分别温度对水解度、多肽得率和对正常人皮肤成纤维细胞(NHDF)增殖率的影响。
由图6和图7可知,Alcalase蛋白酶和胰蛋白酶酶解过程中,随着温度升高,水解度、多肽得率和细胞增殖率均呈现先升高后降低的趋势,这是因为温度的升高可以加快酶促反应,而当温度上升到一定程度时又会增加蛋白酶的变性速度。图6中Alcalase蛋白酶作用时,在60 ℃酶解效果最好,水解度为20.31%,多肽得率为83.42%,细胞增殖率为18.83%,这与潘丽军[19]等采用碱性蛋白酶制备谷氨酰胺活性肽相似,在温度60 ℃时,水解度最大;李岩[20]等采用碱性蛋白酶和黑曲霉酸性蛋白酶双酶水解从猪皮胶原蛋白制备寡肽水解物,其中酶解温度在60 ℃时,水解度最高,达到17.7%。图7中胰蛋白酶作用时,在45 ℃酶解效果最好,水解度为8.58%,多肽得率为60.2%,细胞增殖率为13.93%,这与李诚[22]等选用胰蛋白酶对猪血红蛋白酶解制备降血压肽得到的最佳酶解条件相似,在温度为40~45 ℃间达到峰值,40~45 ℃为最适宜温度。当温度达到55 ℃时,水解度大幅度下降;Zhuang[21]等选取胰蛋白酶在45 ℃条件下制备水母胶原蛋白肽,所得水解度最高。
2.3 酶解顺序的确定
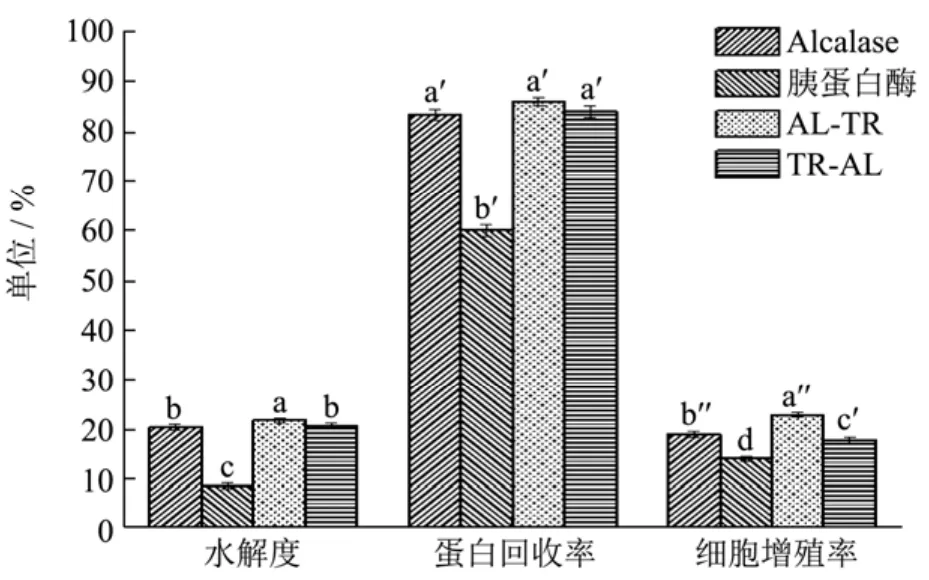
图8 加酶顺序对鹿茸胶原蛋白酶解反应的影响Fig.8 Effects of the added sequence of two enzymes on the enzymatic hydrolysis of collagen from antler of red deer
根据两种蛋白酶的单因素实验结果分别进行水解,并改变两种酶的作用顺序,考察酶解顺序对酶解效果的影响,结果见图8。为进一步提高水解度,使鹿茸胶原蛋白充分水解,提高小分子肽类物质的含量,本研究采用Alcalase蛋白酶和胰蛋白酶分步水解法,在合适的条件下将马鹿茸胶原蛋白水解。双酶分步水解不同于单酶,第一种酶的水解产物将是第二种酶的底物,同时蛋白酶本身也是蛋白质,它们之间会互为底物,交叉影响,本研究在第一种酶水解结束后进行灭酶,以消除其影响。分别以两种酶各自的水解条件,对鹿茸胶原蛋白进行双酶分步水解,以水解度、多肽得率和细胞增殖率为指标,考察加酶顺序对其影响。由图8可知,先加入Alcalase蛋白酶后加入胰蛋白酶的水解方式其水解度、多肽得率、细胞增殖率均高于先加入胰蛋白酶后加入Alcalase蛋白酶的酶解情况,四种酶解方法之间对水解度的影响差异较显著(p<0.05),其中水解度:AL-TR>TR-AL>Alcalase>胰蛋白酶;四种酶解方法之间对多肽得率的影响差异较不显著(p<0.05),其中多肽得率:AL-TR>TR-AL>Alcalase>胰蛋白酶;四种酶解方法之间对细胞增殖率的影响显著(p<0.05),其中细胞增殖率:AL-TR>Alcalase>TR-AL>胰蛋白酶。所以适宜水解方法是先采用Alcalase酶解后采用胰蛋白酶酶解。
2.4 正交试验结果

表2 正交试验结果Table 2 Result of orthogonal experiment
根据单因素实验结果,选择L(36)正交试验表设计正交试验。选取Alcalase酶底比(A)1%、2%、3%,Alcalase酶解pH(B)8.5、9.0、9.5,Alcalase酶解温度(C)55 ℃、60 ℃、65 ℃,胰蛋白酶酶底比(D)4%、5%、6%,胰蛋白酶酶解pH(E)7.5、8.0、8.5,胰蛋白酶酶解温度(F)42 ℃、45 ℃、48 ℃。按照上述单因素方法测定水解度、多肽得率和细胞增殖率,结果见表2:由极差分析结果可知,以水解度为指标的因素影响度依次为:B、A、C、D、F、E,最佳组合为A2B3C2D3E3F1;以多肽得率为指标的因素影响程度依次是:B、A、C、F、E、D,最佳组合为A2B3C2D3E3F1;以NHDF细胞增殖率为指标的因素影响程度依次是:A、B、D、C、F、E,最佳组合为A2B2C2D3E2F1。三个指标单独分析出来的最佳组合不一致,所以需要根据因素对三个指标的影响程度综合考虑,确定适宜工艺条件。Alcalase酶解中pH对三种指标都是影响较大的因素,因此选择pH 9.0,其酶底比对三种指标的影响程度也在第一位和第二位,对于水解度和多肽得率而言,取A2和A3影响程度不大(p<0.05),并且对三种指标的影响都是A2为优,所以选择酶底比为2%,而从细胞增殖率来看,取B2效果较好,所以选择Alcalase酶底比2%;Alcalase酶解温度对三种指标的影响都是C2最好,所以选择60 ℃。胰蛋白酶酶解pH对水解度和多肽得率有一定的影响,但是细胞增殖率作为三者中一个重要的指标应优先考虑,所以选择pH 8.0;胰蛋白酶酶底比和酶解时间对酶解效果好的最优条件一致,分别选择D3和F1,所以本实验的最优条件为A2B2C2D3E2F1,即先用Alcalase于酶底比2%、pH 9.0、温度60 ℃条件下酶解3 h,再用胰蛋白酶于酶底比6%,pH 8.0温度42 ℃条件下酶解3 h。在此最佳条件下,水解度为21.7%,多肽得率是86%,细胞增殖率为22.75%。
2.5 马鹿茸胶原蛋白肽分子量分布结果

图9 电泳图Fig.9 Electrophoretogram
将提取的马鹿茸胶原蛋白和马鹿茸胶原蛋白肽分别测定分子量分布情况,如图9。
根据电泳图可知,马鹿茸胶原蛋白的分子量在100 ku左右,属于大分子物质,并且分子量分布大小范围较窄,说明马鹿茸胶原蛋白保持完整的三股螺旋结构;而马鹿茸胶原蛋白肽基本分布在5 ku以下,说明马鹿茸胶原蛋白已被酶解为小分子物质。
2.6 细胞形态观察
采用正交试验优化后最适条件制备的马鹿茸胶原蛋白肽进行NHDF细胞培养48 h,将不添加马鹿茸胶原蛋白肽设为空白对照组,观察细胞形态。
如图10可以看出,培养48 h后,倒置显微镜下空白组中有一部分没有伸展的圆形细胞,并且细胞数量较少;而添加了马鹿茸胶原蛋白肽培养的NHDF细胞大多呈长梭形、部分呈三角形,可以观察到细胞数量明显增多并且细胞状态良好。因此,结合以上数据,马鹿茸胶原蛋白肽可以促使人皮肤成纤维细胞增殖。
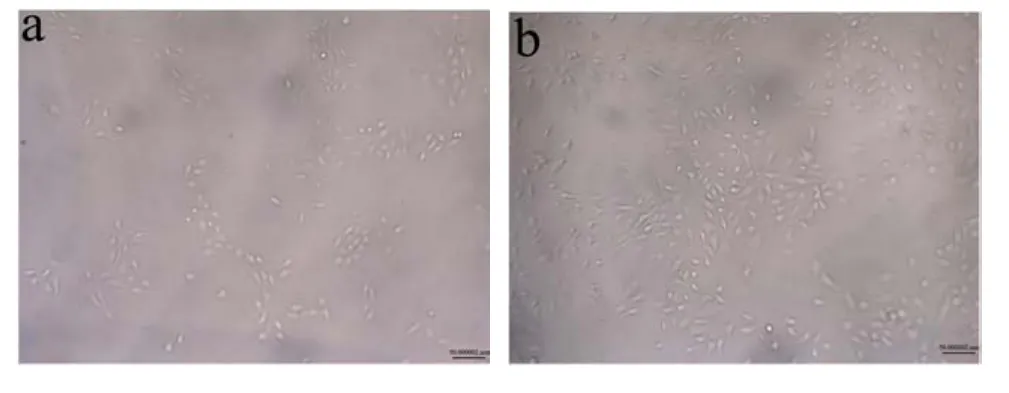
图10 倒置显微镜下观察NHDF细胞培养48 h形态Fig.10 Morphology of fibroblasts observed under inverted microscope
3 结论
Alcalase蛋白酶和胰蛋白酶双酶分步水解可以制备促使人皮肤成纤维细胞增殖的马鹿茸胶原蛋白肽,二者作用顺序影响酶解效果,适宜的制备条件为:先用Alcalase蛋白酶在底物浓度1%,酶底比2%,pH 9.0,温度60 ℃条件下酶解3 h;再用胰蛋白酶在底物浓度1%,酶底比6%,pH 8.0,温度42 ℃条件下酶解3 h,最终水解度为21.7%,多肽得率是86%,细胞增殖率可达到22.75%。
[1] 周雪松.胶原蛋白肽产业现状及发展趋势[J].食品与发酵工业,2013,39(6):111-115 ZHOU Xue-song. Current status and development trend of collagen peptide industry [J]. Food and Fermentation Industry,2013, 39(6): 111-115
[2] Rucklidgea G J, Milnea G, Bosa K J, et al. Deer antler does not represent a typical endochondral growth system:immunoidentification of collagen type X but little collagen type II in growing antler tissue [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 997, 118(2): 303-308
[3] Sui Z G, Zhang L H, Huo Y S, et al. Bioactive components of velvet antlers and their pharmacological properties [J].Journal of Pharmaceutical and Biomedical Analysis, 2014, 87:229
[4] Zhao L, Wang X, Zhang X L, et al. Purification and identification of anti-inflammatorypeptides derived from simulated gastrointestinaldigests of velvet antler protein(Cervus elaphusLinnaeus) [J]. Journal of Food and Drug Analysis, 2016, 24: 376-384. DOI:10.1016/j.jfda.2015.10.003
[5] 杨吉平,张鹤,董颖,等.双酶法制备梅花鹿鹿茸胶原多肽的工艺研究[J].食品科技,2014,1:244-248
YANG Ji-ping, ZHANG He, DONG Ying, et al. Study on the preparation of collagen peptides from deer antler with double enzyme method [J]. Food Science and Technology, 2014, 1:244-248
[6] Zhao L H, Mi Y, Guan H Y, et al. Velvet antler peptide prevents pressure overload-induced cardiac fibrosis via transforming growth factor (TGF)-β1 pathway inhibition [J].European Journal of Pharmacology, 2016, 783: 33-46
[7] 徐明,岳喜庆.酶解法制备鹿茸多肽的研究[J].食品工业科技,2012,33(5):206-207
XU Ming, YUE Xi-qing. Preparation of pilose antler peptides by enzymatic hydrolysis [J]. Food Industry Technology, 2012,33(5): 206-207
[8] Zhang L Z, Xin J L, Zhang X P, et al. The anti-osteoporotic effect of velvet antler polypeptidesfrom Cervus elaphus Linneusin ovariectomized rats [J]. Journal of Ethnopharmacology, 2013, 150(1): 181-186
[9] 翁梁,周秋丽,王丽娟,等.鹿茸多肽促进表皮和成纤维细胞增殖及皮肤创伤愈合[J].药学学报,2001,36(11):817-820
WENG Liang, ZHOU Qiu-li, WANG Li-juan, et al. Hairy antlers polypeptide to promote epidermal and fibroblast proliferation and skin wound healing [J]. Chinese Journal of Pharmacology, 2001, 36(11): 817-820
[10] 赵利.胶原蛋白生物活性肽的研究进展[J].食品科学,2005,26(9):478-480
ZHAO Li. Advances in bioactive peptides of collagen [J].Food Science 2005, 26(9): 478-480
[11] 庄永亮,赵雪,林琳,等复合酶制备鳕鱼皮梯级胶原肽的初步研究[J].食品研究与开发,2009,30(10):15-18
ZHUANG Yong- Liang, ZHAO Xue, LIN Lin, et al. A preliminary study on the preparation of collagen peptides from cod fish by compound enzyme [J]. Food Science and Technology, 2009, 30(10): 15-18
[12] Shigemura Y, Iwai K, Morimatsu F, et al. Effect of prolyl-hydroxyproline (Pro-Hyp), a food-derived CollagenPeptide in human blood, on growth of fibroblasts from mouse skin [J]. Journal of Agricultural and Food Chemistry, 2009, 57(2): 9-444
[13] Adler-nissen Jens. Control of the proteolytic reaction and of the level of bitterness in protein hydrolysis processes [J].Journal of Chemical Technology and Biotechnology, 2008,34(3): 215-222
[14] DoyleB B, Bendit E G, Blout E R. Infrared spectroscopy of collagen and collagen-like polypeptides [J]. Biopolymers,1975, 14(5): 937-957
[15] 许丹.鱿鱼皮胶原蛋白肽制备及其对类风湿性关节炎的作用的研究[D].舟山:浙江海洋学院,2012
XU Dan. Preparation of collagen peptide from squid skin and its effect on rheumatoid arthritis [D]. Zhoushan: Journal of Zhejiang Ocean University, 2012
[16] 陈季旺,夏文水,胡畔,等.鱼肽的酶法制备工艺及其特性的研究[J].食品科学,2007,28(6):218-221
CHEN Ji-wang, XIA Wen-shui, HU Pan, et al. Study on the enzymatic preparation of fish peptides and its characteristics[J]. Food Science, 2007, 28(6): 218-221
[17] 王长周,邱芳萍,房天琪.林蛙皮胶原蛋白肽的制备工艺[J].食品工业科技,2012,33(7):309-314
WANG Chang-zhou, QIU Fang-ping, FANG Tian-qi.Preparation of rana chensinensis skin collagen peptide [J].Food Industry Technology, 2012, 33(7): 309-314
[18] 刘程惠,董秀萍,赵露露,等.胰蛋白酶酶解法制备海参肽的工艺条件[J].大连轻工业学院学报,2006,25(6):83-85
LIU Cheng-hui, DONG Xiu-ping, ZHAO Lu-lu, et al. The preparation of sea cucumber peptide by trypsin enzymatic hydrolysis method [J]. Journal of Dalian Institute of Light Industry, 2006, 25(6): 83-85
[19] 潘丽军,张丽,钟昔阳,等.双酶分步水解法制备谷氨酰胺活性肽的研究[J].食品工业科技,2009,5:184-187
PAN Li-jun, ZHANG Li, ZHONG Xi-yang, et al. Preparation of glutamine active peptides by double enzyme hydrolysis [J].Food Industry Science and Technology, 2009, 5: 184-187
[20] 李岩,班玉凤,郭洪臣,等.pH值渐变条件下双酶协同水解猪皮制备胶原蛋白寡肽的研究[J].食品科学,2003,24(7):74-79
LI Yan, BAN Yu-feng, GUO Hong-chen, et al. Study on preparation of collagen oligopeptide by peptidoglyphics under the condition of pH gradient gradient [J]. Food Science,2003, 24(7): 74-79
[21] 李诚,肖岚,付刚,等.猪皮胶原蛋白抗氧化肽的分离纯化及体外抗氧化活性研究[J].食品工业科技,2014,35(15):95-100,106
LI Cheng, XIAO Lan, FU Gang, et al. Isolation, purification and antioxidant activity of collagen antioxidant peptides from pigs [J]. Food Industry, 2014, 35(15): 95-100, 106
[22] Zhuang Y L, Hou H, Zhao X, et al. Effects of Collagen and Collagen Hydrolysatefrom Jellyfish (Rhopilema esculentum)on Mice Skin Photoaging Induced by UV Irradiation [J].Journal of Food Science, 2009, 74(6): 183-188
