果胶提取工艺对甜菜粕物化性质的修饰作用研究
2018-03-01刘战朋郭晓明皮芳于淑娟
刘战朋,郭晓明,2,皮芳,于淑娟,2,3
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.华南理工大学广东省天然产物绿色加工与产品安全实验室,广东广州 510640)(3.华南理工大学制浆造纸工程国家重点实验室,广东广州 510640)
甜菜粕含有果胶、半纤维素、纤维素等物质[1],是一种潜在价值巨大的加工原料。我国是世界第八大甜菜主产国,甜菜粕资源丰富(590万吨/年,2012~2013)[1]。长期以来,甜菜粕的加工与开发受到了广泛关注。针对甜菜粕中的有效成分,国内外学者开发出甜菜果胶、半纤维素、纳米纤维和甜菜碱等多种产品[2~4]。尽管上述多种技术方案利用了甜菜粕中的有效成分,但仅能消化部分甜菜粕,无法彻底解决二次废粕的堆积问题。
甜菜粕的全资源化技术已成为甜菜粕加工的研究热点。物料的组织结构及物化性质是影响甜菜废粕再利用的关键因素。甜菜粕富含水溶性碳水化合物,具有很强的吸水性[5]。在有效成分萃取过程中,部分细胞壁结构物质溶解于提取液中,从而形成粘稠的浆液,降低了传质的效率[6]。另一方面,甜菜粕吸水后体积膨胀,更增加了分离、干燥等单元操作的作业难度。
当前,甜菜果胶是甜菜粕深加工的热点[7,8],其副产物的综合利用也因而备受关注。甜菜果胶以螯合剂、稀酸、稀碱为提取溶剂[9],在不同溶剂的作用下,最终形成结构各异的二次废粕[10]。然而,关于果胶提取工艺如何修饰甜菜粕的物化性质,却鲜有报道。
基于此,本文以甜菜粕为研究对象,研究螯合剂、稀酸对甜菜粕的修饰作用,旨在揭示甜菜粕结构、形貌在果胶提取过程中的变化规律,并为甜菜废粕再利用提供理论依据。
1 材料与方法
1.1 实验材料及试剂
甜菜粕;95%乙醇、盐酸、浓硫酸、草酸铵、三氟乙酸、氢氧化钠、碳酸钠、碳酸氢钠、磷酸为分析纯;鼠李糖、半乳糖、木糖、果糖,均为分析纯,上海伯奥生物科技有限公司;阿拉伯糖≥98%,美国Sigma-Aldrich Chemical公司;RapidaseC80果胶酶,荷兰DSM公司产品;牛血清蛋白,上海伯奥生物科技有限公司;考马斯亮蓝G250,上海伯奥生物科技有限公司;三苯基苯酚显色剂,上海梯希爱化成工业发展有限公司。
1.2 实验仪器与设备
多功能光电子能谱仪,Kratos Axis Ulra DLD,英国Kratos公司;X射线多晶衍射仪,德国Bruker公司;傅里叶变换红外光谱仪,VERTEX70,德国Bruker公司;ICS-5000阴离子交换色谱系统,配备电化学检测器(ED50),美国Dionex公司;高效液相色谱,美国沃特世公司;GR22高速冷冻离心机,株式会社日立制作所;数显pH计,FE20,瑞士Mettler-toledo公司生产;BSA1245-CW分析天平,德国赛多利斯集团生产;冷冻干燥机,SeienTZ-18N,宁波斯芝生物科技股份有限公司;高速万能粉碎机,FW100,天津市泰斯特仪器有限公司;紫外可见分光光度计,TU1901,北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 连续提取方法

图1 实验流程图Fig.1 The principal flow chart of experiment
参考Yapo等人[11]的方法,依次采用螯合剂、稀酸溶液处理甜菜粕(如图1所示)。首先,将甜菜粕浸泡在0.5%的草酸铵溶液中,浸泡参数为:料液比1:25、温度80 ℃、浸泡时间1 h、搅拌速度250 r/min;浸泡结束后,用400目微孔滤布将液渣分离,残渣标记为粕-CSA1,而上清液则依次经离心(10000 g×15 min)、醇析、干燥(45 ℃,12 h)处理,所得果胶标记为CSA-1;重复用草酸铵溶液浸提一遍,分别得果胶CSA-2和粕-CSA2。由于粕-CSA2残留部分草酸铵,故用蒸馏水将粕-CSA2冲洗5遍;随后,将粕-CSA2分散在蒸馏水中,用H2SO4调节pH到1.5,80 ℃处理1 h,得到果胶LS-1和粕-LS1;采用相同工艺参数,重复用稀硫酸溶液浸提3次,分别得到果胶LS-2和粕-LS2、果胶LS-3和粕-LS3、果胶LS-4和粕-LS4。
1.3.2 果胶成分测定及其甜菜粕形貌表征
1.3.2.1 半乳糖醛酸(GalA)的测定
采用紫外可见分光光度计法[12]测定半乳糖醛酸的含量。
半乳糖醛酸标准曲线:称取半乳糖醛酸标品5 mg溶于去离子水,定容至100 mL,分别取40、120、240、360、400 µL标品到10 mL带塞消化管中,冰水浴条件下加入2.5 mL浓硫酸,混合均匀后置于沸水浴中5 min使其多糖完全水解。随后加入50 µL显色剂,空白样加入50 µL 0.5% NaOH溶液,混合均匀后,静置一段时间,以两个空白样品校零,520 nm波长下测定吸光度。
绘制标准曲线:y=0.0289x+0.0231
式中:y为吸光度;x为D-半乳糖醛酸的含量(µg),R2=0.9995。
果胶样品中GalA的测定:称取5 mg果胶样品,溶解并定容至100 mL。取400 µL样品于10 mL具塞试管中,其余步骤同上,每个样品做三次平行。
1.3.2.2 中性糖含量测定
参照Garna[13]等人的方法:用高效阴离子交换色谱分析。称取10 mg果胶样品于密封消化管中,加入2 mL果胶酶溶液(E.C.3.2.1.15.,日本Amano公司),置于45 ℃水浴中24 h。再加入2 mL、4 mol/L的三氟乙酸(TFA),120 ℃油浴酸解2 h,立即冷却后加7 mol/L氨水调节pH至9.0左右,用去离子水定容至100 mL。水水解液过0.22 μm滤膜后,注射入高效阴离子交换色谱(HPAEC)系统(ICS-5000,Dionex Corp,USA)。色谱条件:色谱柱:CarboPac PA1(4×250 mm)和CarboPac PA1保护柱(4×50 mm);检测器:电化学检测器(ED50);流动相:100 mmol/L NaOH;流速:1 mL/min;柱温:30 ℃;进样量:25 µL;淋洗条件:0~25 min,16 mmol/L NaOH,25~35 min,500 mmol/L NaOH。数据经Chromeleon 7.2软件采集、分析后,绘制色谱曲线。
1.3.2.3 FT-IR图谱分析
冻干后的甜菜粕粉碎后过100目筛,取适量粉末样品(4 mg)与溴化钾(200 mg)压片,采用Vector33测定其红外吸收图谱,扫描波数为4000~400 cm-1,分辨率为4 cm-1。
1.3.2.4 X射线衍射图谱分析
取冻干后的甜菜粕样品,以未处理甜菜粕为对照,粉碎后过100目筛,用X射线多晶衍射仪扫描0 °~70 °角度范围的X射线吸收强度。测定甜菜粕内部结晶度的变化。
相对结晶度分析参考Nishiyama[14]等的方法,计算公式如下:
上式中,I22°为2θ角为22 °处的衍射强度;I18°为2θ角为18 °处的衍射强度。
1.3.2.5 扫面电镜(EDS-SEM)分析
取六种处理方式的甜菜粕,以未处理甜菜粕为对照,将样品用导电双面胶固定在载物台上。样品镀金后,在20 kV加速电压下观察其表面形貌。
1.3.2.6 密度指数测定
甜菜粕样品粉碎、过100目筛后,取适量样品装入1 mL的离心管,填充至刻度,称重。每个样测5次平行,取平均值。
上式中,m1为样品与离心管的质量,g;m0表示离心管的重量,g;V代表样品填充的体积,mL。
1.3.3 数据统计分析
除非另行注明,提取或样品测试平行操作3次,所有数据表示为“平均值±平均偏差”;数据采用origin 9.1作图。
2 结果与讨论
2.1 不同处理方式对甜菜粕FT-IR图谱的影响
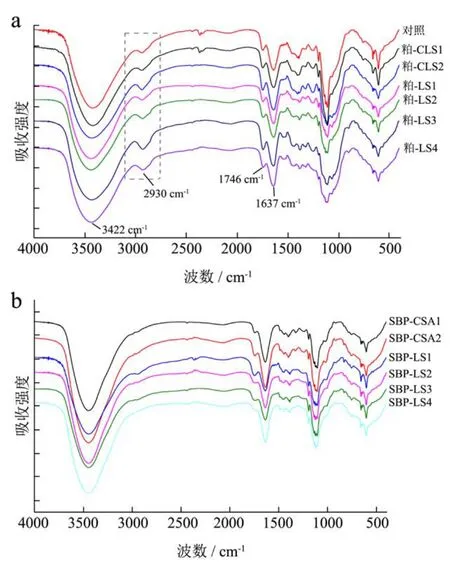
图2 不同处理红外吸收光谱的影响Fig.2 Influence of different treatments on the FTIR spectra
如图2所示,甜菜粕能吸收3800~2500 cm-1、1800~400 cm-1内的红外光,这些光谱信号属于植物多糖的典型红外光谱特征。甜菜粕在3422、2930、1746、1637 cm-1处的吸收峰分别对应于OH-、C-H、C-O及COO-的伸缩振动[15,16]。尽管甜菜果胶与甜菜粕具的红外光谱极为相似,但甜菜果胶在2930 cm-1的吸收强度相对较弱。甜菜粕在溶剂的处理下,结构发生不同的变化。依次经2次草酸铵处理、1次硫酸处理后,C-H伸缩振动强度未发生显著的变化(图2a)。然而,当硫酸提取2次后,甜菜粕在2930 cm-1处的吸收峰强度显著增强(图2a)。由于甜菜果胶在2930 cm-1的吸收强度很低,故甜菜粕中果胶的含量的减少反而有助于增强C-H在2930 cm-1处的振动强度。FT-IR分析结果表明,甜菜果胶的减少可能是引起甜菜粕2930 cm-1处吸收峰增强的原因。
2.2 甜菜粕的XRD衍射图谱及相对结晶度
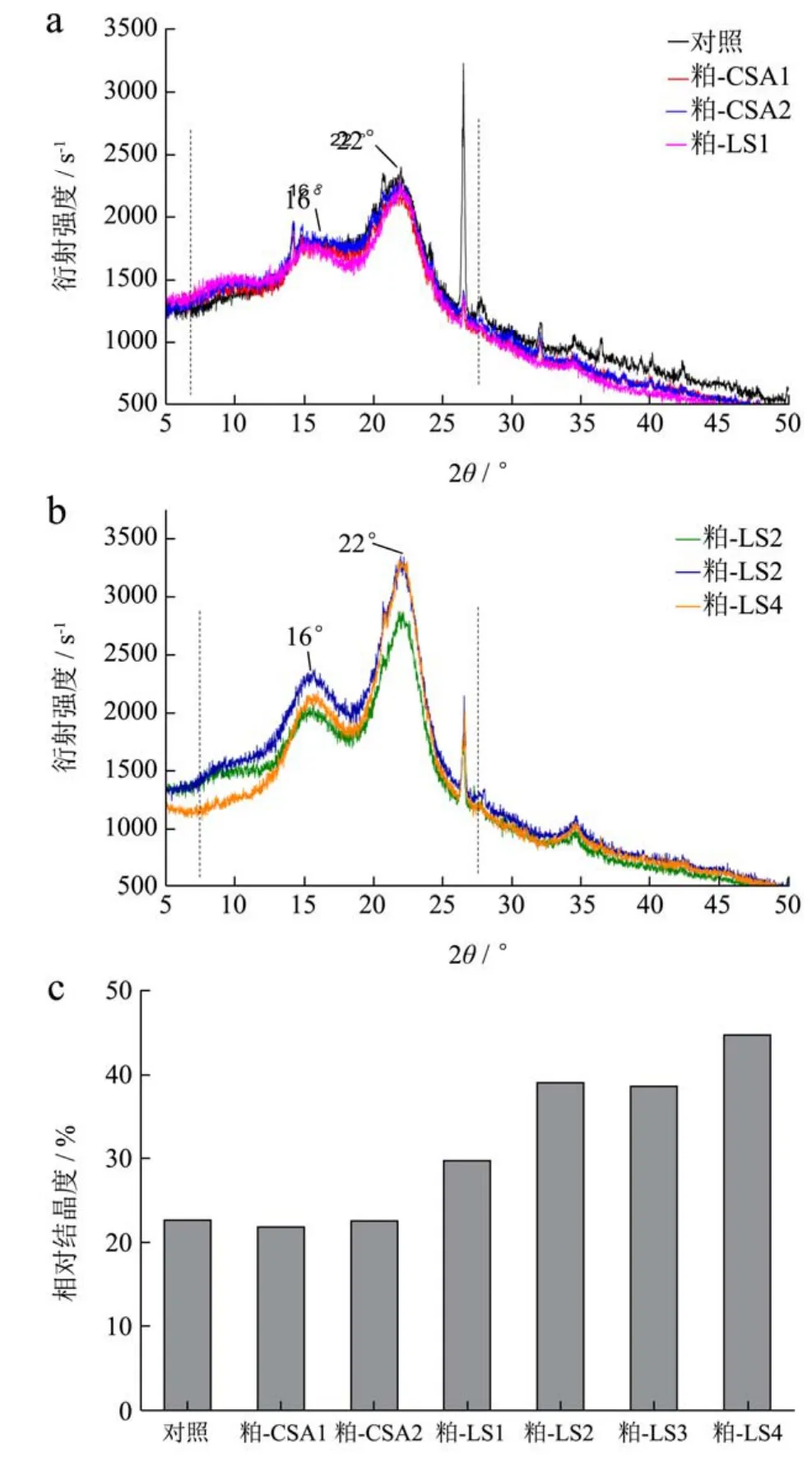
图3 不同处理方式甜菜粕XRD衍射图谱及相对结晶度Fig.3 Effects of different treatments on the X-ray diffraction spectra of sugar beet pulp and their relative crystallinity
纤维素是一类具有晶体结构的多糖,而半纤维素、果胶则为不定形结构。甜菜粕由纤维素、半纤维素、果胶组成,纤维素的相对含量将决定甜菜粕X射线图谱的特性。如图3a所示,在衍射角7.5~27.5 °内,甜菜粕(对照)在16 °、22 °处具有2个衍射峰;22 °处的衍射峰较强,该衍射峰也是纤维素I的衍射特征[13]。图3a~b中的X衍射图谱与Li等人[3]报道的结果一致。依次经草酸铵提取2遍、硫酸提取1遍后,不仅X衍射图谱未发生显著变化,甜菜粕的结晶度也基本保持不变(图3c)。然而,随着硫酸提取次数的增加,甜菜粕在衍射角为12.5~25 °内的吸收强度逐渐升高(图3b),进而导致相对结晶度也逐渐增大(图3c)。对照样品的相对结晶度为22.5%,而粕-LS4的相对结晶度升至44.5%,相对于对照样增加了将近1倍。
XRD衍射图谱的变化间接表明,随着酸提取次数的增加,甜菜粕中纤维素的相对含量逐渐升高。甜菜粕中纤维素得到富集的原因主要有两方面:(1)甜菜粕果胶分次溶解于稀酸溶液中;(2)在热酸作用下,部分半纤维素也可能溶解于提取溶剂中。
2.3 不同处理方式对甜菜粕形貌的影响

图4 不同处理方式甜菜粕扫面电镜图Fig.4 Morphologies of sugar beet pulp with different treatments
如图4所示,提取溶剂对甜菜粕的结构、形貌具有显著的影响。初始甜菜粕(图4a)具有致密的结构,表面为不规则的粗糙褶皱。甜菜粕具有一定的持水性[5],其吸水后体积发生溶胀。为了防止热风干燥对甜菜粕形貌及结构的影响,本文将吸水后的甜菜粕进行冷冻干燥,再观察甜菜粕吸水后的质地及形貌特征。如所示图4b,冻干甜菜粕导致密度下降,表面转变为高低不平、疏松、不规则的形貌。经草酸铵溶液浸泡1遍后,甜菜粕质地更加疏松,其表面具有类似于“中空”的结构(图4c)。这些孔洞可能是水分升华后形成的“通道”,其为提取溶剂渗透到甜菜粕内部创造了有利条件。从图4b与4c可以看出,草酸铵对甜菜粕质地产生实质的影响。草酸铵第2次提取后,甜菜粕表明的孔洞变大(图4d)。再经硫酸浸泡1次数后,与原先的甜菜粕相比(图4d),甜菜粕表面的孔洞变浅,同时也更趋向于椭圆形(图4e);这种形貌变化可能与甜菜粕表面的果胶被溶解有关。随着硫酸浸泡的次数的增加,甜菜粕形貌未发生更显著的变化。
2.4 不同处理方式甜菜粕能谱分析
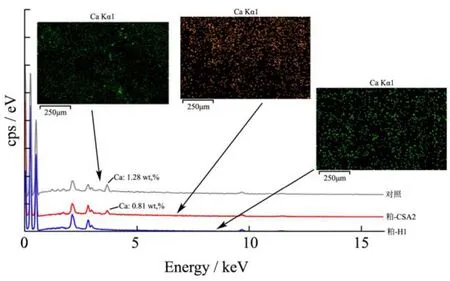
图5 不同提取溶剂对甜菜粕能谱图的影响Fig.5 Effects of different extractants on the energy dispersive Spectra of sugar beet pulp
不同甜菜粕的能谱图如图5所示。本小节重点分析提取溶剂对甜菜粕Ca2+含量的影响。初始甜菜粕的Ca2+含量为1.28%。如图5中的Ca2+分布图所示,Ca2+在甜菜粕中具有随机分布的特点,没有表现出特定的规律。经草酸铵提取2遍后,Ca2+含量下降为0.81%,表明草酸铵能螯合甜菜粕中的部分Ca2+。Ca2+是细胞壁的结构物质之一,其含量下降也表明甜菜粕细胞壁遭受到一定程度的破坏。再经硫酸提取1遍后,甜菜粕中未能检出Ca2+,表明稀酸溶液对Ca2+具有很强的溶解能力。虽然Ca2+已经去除,但甜菜粕中仍残留部分果胶(表1),这表明部分甜菜果胶与Ca2+不存在相互作用。
2.5 密度指数
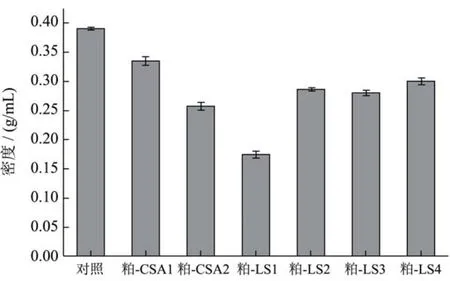
图6 不同甜菜粕的密度指数Fig.6 Density indexes of different sugar beet pulps
不同提取溶剂、提取次数对甜菜粕的密度指数具有显著的影响(图6)。在本文中,密度指数与甜菜粕的持水力成正比;甜菜粕的吸水性越强,质地越疏松,密度也相应越小。初始甜菜粕的密度指数最大,这与SEM分析结果一致(图4a)。经草酸铵处理后,甜菜粕密度指数开始下降,下降的幅度与草酸铵浸泡次数成正比。随后,再经硫酸提取1遍后,甜菜粕的密度指数降至最低(0.173 g/mL)。该结果表明,经硫酸1次浸泡后,甜菜粕的体积充分溶胀。然而,经硫酸提取次数2遍后,甜菜粕密度指数开始升高至0.286 g/mL。进一步增加硫酸提取次数至4时,甜菜粕的密度指数略微上升(0.299 g/mL)。纤维素不仅能形成致密的结晶结构,其分子量也较果胶、半纤维素大。因此,在硫酸分步提取过程中,甜菜粕密度指数的升高主要是纤维素比重的升高所致。
2.6 六种果胶成分分析
如表1所示,因提取条件而异,甜菜果胶的得率介于0.6~4.7%之间。CSA-1、CSA-2的提取率分别为2.0、0.6%,两者占总果胶得率的16.6%。张海燕等[1]研究甜菜果胶的螯合剂法提取工艺,发现甜菜果胶的提取率为9.5~20.9%。但在本文中,CSA-1、CSA-2的得率之和仅为2.6%,这种差异可能与螯合剂的种类有关。酸溶性甜菜果胶占总果胶得率的83.4%,随着硫酸提取次数的增加,果胶得率从4.7%逐渐下降为2.4%。
尽管提取溶剂、提取次数不同,但所有甜菜果胶均富含半乳糖醛酸、中性单糖(表1)。以草酸铵为提取试剂时,甜菜果胶半乳糖醛酸、中性糖分别为75.2~78.5%、21.5~24.5%。CSA-1与CSA-2的中性糖组成相似,两者的阿拉伯糖(10.8~10.9%)、鼠李糖(1.8~2.0%)、木糖(0.8~1.1%)含量接近,但CSA-1的半乳糖(8.0%)及葡萄糖(3.2%)含量较高。与溶解于草酸铵的甜菜果胶相比,酸溶性甜菜果胶的半乳糖醛酸含量较低,而中性糖含量性对较高。以硫酸为提取溶剂时,不同成分随提取次数表现出不同变化趋势。随着提取次数的增加,鼠李糖(4.4~7.8%)、半乳糖(11~14.4%)、木糖(0.9~1.6%)总体呈上升趋势,而阿拉伯糖(13.1~5.4%)却逐渐下降。由于阿拉伯糖单元间的糖苷键在酸性条件下容易水解[17],故阿拉伯糖的下降可能与长时间热酸处理有关。另一方面,半乳糖醛酸、葡萄糖含量与提取次数间没有显著的相关性,其含量分别为69.7~71%、0.3~1.0%。
研究证实,草酸铵、稀酸溶液对甜菜果胶的品质具有显著的影响[18]。为了解释草酸铵与稀酸处理对甜菜果胶的影响,本文还分析了不同甜菜果胶中半乳糖醛酸与鼠李糖的摩尔比(表1)。半乳糖醛酸与鼠李糖的摩尔比越低,表明甜菜果胶侧链相对含量越高;反之亦然[19]。如表1所示,对于草酸铵提取的果胶而言,其半乳糖醛酸/鼠李糖摩尔比为38.4~43.3,显著高于稀酸提取的果胶(9.0~15.9)。可见,稀酸更有利于溶解富含侧链的甜菜果胶。
另一方面,随着稀酸提取次数的增加,半乳糖醛酸/鼠李糖摩尔比逐渐下降;从而间接表明“甜菜果胶侧链越丰富,其对稀酸的耐受能力越高”。这可能是由于部分甜菜果胶(富含侧链)与纤维素等细胞壁结构物质间存在强作用关系,需要稀酸反复浸泡才足以将这部分甜菜果胶从甜菜粕中释放出来。

表1 不同甜菜果胶的得率及化学组成Table 1 Extraction yields and chemical compositions of different sugar beet pectins
3 结论
本文研究草酸铵、稀硫酸对甜菜粕结构的修饰作用。草酸铵能螯合甜菜粕中的部分Ca2+,并释放部分甜菜果胶,导致甜菜粕形成疏松多孔状的表面,但并未改变甜菜粕的相对结晶度。硫酸对Ca2+及甜菜果胶具有更强的溶解能力,随着硫酸浸泡次数的增加,甜菜粕的密度指数先下降后升高,而相对结晶度则逐渐升高。以上研究结果表明,草酸铵对甜菜粕的修饰作用有限,而稀酸处理能使甜菜粕发生实质性的结构变化。甜菜果胶产生的二次废粕富含纤维素,其可作为一种潜在的纤维素基材料。
[1] 张海燕,刘志勇,陈良,等.钙离子螯合剂提取甜菜果胶工艺研究[J].食品工业,2015,2:158-163
ZHANG Hai-yan, LIU Zhi-yong, CHEN Liang, et al. Pectin extraction conditions from sugar beet pulp with chelating agent [J]. The Food Industry, 2015, 2: 158-163
[2] Yapo B M, Robert C, Etienne I, et al. Effect of extraction conditions on the yield, purity and surface properties of sugar beet pulp pectin extracts [J]. Food Chemistry, 2007, 100(4):1356-1364
[3] Li M, Wang L-j, Li D, et al. Preparation and characterization of cellulose nanofibers from de-pectinated sugar beet pulp [J].Carbohydrate Polymers, 2014, 102(3): 136-143
[4] Oosterveld A, Beldman G, Schols H A, et al. Characterization of arabinose and ferulic acid rich pectic polysaccharides and hemicelluloses from sugar beet pulp [J]. Carbohydrate Research, 2000, 328(2): 185-197
[5] Michel F, Thibault J F, Barry J L, et al. Preparation and characterisation of dietary fibre from sugar beet pulp [J].Journal of the Science of Food and Agriculture 1988, 42(1):77-85
[6] Minkov S, Minchev A, Paev K. Modelling of the hydrolysis and extraction of apple pectin [J]. Journal of Food Engineering, 1996, 29(1): 107-113
[7] Chen H-m, Fu X, Luo Z-g. Properties and extraction of pectin-enriched materials from sugar beet pulp by ultrasonic-assisted treatment combined with subcritical water[J]. Food Chemistry, 2015, 168: 302-310
[8] Ma S, Yu S-j, Zheng X-l, et al. Extraction, characterization and spontaneous emulsifying properties of pectin from sugar beet pulp [J]. Carbohydrate Polymers 2013, 98(1): 750-753
[9] Levigne S, Ralet M-C, Thiault J-F. Characterisation of pectins extracted from fresh sugar beet under different conditions using an experimental design [J]. Carbohydrate Polymers, 2002, 49(2): 145-153
[10] Fishman M L, Chau H K, Cooke P H, et al. Physico-chemical characterization of alkaline soluble polysaccharides from sugar beet pulp [J]. Food Hydrocolloids, 2009, 23(6):1554-1562
[11] Yapo B M, Lerouge P, Thibault J F, et al. Pectins from citrus peel cell walls contain homogalacturonans homogenous with respect to molar mass, rhamnogalacturonan I and rhamnogalacturonan II [J]. Carbohydrate Polymers, 2007,69(3): 426-435
[12] Blumenkrantz N, Asboe-Hansen G. New method for quantitative determination of uronic acids [J]. Analytical Biochemistry, 1973, 54(2): 484-489
[13] Garna H, Mabon N, Wathelet B, et al. New method for a two-step hydrolysis and chromatographic analysis of pectin neutral sugar chains [J]. Journal of Agricultural and Food Chemistry, 2004, 52(15): 4652-4659
[14] Nishiyama Y, Langan P, Chanzy H. Crystal structure and hydrogen-bonding system in cellulose Iβ from synchrotron X-ray and neutron fiber diffraction [J]. Journal of the American Chemical Society, 2002, 124(31): 9074-9082
[15] Kamnev A A, Colina M, Rodriguez J, et al. Comparative spectroscopic characterization of different pectins and their sources [J]. Food Hydrocolloids, 1998, 12(3): 263-271
[16] Gnanasambandam R, Proctor A. Determination of pectin degree of esterification by diffuse reflectance Fourier transform infrared spectroscopy [J]. Food Chemistry, 2000,68(3): 327-332
[17] Thibault J-F, Renard C M, Axelos M A, et al. Studies of the length of homogalacturonic regions in pectins by acid hydrolysis [J]. Carbohydrate Research, 1993, 238(93):271-286
[18] Phatak L, Chang K C, Brown G. Isolation and characterization of pectin in sugar-beet pulp [J]. Journal of Food Science, 1988, 53(3): 830-833
[19] Yapo B M, Koffi K L. Extraction and characterization of gelling and emulsifying pectin fractions from cacao pod husk[J]. Journal of Food and Nutrition Research, 2013, 1(4):46-51
