宫颈脱落细胞中P16、Ki67联合细胞学检测在意义不明确的非典型鳞状上皮细胞诊断中的意义
2018-03-01张瑶袁思梅朱丹阳卢彩玲李立峰
张瑶,袁思梅,朱丹阳,卢彩玲,李立峰
宫颈癌的控制和预防关键是及时有效的发现和诊断宫颈上皮内瘤变,研究表明宫颈细胞学检查对临床筛查宫颈癌具有十分有效的作用。其中,意义不明确的非典型鳞状上皮细胞(ASCUS)是宫颈细胞学最常见的细胞异常,其可以有效提示宫颈低级别鳞状上皮内病变(LSIL)或宫颈高级鳞状上皮内病变(HSIL),因此临床检验和筛查ASCUS成为诊治与管理宫颈癌前期病变的重要原则[1-2]。近年来,超薄液基细胞学检查(TCT)可有效降低宫颈癌筛查的假阳性率和漏诊率,已成为宫颈癌早期筛查诊断的重要方法之一[3]。同时,抑癌基因P16和增殖抗原 Ki67呈过表达时可提示癌症的发生与发展,对于诊断鉴别恶性肿瘤具有较高的灵敏度和特异性。本研究选取病理结果为宫颈癌ASCUS的100例患者,采用TCT法检测细胞状态并采用免疫组化法检测组织中 P16和Ki67的含量,旨在探讨宫颈脱落细胞中P16、Ki67和细胞学检测在ASCUS诊断中的意义。现将结果报道如下。
1 资料与方法
1.1 一般资料 选取浙江省台州市第一人民医院2015年6月至2017年5月收治的病理结果为ASCUS的100例患者为观察组;并选择由其他疾病切除子宫但TCT检查正常50例患者为对照组。观察组年龄 20~ 65岁,平均(39.24±3.76)岁;对照组年龄21~65岁,平均(40.31±3.59)岁。两组年龄差异无统计学意义(>0.05)。本研究经医院伦理委员会的许可,患者资源签署知情同意书。
1.2 方法
1.2.1 TCT 宫颈检查之前,要求患者48h内无阴道操作、检查,无性生活。充分暴露宫颈,用专用工具擦取宫颈周围的分泌物和脱落的上皮细胞,将其放在保存液中保存。用液基薄层细胞制片机(Thin-Prep 2000系统)制成切片进行巴氏染色。由专业细胞病理医生按照TBS诊断标准进行细胞学诊断和分析[4]。
1.2.2 免疫组织化学检验 P16和 Ki67在病变去进行定位检测,选取宫颈鳞柱彼此之间交接位置进行取样。活检组织用10%甲醛固定,石蜡包埋连续切片5m/张,共6张。用5%血清进行室温封闭40min后,分别加入1∶1000的P16和Ki67单克隆抗体4℃过夜孵育。隔天加入1∶1000的二抗37℃孵育30 min,PBS清洗后加入SP后进行恒温反应30min,加入DAB显色液进行显色,中性树胶封片后用10倍和40倍物镜显微镜进行观察。P16和 Ki67的阳性表达主要表现为细胞内出现棕黄色颗粒。阳性细胞所占百分比主要参考着色强度分级。(1)阴性(-):无明显阳性细胞;(2)弱阳性(+):阳性细数<25%;(3)中度阳性(2+):阳细胞数 25%~ 50%;(4)(3+)强阳性:阳性细胞数>50%。以中度阳性和强阳性为P16或Ki67过度表达。
1.3 统计方法 采用SPSS 21.0统计软件进行统计学处理,计量资料采用均数±标准差表示。计数资料采用2检验。<0.05为差异有统计学意义。
2.1 两组P16、Ki67检查结果 观察组宫颈内P16水平阳性细胞着色明显,阳性表达率为81.00%,明显高于对照组的2.00%(2=125.382<0.05)。观察组宫颈内Ki67阳性细胞着色明显,阳性表达率为84.00%,明显高于对照组的4.00%(2=118.501< 0.05)。见表 1、2。
2.2 细胞学检查结果 对照组患者行TCT检查后发现宫颈细胞形态正常,无明显病理改变;观察组患者行TCT检查后发现宫颈细胞形态明显发生改变,鳞状细胞分化,细胞轮廓消失,模糊不清;细胞核着色较深核浆比增高,细胞核深染,染色质成块,不规则。见封四彩图8。
2.3 P16、Ki67与TCT检查结果 观察组P16的单独检出率、Ki67和TCT检查的单独检出率均低于联合检出率(2=3.979、6.366、11.031,均<0.05)。联合检出率、特异度和灵敏度均高于P16、Ki67和TCT检查的单独检出率(2=6.373、3.979、11.033,均<0.05)。见表3。
2 结果
3 讨论
TCT检查主要指采用TCT系统对宫颈细胞形态方面的检测来判断宫颈病变的程度[5]。与传统的宫颈刮片巴氏涂片检查相比,明显提高了标本的满意度及宫颈异常细胞检出率;但40%以上的涂片会因血液、黏液和炎症组织的影响而变得混浊不清,以及固定不及时所引起的人为假象,具有一定的假阳性率并且特异性不高,无法真实的反映宫颈的病变程度[6-7]。
P16基因,又称多肿瘤抑制基因(MTS)基因,是一种可直接参与调控细胞周期的抗癌基因。P16作为细胞周期蛋白激酶K(CDK)的抑制因子,主要负性调节细胞增殖与细胞分裂[8-9]。近年来大量学者认为P16可直接反应细胞癌变的效果与进程,是一种宫颈癌恶性程度的病变指标[11-12]。Ki67是一种与细胞增殖相关的核抗原,仅分布于核内,其功能与有丝分裂密切相关,是检测肿瘤细胞增殖活性的可靠指标[12-13]。Ki67在细胞中的阳性表达越高时,说明肿瘤细胞增殖分裂越快,癌组织分化程度越高,治疗及预后的效果越差[12-13]。研究表明,P16和Ki67蛋白在同一细胞异常过表达时,可明显提高肿瘤疾病诊断的灵敏度和特异度[14],对于诊断、鉴别和筛查癌变具有重要的作用和意义。
宫颈癌患者癌变组织内P16和Ki67均呈现异常高表达状态,这提示肿瘤细胞的发生发展及异常增殖状态。本文结果还显示P16、Ki67和TCT检查的联合检出率、联合检测的特异度和灵敏度均优于单独情况,这说明P16、Ki67和TCT检查联合检测在宫颈癌的病变过程中具有较高的临床诊断价值。

表1 两组P16免疫组织化学检查结果 例

表2 患者Ki67免疫组织化学检查结果 例
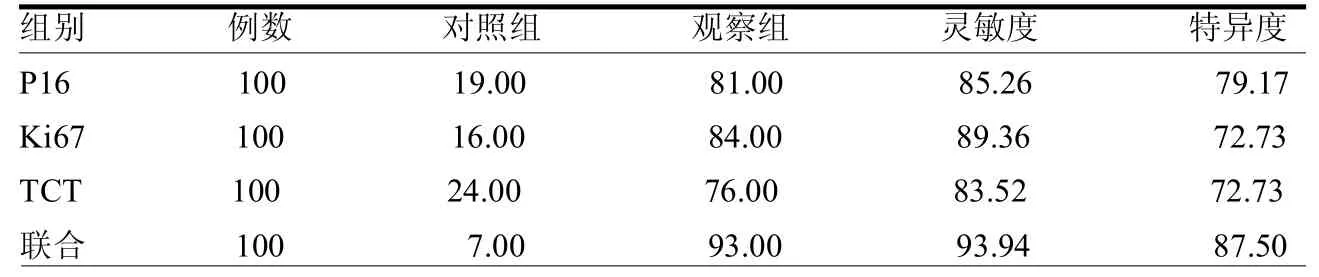
表3 两组P16、Ki67与细胞学联合检测结果 %
[1] 李静瑜.子宫颈癌及宫颈上皮内瘤变流行病学研究[J].中国现代医生,2012,50(36):3-4.
[2] 陈争春,黄勇进.子宫颈癌及宫颈上皮内瘤变流行病学调查[J].中国现代医药杂志,2012,14(06):42-44.
[3] 王焕妮.HPV联合TCT检查对高级别宫颈上皮内瘤变的诊断及随访的临床应用价值[D].广西医科大学,2014.
[4] 刘树范.浅析巴氏五级分类法与TBS描述性诊断报告方式[J].中国实用妇科与产科杂志,2003,19(3):135-137.
[5] 尹成瑞.液基薄层细胞学检测联合阴道镜、LEEP在宫颈癌筛查中的诊治分析[J].中国民族民间医药,2013,22(6):40-41.
[6] 李秀,杨姗姗,安然.宫颈液基薄层细胞学检测(TCT)联合阴道镜在筛查宫颈癌前病变中的价值[J].中国实验诊断学,2013,17(9):1644-1647.
[7] 王方.高危型人乳头瘤病毒检测联合液基薄层细胞学检查在宫颈癌筛查中的临床价值[J].临床和实验医学杂志,2010,9(6):443-444.
[8] Martin N,Beach D,Gil J.Ageing as developmental decay:insights from p16(INK4a)[J].TrendsMolMed,2014,20(12):667-74.
[9]马路.生物标志物p16提高宫颈癌诊断准确性[J].标记免疫分析与临床,2014,(5):624-624
[10]Reuschenbach M,Seiz M,von Knebel Doeberitz C,et al.Evaluation cervical conebiopsiesforcoexpressionofp16INK4a andKi-67inepithelialcells[J].Int JCancer,2012,130(2):388-394.
[11]黄海萍,叶学正,周琦等.P53、P16 在宫颈上皮内瘤变及宫颈癌中的表达及意义探讨[J].肿瘤预防与治疗,2008,21(2):136-139.
[12]钟萍萍,顾依群.P16和Ki-67蛋白在宫颈病变诊断中的应用[J].中国基层医药,2015,22(4):514-526.
[13]Schmidt D,Bergeron C,Denton KJ,et al.p16/ki-67 dual-stain cytology in the triage of ASCUS and LSIL papanicolaou cytology:results from the European equivocal or mildly abnormal Papanicolaou cytologystudy[J].CancerCytopathol.2011,119(3):158-166.
[14]RokitaW,Skawi ski D,Zmelonek-Znamirowska A,et al.Results of pap smears and immunocytochemical detection ofthe p16 and Ki67 proteins in women with cervical intraepithelial neoplasia and cervical cancer[J].Ginekologia Polska,2013,83(11):725-744.
