温度对不同油料作物油脂体理化稳定性的影响
2018-02-28崔春利张鸿超王秋岭蒋姗姗江连洲侯俊财
崔春利,张鸿超,王秋岭,蒋姗姗,周 鑫,江连洲,侯俊财*
大豆、花生、葵花籽是我国重要的油料作物,也是食用油脂的主要来源[1]。油料作物种子中的油脂主要以三酰甘油酯(triacylglycerols,TAGs)的形式贮藏在油脂体中,其为种子萌发和生长提供能量[2]。油脂体内部为TAGs和其他亲脂类营养物质,外层则由磷脂单分子层及其表面嵌插的多种油脂体膜蛋白(如油体蛋白、油体钙蛋白、油体固醇蛋白)构成[3],这种特殊结构赋予了油脂体天然的蛋白-磷脂界面层,与人造水包油(O/W)乳液相比,油脂体在特殊环境下具有更好的理化稳定性[4-5]。
近年来,关于油脂体的研究主要集中在提取、性质特征和潜在应用方面[6](食品、饲料产品、化妆品和工业生产等领域)。Kapchie等[7]通过改进传统的中式规模油脂体提取工艺,提高了油脂体提取效率和产率。Deleu等[8]研究了油菜籽油脂体蛋白和磷脂的界面特性对油脂体乳液稳定性的影响。结果表明:磷脂能够维持乳滴的稳定性;同时证明,油体蛋白是避免油滴聚集必不可少的。Karkani等[5]将绿茶提取物和天然油脂体乳液混合作为功能性饮料基料,发现绿茶多酚可与油脂体相互结合产生不稳定物,但添加少量的卡拉胶,即可保持体系稳定。高蛋白含量豆类种子油脂体油滴体积相对较小[9-10],而低蛋白含量种子(如油茶)油脂体则具有与之不同的结构[11],这种结构和组成上的差异也是影响油脂体理化稳定性的重要因素[12]。
高效地开发利用油脂体,需要对其在实际应用体系中理化性质具有全面的了解。温度处理是许多原料加工中必不可少的操作工序,不同来源油脂体在不同温度下的性质特征可能存在差异。因此,本实验分别选取我国重要的油料作物大豆、花生和葵花籽种子为原料,采用同种方法提取油脂体,研究温度对3 种油脂体理化稳定性的影响,以期为筛选优质的油料作物油脂体提供更多理论依据,同时也为油脂体的实际应用提供参考。
1 材料与方法
1.1 材料与试剂
大豆(东农52号)由东北农业大学大豆研究所提供;花生、葵花籽购于哈尔滨市南极市场;化学试剂均为分析纯。
1.2 仪器与设备
GL-21M高速冷冻离心机 湖南湘仪离心机仪器有限公司;UV-6100紫外-可见分光光度计 日本岛津公司;Mastersizer 2000激光粒度仪、Zetasizer Nano ZS Zeta电位分析仪 英国马尔文仪器有限公司。
1.3 方法
1.3.1 油脂体的制备
大豆、花生、葵花籽油脂体的提取步骤参照Wu Nana等[13]的方法并加以改进。油料作物种子浸泡在蒸馏水中(1∶5,m/V),于4~6 ℃冰箱中放置16~20 h。浸泡后的种子悬浮于5 倍体积的研磨介质(50 mmol/L pH 7.5 Tris-HCl、0.4 mol/L蔗糖溶液、0.5 mol/L NaCl溶液)中,用组织捣碎机研磨,获得匀浆液。过滤液体于10 000 r/min离心30 min。收集上层乳状物,并将其均匀分散在0.1%吐温20中,等体积的缓冲溶液(50 mmol/L pH 7.5 Tris-HCl)置于上层,如上离心;收集上层乳状物并均匀分散于9 mol/L尿素溶液中,等量的缓冲溶液(50 mmol/L pH 7.5 Tris-HCl)置于上层后,如上离心;上述过程重复两次,收集上层乳状物,即得到种子油脂体。新鲜油脂体置于4 ℃冰箱保存备用。
1.3.2 蛋白质含量的测定
蛋白质含量的测定参照GB 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》[14]中的凯氏定氮法。
1.3.3 脂肪含量的测定
脂肪含量的测定参照GB/T 5009.6—2003《食品中脂肪的测定》[15]中的索氏抽提法。
1.3.4 油脂体提取率的计算
油脂体提取率的计算如式(1)所示。

式中:m1为提取所用种子质量/g;m2为提取油脂体质量/g。
1.3.5 ζ-电位和平均粒径的测定
ζ-电位和平均粒径的测定参照Iwanaga等[16]的方法。新鲜油脂体均匀分散于0.1 mol/L pH 7.0 Tris-HCl缓冲溶液中,油脂体悬浮液分别于30、40、50、60、70、80、90 ℃温度下水浴处理30 min,冷却至室温。不同温度处理后的油脂体悬浮液室温条件下贮存24 h后,进行ζ-电位和平均粒径分析。
ζ-电位的测定:油脂体悬浮液ζ-电位用Zetasizer Nano ZS Zeta电位分析仪进行测定,每个样品平行测定3 次。
平均粒径的测定:油脂体悬浮液用Mastersizer 2000激光粒度仪测定平均粒径d32,达到相应的遮光度后进行测定,每个样品平行测定3 次。折射率为1.08,平均粒径的计算公式如式(2)所示。

式中:ni为颗粒个数;di为面积平均粒径/µm;i=1、2、3。
1.3.6 乳化活性及乳化稳定性的测定
将新鲜油脂体均匀分散于0.1 mol/L pH 7.0 Tris-HCl缓冲溶液中,将油脂体悬浮液分别于30、40、50、60、70、80、90 ℃温度下水浴处理30 min,然后冷却至室温。
油脂体乳化特性的测定参照Pearce等[17]的方法:3 mL大豆油与12 mL 1 mg/mL的样品稀释液混合,10 000 r/min均质1 min,随后静置10 min,取0 min和10 min时玻璃容器底部的乳化液100 μL,加入到10 mL 质量分数0.1%的十二烷基硫酸钠溶液中,使用UV-6100紫外-可见分光光度计于500 nm波长处测量其吸光度。
1.3.7 氧化稳定性的测定
新鲜油脂体均匀分散于0.1 mol/L pH 7.0 Tris-HCl缓冲溶液中(质量分数为5%),将油脂体悬浮液分别置于4、25、50 ℃条件下储存,并于0、2、4、6、8、10、12 d分别取样进行过氧化值(peroxide value,POV)测定。
POV测定参照Kapchie等[18]的方法。用预先氧化的大豆油(由AOCS Cd 8-53测得POV)来建立吸光度的标准曲线。对于样品,称取300 mg的油脂体悬浮液置于10 mL的容量瓶中,加入5 mL氯仿/甲醇(2∶1,V/V),涡旋振荡直至充分混合。然后将容量瓶定容到10 mL刻度线,密封,剧烈摇晃10 s。60 μL 30 g/mL硫氰酸铵加入到容量瓶中,混匀,再加入60 μL氯化亚铁溶液(0.5 g硫酸亚铁溶解在50 mL无氧水中,再溶解水合氯化钡0.4 g,加入2 mL 10 mol/L的HCl溶液),充分混匀,反应10 min后,置于玻璃比色杯中,使用UV-6100紫外-可见分光光度计于515 nm波长处测定吸光度,同时做空白对照。
1.4 数据统计分析
所有处理组均平行3 次,采用SPSS Statistix 19.0软件进行数据分析,用LSD进行平均数间显著性差异分析,P<0.05表示差异显著。采用SigmaPlot 11.0软件作图。
2 结果与分析
2.1 不同油料作物种子及其油脂体组成成分分析
不同油料作物种子及其油脂体基本组成成分见表1,大豆、花生和葵花籽3 种油料作物种子的水分、蛋白质以及脂肪含量之间均存在显著性差异(P<0.05)。3 种油料作物油脂体中,大豆油脂体的水分含量和蛋白质含量显著高于葵花籽油脂体和花生油脂体(P<0.05),而其脂肪含量则显著低于后两者(P<0.05);葵花籽油脂体的蛋白质含量显著高于花生油脂体(P<0.05);而葵花籽油脂体的脂肪含量则显著低于花生油脂体(P<0.05)。实验结果表明,不同来源的油料作物,油脂体的基本组成成分含量存在差异,种子蛋白质、脂肪含量较高的油料作物,其油脂体蛋白质、脂肪含量也较高,这与油料作物的品种有关[19];同一油料作物来源中,油脂体的蛋白质含量与脂肪含量呈负相关,这与油脂体的结构有关[3,9];油脂体的蛋白质含量均低于种子的蛋白质含量,而脂肪含量则相反,这说明,油脂体在提取过程中,保留了种子中的大部分脂肪,而绝大部分的外源蛋白质则被去除[20]。
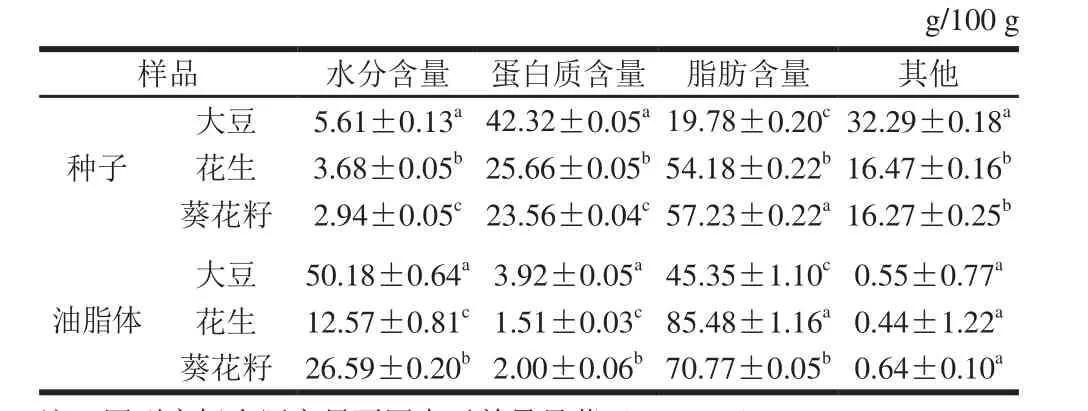
表1 不同油料作物种子及其油脂体组成成分Table 1 Chemical compositions of seeds and OBs thereof
2.2 不同油料作物油脂体的提取率
采用同种提取方法,大豆、花生和葵花籽油脂体的提取率分别为(6.74±0.00)%、(28.35±0.01)%和(35.25±0.01)%,三者之间存在显著性差异(P<0.05),其中,大豆油脂体的提取率远低于花生和葵花籽油脂体。油脂体的组成中绝大部分为脂肪,种子脂肪含量与油脂体含量呈正相关,而3 种油料作物种子的脂肪含量之间存在较大差异,由此导致脂肪含量较高的葵花籽种子,其油脂体提取率相对较高,脂肪含量较低的大豆种子,其油脂体提取率相对较低[3,19]。
2.3 温度对不同油料作物油脂体ζ-电位的影响

图1 温度对大豆、花生和葵花籽油脂体ζ-电位的影响Fig. 1 Effect of heating treatment on the ζ-potentials of OBs from soybean, peanut, and sunぼower
温度对不同油料作物油脂体ζ-电位的影响见图1,3 种未处理的油脂体乳液中,大豆油脂体的ζ-电位显著高于葵花籽和花生油脂体(P<0.05),其中花生油脂体的ζ-电位最低。随着温度的升高,大豆、花生和葵花籽油脂体的ζ-电位分别由未处理时的(-28.03±0.25)、(-21.50±0.52)、(-19.63±0.51)mV降低至90 ℃时的(-18.40±0.52)、(-19.00±0.79)、(-15.83±0.21)mV。由此可知,在加热处理条件下,大豆油脂体ζ-电位变化范围较大,葵花籽和花生油脂体ζ-电位变化范围均较小。大豆、花生和葵花籽油脂体在热处理的作用下,表现出不同的电位趋势,这可能与油料作物的品种有关。根据Tzen等[21]提出的油脂体模型可知,油脂体中油体蛋白带正电的区域与带负电的磷脂及游离脂肪酸通过盐桥相连,而带负电的残基暴露在外侧,因此油脂体整体带负电。大豆油脂体的蛋白质含量比花生油脂体和葵花籽油脂体高,这可能是未处理的大豆油脂体ζ-电位较高的原因。此外,本研究发现,当加热温度较高时,油脂体ζ-电位下降较大,可能由于温度升高导致油脂体界面层的组成或结构发生了改变所致[22]。
2.4 温度对不同油料作物油脂体平均粒径的影响
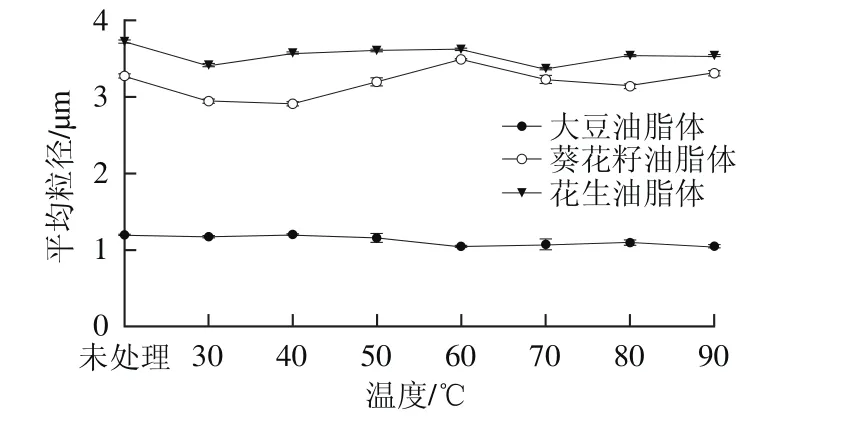
图2 温度对大豆、花生和葵花籽油脂体平均粒径的影响Fig. 2 Effect of heating treatment on the mean particle diameters of OBs from soybean, peanut, and sunぼower
由图2可知,3 种未处理的油脂体乳液中,大豆油脂体的平均粒径显著低于葵花籽和花生油脂体(P<0.05),且花生油脂体的平均粒径最大。油脂体的大小主要由三酰甘油酯与蛋白的比例决定,油脂体油体蛋白含量越高的物种,油脂体粒径越小[3]。随着温度的升高,3 种油脂体的平均粒径变化趋势平稳,这说明加热处理对3 种油脂体的平均粒径影响不大,3 种油脂体均具有良好的热稳定性,本实验结果与Chiang等[23]的研究结果一致。Huang[3]认为油脂体良好的稳定性主要是负电位阻和空间斥力的作用结果。油脂体表面的结构蛋白被认为是T型的发夹结构,其疏水尾部透过磷脂插入三酰甘油酯内部,而亲水性的N-末端和C-末端区域中带正电的残基和带负电的油脂结合,带负电的残基则暴露于油脂体表面,从而提供空间位阻和负电斥力,阻止油脂体之间相互作用发生聚集[3,21],这种特殊的结构使得油脂体结构蛋白亲水端在加热处理时仍能保持其高度非极性的环境,从而保持了油脂体乳液体系的稳定性[22]。
2.5 温度对不同油料作物油脂体乳化特性的影响
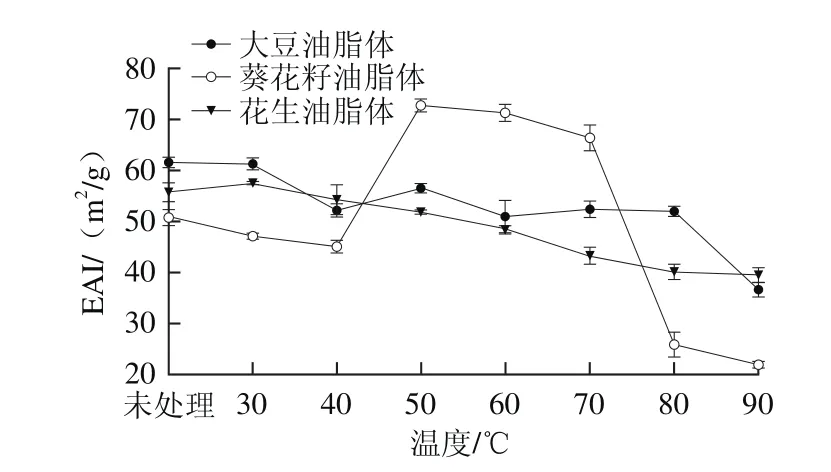
图3 温度对大豆、花生和葵花籽油脂体乳化活性的影响Fig. 3 Effect of heating treatment on the EAI of OBs from soybean,peanut, and sunぼower
温度对不同油料作物油脂体乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)的影响分别见图3、4。由图3可见,3 种未处理的油脂体乳液中,大豆油脂体的EAI(61.59±1.07)m2/g显著高于葵花籽油脂体(50.86±1.59)m2/g和花生油脂体(55.77±1.85)m2/g(P<0.05)。随着加热温度的升高,大豆和花生油脂体EAI均呈现下降趋势,但变化较为平稳,温度由30 ℃升至80 ℃过程中,大豆和花生油脂体EAI分别由(61.32±1.19)、(57.50±0.30)m2/g降低至(51.99±0.90)、(40.13±1.51)m2/g;而葵花籽油脂体的EAI在50 ℃时显著升高至(72.70±1.18)m2/g,当温度升至80 ℃时又急剧下降至(25.93±2.49)m2/g。这可能是由于3 种油脂体表面残留的外源蛋白不同,50、60、70 ℃的热处理条件使得葵花籽油脂体表面蛋白结构展开,隐藏在内部的疏水基团暴露,从而增加了蛋白的表面活性[24]。

图4 温度对大豆、花生和葵花籽油脂体乳化稳定性的影响Fig. 4 Effect of heating treatment on the ESI of OBs from soybean,peanut, and sunぼower
由图4可以看出,3 种未处理的天然油脂体乳液中,葵花籽油脂体的ESI(91.06±2.13)%显著高于大豆油脂体(59.81±1.37)%和花生油脂体(70.51±1.99)%(P<0.05)。随着温度的升高,大豆和花生油脂体的ESI整体呈上升趋势,而葵花籽油脂体的ESI则呈下降趋势,3 种油脂体变化范围均较小。这可能是因为油脂体表面的蛋白质和磷脂之间形成的氢键和疏水相互作用提高了乳滴黏弹性和分子柔性,使得油脂体乳液具有良好的稳定性[20]。当温度升至90 ℃时,大豆和葵花籽油脂体的ESI均明显降低,而花生油脂体的ESI在70、80 ℃和90 ℃之间则无显著差异(P>0.05)。结果表明,不同的加热条件对不同油料作物油脂体的乳化稳定性影响不同,这可能与3 种油脂体中蛋白质、油脂和磷脂的含量不同有关[21],且90 ℃加热处理30 min可能导致大豆和葵花籽油脂体表面蛋白结构发生变化,促使其相互作用增加,表面张力增加,乳液不稳定[25]。
2.6 温度对不同油料作物油脂体氧化稳定性的影响
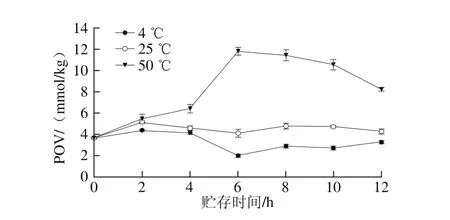
图5 温度对大豆油脂体氧化稳定性的影响Fig. 5 Effect of heating treatment on oxidative stability of OBs from soybean
由图5可见,在4 ℃贮存条件下,大豆油脂体第2天POV(4.39±0.08)mmol/kg显著低于25 ℃(5.16±0.05)mmol/kg和50 ℃(5.47±0.44)mmol/kg(P<0.05)。随着贮存时间的延长,大豆油脂体POV在4 ℃条件下波动范围为(4.11±0.08)~(2.00±0.14)mmol/kg;25 ℃条件下第2天至第12天POV波动范围为(4.80±0.28)~(4.09±0.38)mmol/kg,变化较为平稳;而在50 ℃条件下第6天,大豆油脂体POV急剧升高至(11.83±0.36)mmol/kg,之后则略有降低。

图6 温度对葵花籽油脂体氧化稳定性的影响Fig. 6 Effect of heating treatment on oxidative stability of OBs from sunぼower
由图6可知,葵花籽油脂体在4 ℃和25 ℃贮存条件下第2天POV分别为(0.31±0.00)mmol/kg和(0.02±0.00)mmol/kg,均显著低于50 ℃时的(3.45±0.21)mmol/kg。随着贮存时间的延长,葵花籽油脂体在4 ℃和25 ℃条件下POV增加缓慢,且二者之间无显著性差异(P>0.05);而50 ℃条件下,葵花籽油脂体POV不断增加,12 d内最高达到(11.72±0.22)mmol/kg。
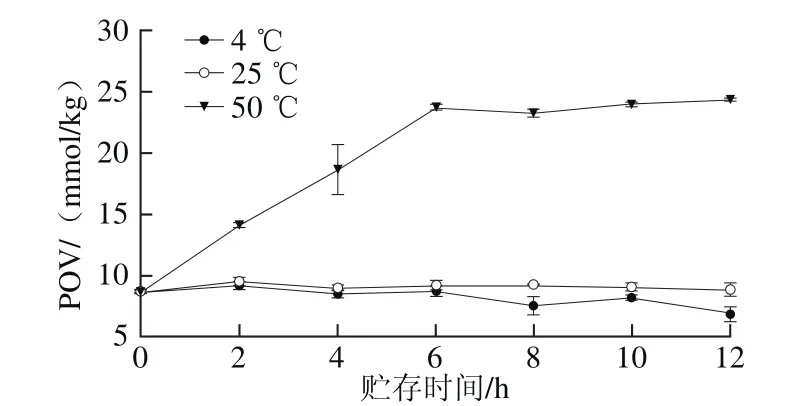
图7 温度对花生油脂体氧化稳定性的影响Fig. 7 Effect of heating treatment on oxidative stability of OBs from peanut
由图7可知,花生油脂体在4 ℃和25 ℃贮存条件下第2天POV分别为(9.13±0.30)mmol/kg和(9.50±0.3 1)m m o l/k g,均显著低于5 0 ℃时的(14.10±0.23)mmol/kg。随着贮存时间的延长,花生油脂体在4 ℃和25 ℃条件下POV变化均不显著;而50 ℃条件下第4天至第12天POV变化范围为(24.29±0.09)~(18.61±2.02)mmol/kg,且第6天达到最大值。
由图5~7可以看出,3 种油料作物油脂体在不同温度贮存条件下发生氧化的顺序为50 ℃>25 ℃>4 ℃,样品贮存温度越高氧化越快,本实验结果与Fisk等[4]的研究结果一致。在4、25 ℃和50 ℃贮存条件下,花生油脂体的初始POV最高,葵花籽油脂体的POV最低;随着贮存时间的延长,花生油脂体POV均显著高于大豆和葵花籽油脂体(P<0.05),这可能与油脂体的大小及脂肪酸组成有关[26]。在4 ℃和25 ℃贮存条件下,3 种油脂体均具有良好的氧化稳定性,且葵花籽油脂体POV一直处于较低水平。Huang等[27]认为油脂体内部是液态的TAGs,外层是由一层磷脂单分子层和油脂体膜蛋白组成的半单位膜,这种特殊的结构紧紧覆盖于油脂体表面,保护了内部的不稳定成分,从而延缓了氧化的进程。此外,油脂体表面的油体蛋白分子的3/5覆盖了油脂体的大部分表面,可阻止外部的磷脂酶作用于磷脂[28],且油脂体在提取过程中残留的外源蛋白质可能比油脂优先氧化,同时存在于油脂体中的天然抗氧化剂如生育酚等也可能是油脂体高氧化稳定性的关键原因[29-30]。而在50 ℃贮存条件下,3 种油脂体POV均出现不同程度的增加,这可能是因为温度过高不仅有利于微生物的繁殖,而且也提高了脂肪酶的活性[31],从而加速了油脂体的氧化;此外,温度过高也促进了外源蛋白的氧化,这可能也是油脂体氢过氧化物含量增加的原因[4,29]。
3 结 论
本实验结果表明,从不同油料作物中提取的油脂体基本组成成分及提取率之间存在较大差异,且在不同温度条件下表现出不同的理化特性。大豆油脂体的ζ-电位显著高于葵花籽和花生油脂体(P<0.05),平均粒径显著低于葵花籽和花生油脂体(P<0.05),大豆和花生油脂体均具有良好的热稳定性;大豆和花生油脂体在一定温度下具有较好的乳化活性和乳化稳定性,而加热处理对葵花籽油脂体乳化特性影响较大;油脂体贮存温度越高氧化速率越快,大豆、葵花籽和花生油脂体在4 ℃和25 ℃贮存条件下均具有良好的氧化稳定性,但花生油脂体氧化程度显著高于大豆葵花籽油脂体(P<0.05)。本研究揭示了温度对不同油料作物油脂体理化稳定性的影响,可为油脂体的实际应用提供理论依据和技术参考。
[1] 周振亚, 李建平, 张晴, 等. 中国植物油产业发展现状、问题及对策研究[J]. 中国农学通报, 2011, 27(32): 92-97.
[2] STYMNE S, STOBART A K. Triacylglycerol biosynthesis[M]//STUMPF W, CONN P M. The biochemistry of plants. 1st ed. New York: Academic Press, 1987: 175-214.
[3] HUANG A H C C. Oleosins and oil bodies in seeds and other organs[J]. Plant Physiology, 1996, 110(4): 1055-1061. DOI:10.1104/pp.110.4.1055.
[4] FISK I D, WHITE D A, LAD M, et al. Oxidative stability of sunぼower oil bodies[J]. European Journal of Lipid Science and Technology,2008, 110(10): 962-968. DOI:10.1002/ejlt.200800051.
[5] KARKANI O A, NENADIS N, NIKIFORIDIS C V, et al. Effect of recovery methods on the oxidative and physical stability of oil body emulsions[J]. Food Chemistry, 2013, 139(1/2/3/4): 640-648.DOI:10.1016/j.foodchem.2012.12.055.
[6] 邢星, 王瑛瑶, 魏安池, 等. 植物种子油体的研究与应用进展[J]. 粮油食品科技, 2015, 23(3): 45-49.
[7] KAPCHIE V N, HAUCK C C, WANG H, et al. Process improvement forsemipurified oleosomes on a pilot-plant scale[J]. Journal of Food Science, 2011, 76(6): C853-C860. DOI:10.1111/j.1750-3841.2011.02278.
[8] DELEU M, VACA-MEDINA G, FABRE J F, et al. Interfacial properties of oleosins and phospholipids from rapeseed for the stability of oil bodies in aqueous medium[J]. Colloids and Surfaces B: Biointerfaces, 2010, 80(2): 125-132. DOI:10.1016/j.colsurfb.2010.05.036.
[9] CHEN B, MCCLEMENTS D J, GRAY D A, et al. Physical and oxidative stability of pre-emulsified oil bodies extracted from soybeans[J]. Food Chemistry, 2012, 132(3): 1514-1520. DOI:10.1016/j.foodchem.2011.11.144.
[10] 齐玉红, 强卫东, 王清曼, 等. 5 种植物油体性质的比较[J]. 西北农林科技大学学报(自然科学版), 2015, 43(2): 223-227. DOI:10.13207/j.cnki.jnwafu.2015.02.031.
[11] 曾艳玲, 曾晓峰, 谭晓风, 等. 不同植物油体蛋白及其油体贮藏最适温度关联研究[J]. 中国粮油学报, 2015, 30(4): 56-60.
[12] NIKIFORIDIS C V, KIOSSEOGLOU V, SCHOLTEN E. Oil bodies:an insight on their microstructure- maize germ vs sunぼower seed[J].Food Research International, 2013, 52(1): 136-141. DOI:10.1016/j.foodres.2013.02.052.
[13] WU Nana, HUANG Xu, YANG Xiaoquan, et al. In vitro assessment of the bioaccessibility of fatty acids and tocopherol from soybean oil body emulsions stabilized with ι-carrageenan[J]. Journal of Agricultural and Food Chemistry, 2012, 60(6): 1567-1575.DOI:10.1021/jf204776q.
[14] 卫生部. 食品安全国家标准 食品中蛋白质的测定: GB 5009.5—2010[S]. 北京: 中国标准出版社, 2014: 1-7.
[15] 卫生部. 食品安全国家标准 食品中脂肪的测定方法: GB/T 5009.6—2003[S]. 北京: 中国标准出版社, 2003: 43-46.
[16] IWANAGA D, GRAY D, DECKER E A, et al. Stabilization of soybean oil bodies using protective pectin coatings formed by electrostatic deposition[J]. Journal of Agricultural and Food Chemistry,2008, 56(6): 2240-2245. DOI:10.1021/jf073060y.
[17] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins:evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723. DOI:10.1021/jf60217a041.
[18] KAPCHIE V N, YAO L, HAUCK C C, et al. Oxidative stability of soybean oil in oleosomes as affected by pH and iron[J].Food Chemistry, 2013, 141(3): 2286-2293. DOI:10.1016/j.foodchem.2013.05.018.
[19] TZEN J T C, CAO Y Z, LAURENT P, et al. Lipids, proteins and structure of seed oil bodies from diverse species[J]. Plant Physiology,1993, 101: 267-276.
[20] PAYNE G, LAD M, FOSTER T, et al. Composition and properties of the surface of oil bodies recovered from Echium plantagineum[J].Colloids and Surfaces B: Biointerfaces, 2014, 116: 88-92.DOI:10.1016/j.colsurfb.2013.11.043.
[21] TZEN J T C, LIE G C, HUANG A H C. Characterization of the charged components and their topology on the surface of plant seed oil bodies[J].Journal of Biological Chemistry, 1992, 267(22): 15626-15634.
[22] IWANAGA D, GRAY D A, FISK I D, et al. Extraction and characterization of oil bodies from soy beans: a natural source of preemulsiベed soybean oil[J]. Journal of Agricultural and Food Chemistry,2007, 55(21): 8711-8716. DOI:10.1021/jf071008w.
[23] CHIANG C J, CHEN H C, CHAO Y P, et al. Efficient system of artificial oil bodies for functional expression and purification of recombinant nattokinase in Escherichia coli[J]. Journal of Agricultural and Food Chemistry, 2005, 53(12): 4799-4804. DOI:10.1021/jf050264a.
[24] 陈珂玥, 任健. 热处理对葵花分离蛋白功能性质的影响[J]. 食品工业, 2015, 36(7): 183-185.
[25] 丁俭, 张巧智, 韩天翔, 等. 热处理对大豆油脂体乳液特性的影响[J].食品科学, 2016, 37(19): 8-14. DOI:10.7506/spkx1002-6630-201619002.
[26] FRANKELE, HUANG S, KANNER J, et al. Interfacial phenomena in the evaluation of antioxidants: bulk oils vs emulsions[J]. Journal of Agricultural and Food Chemistry, 1994, 42(5): 1054-1059.DOI:10.1021/jf00041a001.
[27] HUANG N L, HUANG M D, CHEN T L L, et al. Oleosin of subcellular lipid droplets evolved in green algae[J]. Plant Physiology,2013, 161(4): 1862-1874. DOI:10.1104/pp.112.212514.
[28] CAPUANO F, BEAUDOIN F, NAPIER J A, et al. Properties and exploitation of oleosins[J]. Biotechnology Adcances, 2007, 25(2): 203-206. DOI:10.1016/j.biotechadv.2006.11.006.
[29] FARAJI H, MCCLEMENTS D J, DECKER E A. Role of continuousphase protein on the oxidative stability of ベsh oil-in-water emulsions[J]. Journal of Agricultural and Food Chemistry, 2004, 52:4558-4564. DOI:10.1021/jf035346i.
[30] FISK I D, GRAY D A. Soybean (Glycine max) oil bodies and their associated phytochemicals[J]. Journal of Food Science, 2011, 76(9):C1349-C1354. DOI:10.1111/j.1750-3841.2011.02428.x.
[31] 孙丽琴, 孙立君, 郑刚. 不同的存放条件对油脂酸价和过氧化值的影响[J]. 粮油仓储科技通讯, 2007, 22(2): 45-46.
