冷藏金枪鱼优势腐败菌致腐败能力
2018-02-28刘爱芳钱韻芳
刘爱芳,谢 晶*,钱韻芳
金枪鱼(Thunnus obesus),又称鲔鱼、吞拿鱼,属鲈形目鲭科,多分布在太平洋、大西洋等热带亚热带海洋区域。近年来因其含有丰富的优质蛋白及二十二碳六烯酸、二十碳五烯酸等多种多不饱和脂肪酸,且肉质鲜嫩柔美,深受消费者喜爱,是远洋性重要商品食用鱼[1-2]。然而金枪鱼在贮运及销售等过程中易受微生物生长代谢的影响而腐败变质,致使其营养品质及经济价值下降[3]。金枪鱼肉中微生物构成复杂多样,但仅少数适应生长繁殖较快、代谢产生异味腐败物质的特定优势菌群即特定腐败菌(specific spoilage organisms,SSOs)参与其腐败变质[4-6]。水产品贮藏期间,SSOs生长代谢速率快,致腐败能力强,是其品质控制的关键点。
对于水产品中SSOs的确定,一般从优势腐败菌的筛选及致腐败能力的评价两个方面进行分析。已在前期4 ℃冷藏金枪鱼微生物多样性分析中分离、纯化、鉴定得到金枪鱼肉在腐败终点时的主要优势菌假单胞菌(Pseudomonas spp.)、不动杆菌(Acinetobacter spp.)以及热死环丝菌(Brochothrix thermosphacta),其中假单胞菌和不动杆菌是鱼类低温冷藏过程中常见的革兰氏阴性腐败菌,可利用氨基酸作为生长基质,产生酯、酸等物质[7-10];热死环丝菌则是肉制品中常见的革兰氏阳性兼性厌氧腐败菌[11-12]。水产品中SSOs的生长代谢可加速蛋白质、脂肪以及核苷酸等物质降解,产生醇、挥发性盐基氮(total volatile basic nitrogen,TVB-N)、生物胺、有机酸等小分子物质,释放不良气味,最终导致鱼肉腐败变质。因此,TVB-N、生物胺、三甲胺等腐败代谢产物产量因子可作为水产品优势腐败菌致腐败能力定量分析的评价标准。钱韻芳等[13]将TVB-N及三甲胺产量因子作为4 ℃气调包装的凡纳滨对虾SSOs腐败希瓦氏菌(Shewanella putrefaciens)致腐败能力的定量分析指标,发现其TVB-N产量因子(YTVB-N/CFU)及三甲胺产量因子(YTMA-N/CFU)分别为1.03×10-7mg/CFU和3.95×10-9mg/CFU。Macé等[14-15]通过将不同菌株回接至无菌鱼片并测定其微生物、感官、TVB-N及挥发性气味物质产量变化,明确了8 ℃气调包装的三文鱼及煮熟热带虾的SSOs致腐败特点。
食品微生物的生长预测模型通常有Baranyi-Roberts模型、Gompertz模型、修正的Gompertz模型、Logistic模型、Richards模型、Stannard模型以及Huang模型等[16],其中生鲜水产品中腐败菌生长S型曲线的拟合多采用Baranyi-Roberts模型、修正的Gompertz模型以及Logistic模型[17-18],以此,本实验基于前期冷藏金枪鱼细菌菌相变化规律的研究,将分离得到的3 株优势腐败菌假单胞菌、不动杆菌和热死环丝菌分别接种到无菌鱼肉后4 ℃低温贮藏,分析3 种微生物生长动力学模型可靠性,研究冷藏金枪鱼3 种优势腐败菌的生长动力学参数,并分别以感官评价和生物胺、TVB-N含量为定性、定量指标,分析明确冷藏金枪鱼优势腐败菌的致腐败能力及其腐败特点,为高效率的金枪鱼冷藏保鲜技术提供理论依据。
1 材料与方法
1.1 材料与试剂
金枪鱼取自浙江丰汇远洋渔业有限公司上海供应站,经宰杀分割并真空密封包装,于-60 ℃冻藏。
胰蛋白胨大豆琼脂培养基、胰蛋白胨大豆肉汤、平板计数琼脂培养基、假单胞菌CFC选择性培养基、STAA琼脂培养基 青岛海博生物技术有限公司;盐酸、硼酸、溴甲酚绿-甲基红混合指示剂、高氯酸、氢氧化钠、氨水、醋酸铵等(均为分析纯) 国药集团化学试剂有限公司;丹酰氯 上海安谱实验科技股份有限公司。
1.2 仪器与设备
Kjeltec 8400全自动凯氏定氮仪 丹麦FOSS分析仪器公司;LC-2010C HT 高效液相色谱仪 日本岛津公司;H-2050R台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;VS-1300L-U洁净工作台 苏净集团苏州安泰空气技术有限公司;DHP-9162型电热恒温培养箱 上海一恒科技有限公司;Ymnl-9D拍打式均质器南京以马内利仪器设备有限公司。
1.3 方法
1.3.1 金枪鱼无菌鱼块的制备
参照钱韻芳等[13]的方法并作适当调整,金枪鱼4 ℃冷藏解冻后,75%乙醇中浸泡30 s,无菌水多次清洗后超净工作台内晾干,备用。
1.3.2 腐败菌菌种活化及菌悬液的制备
于前期冷藏金枪鱼细菌菌相演替变化规律的研究中,分离、纯化、鉴定获得4 ℃冷藏金枪鱼货架期终点(贮存第168小时)时的3 株优势腐败菌,分别为不动杆菌、假单胞菌、热死环丝菌,所得菌株使用甘油保存于-40 ℃中备用。上述实验室所保存的3 株菌株经活化后,接种到胰蛋白胨培养基上划线25 ℃培养24~48 h后,取典型单菌落接种于300 mL胰蛋白胨肉汤中,30 ℃摇床培养12~18 h至菌液浓度达到108CFU/mL。离心20~30 min,弃上清液,无菌生理盐水稀释至106CFU/mL,备用。
1.3.3 接种与贮藏
取上述无菌金枪鱼肉,无菌操作台内分别于106CFU/mL的不动杆菌、假单胞菌、热死环丝菌菌悬液中浸泡30 s后,捞出沥干,分装于保鲜袋中,4 ℃低温贮藏。每12 h定期取样进行感官评定,菌落计数,每隔24 h测定其TVB-N含量和生物胺含量等相关指标。
1.3.4 金枪鱼感官品质分析
综合参考雷志方等[19]的方法及SC/T 3117—2006《生食金枪鱼》安全卫生标准[20],由5 名专业人士组成感官评定小组,对金枪鱼的色泽、气味、组织形态和弹性结构4 个方面综合评分,取4 项平均分为感官得分。
1.3.5 冷藏金枪鱼理化品质分析
TVB-N含量的测定:取5 g碎鱼肉,依据SC/T 3032-2007《水产品中挥发性盐基氮的测定》[21]方法,使用自动凯氏定氮仪对TVB-N含量进行测定。
生物胺含量的测定:参照GB/T 20768—2006《鱼和虾中有毒生物胺的测定 液相色谱-紫外检测法》[22]方法对样品进行生物胺的提取、衍生处理后,采用高效液相色谱-紫外检测法进行定量检测,具体色谱条件如下:色谱柱为C18色谱柱,柱温、流速、进样量及检测波长分别为40 ℃、1 mL/min、10 μL及254 nm,流动相为0.1 mol/mL醋酸铵(A)和乙腈(B),梯度洗脱(0~22 min,50% A~10% A;22~34 min,10% A~50% A;34~39 min,50% A)。生物胺指数在数值上为组胺、酪胺、腐胺、尸胺含量的总和[11]。
1.3.6 腐败菌生长情况的测定
以GB 47892—2010《食品微生物学 检验菌落总数测定》[24]为参考,取金枪鱼肉25 g于无菌均质袋中,加入225 mL生理盐水后使用拍击式均质器拍打1~2 min,制备样品匀液,并依次做10 倍梯度稀释。取1 mL适宜稀释度的样品匀液,分别接种于相应培养基中,每个稀释度3 个平行。相关培养条件见表1。
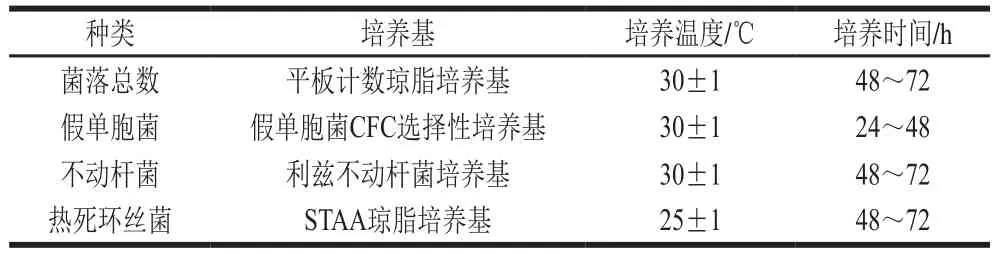
表1 金枪鱼腐败细菌培养方法Table 1 Culture methods for spoilage organisms in tuna
1.3.7 腐败菌生长动力学模型的建立及可靠性评价
1.3.7.1 腐败菌生长动力学模型的建立
本研究采用Baranyi-Roberts模型[25]、修正的Gompertz模型以及Logistic模型[26]对实验数据进行分析,建立腐败菌的生长动态模型,其方程表达式如式(1)~(2)所示。
Baranyi-Roberts模型如式(1)所示。
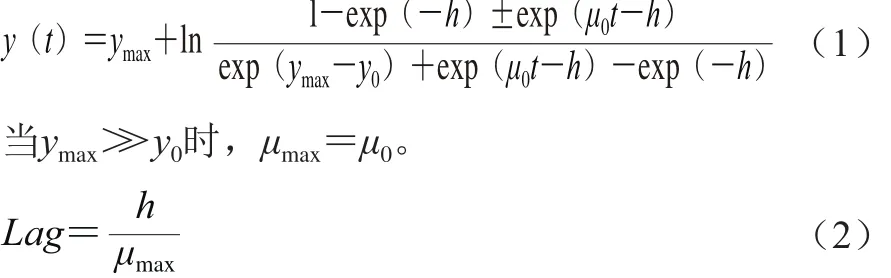
式中:ymax为微生物达到稳定时的最大数量(lg(CFU/g));y0为初始微生物数量(lg(CFU/g));μ0为初始比生长速率/h-1;μmax为最大比生长速率/h-1;h为适应因素;Lag为延滞时间/h;t为贮藏时间/h。
修正的Gompertz方程如式(3)所示。
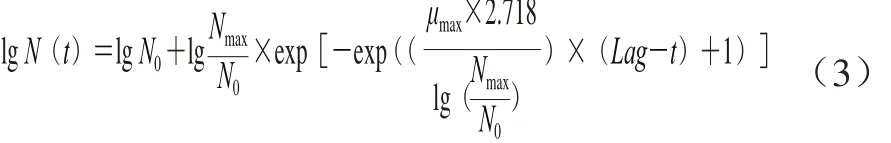
式中:N(t)为贮藏时间为t时的腐败菌数/(CFU/g);N0、Nmax分别为初始菌落数和生长稳定期时最大菌落数/(CFU/g)。
Logistic模型(式(4))。
应用型人才的培养离不开实验实训场所,一方面加强校内实验室建设,按照工作环境和工作要求建立校内仿真实验室,模拟工作环境对学生进行专业实践方面的训练。另一方面,积极拓展校外实践基地,与企业、工厂等单位合作建立大学生实践基地,将部分实践性课程搬入实践基地组织教学[4]。
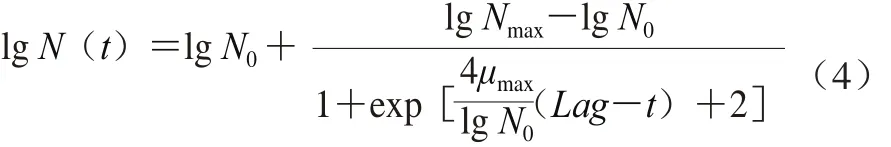
1.3.7.2 腐败菌生长动力学模型的可靠性评价
分析比较模型拟合所得预测值及实验观测值,依据统计学参数修正决定系数R2Adj、均方误差(mean square error,MSE)、准确因子(accuracy factor,Af)以及偏差因子(bias factor,Bf)对所得微生物生长动力学模型的可靠性进行评价[27-28]。
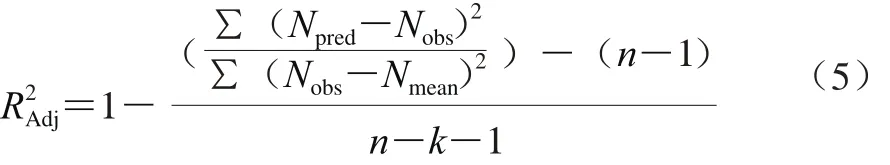
MSE根据式(6)计算。

式中:Nobs为观测值;Npred为预测值;n为观测值个数;Nmean为观测值平均值;k为模型中变量参数的个数。
1.3.8 优势腐败菌致腐败能力定量分析
以腐败代谢产物产量因子YTVB-N/CFU,即冷藏金枪鱼货架期终点时单位腐败菌产生的腐败代谢产物的量为细菌腐败能力的定量指标[29],其计算公式如式(9)所示。
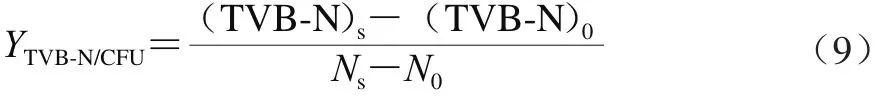
1.4 数据处理
使用SPSS 19.0和Excel 2010软件进行数据统计处理,采用Duncan法,P<0.05为显著,并用Origin 9.0软件进行非线性回归分析、多项式曲线拟合。
2 结果与分析
2.1 冷藏金枪鱼腐败微生物菌落数变化及生长动力学参数分析
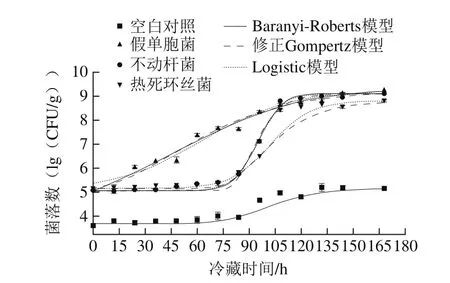
图1 接种不同菌株的金枪鱼冷藏期间腐败菌菌落数变化情况Fig. 1 Microbial counts of tuna inoculated with different spoilage bacteria during chilled storage
采用Baranyi-Roberts模型、修正的Gompertz模型以及Logistic模型对接种的优势腐败菌的生长动态进行分析描述,未接菌空白对照组金枪鱼的微生物生长动态以非线性方程拟合,接菌金枪鱼4 ℃冷藏期间腐败菌菌落数拟合及生长变化情况如图1所示。接种高浓度假单胞菌、不动杆菌和热死环丝菌实验组的初始菌落数分别为5.04、5.07 lg(CFU/g)和5.14 lg(CFU/g),接种效果无显著差异,相比于空白对照组初始菌落数高出近2 个数量级,直至实验末期空白对照组的菌落总数达5.15 lg(CFU/g),才与接菌实验组初期菌落数相近,且贮藏期间接菌实验组与空白对照组微生物数量差距较大,因此可近似忽略冷藏期间无菌金枪鱼鱼肉中残留杂菌对其优势腐败微生物致腐败能力的影响。冷藏实验过程中,接种假单胞菌组菌落数始终高于接种不动杆菌与热死环丝菌实验组,与前期冷藏金枪鱼菌相演替变化规律研究中货架期末期菌群组成略有不同,推测与金枪鱼初始菌相结构及各腐败菌代谢特点有关[27-29]。接种假单胞菌组菌落数冷藏12 h后迅速增长,而菌落数演变情况相似的不动杆菌和热死环丝菌组在前86 h生长较缓,菌落数均未超过6.0 lg(CFU/g);冷藏96 h后不动杆菌组与热死环丝菌组微生物快速增加,随后鱼肉中营养物质消耗、代谢产物累积,实验组菌落数的增长曲线均趋于平缓,至贮藏168 h时接种假单胞菌、不动杆菌和热死环丝菌组的微生物数量分别增至9.26、9.09 lg(CFU/g)和8.79 lg(CFU/g)。
分析图1可知,经各模型拟合所得生长曲线与实测值吻合程度较高,呈典型S型,可初步判定3 种模型均能分别较好拟合冷藏金枪鱼中3 种优势腐败菌的生长动态。结合表2各方程对冷藏金枪鱼优势腐败菌菌落数拟合所得统计学参数、MSE、Af和Bf分析评价拟合可靠性,越大则微生物生长曲线与微生物生长动力学方程拟合程度越高,MSE越小则模型描述实验数据的精确度越高;Af和Bf分别描述模型预测值与实验观测值的接近程度和偏差程度,Af越接近1则模型拟合准确度越高,一般认为1.10<Af<1.90为可接受范围,0.90<Bf<1.05时模型评估效果较好[28]。各模型方程对冷藏金枪鱼优势腐败菌生长曲线拟合均较高(j>0.97),MSE近似为0,Af及Bf都接近于1,说明各模型方程能够很好地描述金枪鱼3 种优势腐败菌4 ℃下的生长曲线;假单胞菌的修正Gompertz方程0.99,高于方程Baranyi-Roberts和方程Logistic对假单胞菌生长曲线的拟合;由方程Baranyi-Roberts和方程Logistic拟合不动杆菌生长曲线所得j均高于0.99,且MSE、Af和Bf呈现的拟合效果较好,故可采用Baranyi-Roberts方程或方程Logistic描述冷藏金枪鱼中不动杆菌的生长动态;对于热死环丝菌生长动态的微生物动力学方程的拟合,分析比较统计学参数发现,Baranyi-Roberts方程未能对热死环丝菌的生长动态作出拟合,Logistic方程拟合>0.98高于修正Gompertz方程>0.96,故采用Logistic方程描述冷藏金枪鱼中热死环丝菌的生长动态更为贴切。通过Baranyi-Roberts方程、修正的Gompertz方程以及Logistic方程拟合所得腐败微生物生长动力学参数见表2。冷藏金枪鱼中假单胞菌Lag为10.85 h,不动杆菌和热死环丝菌的延滞时间分别为83.93 h和79.11 h,假单胞菌延滞期显著少于不动杆菌和热死环丝菌,而不动杆菌和热死环丝菌的最大比生长速率(μmax)明显大于假单胞菌,分别为0.182 9、0.111 1 h-1和0.045 7 h-1,说明假单胞菌相比于不动杆菌和热死环丝菌可更加快速适应冷藏金枪鱼中生存环境,利用氨基酸作为生长基质进行生长代谢繁殖等生理活动,但其对数生长繁殖能力弱于不动杆菌和热死环丝菌;4 ℃冷藏金枪鱼假单胞菌最大腐败菌数(lg Nmax)高于不动杆菌和热死环丝菌,分别为9.11、9.09 lg(CFU/g)和8.78 lg(CFU/g),表明生长稳定期时假单胞菌菌落数量优于不动杆菌和热死环丝菌。
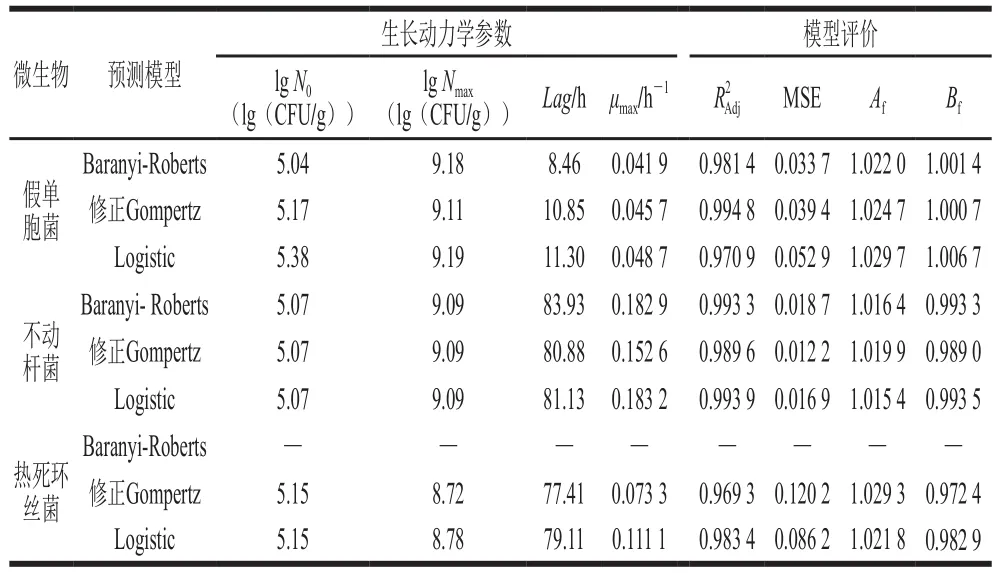
表2 接种不同菌株金枪鱼冷藏期间微生物生长动力学参数及模型评价Table 2 Microbial growth kinetic parameters and model evaluation for tuna inoculated with different spoilage bacteria during chilled storage
2.2 冷藏金枪鱼感官品质变化及含氮腐败物质产量变化分析
2.2.1 冷藏金枪鱼感官品质变化分析
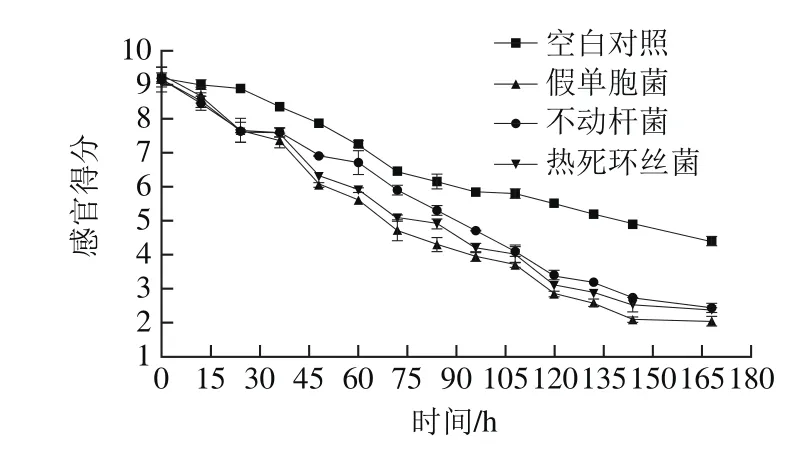
图2 接种不同菌株的金枪鱼冷藏期间感官品质变化Fig. 2 Sensory quality changes of tuna inoculated with different spoilage bacteria during chilled storage
接种不同菌株的金枪鱼在4 ℃冷藏条件下的感官评定结果如图2所示。整体而言,因微生物代谢加速蛋白质、氨基酸等营养物质的降解,致使金枪鱼逐渐出现肉质松软、色泽暗淡、散发腥臭味等腐败变质现象,感官品质均呈下降趋势,且接菌实验组感官品质较空白对照组低。接种假单胞菌、不动杆菌和热死环丝菌的冷藏金枪鱼的感官得分在贮藏前48 h并无显著性差异(P>0.05),分别于贮藏第48、72小时和第60小时到达高品质期终点,至贮藏第96、108小时和第105小时开始出现腥臭味,此时感官得分分别为3.95、4.10和4.00,到达感官拒绝的腐败点;空白对照组于冷藏第96小时时低于可生食感官分值6 分,直至贮藏末期其感官评分未低于金枪鱼腐败点感观分值4 分。
2.2.2 冷藏金枪鱼TVB-N含量变化分析
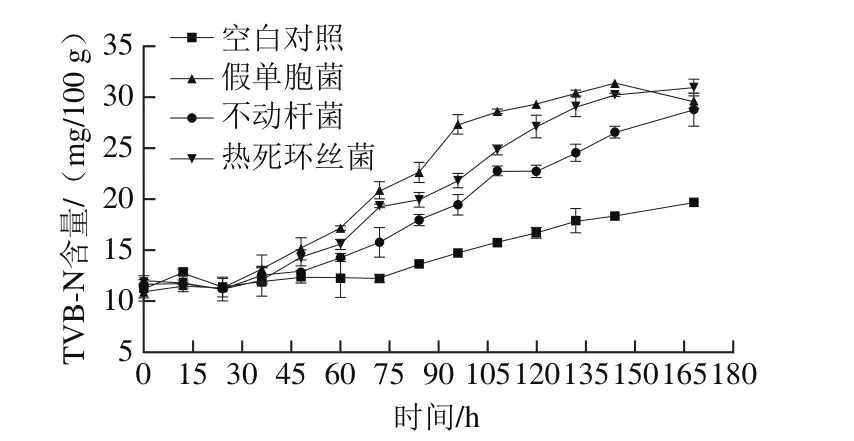
图3 接种不同菌株的金枪鱼冷藏期间TVB-N含量的变化Fig. 3 Changes in TVB-N contents of tuna inoculated with different spoilage bacteria during chilled storage
金枪鱼冷藏期间TVB-N的累积多由蛋白质腐败降解产生胺及氨类等盐基氮类物质所致,其值越高,则氨基酸降解越严重,是评价鱼肉品质的重要鲜度指标[20]。由图3可知,空白组和接种假单胞菌、不动杆菌以及热死环丝菌组的TVB-N含量在0~48 h贮藏初期无显著差异,初始TVB-N含量分别为11.27、10.91、11.60 mg/100 g和11.94 mg/100 g,相比于新鲜淡水鱼,初始TVB-N含量较高[33-34];冷藏48 h后TVB-N含量迅速增加,接种假单胞菌、不动杆菌和热死环丝菌组的金枪鱼到达感官拒绝点时TVB-N含量分别为27.32、22.80 mg/100 g和24.85 mg/100 g,接种假单胞菌组TVB-N含量高于其他3 组。
2.2.3 冷藏金枪鱼生物胺含量及生物胺指数变化分析
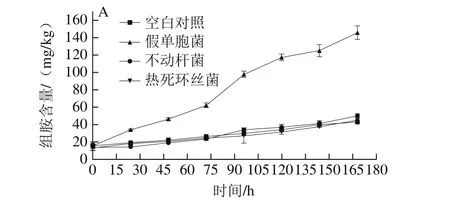
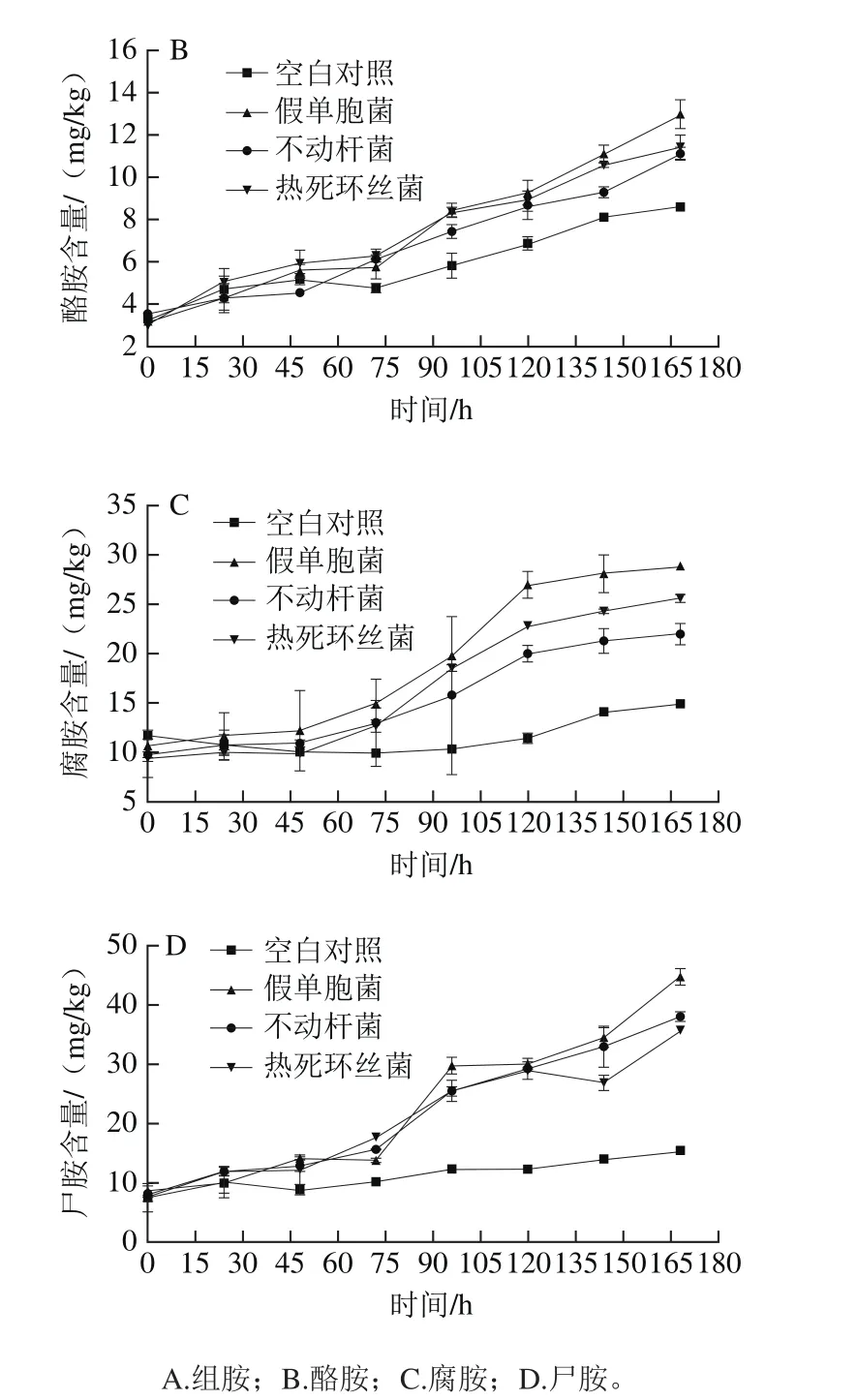
图4 接种不同菌株的金枪鱼冷藏期间生物胺含量的变化Fig. 4 Changes in biogenic amine contents of tuna inoculated with different spoilage bacteria during chilled storage
水产品特别是游离氨基酸含量较高的金枪鱼在贮藏过程中,易受腐败微生物代谢产物脱羧酶的影响,使其游离氨基酸发生脱羧作用,产生大量具有生物活性的生物胺。已有研究表明组胺、酪胺、腐胺和尸胺是金枪鱼贮藏过程中产生的主要胺类,与其食用安全性及鲜度变化相关性显著[35-36]。由图4接种不同菌株的金枪鱼4 ℃冷藏过程中生物胺的变化情况可知,各处理组生物胺含量随贮藏时间的延长逐渐上升;空白对照组的生物胺含量增长缓慢,相比于新鲜金枪鱼,冷藏至第168小时其组胺、酪胺、腐胺和尸胺分别增长27.14、5.37、3.27 mg/kg和7.56 mg/kg,组胺含量增长较高;贮藏过程中,接种假单胞菌的金枪鱼各生物胺含量,整体高于其他处理组。如图4A所示,接种不动杆菌组与接种热死环丝菌组的组胺产生量与未接菌组无显著差异(P>0.05),接种假单胞菌组中组胺产生量显著高于其他处理组(P<0.05),至贮藏96 h假单胞菌组中组胺含量升至97.89 mg/kg,超过SC/T 3117—2006中对于生食金枪鱼中组胺含量的限制(90 mg/kg),贮藏第168小时,假单胞菌处理的金枪鱼肉中组胺含量相比于空白对照组高出2.43 倍。图4B中显示酪胺含量在金枪鱼冷藏过程中随贮藏时间依次持续增加,至第168小时货架期终点,接种假单胞菌、不动杆菌和热死环丝菌的金枪鱼处理组中酪胺含量分别增至12.97、11.09 mg/kg和11.38 mg/kg。腐胺和尸胺是鱼肉腐败变质过程中散发腐臭气味的主要原因,由图4C、D可知,不动杆菌组和热死环丝菌组的腐胺含量在贮藏前72 h变化趋势相似,接种假单胞菌组的腐胺含量在金枪鱼冷藏第72小时后开始显著上升,表明此时鱼肉品质开始下降,至贮藏第96小时,假单胞菌组腐胺含量增长速度进一步加快,增至19.78 mg/kg,鱼肉品质到达腐败点[35];尸胺变化趋势同腐胺较为相似,贮藏末期,假单胞菌组、不动杆菌组和热死环丝菌组尸胺含量分别升至44.72、38.07 mg/kg和35.69 mg/kg。
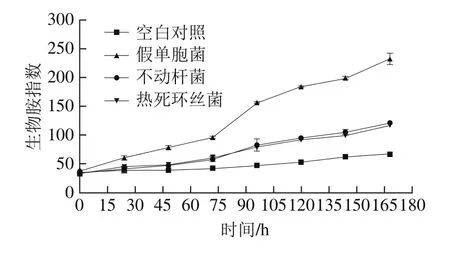
图5 接种不同菌株的金枪鱼冷藏期间生物胺指数的变化Fig. 5 Changes in biogenic amine index of inoculated tuna with different spoilage bacteria during chilled storage
生物胺指数数值上与组胺、酪胺、腐胺和尸胺含量的总和相等,可反映金枪鱼冷藏期间生物胺整体变化情况,多以生物胺指数值100作为金枪鱼质量阈值[36],接种不同菌株的金枪鱼冷藏期间生物胺指数变化情况如图5所示。假单胞菌组于贮藏12 h其生物胺开始迅速增长,贮藏96 h时其生物胺指数155.84已超过规定阈值100;贮藏末期,接种不动杆菌组和热死环丝菌组的生物胺指数分别达到121.11和117.43。
2.3 冷藏金枪鱼优势腐败菌致腐败能力的定量分析
以腐败微生物代谢产生TVB-N的产量因子YTVB-N/CFU作为冷藏金枪鱼中优势腐败菌假单胞菌、不动杆菌和热死环丝菌致腐败能力评价指标,所得结果如表3所示。冷藏金枪鱼中3 株优势腐败菌中假单胞菌的产量因子YTVB-N/CFU最高,为7.36×10-8mg TVB-N/CFU,比热死环丝菌的产量因子高出45%,是不动杆菌产量因子的3.97 倍,这可能与假单胞菌在有氧冷藏的环境中可分泌活性较高的蛋白酶和脱羧酶有关[37]。因此4 ℃冷藏金枪鱼中假单胞菌和热死环丝菌的致腐能力强于不动杆菌。
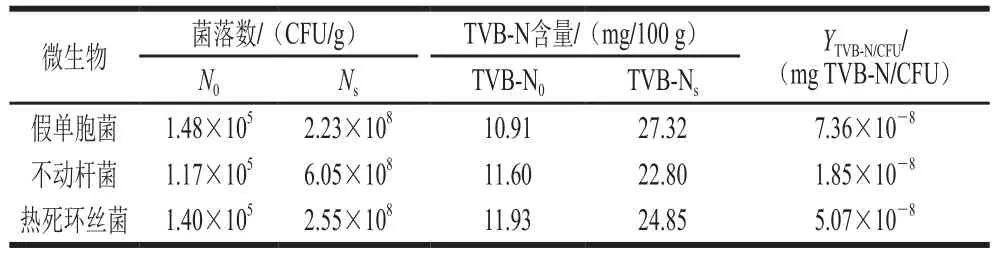
表3 接种不同菌株的金枪鱼冷藏期间致腐因子比较Table 3 Comparison of yield factors of TVB-N in tuna inoculated with different spoilage bacteria during chilled storage
3 结 论
将从冷藏金枪鱼货架期终点分离、纯化、鉴定所得优势腐败菌假单胞菌、不动杆菌和热死环丝菌回接于无菌金枪鱼肉中,分析贮藏期间各优势腐败菌生长动力学参数及金枪鱼品质变化发现,4 ℃冷藏金枪鱼中假单胞菌和热死环丝菌的生长动态描述最佳的方程分别为修正Gompertz方程和Logistic方程,不动杆菌生长曲线的拟合可采用Baranyi-Roberts方程或Logistic方程;接种不动杆菌和热死环丝菌的冷藏金枪鱼货架期为108 h,比接种假单胞菌组的货架期较长;好氧嗜冷菌假单胞菌在冷藏金枪鱼中生长快速,比不动杆菌和热死环丝菌具有更强的产生TVB-N和生物胺的能力。冷藏金枪鱼优势腐败菌致腐能力的分析研究可为冷藏金枪鱼靶向保鲜技术的发展及食品栅栏技术在金枪鱼保鲜中应用提供理论依据,但研究未涉及各腐败菌间的交互作用以及致腐败机制,这将是今后研究工作的重点。
[1] WILLIAMS P G, REID C. Overview of tuna ベsheries in the western and Central Paciベc Ocean, including economic conditions-2010[M].Federated States of Micronesia: Western and Central Paciベc Fisheries Commission Scientiベc Committee, 2011: 1-49.
[2] SILBANDE A, ADENET S, SMITH-RAVIN J, et al. Quality assessment of ice-stored tropical yellowベn tuna (Thunnus albacares)and inぼuence of vacuum and modiベed atmosphere packaging[J]. Food Microbiology, 2016, 60: 62-72. DOI:10.1016/j.fm.2016.06.016.
[3] 罗庆华. 水产品特定腐败菌研究进展[J]. 食品科学, 2010, 31(23):468-472.
[4] DALGAARD P. Qualitative and quantitative characterization of spoilage bacteria from packed fish[J]. International Journal of Food Microbiology, 1995, 26(3): 319-333.
[5] GRAM L, HUSS H H. Microbiological spoilage of fish and fish products[J]. International Journal of Food Microbiology, 1996, 33(1):121-137.
[6] DABADÉ D S, BESTEN H M W D, AZOKPOTA P, et al. Spoilage evaluation, shelf-life prediction, and potential spoilage organisms of tropical brackish water shrimp (Penaeus notialis) at diあerent storage temperatures[J]. Food Microbiology, 2015, 48: 8-16. DOI:10.1016/j.fm.2014.11.005.
[7] GILL C O, NEWTON K G. The development of aerobic spoilage ぼora on meat stored at chill temperatures[J]. Journal of Applied Bacteriology,1977, 43(2): 189-195. DOI:10.1111/j.1365-2672.1977.tb00742.x.
[8] LUND B M, BAIRD-PARKER T C, GOULD G W. The microbiological safety and quality of food[M]. Aspen: Aspen Publishers, 2000: 472-506.
[9] BEKAERT K, DEVRIESE L, MAES S, et al. Characterization of the dominant bacterial communities during storage of Norway lobster and Norway lobster tails (Nephrops norvegicus) based on 16S rDNA analysis by PCR-DGGE[J]. Food Microbiology, 2015, 46: 132-138.DOI:10.1016/j.fm.2014.06.022.
[10] 彭勇. 冷却猪肉常见腐败微生物致腐能力的研究[D]. 北京: 中国农业大学, 2005: 21-23.
[11] PENNACCHIA C, ERCOLINI D, VILLANI F. Development of a Real-Time PCR assay for the specific detection of Brochothrix thermosphacta in fresh and spoiled raw meat[J]. International Journal of Food Microbiology, 2009, 134(3): 230-236. DOI:10.1016/j.ijfoodmicro.2009.07.005.
[12] 许振伟, 许钟, 杨宪时, 等. 鱼类腐败菌腐败能力测定方法[J]. 食品科学, 2010, 31(20): 355-359.
[13] 钱韻芳, 杨胜平, 谢晶, 等. 气调包装凡纳滨对虾特定腐败菌致腐败能力研究[J]. 中国食品学报, 2015, 15(1): 85-91. DOI:10.16429/J.1009-7848.2015.01.014.
[14] MACÉ S, JOFFRAUD J J, CARDINAL M, et al. Evaluation of the spoilage potential of bacteria isolated from spoiled raw salmon(Salmo salar) ベllets stored under modiベed atmosphere packaging[J].International Journal of Food Microbiology, 2013, 160(3): 227-238.DOI:10.1016/j.ijfoodmicro.2012.10.013.
[15] MACÉ S, CARDINAL M, JAFFRÈS E, et al. Evaluation of the spoilage potential of bacteria isolated from spoiled cooked whole tropical shrimp (Penaeus vannamei) stored under modiベed atmosphere packaging[J]. Food Microbiology, 2014, 40(2): 9-17. DOI:10.1016/j.fm.2013.11.018.
[16] 周康, 刘寿春, 李平兰, 等. 食品微生物生长预测模型研究新进展[J].微生物学通报, 2008, 35(4): 589-594. DOI:10.13344/j.microbiol.china.2008.04.019.
[17] 丁婷, 李婷婷, 励建荣, 等. 冷藏三文鱼片微生物生长动力学模型适用性分析及货架期模型的建立[J]. 中国食品学报, 2015, 15(5): 63-73.DOI:10.16429/j.1009-7848.2015.05.009.
[18] GINSON J, PANDA S K, BINDU J, et al. Effect of high pressure treatment on microbiological quality of Indian white prawn(Fenneropenaeus indicus) during chilled storage[J]. Food Microbiology, 2015, 46: 596-603. DOI:10.1016/j.fm.2014.10.008.
[19] 雷志方, 谢晶, 刘爱芳, 等. 复合保鲜剂优化及其对生食金枪鱼的保鲜效果[J]. 食品与发酵工业, 2015, 41(10): 170-176. DOI:10.13995/j.cnki.11-1802/ts.201510032.
[20] 农业部. 生食金枪鱼: SC/T 3117—2006[S]. 北京: 中国农业出版社,2006: 1-10.
[21] 农业部. 水产品中挥发性盐基氮的测定: SC/T 3032—2007[S]. 北京:中国农业出版社, 2007: 1-2.
[22] 国家质量监督检验检疫总局. 鱼和虾中有毒生物胺的测定 液相色谱-紫外检测法: GB/T 20768—2006[S]. 北京: 中国标准出版社,2007: 1-6.
[23] ZARE D, MUHAMMAD K, BEJO M H, et al. Determination of urocanic acid, a compound implicated in histamine toxicity, and assessment of biogenic amines relative to urocanic acid content in selected fish and fish products[J]. Journal of Food Composition and Analysis, 2015, 37(26): 95-103. DOI:10.1016/j.jfca.2014.06.014.
[24] 卫生部. 食品安全国家标准食品微生物学检验: 检验菌落总数测定:GB 4789.2—2010[S]. 北京: 中国标准出版社, 2010: 1-5.
[25] BARANYI J, ROBERTS T A. Mathematics of predictive food microbiology[J]. International Journal of Food Microbiology, 1995,26(2): 199-218. DOI:10.1016/0168-1605(94)00121-L.
[26] ZWIETERING M H, JONGENBURGER I, ROMBOUTS F M, et al.Modeling of the bacterial growth curve[J]. Applied & Environmental Microbiology, 1990, 56(6): 1875-1881.
[27] ROSS T. Indices for performance evaluation of predictive models in food microbiology[J]. Journal of Applied Bacteriology, 1996, 81(5):501-508. DOI:10.1111/j.1365-2672.1996.tb03539.x.
[28] 王军, 董庆利, 丁甜. 预测微生物模型的评价方法[J]. 食品科学,2011, 32(21): 268-272.
[29] DALGAARD P, GRAM L, HUSS H H. Spoilage and shelflife of cod fillets packed in vacuum or modified atmospheres[J].International Journal of Food Microbiology, 1993, 19(4): 283-294.DOI:10.1016/018-1605(93)90020-H.
[30] CALLIAUW F, MULDER T D, BROEKAERT K, et al. Assessment throughout a whole fishing year of the dominant microbiota of peeled brown shrimp (Crangon crangon) stored for 7 days under modiベed atmosphere packaging at 4 °C without preservatives[J]. Food Microbiology, 2015, 54: 60-71. DOI:10.1016/j.fm.2015.10.016.
[31] 谢晶, 刘骁, 杨茜, 等. PCR结合表型鉴定对超高压处理后的冷藏带鱼细菌菌相分析[J]. 农业工程学报, 2016, 32(5): 307-314.DOI:10.11975/j.issn.1002-6819.2016.05.045.
[32] GE C, CHANG S L, YU Z, et al. Comparison of bacterial proベles of fish between storage conditions at retails using DGGE and banding pattern analysis: consumer’s perspective[J]. Food & Nutrition Sciences, 2012, 3(2): 190-200. DOI:10.4236/fns.2012.32028.
[33] SILBANDE A, ADENET S, SMITH-RAVIN J, et al. Quality assessment of ice-stored tropical yellowベn tuna (Thunnus albacares)and inぼuence of vacuum and modiベed atmosphere packaging[J]. Food Microbiology, 2016, 60: 62-72. DOI:10.1016/j.fm.2016.06.016.
[34] EDIRISINGHE R K B, GRAFFHAM A J, TAYLOR S J.Characterisation of the volatiles of yellowベn tuna (Thunnus albacares)during storage by solid phase microextraction and GC-MS and their relationship to ベsh quality parameters[J]. International Journal of Food Science & Technology, 2007, 42(10): 1139-1147. DOI:10.1111/j.1365-2621.2006.01224.x.
[35] 刘寿春, 钟赛意, 马长伟, 等. 以生物胺变化评价冷藏罗非鱼片腐败进程[J]. 农业工程学报, 2012, 28(14): 277-282. DOI:10.3969/j.issn.1002-6819.2012.14.042.
[36] 李苗苗, 王江峰, 徐大伦, 等. 4 种保鲜处理对冰温贮藏金枪鱼片生物胺的影响[J]. 中国食品学报, 2015, 15(2): 111-119. DOI:10.16429/j.1009-7848.2015.02.017.
[37] 綦国红. 食源假单胞菌群体感应信号分子的产生及其对食品腐败的影响[D]. 南京: 南京农业大学, 2006: 68-92.
