啤酒花废弃枝叶多酚、黄酮含量与抗氧化活性的相关性分析
2018-02-28白姗姗张莹莹刘玉梅
白姗姗,张莹莹,赵 强,刘玉梅*
啤酒花(Humulus lupulus L.)是啤酒酿造过程中不可缺少的原料之一,被誉为“啤酒的灵魂”,同时具有健胃、消食等功效,可用于治疗癔病、膀胱炎、肺结核等[1-5],主要化学成分为树脂类[6]、挥发油[7-8]、多酚类[9-10]、黄酮类[11]等,其中多酚和黄酮类化合物具有很强的抗菌、抗炎、抗氧化等作用,也是各种植物中的主要抗氧化活性成分[12]。中国啤酒花产量位居世界第3,仅次于美国、德国,新疆则是我国啤酒花最大的产区[13-14]。啤酒花采摘期间会产生大量的废弃枝叶,对其活性成分的研究和开发对发展新疆的经济具有重要的意义。前期研究发现,啤酒花废弃枝叶中含有丰富的营养成分,并具有一定的抗氧化活性[15],但抗氧化作用的物质基础尚不明确。因此,对啤酒花废弃枝叶抗氧化活性成分的深入研究,可以为开发利用啤酒花废弃枝叶提供理论依据。
本实验以新疆大面积种植的香型花札一和高酸型花马可波罗2 个品种的废弃枝叶为原料,并根据采摘部位将其分为主枝、侧枝和叶子,分别以乙醇提取其活性成分,后经氯仿、乙酸乙酯、正丁醇依次萃取得不同极性部位,通过羟自由基(•OH)和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除实验、β-胡萝卜素-亚油酸法及磷钼酸法4 个评价体系,研究其醇提取物及不同极性部位的抗氧化能力,结合样品中多酚及黄酮含量的相关性分析,对啤酒花废弃枝叶进行综合分析。
1 材料与方法
1.1 材料与试剂
札一、马可波罗啤酒花废弃枝叶由新疆三宝乐农业科技有限公司提供,实验室分选为主枝、侧枝和叶子3 类样品,40 ℃烘干、粉碎、过40 目筛,备用。
DPPH 美国Sigma-Aldrich公司;没食子酸中国药品生物制品检定所;芦丁 北京化学试剂公司;2,6-二叔丁基对甲酚(2,6-di-tert-butyl-p-cresol,BHT)、β-胡萝卜素、吐温40、亚油酸、邻二氮菲、硫酸亚铁、质量分数30%过氧化氢、磷酸二氢钠、磷酸氢二钠、钼酸铵、氯化钠、浓硫酸、无水甲醇、无水乙醇、氯仿、乙酸乙酯、正丁醇、石油醚等均为分析纯。
1.2 仪器与设备
KQ-100VED型三频数控超声波清洗器 昆山超声仪器有限公司;BS210S型电子天平 德国赛多利斯公司;DHP-420型电热恒温培养箱 北京市永光明医疗仪器厂;UV-5300PC型紫外-可见分光光度计 上海元析仪器有限公司;DHG-9075A型电热鼓风干燥箱 上海一恒科学仪器有限公司;Anke.TGL-16G型离心机上海安亭科学仪器厂;HH-S4型数显恒温水浴 江苏省金坛市医疗仪器厂。
1.3 方法
1.3.1 啤酒花废弃枝叶浸膏的提取
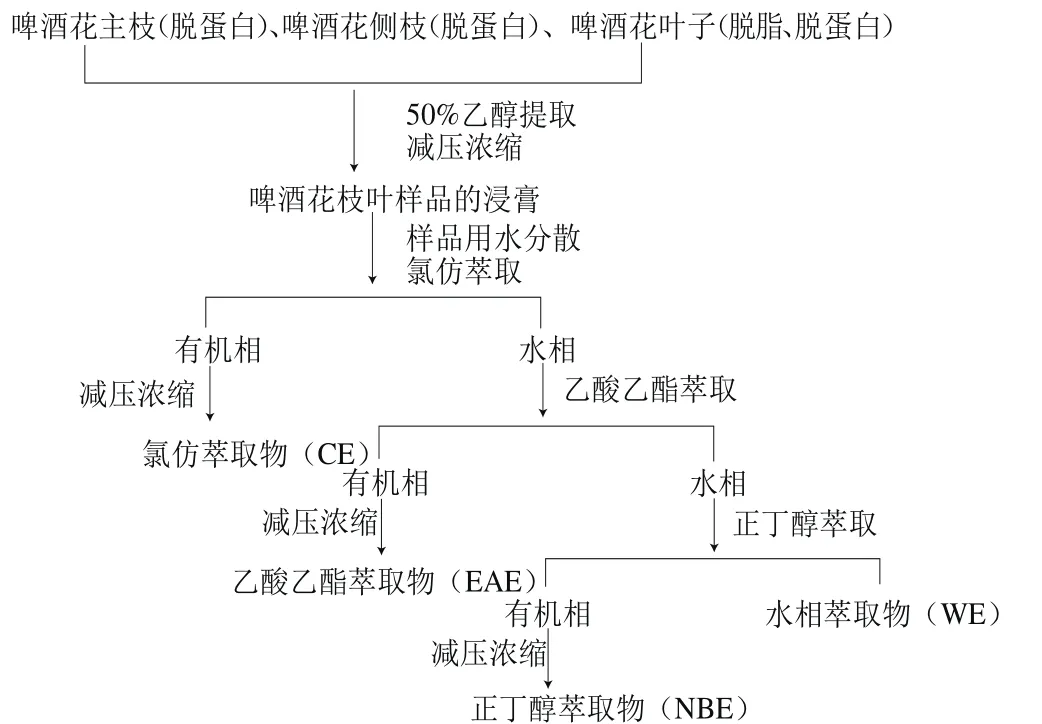
取札一、马可波罗啤酒花的主枝、侧枝及叶子(叶子预先以石油醚脱脂),用质量分数5%的NaCl溶液脱蛋白,以料液比1∶30(m/V)加入50%(体积分数,下同)乙醇溶液,超声波辅助提取10 min后,在60 ℃条件下浸提50 min,重复上述操作2 次,合并滤液,浓缩得浸膏,各提取物的浸膏得率见表1。准确称取一定量的浸膏,加水分散得乙醇提取物(ethanol extract,EE),再依次用氯仿、乙酸乙酯、正丁醇萃取,萃取液分别回收溶剂后,得氯仿萃取物(chloroform extracts,CE)、乙酸乙酯萃取物(ethyl acetate extracts,EAE)、正丁醇萃取物(n-butanol extracts,NBE)和水相萃取物(water extracts,WE),萃取流程见图1。将上述各萃取物分别用50%乙醇溶解并定容至25 mL,冷藏,用于后续多酚、黄酮含量的测定及抗氧化实验(各测试样品的质量浓度可依据浸膏得率计算)。测试前将样品恢复至室温后根据需要进行相应的稀释处理。
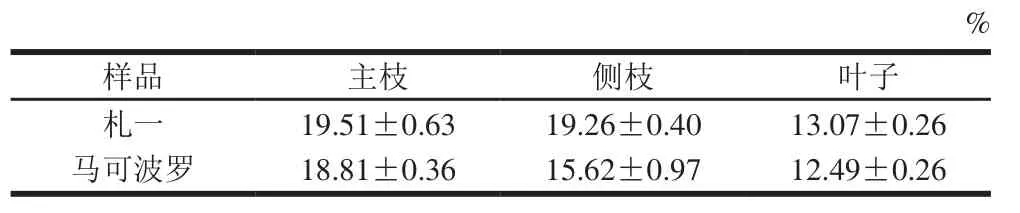
表1 啤酒花废弃枝叶浸膏得率Table 1 Yields of ethanol extracts from abandoned hop branches and leaves
1.3.2 总多酚含量的测定
采用福林-酚比色法[16-18],以干燥至恒质量的没食子酸为标准品,以A760nm对没食子酸质量浓度(ρ)进行线性回归,得标准曲线方程为A760nm=0.011 8ρ-0.053 6,R=0.997 8,线性范围为8.86~106.32 mg/L。
1.3.3 总黄酮含量的测定
采用NaNO2-Al(NO3)3-NaOH比色法[19-20],以干燥至恒质量的芦丁为标准品,以A510nm对芦丁质量浓度(ρ)作图,得线性回归方程A510nm=15.164 5ρ-0.002 0,R=0.999 3,线性范围为8.73~69.82 mg/L。
1.3.4 清除•OH活性测定
采用邻二氮菲-Fe2+氧化法评价样品清除•OH能力[21],以BHT(0.06~0.24 mg/mL)为对照。

式中:E为•OH清除率/%;A样是加样品时溶液的吸光度;A损是以重蒸水代替样品溶液时溶液的吸光度;A未是以重蒸水代替样品和质量分数0.01% H2O2时溶液的吸光度。
1.3.5 清除DPPH自由基活性测定
DPPH自由基清除实验参照文献[22-23]的方法,以BHT(0.06~0.60 mg/mL)为对照。

式中:D为DPPH自由基清除率/%;A1为加样品时溶液的吸光度;A0为未加样品时溶液的吸光度。
1.3.6 β-胡萝卜素-亚油酸体系抗氧化活性测定
根据文献[24]的方法,以BHT(0.10×10-4~0.10 mg/mL)为对照,以抗氧化指数(antioxidant activity index,AAI)的大小来反映抗氧化剂总抗氧化能力的强弱。
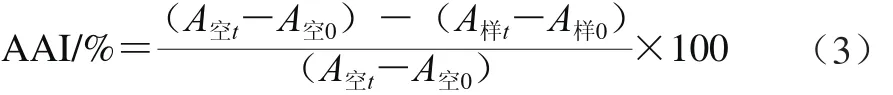
式中:A样t、A空t分别表示120 min时样品和空白的吸光度;A样0、A空0分别表示0 min时样品和空白的吸光度。
1.3.7 磷钼酸体系抗氧化活性实验
按文献[25]方法,以0.75 mg/mL的VC为对照,以抗氧化能力(antioxidant activity,AA)的大小来反映抗氧化剂总抗氧化能力的强弱。

式中:A0和A1分别表示VC和样品在820 nm波长处的吸光度。
1.4 数据统计分析
所有实验数据均为3 次重复实验结果的平均值。采用OriginPro 8.6或SPSS 16.0软件处理数据,并用ANOVA和邓肯氏多重差异分析(P<0.05)。所有实验数据均表示为。
2 结果与分析
2.1 啤酒花枝叶中多酚、黄酮含量
多酚和黄酮类化合物在自然界中分布广泛,且具有较强的抗氧化活性。该两类化合物的极性范围较宽,可以从不同极性的溶剂中萃取得到。因此,不同极性部位所得到的多酚、黄酮类化合物的种类及含量也会有所差异。札一和马可波罗啤酒花不同极性部位的多酚、黄酮含量分别见表2、3。
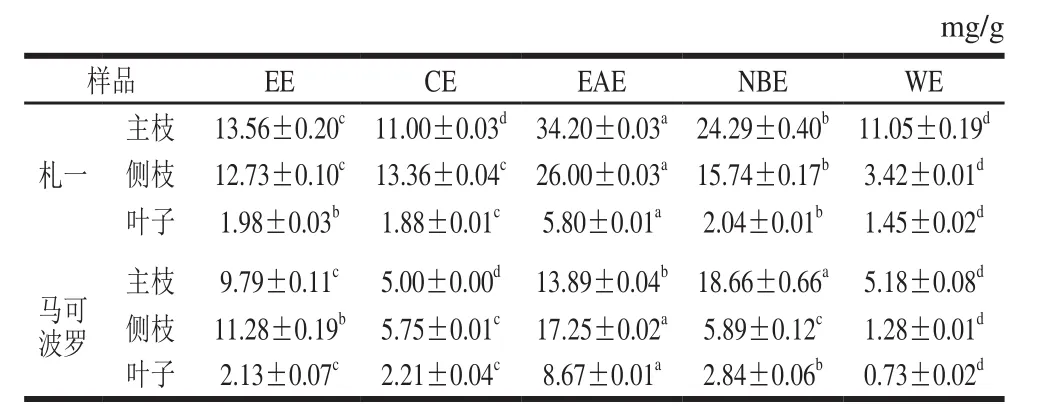
表2 各样品多酚的含量Table 2 Contents of polyphenols in different solvent extracts
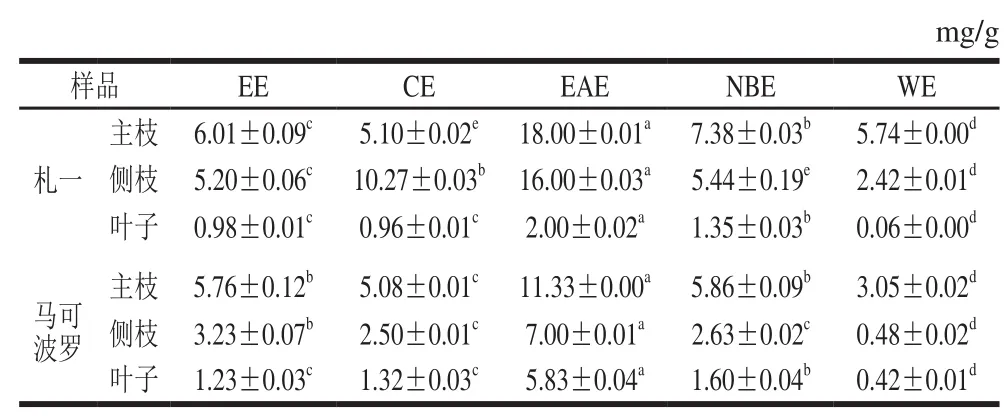
表3 各样品黄酮的含量Table 3 Contents of ぼavonoids in different solvent extracts
由表2、3可知,啤酒花枝叶中均含有一定量的多酚和黄酮类化合物。札一枝干中多酚、黄酮含量均高于马可波罗,而叶子中的含量均较低。同一样品中EAE的多酚、黄酮含量均高于CE、NBE和WE,这与张强等[26]对杜仲叶提取物不同极性部位多酚含量研究的结果一致。不同极性部位相比较发现,EAE的多酚、黄酮含量均显著高于EE(P<0.05),札一枝干和马可波罗主枝的NBE中多酚、黄酮含量也高于EE,表明经不同极性溶剂萃取后多酚、黄酮物质在EAE部位和札一枝干、马可波罗主枝的NBE部位得到富集。
2.2 啤酒花枝叶提取物对•OH清除活性的比较
由图2可知,各样品对•OH均有一定的清除能力,且表现出明显的量效关系。在枝干中,清除•OH的能力均为EAE最强,WE最弱;而在叶子中,EAE、CE的清除能力最强,NBE次之,但均显著高于WE。
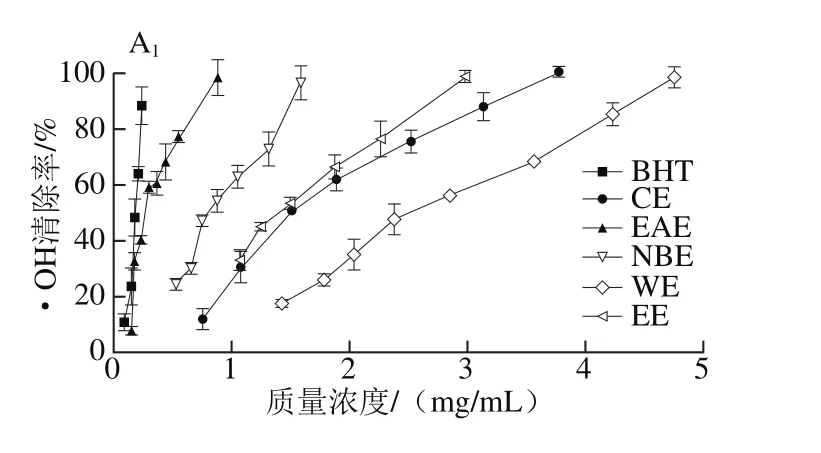
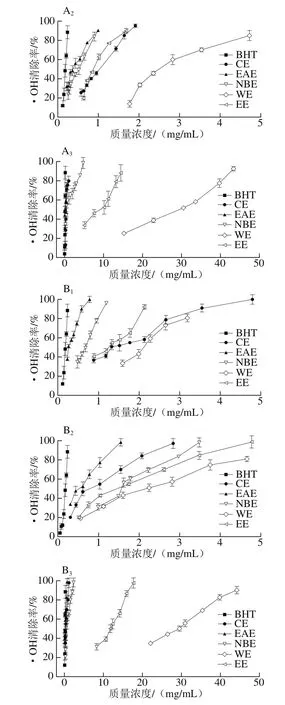
图2 各样品清除•OH能力Fig. 2 Hydroxyl radical scavenging capacity of different solvent extracts
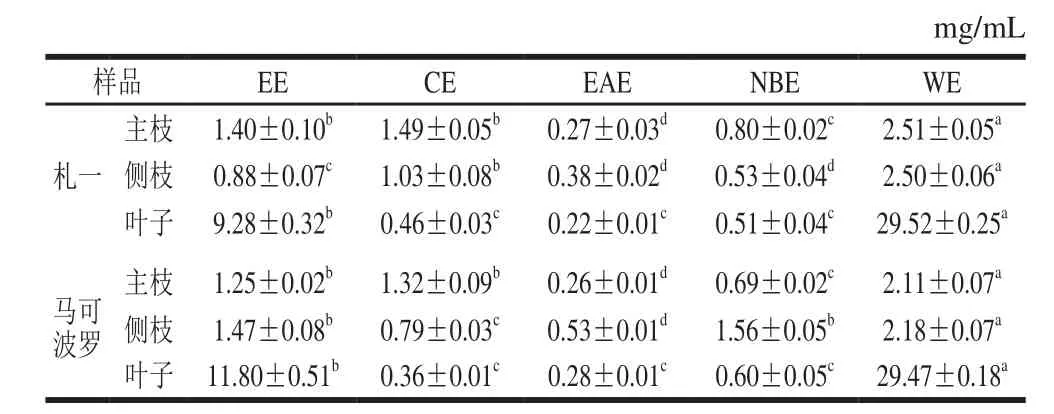
表4 各样品清除•OH的IC50值Table 4 IC50 for hydroxyl radical scavenging activity
清除•OH的能力通常以50%清除率时的样品质量浓度,即IC50值来衡量,IC50值越小,样品抗氧化活性越强。由表4的IC50值可知,对2种啤酒花叶子极性部位提取物而言,除WE对•OH清除能力较差外,其他极性部位对•OH清除能力的差异不显著(P>0.05),略低于对照品BHT(IC50值为(0.18±0.01)mg/mL)。总体而言,EAE部位清除•OH能力较强,该结论与王春景等[27]研究鸡眼草和刘琼等[28]研究傣药竹叶兰的结果类似。
2.3 啤酒花枝叶提取物对DPPH自由基清除作用的比较
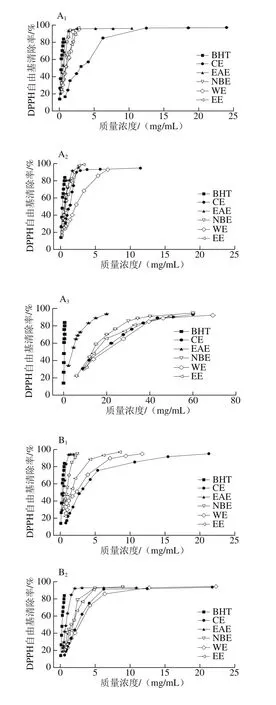
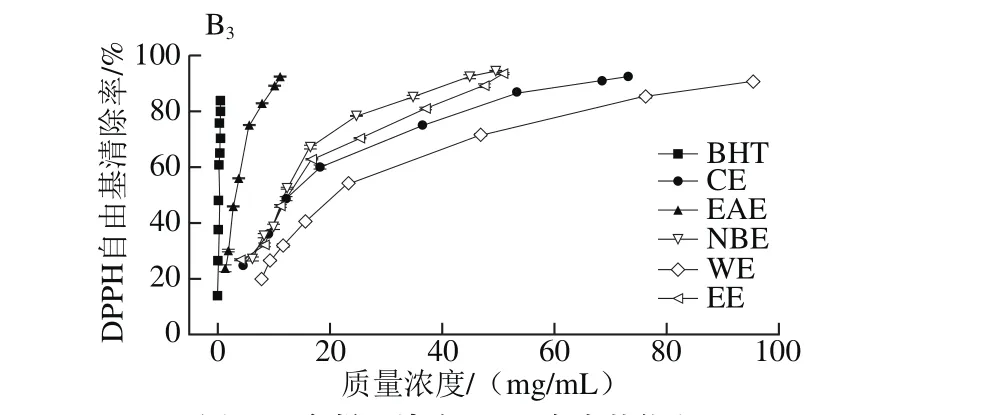
图3 各样品清除DPPH自由基能力Fig. 3 DPPH radical scavenging activity of different solvent extracts
由图3可知,各样品对DPPH自由基均有一定的清除能力。当枝干样品质量浓度为0~5 mg/mL时,清除率随质量浓度的增大而增大,超过5 mg/mL时,清除率趋于平缓,说明测试体系内DPPH自由基已基本清除完全。
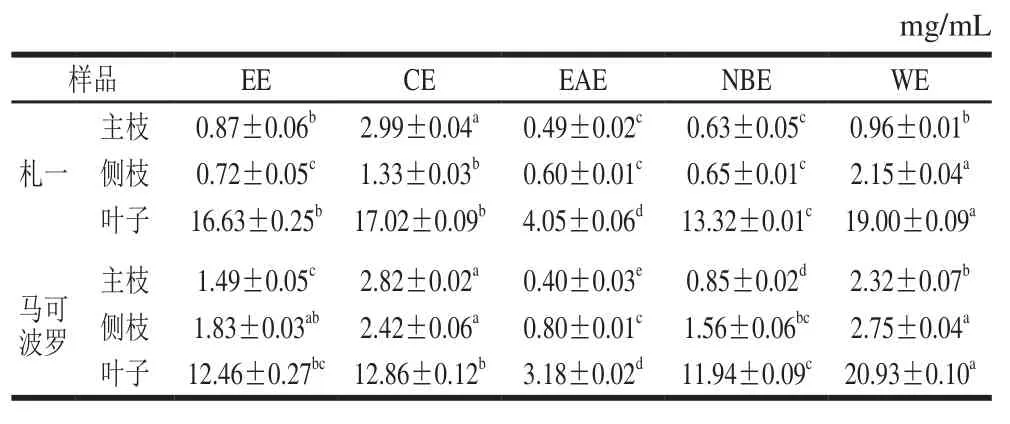
表5 各样品清除DPPH自由基的IC50值Table 5 IC50 for DPPH radical scavenging activity
由表5的IC50值可知,样品枝叶中EAE清除DPPH自由基的能力均最强,主枝中CE最弱,侧枝和叶子中WE最弱,且均低于对照组BHT(IC50值为(0.25±0.01)mg/mL)。对同一样品的同一极性部位而言,枝干部分清除DPPH自由基的能力显著高于叶子。上述结论与黄一泓等[29]研究藏红花的结果相似,但在相同的质量浓度下,枝干部分的EAE和NBE清除DPPH自由基能力远高于藏红花萃取物。
2.4 啤酒花枝叶提取物在β-胡萝卜素-亚油酸乳化体系中总抗氧化能力的比较
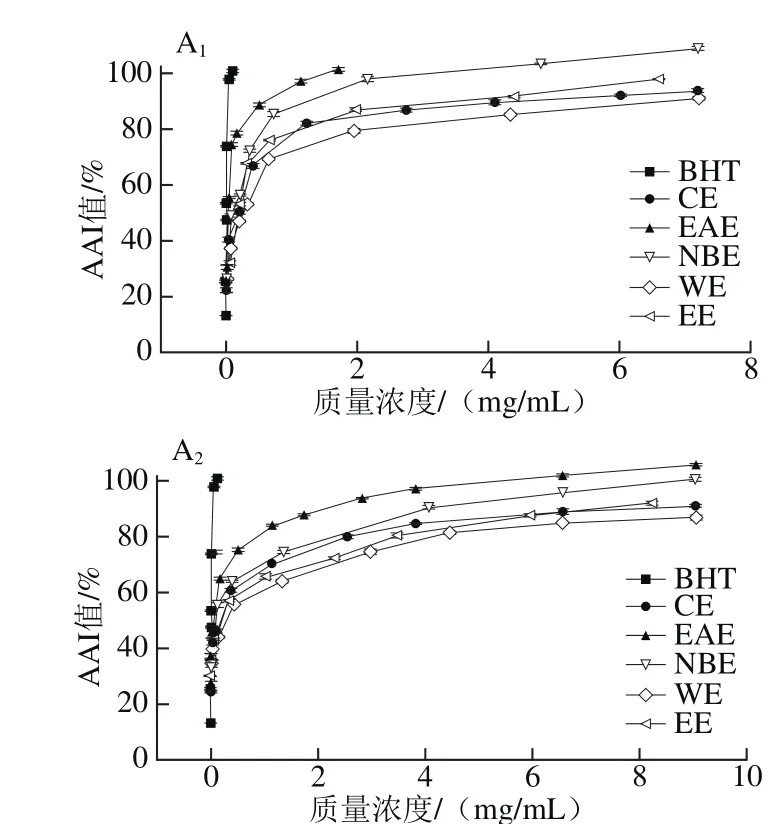
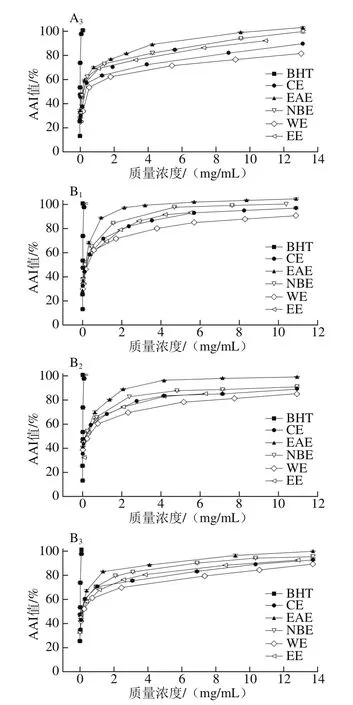
图4 各样品在β-胡萝卜素-亚油酸乳化体系中的抗氧化能力Fig. 4 Total antioxidant activity in β-carotene-linoleic acid model
由图4可知,各样品均有一定的抗氧化能力,当质量浓度为0~3 mg/mL时,AAI值迅速增大,继续增大质量浓度,AAI值逐渐趋于平缓。样品总抗氧化能力依次为EAE>NBE>CE>WE,略小于BHT(IC50值为3.82×10-3mg/mL)。
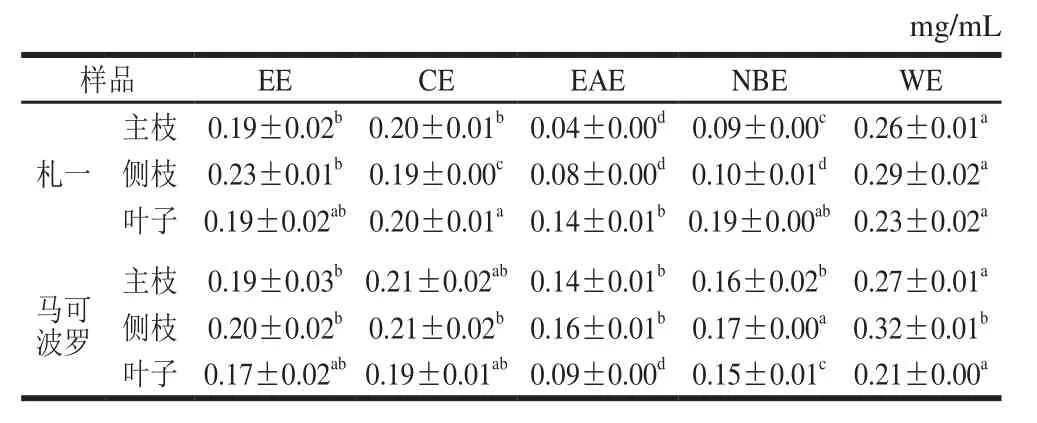
表6 β-胡萝卜素-亚油酸体系中各样品IC50值Table 6 IC50 for total antioxidant activity in β-carotene-linoleic acid model
由表6的IC50值可知,枝干中札一各极性部位的抗氧化活性略高于马可波罗,叶子中则相反;而札一和马可波罗两个品种枝干部分的抗氧化活性区别不大。祁英等[30]对新疆紫草不同极性部位总抗氧化活性的研究显示,当样品质量浓度为2 mg/mL时,EAE和NBE部位的AAI值分别为98%、28%,此结论与本实验中EAE的总抗氧化活性接近,但NBE的活性远小于本实验的啤酒花枝叶提取物。
2.5 啤酒花枝叶提取物在磷钼酸体系中总抗氧化能力的比较
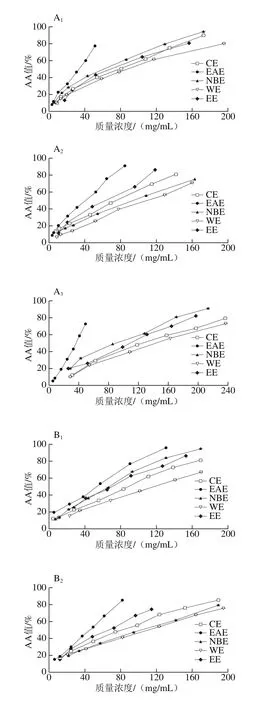
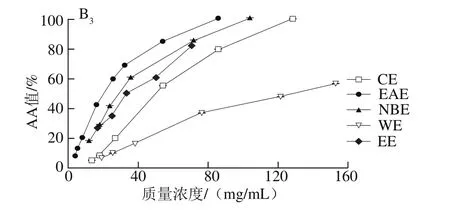
图5 各样品在磷钼酸体系中的抗氧化能力Fig. 5 Total antioxidant activity in phosphomolybdenum model
由图5可知,各样品抗氧化的AA值随样品质量浓度的增大而增大,表现出质量浓度依赖性。样品主枝和叶子中各部位的抗氧化能力以EAE最强,其次是NBE、CE和WE;侧枝中各部位的抗氧化能力依次为EAE、CE、NBE和WE。
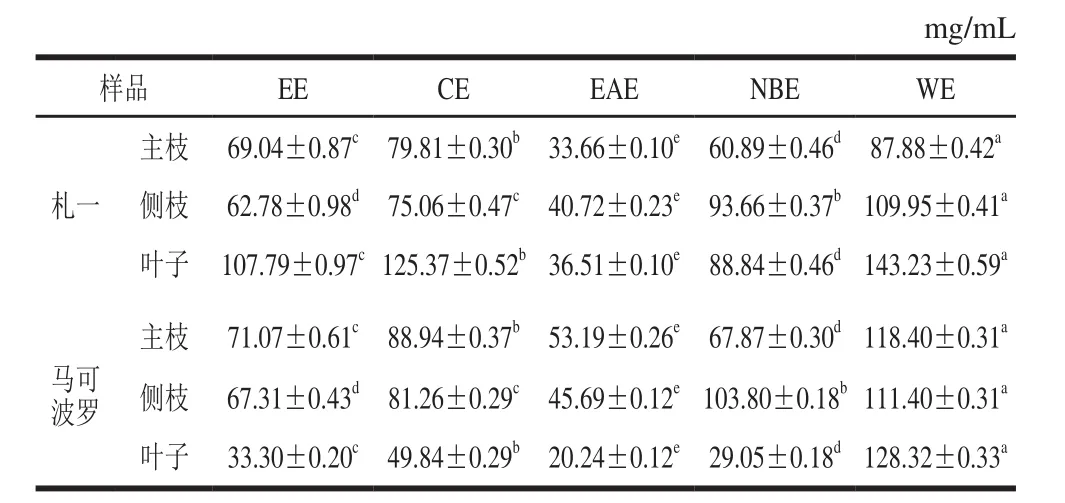
表7 磷钼酸体系中各样品IC50值Table 7 IC50 in phosphomolybdenum model
由表7可知,磷钼酸体系中样品抗氧化能力与β-胡萝卜素-亚油酸乳化体系的结果类似,枝干中札一各极性部位的抗氧化活性高于马可波罗,而叶子中相反,且不同极性部位存在显著差异(P<0.05)。
由表4~7的数据可知,所有抗氧化体系中,EAE的抗氧化能力均高于EE,与黄酮、多酚含量的研究结果一致,说明多酚、黄酮为其主要的抗氧化活性成分。啤酒花枝叶提取物在β-胡萝卜素-亚油酸体系的IC50最小,在0.04~0.32 mg/mL之间,磷钼酸体系最大,达到20.24~143.23 mg/mL。
2.6 啤酒花枝叶不同极性部位多酚、黄酮含量与抗氧化活性的相关性分析
大量研究表明,植物活性成分的抗氧化能力可能与其多酚、黄酮的含量有关[18]。为了进一步研究上述提取物的抗氧化活性与多酚、黄酮含量的相关性,对不同极性部位抗氧化的IC50值与多酚、黄酮含量进行统计分析,4 种抗氧化体系与啤酒花主枝、侧枝和叶子中的多酚、黄酮含量的相关性分析见表8。
多酚和黄酮含量与抗氧化活性的相关性差异较大。在枝干中,多酚和黄酮含量与抗氧化能力均为极显著负相关,相关系数在-0.652~-0.917之间(P<0.01),在叶子提取物中,除多酚含量与•OH清除能力的相关系数为-0.493(显著相关(P<0.05)),在其他抗氧化体系中均为极显著负相关,相关系数在-0.728~-0.934(P<0.01)之间,说明啤酒花枝叶样品中的多酚、黄酮为其主要抗氧化成分。多酚和黄酮结构中的邻位酚羟基很容易被氧化成醌类结构,使得多酚和黄酮具有较强捕捉自由基的能力和抗氧化活性,并且抗氧化活性强弱与其多酚和黄酮类物质含量的高低、种类、结构有关,这也说明啤酒花枝叶提取物中多酚、黄酮的种类多样。
3 结 论
札一和马可波罗啤酒花枝叶提取物中含有多酚、黄酮类化合物,且具有一定的抗氧化能力。因多酚、黄酮类化合物种类多,极性范围较宽,而经不同溶剂萃取后,EAE的多酚、黄酮含量和抗氧化活性均高于EE,说明啤酒花枝叶提取物主要以极性较低的黄酮苷元类物质为主,经过初步分离后,乙酸乙酯对这些成分有效富集。相关性分析也表明,除个别样品外,所有抗氧化活性体系与多酚、黄酮含量的相关系数绝对值均大于0.650,说明多酚和黄酮是啤酒花枝叶抗氧化作用的主要物质基础。而对于啤酒花枝叶的抗氧化成分及其活性的构效关系还有待进一步深入探明。
[1] ZANOLI P, ZAVATTI M. Pharmacognostic and pharmacological profile of Humulus lupulus L.[J]. Journal of Ethnopharmacology,2008, 116(3): 383-396. DOI:10.1016/j.jep.2008.01.011.
[2] 刘玉梅. 啤酒花的化学成分及药理作用研究进展[J]. 食品科学,2009, 30(23): 521-527. DOI:10.3321/j.issn:1002-6630.2009.23.117.
[3] 王仿, 张霞, 熊杰, 等. 新疆野生啤酒花多酚类物质提取与含量比较[J].食品科学, 2010, 31(6): 36-38.
[4] 方威, 熊晶, 邢莹莹, 等. 啤酒花茎叶不同提取部位的体外抗肿瘤活性研究及其化学成分鉴定[J]. 药学进展, 2009, 33(10): 458-462.DOI:10.3969/j.issn.1001-5094.2009.10.005.
[5] 林柳悦, 蒋益萍, 张巧艳, 等. 啤酒花化学成分和药理活性研究进展[J]. 中国中药杂志, 2017, 42(10): 1830-1836. DOI:10.19540/j.cnki.cjcmm.20170224.019.
[6] 熊皓平, 何国庆, 陈云龙, 等. 啤酒花有效成分分析[J]. 浙江大学学报(农业与生命科学版), 2005, 31(6): 769-772. DOI:10.3321/j.issn:1008-9209.2005.06.023.
[7] LIGOR M, STANKEVIČIUS M, WENDA-PIESIK A, et al.Comparative gas chromatographic-mass spectrometric evaluation of hop (Humulus lupulus L.) essential oils and extracts obtained using different sample preparation methods[J]. Food Analytical Methods,2013, 7(7): 1433-1442. DOI:10.1007/s12161-013-9767-5.
[8] MONGELLI A, RODOLFI M, GANINO T, et al. Are Humulus lupulus L. ecotypes and cultivars suitable for the cultivation of aromatic hop in Italy? A phytochemical approach[J]. Industrial Crops and Products,2016, 83: 693-700. DOI:org/10.1016/j.indcrop.2015.12.046.
[9] KURUMATANI M, FUJITA R, TAGASHIRA M, et al. Analysis of polyphenols from hop bract region using CCC[J]. Journal of Liquid Chromatography & Related Technologies, 2005, 28(12/13): 1971-1983. DOI:10.1081/JLC-200063640.
[10] NAGASAKO-AKAZOME Y, HONMA D, TAGASHIRA M, et al.Safety evaluation of polyphenols extracted from hop bracts[J]. Food and Chemical Toxicology, 2007, 45(8): 1383-1392. DOI:10.1016/j.fct.2007.01.019.
[11] 张维库, 王守宝, 付骋宇, 等. 啤酒花的黄酮类成分[J]. 中国中药杂志, 2013, 38(10): 1539-1542. DOI:10.4268/cjcmm20131017.
[12] WANG X, YANG L, YANG X, et al. In vitro and in vivo antioxidant and antimutagenic activities of polyphenols extracted from hops(Humulus lupulus L.)[J]. Journal of the Science of Food and Agriculture, 2014, 94(8): 1693-1700. DOI:10.1002/jsfa.6534.
[13] JOSEF P, VLADIMĺR N, ALENA H, et al. Assessment of the genetic diversity of wild hops (Humulus lupulus L.) in Europe using chemical and molecular analyses[J]. Biochemical Systematics and Ecology,2010, 38(2): 136-145. DOI:10.1016/j.bse.2009.12.023.
[14] 韩珍琼, 李小波. 啤酒花保健饮料的生产工艺研究[J]. 食品工业科技, 2005, 26(3): 131-132; 135. DOI:10.13386/j.issn1002-0306.2005.03.044.
[15] 白姗姗, 刘博奥, 刘玉梅. 啤酒花废弃枝叶的营养成分及抗氧化活性研究[J]. 酿酒科技, 2016(3): 61-64. DOI:10.13746/j.njkj.2015446.
[16] DUAN X J, ZHANG W W, LI X M, et al. Evaluation of antioxidant property of extract and fractions obtained from a red alga, Polysiphonia urceolata[J]. Food Chemistry, 2006, 95(1): 37-43. DOI:10.1016/j.foodchem.2004.12.015.
[17] DULF F V, VODNAR D C, SOCACIU C. Effects of solid-state fermentation with two ベlamentous fungi on the total phenolic contents,flavonoids, antioxidant activities and lipid fractions of plum fruit(Prunus domestica L.) by-products[J]. Food Chemistry, 2016, 209: 27-36. DOI:10.1016/j.foodchem.2016.04.016.
[18] HAYOUNI E A, ABEDRABBA M, BOUIX M, et al. The effects of solvents and extraction method on the phenolic contents and biological activities in vitro of Tunisian Quercus coccifera L. and Juniperus phoenicea L. fruit extracts[J]. Food Chemistry, 2007, 105(3): 1126-1134. DOI:10.1016/j.foodchem.2007.02.010.
[19] VIACAVA G E, ROURA S I. Principal component and hierarchical cluster analysis to select natural elicitors for enhancing phytochemical content and antioxidant activity of lettuce sprouts[J].Scientia Horticulturae, 2015, 193: 13-21. DOI:org/10.1016/j.scienta.2015.06.041.
[20] ZIELINSKI A A F, HAMINIUK C W I, ALBERTI A, et al. A comparative study of the phenolic compounds and the in vitro antioxidant activity of different Brazilian teas using multivariate statistical techniques[J]. Food Research International, 2014, 60: 246-254. DOI:0.1016/j.foodres.2013.09.010.
[21] 刘芬, 詹文红. 白芍总苷体外抗氧化活性研究[J]. 现代药物与临床,2015, 30(2): 132-135. DOI:10.7501/j.issn.1674-5515.2015.02.004.
[22] KAEWPIBOON C, LIRDPRAPAMONGKOL K, SRISOMSAP C,et al. Studies of the in vitro cytotoxic, antioxidant, lipase inhibitory and antimicrobial activities of selected Thai medicinal plants[J]. BMC Complementary and Alternative Medicine, 2012, 12(1): 217-225.DOI:10.1186/1472-6882-12-217.
[23] KOU X, GAO J, XUE Z, et al. Purification and identification of antioxidant peptides from chickpea (Cicer arietinum L.) albumin hydrolysates[J]. LWT-Food Science and Technology, 2013, 50(2):591-598. DOI:10.1016/j.lwt.2012.08.002.
[24] 凌关庭. 抗氧化食品与健康[M]. 北京: 化学工业出版社, 2004:333-334.
[25] 陈南迪, 方妙玉, 吴锡鸿, 等. 不同品种蜂花粉总黄酮含量与抗氧化活性相关性的研究[J]. 食品工业科技, 2013, 34(1): 70-73.DOI:10.13386/j.issn1002-0306.2013.01.007.
[26] 张强, 苏印泉, 张京芳. 杜仲叶不同萃取物抗氧化活性比较分析[J].食品科学, 2011, 32(13): 23-27.
[27] 王春景, 胡小梅, 张鼎, 等. 鸡眼草抗氧化活性部位的筛选及其黄酮和总酚含量[J]. 中药材, 2014, 37(5): 868-871. DOI:10.13863/j.issn1001-4454.2014.05.034.
[28] 刘琼, 李乔丽, 放茂良, 等. 傣族药竹叶兰不同极性部位提取物的抗氧化性研究[J]. 中国农学通报, 2011, 27(14): 77-81.
[29] 黄一泓, 刘雅莉, 武文斌, 等. 藏红花花瓣体外抗氧化活性部位的筛选与研究[J]. 天然产物研究与开发, 2013, 25(11): 1489-1493; 1567.DOI:10.16333/j.1001-6880.2013.11.004.
[30] 祁英, 刘玉梅. 新疆紫草不同极性部位的抗氧化活性研究[J]. 中国现代应用药学, 2013, 30(8): 850-856. DOI:10.13748/j.cnki.issn1007-7693.2013.08.012.
