谷氨酰胺转氨酶热稳定剂优化
2018-02-28任立均刘龙刘松堵国成陈坚
任立均,刘龙*,刘松,堵国成,陈坚
1(江南大学 工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
谷氨酰胺转氨酶(Transglutaminase, TGase, EC 2.3.2.13),能够催化蛋白质肽链中谷氨酰胺残基的 γ-羧酰胺基与赖氨酸 ε-酰基或其他酰基反应,形成 ε-(γ-谷氨酰基)赖氨酸共价键,从而使蛋白质分子发生交联,达到提高蛋白质的功能性质以及改善蛋白质结构的目的。特殊的催化能力使得该酶作为一种新型的酶制剂被广泛应用于食品工程、材料工程、纺织与皮革加工、生物医药等领域[1]。然而,较低的热稳定性使商品化的TGase主要通过高能耗的冷冻干燥制备酶粉,同时常温下液体TGase储存稳定性不佳。因此,选择适合的保护剂提高TGase的热稳定性对该酶的应用有重要意义[2]。
目前,关于TGase热稳定性的研究已有大量报道。基于重组表达系统,研究者对TGase进行分子改造提高酶稳定性,包括定点突变[3]、融合双亲短肽[3]、引入二硫键[4]等。此外,固定化TGase[5]和邻苯二甲酸酐修饰亦被用于TGase的稳定化改造[6]。尽管分子改造及化学修饰能有效改善TGase的热稳定性,但由于转基因及化学残留的安全隐患限制了其在食品工业中的应用。通过添加食品安全的稳定剂能有效避免上述问题,是一种经济、便捷、有效的酶稳定化方法。已有的研究表明,糖类(海藻糖、蔗糖、果糖)[7-10]、醇类[11-13]、盐类[14]能有效提高碱性磷酸酶、过氧化氢酶、木瓜蛋白酶等的热稳定性。
本研究首先通过单因素实验从糖类、盐类、醇类等中筛选对TGase热稳定性有明显作用的稳定剂,然后进行正交实验,获得了能显著提高TGase热稳定性的配方。研究结果将进一步促进TGase的工业化生产与应用。
1 材料与方法
1.1 材料与试剂
1.1.1 主要试剂
StreptoverticilliummobaraenseTGase(酶活≥1 500 U/g),小麦蛋白:江苏一鸣生物制品有限公司;N-carboxybenzoyl-L-glutaminylglycine (N-CBZ-Gln-Gly),L-谷氨酸-γ-单羟胺酸:色谱纯,上海Sigma-Aldrich 公司;还原型谷胱甘肽:分析纯,生工生物工程(上海)股份有限公司;胰蛋白胨:分析纯,英国Oxoid公司;脱脂奶粉:澳大利亚Devondale Murray Goulburn合作社;大豆蛋白:分析纯,河南恒锐食品添加剂有限公司;精氨酸、蛋氨酸、甘氨酸、半胱氨酸、亮氨酸:分析纯,上海阿拉丁生化科技股份有限公司;丙三醇、山梨醇、聚乙二醇1000(Polyethylene glycol 1000, PEG1000)、葡萄糖、蔗糖、α-乳糖、海藻糖、NaCl、KCl、NH4Cl、(NH4)2SO4:分析纯,上海国药集团。
1.1.2 主要溶液[3]
(1) 溶液A(反应底物液)
0.2 mol/L三羟甲基氨基甲烷-盐酸缓冲液(pH 6.0)、0.1 mol/L盐酸羟胺、0.01 mol/L还原型谷胱甘肽、10 g/L CBZ-GLN-GLY(Nalpha-Carbobenzyloxy-Glutamine Glycine)(溶于0.2 mol/L NaOH中)4种试剂以2∶1∶1∶1混合配置,pH 6.0,现配现用,冰箱存放。
(2) 溶液B(终止剂)
3 mol/L HCl、12%三氯乙酸、5% FeCl3· 6 H2O(溶于0.1 mol/L HCl中)3种试剂以1∶1∶1混合配制。
(3) 磷酸盐缓冲液
0.2 mol/L Na2HPO4-NaH2PO4缓冲液,pH 7.4。
1.2 仪器与设备
DKB-600A型电热恒温水槽,上海森信实验仪器有限公司;高速离心机(CR22GⅡ);日本 HITACHI 公司;紫外可见光分光光度计(Shimadzu UV-2450);日本 Shimadzu 公司;Cytation3细胞成像多功能检测系统;美国伯腾仪器有限公司;Eppendorf 5424 高速离心机;美国 Eppendorf 公司;pH计,瑞士 Mettler-Toledo公司;制冰机,北京科创百方科技发展有限公司。
1.3 方法
1.3.1 样品制备
TGase酶粉用Na2HPO4-NaH2PO4缓冲液溶解,定量称取各种稳定剂,使酶粉分别与各个稳定剂充分混溶,控制各实验组中TGase的初始酶活在1.5 U/mL左右,稳定剂的质量浓度分别为0、10、20、30、40、50 g/L。
1.3.2 TGase酶活测定
比色法测定酶活[15]。用 α-N-CBZ-Gln-Gly 为作用底物,L-谷氨酸-γ-单羟胺酸做标准曲线。1个单位TGase 酶活定义为:在37 ℃条件下,每分钟催化上述底物形成 1 μmol的L-谷氨酸-γ-单羟胺酸的酶量(U/mL)。 酶活测定条件为37 ℃条件下反应10 min。
1.3.3 TGase热稳定性检测
本实验以TGase的t1/2(55 ℃)(即TGase在55 ℃热处理下酶活降低到初始酶活一半所需的时间)作为衡量TGase热稳定性的指标。同时用55 ℃水浴处理预冷的对照组TGase和实验组TGase,前30 min内每隔3 min取样,之后每隔10 min 取样,样品立即置于冰上冷却3 min,随后按照1.3.2测TGase的残余酶活力。酶的t1/2可通过作活力-时间图解得[16]。
1.3.4 TGase最适反应温度测定
按照1.3.2测定不同温度下TGase的酶活,定义37 ℃下各组的残余酶活率为100%,比较添加复合配方的实验组与对照组的残余酶活率。
1.3.5 TGase在不同温度下的热稳定性检测
将各组在不同温度下热处理1 h后按照1.3.2测定各组保温前后TGase的酶活,定义各组的残余酶活率为:

1.3.6 TGase常温储存稳定性检测
将各组在常温(25 ℃)下储存80 d,每隔10天按照1.3.2测定各组TGase的酶活,定义各组第0天的残余酶活率为100%,比较实验组与对照组储存不同时间的残余酶活率。
2 结果与分析
2.1 糖对TGase热稳定性的影响
糖类是一种常被用来研究酶热稳定性的稳定剂,糖类中的氢键能够降低蛋白质的自由能,这对维持蛋白质天然结构的稳定性有重要的作用[17]。本实验选用了4种糖类(葡萄糖、α-乳糖、蔗糖、海藻糖)进行研究,结果如图1。4种糖类对热处理下的TGase稳定性均有积极影响。其中50 g/L葡萄糖的保护效果最为明显,55 ℃下TGase的t1/2达到了34.74 min,比对照9.74 min提高了256.67%。大量的报道表明,在酶液中添加糖类,如葡萄糖、蔗糖、海藻糖、乳糖等能有效改善疏水相互作用,改变溶液的表面张力[17],提高酶的热稳定性。
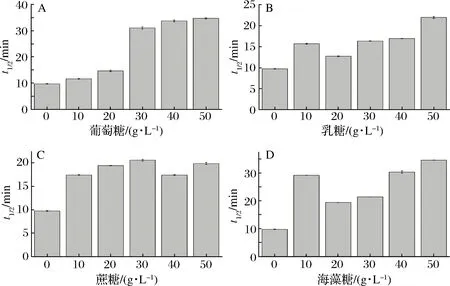
A-葡萄糖;B-乳糖;C-蔗糖;D-海藻糖图1 糖类对TGase t1/2(55 ℃)的影响Fig.1 The effects of saccharides on t1/2(55 ℃) of TGase
2.2 醇对TGase热稳定性的影响
多元醇也是一种有效的酶稳定剂,山梨醇和甘油是多元醇中最常被用作蛋白质稳定剂的两种,不同的作用机制被用来解释这两种醇对酶的稳定作用,包括优先水合,包埋蛋白,优先排斥变性蛋白等[18]。本实验选用了3种醇类(山梨醇、甘油、PEG1000)进行研究。如图2,3种醇类均促进了TGase热稳定性,其中50 g/L的山梨醇使55 ℃下TGase的t1/2达到34.81 min,比对照提高257.39%。文献显示,甘油和山梨醇能在一定程度上帮助蛋白质抵抗热变性[11-13]。一般认为,醇类是通过羟基与酶分子的相互作用[19]及降低介质的介电常数来加强酶分子的疏水作用[20],从而改善酶的热稳定性。

A-山梨醇;B-甘油;C-PEG1000图2 醇类对TGase t1/2(55 ℃)的影响Fig.2 The effects of polyols on t1/2(55 ℃) of TGase
2.3 盐对TGase热稳定性的影响
有研究表明,添加不同的盐能增加酶的热稳定性[14]。毛新焕等人通过研究一些金属硫酸盐还发现某些金属的硫酸盐对辣根过氧化物酶具有一定的稳定作用[21]。本实验选用4种盐类(NaCl, KCl, NH4Cl, (NH4)2SO4)进行研究。如图3,低浓度KCl、NH4Cl和(NH4)2SO4对TGase的保护均随着浓度的增大而作用增强。 50 g/L的KCl、NH4Cl和(NH4)2SO4影响下TGase的t1/2分别较对照提高6.84倍、8.65倍和12.68倍,40 g/L的NaCl使TGase的t1/2达到107.24 min,较对照提高10倍。这说明选择的4种金属阳离子和硫酸根离子均对酶的热稳定有良好的保护效果。

(A)NaCl;(B)KCl;(C)NH4Cl;(D)(NH4)2SO4图3 盐类对TGase t1/2(55 ℃)的影响Fig.3 The effects of salts on t1/2(55 ℃) of TGase
2.4 蛋白质和多肽对TGase热稳定性的影响
为了保护目标蛋白在逆境环境中的稳定性,也有研究者曾尝试将一些保护性蛋白和多肽添加到目标蛋白溶液中,如大豆多肽,谷朊粉,脱脂乳等,这些物质在保护TGase的热稳定性方面均取得了良好的效果[22]。本实验选用4种物质(胰蛋白胨、脱脂乳粉、大豆蛋白、小麦蛋白)进行研究。
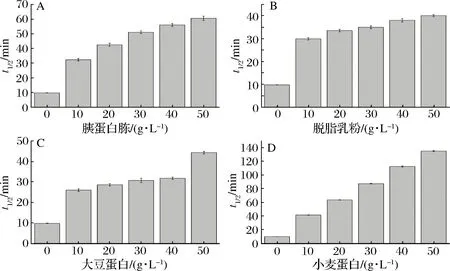
(A)胰蛋白胨;(B)脱脂乳粉;(C)大豆蛋白;(D)小麦蛋白图4 蛋白质和多肽对TGase t1/2(55 ℃)的影响Fig.4 The effect of proteins and peptide on t1/2(55 ℃) of TGase
由图4可知,4种物质均能改善TGase热稳定性,其中小麦蛋白的影响较为显著,50 g/L的小麦蛋白使TGase的t1/2达到135.02 min,较对照提高12.86倍。有学者认为,一些食品蛋白质存在分子内和分子间的交联(如二硫键、酪氨酸的交联),将其加入酶液中会形成类似于保护膜的网络状空间结构,包裹酶分子,锁住一定的水分,尽可能地阻止不良环境对酶活性的破坏[23]。且有些蛋白质(如酪蛋白)可能存在有目标酶的催化底物,会在酶的活性中心附近聚集,形成疏水结构,保护酶的催化活性[17]。此外,小麦蛋白粉中小麦多肽的抗氧化能力也能在一定程度上防止TGase活性中心的巯基被氧化[24],保护酶的热稳定性。
2.5 氨基酸对TGase热稳定性的影响
目前,常见的蛋白质稳定剂除了糖类,多元醇,离子化合物,还有一些氨基酸及其衍生物等[25]。这些小分子物质作为分子伴侣,在逆境中维持着蛋白质的天然构象和功能以阻止蛋白质的变性。考虑到不同氨基酸的亲水性和疏水性强弱不一,选用了5种氨基酸(精氨酸、甘氨酸、亮氨酸、蛋氨酸、半胱氨酸)进行研究。由于部分氨基酸在磷酸缓冲液中的溶解度较低,我们只研究了10 g/L的各类氨基酸对TGase热稳定性的影响。图5显示各类氨基酸对TGase的保护作用,效果最好的甘氨酸对应的TGaset1/2为14.07 min,同比对照提高44.46%。其他4种氨基酸对TGase的保护性并不明显,精氨酸的存在还破坏了TGase的热稳定性。研究甘氨酸分子结构可知,甘氨酸的侧链是个氢原子,其α-碳上的2个氢原子赋予分子疏水特性,较小的侧链使甘氨酸可以填进蛋白质结构中不能容纳别的氨基酸的缝隙里[26],从而有效维持目标蛋白的三维结构不被破坏。但与效果较好的糖、盐、醇类或蛋白质影响下的TGase相比,添加氨基酸的TGase的热稳定性并没有得到明显地改善,且大部分氨基酸溶解度较差,价格较为昂贵,不适合在工业生产中大规模应用。综合以上因素,不考虑把氨基酸作为正交试验的因素。
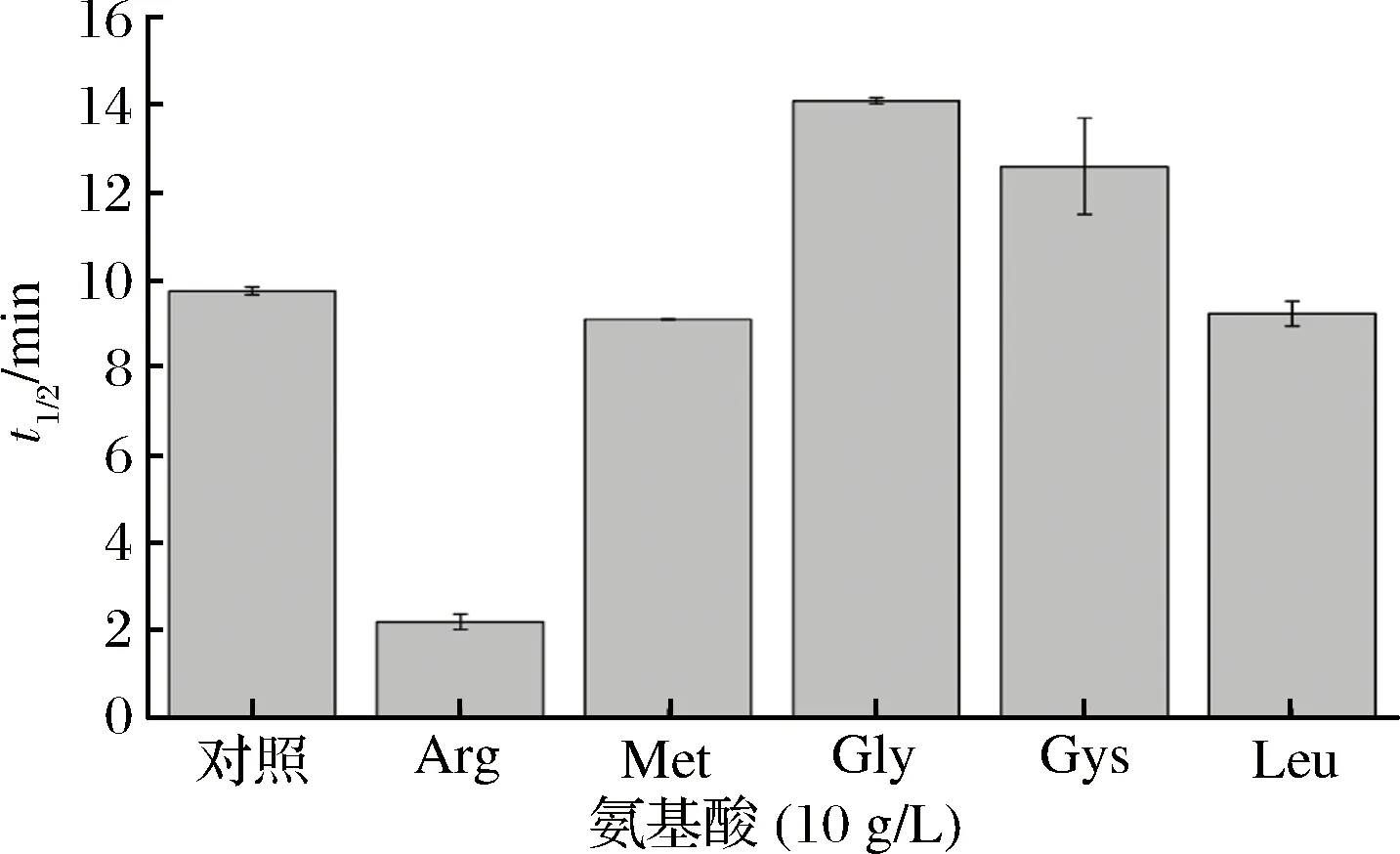
图5 氨基酸类对TGase t1/2(55 ℃)的影响Fig.5 The effects of amino acids on t1/2(55 ℃) of TGase
2.6 复合稳定剂对TGase热稳定性的影响
2.6.1 复合稳定剂的确定
通过对上述的糖类、盐类、醇类、小麦蛋白和氨基酸进行的单因素实验,同时考虑稳定剂的经济成本以及能否和TGase一起广泛应用于食品、生物等各领域,选取几个能明显改善TGase热稳定性的因素水平,进行正交试验,并对结果进行极差分析,以便获取最佳的稳定剂配方。采用L9(34)正交表,以山梨醇(A)、NaCl(B)、葡萄糖(C)、小麦蛋白(D)作为4个考察因素,选取3个水平进行试验,见表1和表2。

表1 TGase热稳定剂L9(34)正交试验因素水平表
按表1的正交因素水平设计L9(34)正交试验,结果见表2。

表2 TGase热稳定剂L9(34)正交试验设计及结果
由表2的极差分析结果可以看到,RA>RD>RB>RC,4个因素对TGase热稳定性的影响大小依次为:山梨醇(A)>小麦蛋白(D)>NaCl(B)>葡萄糖(C)。在这4个因素中,山梨醇和小麦蛋白的影响较为明显。在试验设计的范围内,优化TGase热稳定剂最佳组合为A3B3C3D3,即山梨醇50 g/L、小麦蛋白50 g/L、NaCl 50 g/L、葡萄糖50 g/L。对最优组合进行3次平行实验验证,TGase在55 ℃时的t1/2的平均值为591.49 min,较对照提高59.73倍,高于表2中的每一项试验结果,故A3B3C3D3为TGase复合稳定剂的最佳配方。
2.6.2 复合稳定剂对TGase最适反应温度的影响
当TGase应用于食品生产领域时,食品的高温加工工艺会显著地破坏TGase的酶活,限制其工业应用范围。本研究考察了复合稳定剂中TGase的最适反应温度,图6显示其最适反应温度为60 ℃,较对照组提高了10 ℃,有效地改善了TGase在高温加工应用中的局限性。
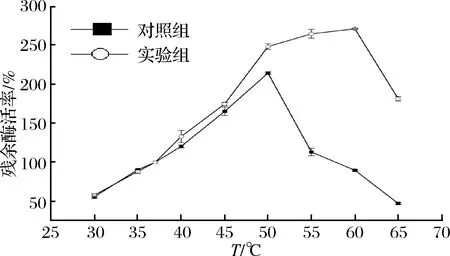
图6 复配稳定剂中TGase的最适反应温度Fig.6 The optimum reaction temperature of TGase in the best compound stabilizer
2.6.3 复合稳定剂中TGase在不同温度下的热稳定性
由图7可知,随着处理温度的升高,酶的活力逐渐下降。对照组在40 ℃甚至更高温度热处理后,酶活的衰减速率较实验组下降更为显著。60 ℃热处理1h后,对照组的残余酶活率已降至0,实验组仍能维持在42.11%,复合稳定剂中的TGase对温度的耐受性有了较大的改善,有利于延长酶在高温加工中的应用时间。
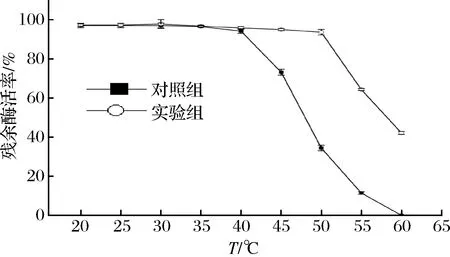
图7 复配稳定剂中TGase在不同温度下的热稳定性Fig.7 The thermal stability of TGase at different temperatures in the best compound stabilizer
2.6.4 复合稳定剂中TGase的常温储存稳定性
成品TGase在常温储存期间容易受温度的影响而逐渐丧失酶活,使其商业应用价值下降,为此,我们考察了实验组TGase的常温储存稳定性。由图8可知,随着时间的增加,对照组的酶活下降速率明显快于实验组。当常温存储80 d后,对照组的残余酶活率已下降至11%,而实验组仍能维持在73.84%,有效地延缓了常温下酶的失活速率,有利于延长成品TGase的货架期,维持其商业应用价值。
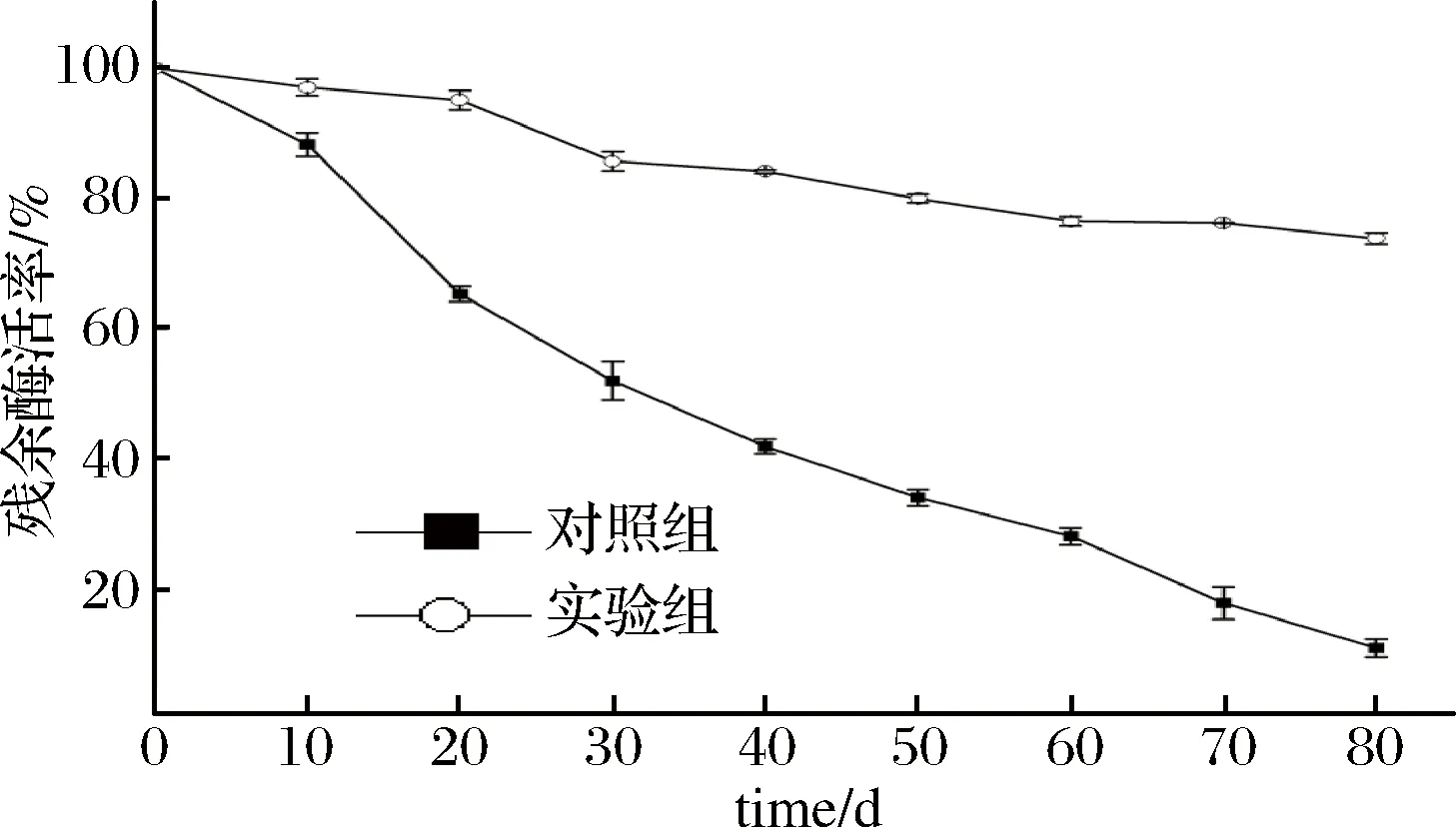
图8 复配稳定剂中TGase的常温储存稳定性Fig.8 The room temperature storage stability of TGase in the best compound stabilizer
3 结论
微生物来源的TGase在保存中容易因各种外在因素而发生酶失活,温度对酶活的影响更是限制其应用范围的关键因素。相较于分子改造的繁琐和难以工业化等问题,外源添加廉价、安全的稳定剂成为酶制剂领域常用的手段。本实验研究了糖、盐和多元醇等对TGase热稳定性的影响,并根据单因素结果设计了正交试验,确定复合稳定剂的最佳配方为:山梨醇50 g/L、小麦蛋白50 g/L、NaCl 50 g/L、葡萄糖50 g/L,得到TGase的t1/2为591.49 min,最适反应温度为60 ℃,分别较对照提高了59.73倍和10 ℃,对不同温度的耐受性也明显优于对照,常温存储80 d后的残余酶活率仍能维持在73.84%。因此,复配稳定剂能较好地改善TGase的热稳定性。目前,诸多的稳定剂已被应用于各类酶的逆境稳定性研究,虽有一定的稳定效果但还远不能满足各类工业应用坏境的需求,对新型稳定剂的开发和研究也鲜有报道。基于此,研究者们可以研究和筛选新型稳定剂对TGase稳定性的作用效果,以期能不断优化TGase的稳定性。
[1] SANTOS M,TORNE J M.Recent patents on transglutaminase production and applications: a brief review[J].Recent Patents on Biotechnology,2009,3(3):166-174.
[2] 叶双双,周丽,周哲敏.基于保护剂筛选及优化策略提高苯丙氨酸羟化酶热稳定性[J].食品与发酵工业,2016,42(6):56-61.
[3] 童理明.分子改造提高谷氨酰胺转胺酶热稳定性[D].无锡:江南大学,2016:3-7.
[4] 刘中美,坤杜,周哲敏.人工设计二硫键增强谷氨酰胺转胺酶热稳定性[J].食品与生物技术学报,2015,34(10):1 057-1 061.
[5] 张春红,高慧楠,常南,等.以壳聚糖为载体固定化谷氨酰胺转氨酶的研究[J].食品科技,2009,34(12):33-35.
[6] 刘松,堵国成,陈坚.化学修饰提高谷氨酰胺转胺酶活性与热稳定性[J].食品与生物技术学报,2015,34(11):1 135-1 140.
[7] SEKIGUCHI S,HASHIDA Y,YASUKAWA K,et al.Stabilization of bovine intestine alkaline phosphatase by sugars[J].Bioscience Biotechnology and Biochemistry,2012,76(1):95-100.
[8] BELLUZO S,BOERIS V,FARRUGGIA B,et al.Influence of stabilizers cosolutes on catalase conformation[J].International Journal of Biological Macromolecules,2011,49(5):936-941.
[9] 常忠义,荣绍丰,高红亮,等.采用TG和DSC方法研究糖类对谷氨酰胺转胺酶热稳定性的影响[J].食品科学,2007,28(2):202-205.
[10] SZABO A,KOTORMAN M,LACZKO I,et al.Influence of carbohydrates on stability of papain in aqueous tetrahydrofuran mixture[J].Journal of Chemical Technology and Biotechnology,2009,84(1):133-138.
[11] PAZHANG M,MEHRNEJAD F,PAZHANG Y,et al.Effect of sorbitol and glycerol on the stability of trypsin and difference between their stabilization effects in the various solvents[J].Biotechnology and Applied Biochemistry,2016,63(2):206-213.
[12] KUMAR V,CHARI R,SHARMA V K,et al.Modulation of the thermodynamic stability of proteins by polyols:Significance of polyol hydrophobicity and impact on the chemical potential of water[J].International Journal of Pharmaceutics,2011,413(1-2):19-28.
[13] PETERSEN S B,JONSON V,FOJAN P,et al.Sorbitol prevents the self-aggregation of unfolded lysozyme leading to an up to 13 degrees C stabilisation of the folded form[J].Journal of Biotechnology,2004,114(3):269-278.
[14] 朱怀梅,常忠义,高红亮, 等.盐离子对微生物谷氨酰胺转胺酶热稳定性的影响[J].云南大学学报(自然科学版),2008,30(S1):426-429.
[15] GROSSOWICZ N,WAINFAN E,BOREK E,et al.The enzymatic formation of hydroxamic acids from glutamine and asparagine[J].Journal of Biological Chemistry,1950,187(1):111-125.
[16] O′FAGAIN C.Enzyme stabilization - recent experimental progress[J].Enzyme and Microbial Technology,2003,33(2-3):137-149.
[17] 彭灿.微生物谷氨酰胺转胺酶稳定性的研究[D].上海:华东师范大学,2007:46-52.
[18] TIMASHEFF S N.Protein hydration, thermodynamic binding, and preferential hydration[J].Biochemistry,2002,41(46):13 473-13 482.
[19] FERNANDEZ L,GOMEZ L,RAMIREZ H L,et al.Thermal stabilization of trypsin with glycol chitosan[J].Journal of Molecular Catalysis B-Enzymatic,2005,34(1-6):14-17.
[20] COMBES D,MONSAN P.Effect of polyhydric alcohols on invertase stabilization[J].Annals of the New York Academy of Sciences,1984,434:61-63.
[21] 毛新焕,李响,王姗姗,等.辣根过氧化物酶的热稳定剂筛选[J].生物工程学报,2009,25(3):388-391.
[22] 荣绍丰,高红亮,常忠义,等.一些蛋白质和多肽对谷氨酰胺转胺酶热稳定性的影响[J].食品工业科技,2006,27(12):95-97.
[23] 王璋,许时婴,汤坚.食品化学[M].北京:中国轻工业出版社,1999:48-69.
[24] 彭灿,常忠义,王疆元,等.谷朊粉水解物对微生物谷氨酰胺转氨酶稳定性的影响[J].西北农林科技大学学报(自然科学版),2007,35(8):171-175.
[25] KUMAR V,SHARMA V K,KALONIA D S.Effect of polyols on polyethylene glycol (PEG)-induced precipitation of proteins: Impact on solubility, stability and conformation[J].International Journal of Pharmaceutics,2009,366(1-2):38-43.
[26] 王希成.生物化学[M].第3版.北京:清华大学出版社,2010:10-16.
